2. 浙江省食品药品检验研究院, 浙江 杭州 310004;
3. 浙江大学药学院药物代谢和药物分析研究所, 浙江省抗肿瘤药物研究重点实验室, 浙江 杭州 310058
2. Zhejiang Institute for Food and Drug Control, Hangzhou 310004, China;
3. Institute of Drug Metabolism and Pharmaceutical Analysis, Zhejiang Province Key Laboratory of Anti-Cancer Drug Research, College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058, China
抗肿瘤药物治疗指数较小, 在临床肿瘤化疗中往往很难预测药物对肿瘤的作用和机体毒性, 因此抗肿瘤药物临床的应用及疗效就受到很大的限制。研究发现, 药物代谢酶和药物转运体是导致抗肿瘤药物临床上发生不良反应的主要机制之一[1]。其中, 药物转运体是人体组织生物膜上参与药物跨膜运输的特殊蛋白, 通过控制药物的胞内摄入和排出从而介导药物的体内过程, 继而对药物的生物利用度、药效以及毒性产生影响[2]。临床中, 很多药物的体内过程主要依赖药物转运体参与完成, 因此生物膜对药物的通透性变化可能对药物的药理作用和毒性反应产生影响。为了最大限度地减少药物转运体介导的抗肿瘤药物不良反应, 尤其是合用后的不良药物相互作用, 需要理清药物转运体在药物体内过程中所起的具体作用, 阐明药物转运体如何介导抗肿瘤药物的毒性反应, 从而为临床抗肿瘤药物的合理使用提供参考。
1 药物转运体的分类及作用于药物临床反应的方式转运体通过调控药物在肠上皮细胞、肝细胞和(或)肾小管上皮细胞的进出, 影响了药物在体内吸收以及消除过程(图 1)。除此之外, 转运体也能促进或限制药物在脑、胎盘、肿瘤、T细胞及其他细胞的跨膜过程。按转运机制和方向的不同, 转运体可分为摄取型转运体和外排型转运体。摄取型转运体的主要功能是促进药物向细胞内转运, 促进吸收, 如有机阴离子多肽转运体(organic anion-transporting polypeptide, OATP)、有机阴离子转运体(organic anion transporter, OAT)、有机阳离子转运体(organic cation transporter, OCT)和寡肽转运体(peptide transporter, PEPT)等; 而外排型转运体的主要功能则是将药物从细胞内排出, 限制药物的摄取和吸收, 其功能类似外排泵, 如多药及毒性化合物外排蛋白(multidrug and toxic compound extrusion transporter, MATE)、多药耐药外排蛋白(multidrug efflux transporters, MDR)、多药耐药相关蛋白(multidrug resistance protein, MRP)、肺耐药蛋白(lung resistance-related protein, LRP)、胆盐输出泵(bile salt export pump, BSEP)和乳腺癌耐药蛋白(breast cancer resistance protein, BCRP)等。
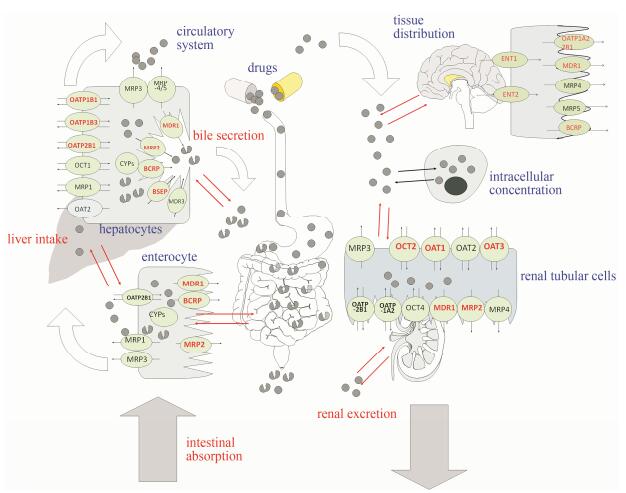
|
Figure 1 Function of transporters |
转运体的功能改变(药物间的竞争作用、病理环境的影响以及基因多态性等)将影响药物在组织中的暴露, 并可能导致药效降低或毒性增加。抗肿瘤治疗一般为药物联合治疗, 药物间存在着相互作用可以引起抗肿瘤药物毒性的加重, 且其性质和程度在不同个体之间差异较大[3]。药物转运体广泛分布于体内各组织脏器, 如肠道、大脑、肝脏和肾脏等, 且存在一定程度的底物重叠性, 药物转运体介导的药物相互作用可能是抗肿瘤药物毒性加重的原因之一[4]。转运体的表观遗传修饰和基因多态性均导致药物吸收速率方面呈较大个体差异, 也可能是抗肿瘤药物发生毒性反应的重要原因[5]。当肿瘤及炎症相关疾病发生时, 药物转运体表达及活性都受到炎症相关因素不同程度的影响[6, 7]。例如, 甲氨喋呤是许多摄取型转运体和外排型转运体的共同底物[8], 而当肿瘤及胆汁淤积[9]等炎症相关疾病发生时, 这些转运体发生改变, 使甲氨喋呤产生了不可预知的肾脏及肝脏组织毒性。转运体基因多态性是导致抗肿瘤药物毒性个体差异的重要原因之一[10]。比如, 铂类药物所引起的肾毒性、耳毒性、神经毒性与转运体基因多态性之间存在的密切关联。此外, 药物对转运体也存在诱导或抑制作用, 从而改变其转运药物的能力[11]。目前, 国际转运体协会(International Transporter Consortium, ITC)以及美国FDA指南已将部分主要转运体列为药物开发早期筛查项目, 为潜在的药物不良反应以及药物间相互作用提供指导。比如美国FDA临床试验指导原则建议在药物开发中研究的转运体包括BCRP、OATPs、OCTs、OATs和MDR1, 必要时还要进行MRPs、MATEs和BSEP等相关转运体的研究。
2 抗肿瘤药物毒性与转运体相关性根据抗肿瘤作用的机制将抗肿瘤药物分为直接影响DNA结构和功能的药物、干扰核苷酸生物合成的药物、干扰转录过程和阻止RNA合成的药物、干扰蛋白质合成和功能的药物、影响激素平衡的药物以及其他药物。
2.1 转运体参与的直接影响DNA结构和功能的抗肿瘤药物毒性 2.1.1 顺铂肾毒性、耳毒性、周围神经毒性与相关转运体顺铂是治疗实体瘤最常用的细胞毒药物, 也是治疗非小细胞肺癌的一线用药。临床上, 顺铂引起的不良反应包括肾毒性、耳毒性以及周围神经毒性等, 是严重阻碍其临床应用的重要因素。研究表明, 导致铂类毒性增强的机制主要包括:细胞内药物蓄积增多、生物转化能力减弱和DNA修复能力降低[12]。
顺铂肾毒性的发生率很高, 约三分之一接受顺铂治疗的患者会发生肾毒性。顺铂引起肾毒性的机制复杂, 涉及多种途径和分子, 氧化应激是发病机制中最为重要的机制之一。另有研究表明顺铂肾毒性的发生与顺铂进入细胞内对Na+-K+-ATP酶的抑制有关[13]。Huang等[14, 15]的研究发现顺铂在肾脏特别是近端小管的蓄积显著高于其他组织, OCT2为肾脏表达最丰富的转运蛋白, 是参与顺铂在体内的吸收与转运的主要转运体。在Oct1/2-/-双敲除的小鼠模型中, 研究人员发现顺铂蓄积量减少并且未发生严重的肾小管损害[16], 此外, 在野生型小鼠中给予顺铂和OCT2抑制剂西咪替丁, 顺铂肾毒性的发生也相应减少[16, 17], 也有临床研究表明使用顺铂的患者联合服用西咪替丁后, 肾毒性有所改善[18]。然而, 也有研究认为OCT2抑制剂西咪替丁和昂丹司琼与顶侧表达的MATE1存在更强的相互作用, 抑制顺铂从肾细胞排出, 从而增加顺铂肾毒性[18]。OCT2基因存在基因多态性, 808G > T突变致使OCT2对底物的转运能力降低。Iwata等[19]研究发现OCT2 808G > T位点GG、GT基因型患者分别使用顺铂后, 27%的GG基因型患者显示Ⅱ度肌酐升高, 而GT基因型患者未发现明显的肾毒性, 表明OCT2 808G > T突变有可能减轻顺铂的肾毒性。此外, 铜离子转运蛋白1 (copper transporter protein, CTR1) 也参与顺铂在肾小管上皮细胞的摄取[20], 但也有研究对此结论表示异议[21]。此外, 研究人员发现铜离子转运体另一亚型(copper-transporting P-type adenosine triphosphatase, ATP7A, ATP7B)介导了顺铂外排转运和分布至特定的亚细胞器的过程, 与顺铂在肾脏中的蓄积有关[22, 23]。ATP7A和B转运蛋白对铂类分布的影响与对铜的作用非常相似, 使铂类药物在泡囊封存后不容易排出。ATP7A和ATP7B的表达还与顺铂的敏感性和耐药性有关。顺铂主要经OCT2摄取吸收后, 由外排蛋白MATE1外排进入肾腔, 在基因敲除小鼠模型的研究结果与预期一致, Mate1敲除的小鼠表现更严重的肾毒性[24]。有趣的是, MATE1和MATE2-K对奥沙利铂有更高的亲和力, 这可能是奥沙利铂肾毒性发生率较低的原因[18]。一些研究表明顺铂进入肾细胞内生成顺铂水合衍生物, 促使细胞内的氯离子浓度比细胞外低13倍, 抑制Na+-K+-ATP酶, 从而发生肾毒性[13]。这些顺铂水合物易与DNA、蛋白质发生亲电反应。谷胱甘肽(GSH)也可以与顺铂结合并进一步代谢成活性硫醇中间体[25]。Xia等[25]的研究发现肾小管上皮细胞顶侧膜表达的MRP2可以把顺铂从肾细胞排出到细胞外, 在Mrp2基因敲除小鼠模型中, 野生型小鼠的肾脏和肝脏中顺铂的浓度显著高于基因敲除组, 同时可观察到广泛的近端小管损伤, 在mRNA水平上, Mrp2基因敲除小鼠肾脏组织中谷胱甘肽S-转移酶高表达, 可能与其代谢成有毒中间体硫醇有关。
顺铂可导致永久性的耳聋、耳鸣和听力损伤[22], 其可能的机制是顺铂在耳蜗蓄积诱导活性氧和/或导致细胞清除酶的耗竭最终导致细胞凋亡[26], 大量文献表明CTR1和OCT2参与了顺铂耳毒性的发生。研究者在野生型小鼠中联合给予顺铂和OCT2抑制剂西咪替丁后, 发现顺铂耳毒性的发生风险显著降低[15, 17]。另在Oct1/2-/-小鼠模型中, 给药顺铂后未发生听觉损伤, 而野生型小鼠中却发生了严重耳毒性[17]。CTR1在内耳中大量表达[27], 参与了铂类药物进入细胞过程[28]。动物实验发现, 小鼠腹腔给药顺铂, 并在前耳蜗内给予CTR1抑制剂硫酸铜后, 小鼠的听觉并未损伤[27]。Xu等[29]对CTR1基因的20个SNP进行了筛查, 发现rs10981694A > C基因多态性位点与顺铂引起的耳毒性密切相关(P < 0.05), 其中C等位基因的携带者对耳毒性的耐受性较差(P < 0.05), 但CTR1基因多态性与骨髓抑制, 胃肠道毒性、肾毒性无显著相关性。铂类药物很难透过血脑屏障, 却与周围神经有很高的亲和力。由于背根神经节缺乏血脑屏障, 因此铂类药物很容易在背根神经节中蓄积而在有屏障保护的脊髓和大脑中很少蓄积。铂类药物蓄积在背根神经节中与DNA形成复合物, 造成神经元细胞凋亡从而引起神经毒性的发生[15]。CTR1和ATP7A在大鼠脊髓背根神经节组织中大量表达[22, 23], 但两者表达的神经元有所不同, CTR1主要在背根神经节的大纤维感觉神经元表达, ATP7A则是在背根神经节的小纤维神经元高表达, 给药顺铂产生剂量相关的大纤维感觉神经病变[23]。OCT2在人和鼠脊髓背根神经节细胞内也有表达, 可能对顺铂引起的神经毒性也有作用[15]。
2.1.2 奥沙利铂引起的毒性与相关转运体周围神经毒性是奥沙利铂的剂量限制毒性[30], 发生率约为68%~98%。该毒性呈剂量依赖性, 据报道, 奥沙利铂的周围神经毒性与细胞内钙减少和生长相关蛋白的表达有关, 也有学者认为是与奥沙利铂诱发的氧化应激有关, 而目前广为接受的观点是奥沙利铂在背根神经节的蓄积降低细胞代谢和轴突转运而导致神经病变[26]。与顺铂类似, 奥沙利铂的周围神经毒性与脊髓背根神经节组织中大量表达的CTR1和ATP7A有关[23]。最近的研究表明OCT2在脊髓背根神经节细胞内也高表达, 在OCT2过表达的细胞模型中奥沙利铂的摄取量增加了16~35倍。而在Oct2基因敲除的小鼠中, 奥沙利铂的神经毒性显著减弱[30]。OCTs在肿瘤细胞中的表达可以被表观遗传修饰下调, 作者研究团队通过对肾细胞癌患者的肾肿瘤组织及配对的正常肾组织进行分析, 发现OCT2转运体在肾细胞癌肿瘤组织中的蛋白表达几乎完全丢失。转录水平的抑制是OCT2转运体蛋白表达丢失的重要原因之一, DNA甲基化在OCT2转录抑制中发挥重要作用。荷瘤小鼠给予DNA甲基转移酶抑制剂地西他滨后肾癌组织中OCT2的表达水平明显升高, 致使奥沙利铂在肾癌组织中积聚大量增加。多药及毒性化合物外排转运蛋白(MATE-2K, 该转运体可将奥沙利铂排出细胞外)在肾细胞癌中的表达也显著降低, 但是地西他滨不能诱导其表达增加, 这使得进入肾癌细胞的奥沙利铂不易被其排出体外。而在正常肾细胞中由于OCT2和MATE-2K的表达都较高, 奥沙利铂可以被MATE-2K外排至尿中而不易积聚, 使得其对正常肾组织毒性较低(图 2)[31]。还有研究显示, 奥沙利铂的摄取呈温度和钠离子依赖性, 在培养基中加入麦角硫因(OCTN1抑制剂[32])后奥沙利铂的摄取量减少, 其毒性也随之降低, 表明肉碱/有机阳离子转运体OCTN1和OCTN2 (钠离子依赖转运体)参与奥沙利铂的神经毒性[33]。而顺铂不是OCTN1和OCTN2的底物, 所以顺铂引起的周围神经毒性与OCTN1和OCTN2无相关性[34]。此外, 奥沙利铂在耳蜗的蓄积量较少, 很少引起耳毒性[26]。

|
Figure 2 The expression of OCT2 and MATE-2K in normal renal cells and renal carcinoma cells and their effects on oxaliplatin uptake |
伊立替康是一种拓扑异构酶抑制剂, 在体内代谢为活性化合物7-乙基-10-羟基喜树碱(SN-38), 后者发挥抗癌作用的同时还伴有严重的毒性。SN-38被进一步代谢为无活性的葡萄糖醛酸结合物(SN-38G)。大部分SN-38G是通过转运蛋白MDR1、MRP2、BCRP进入胆汁, 肾清除仅占总SN-38清除量的30%, 然而, 胆汁中的SN-38G在肠道菌群的作用下进一步水解成SN-38, 引起胃肠道毒性, 包括迟发性腹泻[35]。
OATP1B1在肝中高表达, SN-38是OATP1B1的底物, OATP1B1的基因多态性降低其转运能力, 从而导致SN-38在胃肠道暴露引发胃肠道毒性。在Oatp1a/1b敲除的大鼠模型中, 灌胃给药伊立替康后, 发现代谢物SN-38的血浆浓度增加, 而肝组织中含量减少, 胆汁排泄量降低, 并发现伊立替康和SN-38的血药浓度在基因敲除大鼠中比野生型大鼠高2~3倍[36, 37]。临床研究表明OATP1B1 388G > A (rs2306283) 基因中杂合子G/A胃肠道毒性的发生存在显著性差异(P = 0.027 7)[38]。OATP2B1在肝和肠组织中高表达, 主要位于肠膜细胞顶端, 具有pH依赖性, 在肠道吸收中起重要作用[35], 研究发现转运体OATP2B1也参与SN-38在胃肠道组织的摄取, 与伊立替康的胃肠道毒性的发生有关[8]。
中性粒细胞减少症是伊立替康临床应用中又一限制因素。研究报道ATP结合盒转运蛋白的基因多态性与伊立替康的中性粒细胞减少症相关[39]。多种ATP结合盒转运蛋白, 包括MDR1和MRP1[40], 它们的表达与伊立替康及其代谢物SN-38在体内的血药浓度有关, MDR1涉及伊立替康的胆汁排泄, 如果MDR1表达增加, 则SN-38的胆汁排泄量就增加, 相应的血浆浓度就低, 中性粒细胞减少症的发生降低[39]。MRP1是SN-38的肝基底外排蛋白, 它的表达增加, 则SN-38的系统暴露量就增加, 从而中性粒细胞减少症的发生升高, 值得注意的是, MRP1在肝脏的表达相对较低, 所以一旦它的表达增加将显著影响其外排入血的量[22]。临床研究表明携带ABCC1 (MRP1) rs17501331和ABCB1 rs12720066基因的患者服用伊立替康时更容易产生中性粒细胞减少症[38]。
2.2 转运体参与干扰核苷酸生物合成的抗肿瘤药物毒性抗肿瘤药物甲氨蝶吟(MTX)是一种对二氢叶酸还原酶具有高度亲和力的抗代谢药, 静脉给药后主要经肾脏直接清除, 部分则在肝内氧化为7-羟基甲氨蝶吟(7-OH MTX), 再由肾脏排泄, 其胆汁排泄的量不超过20%[41]。MTX毒性表现包括皮疹、胃肠道反应, 甚至可引起严重的骨髓抑制, 大剂量长期用药可致肝、肾损害以及神经毒性。MTX的肾毒性主要与MTX结晶沉积物和水难溶代谢物7-OH MTX的生成有关[42], 而MTX的低清除率是其发生不良反应的决定性因素[41]。转运蛋白介导的肾小管主动分泌途径约占MTX肾清除的三分之一, 占总清除量的四分之一[41], 因此相关转运蛋白是影响MTX的药代动力学变化的主要因素。
SLC19A1编码的还原型叶酸载体(reduced folate carrier, RFC1) 属于溶质蛋白转运体家族, MTX进入细胞主要通过它介导的主动转运机制实现。RFC1的基因与蛋白表达水平显著影响MTX的吸收, 从而影响其疗效与毒性[42]。基因多态性的研究结果表明RFC1 80G/A多态性与MTX毒性不相关, 而RFC1 rs7499的基因多态性与MTX的总体毒性相关, 而MTX的胃肠道毒性分别与RFC1 rs7499、80G/A、rs2838956具有相关性。这些结果说明不同RFC1基因的多态性具有不同的临床结果[42]。当RFC1饱和后, MTX也可以通过叶酸受体α (folate receptor alpha, FOLR1)、OATP1B1、OATP1B3等转运蛋白进入细胞[43]。进入肝细胞后大部分的MTX由MRP3和MRP4进入血液, 只有一小部分经由MRP2、MDR1、BCRP分泌到胆管。此外, MTX从细胞外排至肠腔则依赖ATP结合盒(ABC)转运蛋白, 即MDR1、BCRP[43]完成。在动物模型中, 研究者发现7-羟基甲氨蝶吟在Mrp2、Mrp3、Bcrp基因敲除小鼠尿液中的排泄量显著高于野生型小鼠, 肾毒性显著降低, 这表明Mrp2、Mrp3、Bcrp三者对由MTX和7-OH MTX蓄积所导致的肾毒性非常重要[44]。服用MTX时, 那些携带MDR1基因1199GA/3435CC位点的患者比携带3435CT/TT的患者显示更明显肝毒性[45]。此外, 一些分布在肾小管近端细胞基底层的OAT1、OAT3和肾小管近端细胞顶膜的OAT4、OATP1A2也参与摄取MTX进入肾细胞[43]。有关转运蛋白的基因多态性影响MTX和7-OH MTX的肾清除。相关基因多态性研究结果表明, 单核苷酸多态性在SLC19A1 rs7499 G携带者, SLC46A1 rs2239907 G纯合子, SLCO1B1 rs4149056 T携带者和T纯合子分别与MTX有关的总体毒性的风险相关[43]。SLC19A1 rs7499 G携带者和SLC19A1 rs1051266 G携带者、SLC19A1 rs2838956携带者、SLCO1B1 rs4149056携带者均与MTX胃肠毒性的相关[43]。
2.3 转运体参与干扰蛋白质合成和功能的抗肿瘤药物毒性 2.3.1 紫杉醇周围神经病变与相关的转运体紫杉醇是临床重要的化疗药物, 主要用于早期和转移性乳腺癌。紫杉醇引起的周围神经病变(peripheral neuropathy, PIPN)临床症状如麻木、刺痛、灼痛, 以及无运动症状。PIPN是紫杉醇的剂量限制性毒性, 显著降低患者的生活质量。约50%的患者需要4~6个月恢复, 严重的PIPN可能会持续数年[46]。引起PIPN的因素很多, 其中药物暴露是毒性发生的主要原因。紫杉醇是通过底侧膜表达的有机阴离子转运蛋白OATP1B3转运入肝细胞, 再由肝中细胞色素P450 2C8 (CYP2C8) 和细胞色素P450 3A4 (CYP3A4) 代谢, 最终由顶侧膜MDR1外排入毛细胆管[46]。研究表明MDR1的基因多态性与PIPN具有相关性, 临床研究发现携带ABCB1 1236 TT的患者比携带ABCB1 CT/CC的患者更易发生紫杉醇诱导的周围神经毒性。携带ABCB1 3435 TT位点的患者发生2级以上的神经毒性风险较高, 携带SLCO1B3334 TT和ABCB1 1236 TT的患者得PIPN的风险较高[46]。
2.3.2 多西他赛胃毒性与相关的转运体多西他赛属于紫杉醇类抗肿瘤药, 是在紫杉醇的基础上经结构修饰后获得的新抗肿瘤药物, 适用于先期化疗失败的晚期或转移性乳腺癌的治疗以及晚期或转移性非小细胞肺癌的治疗。其主要不良反应包括骨髓抑制、外周神经毒性以及胃肠毒性等。在相同有效剂量的情况下, 应用紫杉醇更易导致周围神经病变多, 而多西他赛治疗的患者中血液毒性更常见[47]。
其中, 多西他赛的胃肠道毒性与介导多西他赛外排的MDR1密切相关[48]。当多西他赛与MDR1抑制剂拉帕替尼的联合给药后发现多西他赛的胃肠道毒性加重[49]。而Mdr1a-/-小鼠灌胃给药后, 多西他赛体内AUC显著高于野生小鼠; 若联用MDR1抑制剂环孢菌素A后, 组织中多西他赛的浓度显著提高[50]。上述实验结果表明, 通过直接或竞争性抑制剂抑制MDR1的外排作用, 可能会导致细胞内药物浓度的增加, 同时也增加了组织毒性[49]。有研究指出, MDR1基因突变可通过影响其表达而改变其外排功能, 其中C3435T患者与多西他赛乳腺癌化疗时不良反应的发生相关, TT、TC和CC型患者Ⅲ度白细胞减少症的发生频率分别为100%、77.3%和54.5%[51]。应用多西他赛联合顺铂治疗的患者中, ABCB1 3435TT基因型携带者相对于CC和CT基因型携带者发生2级腹泻风险较高, 而在多西他赛联合多柔比星治疗的患者中发现TT基因型的患者发生3级腹泻风险较高[48]。而MDRl突变体3435C > T以及2677 G > T/A已成为临床中胃肠道毒性生物标志物[48]。
与胃肠道毒性相似, 对于多西他赛的血液疾病, 研究主要聚焦于ABCB1 3435C > T (rs1045642) 和ABCB1 2677G > T/A (rs2032582) 基因多态性与多西他赛血液系统毒性的相关性。对于多西他赛单药治疗的TT基因型携带者发生3级中性粒细胞减少率较高[47]。在一项应用阿霉素联合多西他赛治疗乳腺癌的大样本临床研究中, 携带TT基因位点的患者发生血液毒性的比例较高[47]。其他转运体基因多态性研究中ABCC2 101620771C > G和SLCO1B3 1683-5676A > G为接受多西他赛治疗患者中发生3级白细胞/中性粒细胞减少症的高危因素[47]。
2.4 其他抗肿瘤药物毒性与转运体更多有关转运体对抗肿瘤药物不良反应的影响, 可参见表 1[31, 38, 52-58]。
| Table 1 Toxic effects of antitumor drugs based on drug transporters |
药物转运体分布在特定的组织和细胞中, 对药物在体内的分布、药物的疗效以及毒性起重要作用。药物转运体通过摄取或外排作用使药物在体内蓄积从而产生药效或毒性。比如, 上皮细胞通过细胞信号转导途径形成极化初始状态, 转运蛋白分布在细胞膜的顶端或基底, 药物通过这种生理特征可以靶向到特定的组织或细胞发挥药效, 同时, 也可能诱发药物毒性。
药物在细胞内的积聚由药物的摄取和外排共同决定。许多抗肿瘤药物都是经特异性转运体摄取入细胞或者排至细胞外, 因此转运体在决定抗肿瘤药物的细胞内积聚中发挥着重要作用。外排转运体, 比如P-gp, 因在肿瘤多药耐药机制或转运体基因多态性引起的药物毒性研究中已经获得较多的关注。而近年来的研究发现, 摄取转运体在抗肿瘤药物的毒性发生发展中也有重要的毒理学意义, 比如摄取转运体介导的药物蓄积是顺铂毒性发生的重要原因[15]。
目前基于转运体介导的抗肿瘤药物作用机制多停留在体外细胞模型及动物模型, 仍然需要大样本的临床研究进行验证。转运体基因多态性与抗肿瘤药物毒性反应的相关性研究结果不尽相同, 分析原因可能是样本量偏少、纳入患者在人群种族上有差异、临床治疗中存在肿瘤分期、毒性评价指标不一致、抗肿瘤药物多环节、多因素的复杂作用机制。因此, 进行多中心大样本研究结合深入的机制研究将有助于从分子水平阐释转运体介导的抗肿瘤药物毒性。其次, 肿瘤状态下转运体表达或者活性可能发生变化, 这些变化可能会影响抗肿瘤药物的药效和毒性。比如, 外排转运体MRP4在肾细胞癌组织中的mRNA表达较正常组织高, 而近端肾小管上皮细胞膜上的摄取转运体, 除PEPT1以外, 其余mRNA的表达在肾细胞癌中较正常肾组织均有不同程度的表达降低[59]。肝特异性表达的有机阳离子转运体OCT1在肝癌组织中表达丢失, 研究发现该转运体的编码基因SLC22A1的启动子在肝组织中的甲基化程度在正常组织、癌旁组织和肿瘤组织中依次升高, 与其蛋白表达水平呈负相关[60]。这些转运体表达或活性的变化可能涉及肿瘤表观遗传的修饰作用。与基因多态性相比, 表观遗传修饰因为容易受到外界环境(包括病理状态、外源物暴露等)的影响而更富多样性。因此, 表观遗传调控转运体基因的表达, 也在很大程度上引发机体对药物反应的个体差异。转运体基因的表观遗传研究将有助于预测机体对药物反应(包括治疗效果及不良反应)以及表观遗传介导的药物-药物相互作用, 对临床用药具有指导意义。在以后的研究设计如能结合肿瘤表观遗传组学理念进行更深入、更准确地研究转运体在抗肿瘤药物毒性发生的作用将具有深远的转化意义。
| [1] | Hucke A, Ciarimboli G. The role of transporters in the toxicity of chemotherapeutic drugs: focus on transporters for organic cations[J]. J Clin Pharmacol, 2016, 56: 157–172. DOI:10.1002/jcph.v56.2 |
| [2] | Degorter MK, Xia CQ, Yang JJ, et al. Drug transporters in drug efficacy and toxicity[J]. Annu Rev Pharmacol Toxicol, 2012, 52: 249–273. DOI:10.1146/annurev-pharmtox-010611-134529 |
| [3] | Scripture CD, Figg WD. Drug interactions in cancer therapy[J]. Nat Rev Cancer, 2006, 6: 546–558. DOI:10.1038/nrc1887 |
| [4] | Nigam SK. What do drug transporters really do?[J]. Nat Rev Drug Discov, 2015, 14: 29–44. |
| [5] | Niemi M. Transporter pharmacogenetics and statin toxicity[J]. Clin Pharmacol Ther, 2010, 87: 130–133. DOI:10.1038/clpt.2009.197 |
| [6] | Morgan ET, Goralski KB, Piquette-Miller M, et al. Regula tion of drug-metabolizing enzymes and transporters in infec tion, inflammation, and cancer[J]. Drug Metab Dispos, 2008, 36: 205–216. DOI:10.1124/dmd.107.018747 |
| [7] | Gao LC, Zhang W, Fan L, et al. Progress and research about effects of inflammation on expression and activity of drug transporters[J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 7–10. |
| [8] | Lee W, Kim RB. Transporters and renal drug elimination[J]. Annu Rev Pharmacol Toxicol, 2004, 44: 137–166. DOI:10.1146/annurev.pharmtox.44.101802.121856 |
| [9] | Geier A, Wagner M, Dietrich CG, et al. Principles of hepatic organic anion transporter regulation during cholestasis, inflammation and liver regeneration[J]. Biochim Biophys Acta, 2007, 1773: 283–308. DOI:10.1016/j.bbamcr.2006.04.014 |
| [10] | Zhou Q, Yu LS, Zeng S. Personalized dosing from perspective of pharmacogenomics of drug metabolizing enzymes and transporters[J]. Acta Pharm Sin (药学学报), 2017, 52: 1–7. |
| [11] | Gillet JP, Efferth T, Remacle J. Chemotherapy-induced resis tance by ATP-binding cassette transporter genes[J]. Biochim Biophys Acta, 2007, 1775: 237–262. |
| [12] | Zheng Y, Yin JY, Zhou HH, et al. Advances in relationship of genetic polymorphism with the toxicity caused by platinum-based therapy[J]. Chin J Clin Pharm Therap (中国临床药理学与治疗学杂志), 2014, 19: 1051–1056. |
| [13] | Eljack ND, Ma HY, Drucker J, et al. Mechanisms of cell uptake and toxicity of the anticancer drug cisplatin[J]. Metallomics, 2014, 6: 2126–2133. DOI:10.1039/C4MT00238E |
| [14] | Huang D, Wang C, Duan Y, et al. Targeting Oct2 and P53: formononetin prevents cisplatin-induced acute kidney injury[J]. Toxicol Appl Pharmacol, 2017, 326: 15–24. DOI:10.1016/j.taap.2017.04.013 |
| [15] | Ciarimboli G. Membrane transporters as mediators of cisplatin side-effects[J]. Anticancer Res, 2014, 34: 547–550. |
| [16] | Franke RM, Kosloske AM, Lancaster CS, et al. Influence of Oct1/Oct2-deficiency on cisplatin-induced changes in urinary N-acetyl-beta-D-glucosaminidase[J]. Clin Cancer Res, 2010, 16: 4198–4206. DOI:10.1158/1078-0432.CCR-10-0949 |
| [17] | Ciarimboli G, Deuster D, Knief A, et al. Organic cation transporter 2 mediates cisplatin-induced oto-and nephrotoxicity and is a target for protective interventions[J]. Am J Pathol, 2010, 176: 1169–1180. DOI:10.2353/ajpath.2010.090610 |
| [18] | Harrach S, Ciarimboli G. Role of transporters in the distribution of platinum-based drugs[J]. Front Pharmacol, 2015, 6: 85. |
| [19] | Iwata K, Aizawa K, Kamitsu S, et al. Effects of genetic variants in SLC22A2 organic cation transporter 2 and SLC47A1 multidrug and toxin extrusion 1 transporter on cisplatin-induced adverse events[J]. Clin Exp Nephrol, 2012, 16: 843–851. DOI:10.1007/s10157-012-0638-y |
| [20] | Pabla N, Murphy RF, Liu K, et al. The copper transporter Ctr1 contributes to cisplatin uptake by renal tubular cells during cisplatin nephrotoxicity[J]. Am J Physiol Renal Physiol, 2009, 296: 505–511. |
| [21] | Ivy KD, Kaplan JH. A re-evaluation of the role of hCTR1, the human high-affinity copper transporter, in platinum-drug entry into human cells[J]. Mol Pharmacol, 2013, 83: 1237–1246. DOI:10.1124/mol.113.085068 |
| [22] | Liu JJ, Jamieson SM, Subramaniam J, et al. Neuronal expression of copper transporter 1 in rat dorsal root ganglia: association with platinum neurotoxicity[J]. Cancer Chemo ther Pharmacol, 2009, 64: 847–856. DOI:10.1007/s00280-009-1017-6 |
| [23] | Ip V, Liu JJ, Mercer JF, et al. Differential expression of ATP7A, ATP7B and CTR1 in adult rat dorsal root ganglion tissue[J]. Mol Pain, 2010, 6: 53. |
| [24] | Yonezawa A, Inui K. Organic cation transporter OCT/ SLC22A and H+/organic cation antiporter MATE/SLC47A are key molecules for nephrotoxicity of platinum agents[J]. Biochem Pharmacol, 2011, 81: 563–568. DOI:10.1016/j.bcp.2010.11.016 |
| [25] | Wen X, Buckley B, Mccandlish E, et al. Transgenic expres sion of the human MRP2 transporter reduces cisplatin accu mulation and nephrotoxicity in Mrp2-null mice[J]. Am J Pathol, 2014, 184: 1299–1308. DOI:10.1016/j.ajpath.2014.01.025 |
| [26] | Karasawa T, Steyger PS. An integrated view of cisplatin-induced nephrotoxicity and ototoxicity[J]. Toxicol Lett, 2015, 237: 219–227. DOI:10.1016/j.toxlet.2015.06.012 |
| [27] | More SS, Akil O, Ianculescu AG, et al. Role of the copper transporter, CTR1, in platinum-induced ototoxicity[J]. J Neurosci, 2010, 30: 9500–9509. DOI:10.1523/JNEUROSCI.1544-10.2010 |
| [28] | Deng JH. Advances in pharmocogenetics of platinum neuro toxicity[J]. Chin J Clin Pharm Ther (中国临床药理学与治疗学), 2012, 17: 458–462. |
| [29] | Xu X, Ren H, Zhou B, et al. Prediction of copper transport protein 1 (CTR1) genotype on severe cisplatin induced toxicity in non-small cell lung cancer (NSCLC) patients[J]. Lung Cancer, 2012, 77: 438–442. DOI:10.1016/j.lungcan.2012.03.023 |
| [30] | Sprowl JA, Ciarimboli G, Lancaster CS, et al. Oxaliplatin-induced neurotoxicity is dependent on the organic cation transporter OCT2[J]. Proc Natl Acad Sci U S A, 2013, 110: 11199–11204. DOI:10.1073/pnas.1305321110 |
| [31] | Liu YQ, Zheng XL, Yu QQ, et al. Epigenetic activation of the drug transporter OCT2 sensitizes renal cell carcinoma to oxaliplatin[J]. Sci Transl Med, 2016, 8: 348–397. |
| [32] | Wen YJ, Jin LS, Wang YQ, et al. Establishment and application of cell models with stable expression of hOCTN1/2[J]. Acta Pharm Sin (药学学报), 2016, 51: 931–937. |
| [33] | Jong NN, Nakanishi T, Liu JJ, et al. Oxaliplatin transport mediated by organic cation/carnitine transporters OCTN1 and OCTN2 in overexpressing human embryonic kidney 293 cells and rat dorsal root ganglion neurons[J]. J Pharmacol Exp Ther, 2011, 338: 537–547. DOI:10.1124/jpet.111.181297 |
| [34] | Yonezawa A, Masuda S, Yokoo S, et al. Cisplatin and oxaliplatin, but not carboplatin and nedaplatin, are substrates for human organic cation transporters (SLC22A1-3 and multidrug and toxin extrusion family)[J]. J Pharmacol Exp Ther, 2006, 319: 879–886. DOI:10.1124/jpet.106.110346 |
| [35] | Fujita D, Saito Y, Nakanishi T, et al. Organic anion trans porting polypeptide (OATP)2B1 contributes to gastrointestinal toxicity of anticancer drug SN-38, active metabolite of irinotecan hydrochloride[J]. Drug Metab Dispos, 2016, 44: 1–7. |
| [36] | Iusuf D, Ludwig M, Elbatsh A, et al. OATP1A/1B transporters affect irinotecan and SN-38 pharmacokinetics and carboxyles terase expression in knockout and humanized transgenic mice[J]. Mol Cancer Ther, 2014, 13: 492–503. DOI:10.1158/1535-7163.MCT-13-0541 |
| [37] | Katsube Y, Tsujimoto M, Koide H, et al. Cooperative inhibitory effects of uremic toxins and other serum components on OATP1B1-mediated transport of SN-38[J]. Cancer Chemo ther Pharmacol, 2017, 79: 783–789. DOI:10.1007/s00280-017-3276-y |
| [38] | Di Martino MT, Arbitrio M, Leone E, et al. Single nucleotide polymorphisms of ABCC5 and ABCG1 transporter genes correlate to irinotecan-associated gastrointestinal toxicity in colorectal cancer patients: a DMET microarray profiling study[J]. Cancer Biol Ther, 2011, 12: 780–787. DOI:10.4161/cbt.12.9.17781 |
| [39] | Li M, Seiser EL, Baldwin RM, et al. ABC transporter poly morphisms are associated with irinotecan pharmacokinetics and neutropenia[J]. Pharmacogenomics J, 2016. DOI:10.1038/tpj.2016.75 |
| [40] | Mallick P, Basu S, Moorthy B, et al. Role of Toll-like receptor 4 in drug-drug interaction between paclitaxel and irinotecan in vitro[J]. Toxicol In Vitro, 2017, 41: 75–82. DOI:10.1016/j.tiv.2017.02.019 |
| [41] | Muhrez K, Benz-De Bretagne I, Nadal-Desbarats L, et al. Endogenous metabolites that are substrates of organic anion transporter's (OATs) predict methotrexate clearance[J]. Pharmacol Res, 2017, 118: 121–132. DOI:10.1016/j.phrs.2016.05.021 |
| [42] | Nigam SK, Bush KT, Bhatnagar V. Drug and toxicant handling by the OAT organic anion transporters in the kidney and other tissues[J]. Nat Clin Pract Nephrol, 2007, 3: 443–448. |
| [43] | Lima A, Bernardes M, Azevedo R, et al. SLC19A1, SLC46A1 and SLCO1B1 polymorphisms as predictors of methotrexate-related toxicity in portuguese rheumatoid arthritis patients[J]. Toxicol Sci, 2014, 142: 196–209. DOI:10.1093/toxsci/kfu162 |
| [44] | Vlaming ML, Van Esch A, Pala Z, et al. Abcc2 (Mrp2), Abcc3 (Mrp3), and Abcg2 (Bcrp1) are the main determinants for rapid elimination of methotrexate and its toxic metabolite 7-hydroxymethotrexate in vivo[J]. Mol Cancer Ther, 2009, 8: 3350–3359. DOI:10.1158/1535-7163.MCT-09-0668 |
| [45] | Gregers J, Green H, Christensen IJ, et al. Polymorphisms in the ABCB1 gene and effect on outcome and toxicity in childhood acute lymphoblastic leukemia[J]. Pharmacoge nomics J, 2015, 15: 372–379. DOI:10.1038/tpj.2014.81 |
| [46] | Tanabe Y, Shimizu C, Hamada A, et al. Paclitaxel-induced sensory peripheral neuropathy is associated with an ABCB1 single nucleotide polymorphism and older age in Japanese[J]. Cancer Chemother Pharmacol, 2017, 79: 1179–1186. DOI:10.1007/s00280-017-3314-9 |
| [47] | Frederiks CN, Lam SW, Guchelaar HJ, et al. Genetic poly morphisms and paclitaxel-or docetaxel-induced toxicities: a systematic review[J]. Cancer Treat Rev, 2015, 41: 935–950. DOI:10.1016/j.ctrv.2015.10.010 |
| [48] | Berthiaume JM, Wallace KB. Adriamycin-induced oxidative mitochondrial cardiotoxicity[J]. Cell Biol Toxicol, 2007, 23: 15–25. DOI:10.1007/s10565-006-0140-y |
| [49] | Hudachek SF, Gustafson DL. Coadministration of lapatinib increases exposure to docetaxel but not doxorubicin in the small intestine of mice[J]. Anticancer Drug, 2013, 24: 958–968. DOI:10.1097/CAD.0b013e3283645e1a |
| [50] | Mealey KL, Fidel J. P-glycoprotein mediated drug interac tions in animals and humans with cancer[J]. J Vet Intern Med, 2015, 29: 1–6. DOI:10.1111/jvim.12525 |
| [51] | Tran A, Jullien V, Alexandre J, et al. Pharmacokinetics and toxicity of docetaxel: role of CYP3A, MDR1, and GST poly morphisms[J]. Clin Pharmacol Ther, 2006, 79: 570–580. DOI:10.1016/j.clpt.2006.02.003 |
| [52] | Bohanec Grabar P, Logar D, Lestan B, et al. Genetic determinants of methotrexate toxicity in rheumatoid arthritis patients: a study of polymorphisms affecting methotrexate transport and folate metabolism[J]. Eur J Clin Pharmacol, 2008, 64: 1057–1068. DOI:10.1007/s00228-008-0521-7 |
| [53] | Vlaming ML, Pala Z, Van Esch A, et al. Impact of Abcc2 (Mrp2) and Abcc3 (Mrp3) on the in vivo elimination of metho trexate and its main toxic metabolite 7-hydroxymethotrexate[J]. Clin Cancer Res, 2008, 14: 8152–8160. DOI:10.1158/1078-0432.CCR-08-1609 |
| [54] | Vulsteke C, Lambrechts D, Dieudonne A, et al. Genetic variability in the multidrug resistance associated protein-1 (ABCC1/MRP1) predicts hematological toxicity in breast cancer patients receiving (neo-)adjuvant chemotherapy with 5-fluorouracil, epirubicin and cyclophosphamide (FEC)[J]. Ann Oncol, 2013, 24: 1513–1525. DOI:10.1093/annonc/mdt008 |
| [55] | Low SK, Kiyotani K, Mushiroda T, et al. Association study of genetic polymorphism in ABCC4 with cyclophosphamide-induced adverse drug reactions in breast cancer patients[J]. J Hum Genet, 2009, 54: 564–571. DOI:10.1038/jhg.2009.79 |
| [56] | Burger H, Loos WJ, Eechoute K, et al. Drug transporters of platinum-based anticancer agents and their clinical signify cance[J]. Drug Resist Updat, 2011, 14: 22–34. DOI:10.1016/j.drup.2010.12.002 |
| [57] | Jabir RS, Naidu R, Annuar MA, et al. Pharmacogenetics of taxanes: impact of gene polymorphisms of drug transporters on pharmacokinetics and toxicity[J]. Pharmacogenomics, 2012, 13: 1979–1988. DOI:10.2217/pgs.12.165 |
| [58] | Tamura M, Kondo M, Horio M, et al. Genetic polymorphisms of the adenosine triphosphate-binding cassette transporters (ABCG2, ABCB1) and gefitinib toxicity[J]. Nagoya J Med Sci, 2012, 74: 133–140. |
| [59] | Rhodes DR, Yu J, Shanker K, et al. ONCOMINE: a cancer microarray database and integrated data-mining platform[J]. Neoplasia, 2004, 6: 1–6. DOI:10.1016/S1476-5586(04)80047-2 |
| [60] | Schaeffeler E, Hellerbrand C, Nies AT, et al. DNA methyla tion is associated with downregulation of the organic cation transporter OCT1 (SLC22A1) in human hepatocellular carci noma[J]. Genome Med, 2011, 3: 82. DOI:10.1186/gm298 |
 2017, Vol. 52
2017, Vol. 52


