2. 山西中医学院中药学院, 山西 太原 030619;
3. 山西大学化学化工学院, 山西 太原 030006
2. College of Chinese Material Medicine, Shanxi University of Traditional Chinese Medicine, Taiyuan 030619, China;
3. College of Chemistry and Chemical Engineering; Shanxi University, Taiyuan 030006, China
葛根芩连汤始载于《伤寒论》, 由葛根、黄芩、黄连和甘草4味药组成, 是中药治疗急性腹泻的经典方剂。作为经方, 现代医家溯本求源, 灵活运用, 将其作为治疗糖尿病及其并发症的基础方[1,2], 可谓古方新用、异病同治。药理研究表明, 葛根芩连汤(GQD)对高糖高脂饲料联合链脲佐菌素(STZ)诱导的2型糖尿病(T2DM)大鼠有明显治疗效果[3]。
目前, GQD市售成药产品较多, 以片剂、微丸、胶囊剂、口服液和颗粒剂等为主[4], 但以上剂型存在不能辨证论治和随证化裁加减的缺点。汤剂是临床应用最成熟、范围最广的药物服用方式。煮散基于传统中药煎煮用药形式, 渊于先秦, 历史悠久。“煮散”一词首见于唐代孙思邈《备急千金要方》, 宋代达到全盛, 《太平惠民和剂局方》汤剂方中近一半为煮散法[5]。煮散可保留汤剂优点, 又有节省中药资源、节约能源和简化工艺等特点[6]。陈士林等[7]进一步提出“中药精准煮散饮片”的概念, 倡导煮散标准化、规范化工艺制备和全过程质量追溯, 从而提高中医临床疗效的稳定性和临床评价的可靠性。
近期, 不少学者以经典方剂为研究对象进行了煮散与饮片的对比研究, 如对四物汤、四君子汤和四逆汤煮散与原饮片化学成分提取率的比较研究[7]。仝小林课题组对GQD煮散与传统饮片的煎煮工艺进行了系统研究, 发现煮散有效成分煎出率和干膏得率均高于传统饮片[7-9]; 同时发现, GQD煮散与饮片调节空腹血糖和糖化血清蛋白作用相当[10], 降糖降脂效应相当[11]。
综上, 多数研究集中在GQD煮散工艺优化、煮散与饮片汤剂化学成分及单一或几个药效指标比较研究, 未见GQD煮散和饮片对T2DM干预作用的代谢组学比较研究。1H NMR代谢组学技术能全面分析生物体的内源性代谢产物, 考察生物体在生理和病理状态下内源性小分子代谢轮廓及代谢产物的动态变化, 具有整体性、动态性和系统性的特点[12], 与中医药学的治疗特点有着异曲同工之妙。本研究以T2DM大鼠血液内源性代谢物的变化规律为切入点, 从代谢组学的角度, 研究GQD煮散与传统饮片干预T2DM大鼠的生物学机制, 为煮散的临床应用提供整体动物水平的理论和方法依据。
材料与方法仪器与试剂 Bruker 600-MHz AVANCE III NMR Spectrometer (600.13 MHz质子频率, 德国布鲁克公司); Waters Acquity UPLC H-Class系统(美国Waters公司), 包括样品管理器、四元溶剂管理器、二极管阵列检测器及Empower工作站; 安稳型血糖测定仪(三诺生物传感股份有限公司); 十万分之一天平(德国赛得利斯集团)。柠檬酸纳(批号: 20150116)、柠檬酸(批号: 20141108) 购自国药集团化学试剂有限公司; 水合氯醛(批号: 20150306) 购自天津市光复精细化工研究所; 乙腈(色谱纯, Merck公司); 甲醇、甲酸(色谱纯, 天津市大茂化学试剂厂); 重水(Norell, Landisville, 美国)。高糖高脂饲料配方为猪油10%、蔗糖5%、蛋黄粉5%、胆固醇1%、胆盐0.1%、普通饲料78.9%, 购自于北京诺康源有限公司。
药品 葛根(批号: 1403090191) 购自安国市祁澳中药饮片有限公司; 黄芩(批号: 140323)、黄连(批号: 131214) 均购自亳州蜀中药业有限公司; 甘草(批号: 1204037) 购自安国市药兴药材有限公司饮片加工厂。以上饮片经山西中医学院中药鉴定教研室裴香萍副教授分别鉴定为豆科植物野葛[Pueraria lobata (Willd.) Ohwi]的干燥根、唇形科植物黄芩(Scutellaria baicalensis Georgi.)的干燥根、毛茛科植物(Coptis chinensis Franch.)的干燥根茎、豆科植物乌拉尔甘草(Glycyrrhiza uralensis Fisch.)的干燥根及根茎。3'-羟基葛根素(批号: 141013)、葛根素(批号: 20130907)、大豆苷(批号: 130527)、大豆苷元(批号: 130715)、黄芩苷(批号: 131109)、汉黄芩苷(批号: 130612)、黄芩素(批号: 130625)、汉黄芩素(批号: 130612)、黄连碱(批号: 130628)、小檗碱(批号: 130526)、巴马汀(批号: 130427) 对照品均购自四川省维克奇生物科技有限公司, 甘草苷(批号: 130420)、甘草素(批号: 131024)、甘草酸铵(批号: 130803) 对照品均购自南京春秋生物工程有限公司, 纯度≥98%。格列美脲片(批号: 20141202) 购自上海天赐福生物工程有限公司; 链脲佐菌素(STZ) (批号: 1126C0314) 购自Sigma公司。
实验动物 SPF级雄性SD大鼠62只, 体重(200 ± 20) g, 由北京维通利华实验动物技术有限公司提供, 许可证号为SCXK (京) 2014-0013。动物饲养室保持温度22~25 ℃, 相对湿度45%左右, 自然昼夜节律光照, 动物自由摄食, 饮水。
GQD 饮片制备按8:3:3:2的比例称取葛根、黄芩、黄连和甘草饮片共1.2 kg, 加入5倍量的水, 浸泡30 min, 加热至沸, 煎煮30 min, 滤过; 滤渣再加4倍量的水, 加热至沸, 煎煮30 min, 滤过。合并两次滤液, 浓缩至2 g·mL-1。
GQD 煮散制备取葛根、黄芩、黄连、甘草适量分别粉碎, 过60目筛, 取药粉按饮片煎剂比例和用量混合均匀, 加入5倍量水, 浸泡30 min, 加热至沸, 煎煮30 min, 期间持续搅拌, 滤过; 滤渣再加4倍量水, 加热至沸, 煎煮30 min, 持续搅拌, 滤过, 合并两次滤液, 浓缩至2 g·mL-1。
HPLC指纹图谱分析色谱条件 色谱柱为Agela-MP C18 (2.1 mm × 250 mm, 5 µm); 检测波长为254 nm; 流动相: A (乙腈)-B (0.1%甲酸水); 梯度洗脱: 0~25 min, 5% → 20% A; 25~30 min, 20% A; 30~35 min, 20% → 22% A; 35~55 min, 22% → 40% A; 55~65 min, 40% → 63% A; 65~70 min, 63% → 80% A。流速为1.0 mL·min-1; 进样量10 μL; 柱温30 ℃。
对照品溶液制备 分别取14个对照品适量, 精密称定, 加甲醇制成每1 mL含0.2 mg的单一对照品储备液, 各精密量取0.1 mL, 置2 mL量瓶中, 加甲醇定容至刻度, 摇匀, 制成混合对照品溶液。
供试品溶液制备 分别取上述GQD饮片与煮散浸膏约0.1 g, 精密称定, 置具塞锥形瓶中, 加70%甲醇25 mL, 称重, 超声提取30 min, 放冷, 70%甲醇补足重量, 摇匀, 滤过, 取续滤液, 0.45 µm微孔滤膜滤过, 作为供试品溶液。
方法学验证 精密度:取同一混合对照品溶液, 连续进样6次, 计算各共有峰相对保留时间和相对峰面积的RSD值; 稳定性:取同一份GQD饮片和煮散, 按供试品溶液制备方法制备, 在上述色谱条件下分别于0、3、5、7、12和24 h进行测定, 并计算各共有峰的相对保留时间和相对峰面积的RSD值。重复性:分别取同一批GQD饮片和煮散各6份, 按供试品溶液制备方法制备, 在上述色谱条件下测定, 计算各共有峰相对保留时间和相对峰面积的RSD值。
糖尿病大鼠模型的制备及实验分组 大鼠适应性喂饲1周后, 随机选取10只喂养普通饲料, 另外52只喂饲高糖高脂饲料4周后, 大鼠按35 mg·kg-1空腹腹腔注射由柠檬酸缓冲液新鲜配制的STZ溶液, 普通饲料喂饲的大鼠同时注射等体积的柠檬酸缓冲液。注射STZ溶液1周后, 尾尖取血测定FBG浓度, 血糖值≥11.1 mmol·L-1认为造模成功。喂饲普通饲料的10只大鼠为正常对照组, 继续喂饲常规饲料, 灌胃给予生理盐水。将造模成功的T2DM大鼠(52只)随机分为4组, 每组13只, 分别为模型组(生理盐水)、阳性药组(格列美脲0.67 mg·kg-1)、GQD饮片组(2 g·mL-1)和GQD煮散组(2 g·mL-1), 均喂饲高糖高脂饲料, 按1 mL·100 g-1剂量灌胃给药, 持续8周。
一般情况观察与体质量测定 每日观察各组大鼠外表、精神状态、活动情况、进食量、饮水量及小便等的变化。分别于造模(注射STZ)前1天、造模成功后第0、7、14、21、28、35、42、49、56天(禁食12 h)称量大鼠体质量。
血糖的测定 分别于造模(注射STZ)前1天及造模成功后第0、14、28、42、56天(禁食12 h)尾尖采血, 血液滴于安装在血糖仪的试纸上直接测定空腹血糖(fasting blood glucose, FBG)。
血清样本收集及处理 末次给药前, 各组动物禁食12 h, 给药后1 h, 以5%水合氯醛麻醉, 腹主动脉取血, 离心(4 ℃, 3 500 r·min-1, 10 min), 分离血清于-80 ℃冷冻保存。
1H NMR样品的制备 精密吸取血清样品450 µL, 加入重水300 µL, 涡旋30 s, 离心(4 ℃, 13 000 r·min-1, 15 min), 取上清液600 μL转移至5 mm的核磁管中待测。
1H NMR测定及条件样品在25 ℃下于600 MHz NMR仪上测定, 测定频率为600.13 MHz, 采用Carr-Purcell-Meiboom-Gill (CPMG)脉冲序列, 扫描次数为64, 以衰减蛋白质和脂蛋白的宽峰, 谱宽12 019.2 Hz, 脉冲时间为14 μs, 采样时间为2.72 s, 延迟时间为1.0 s, 采样数据点为65 536, 采样间隔为40.5 μs。
1H NMR图谱分析 NMR数据导入软件MestReNova (version 8.0.1, Mestrelab Research, Santiago de Compostella, Spain)进行处理。NMR谱图中, 手动进行相位、基线调整, 以乳酸的化学位移δ = 1.33为标准进行化学位移校正, 以0.01积分段对化学位移区间δ 0.82~8.49进行分段积分, 其中δ 4.69~5.18 (残余水峰)不进行积分, 积分数据进行归一化, 导入Excel表中进行下一步多元统计分析。
统计学分析 处理后的数据采用SIMCA-P 13.0 (瑞典Umetrics, umea)软件进行主成分分析(principal component analysis, PCA), 再用正交偏最小二乘判别分析法(Orthogonal PLS-DA, OPLS-DA)的S-plot图结合VIP > 1及SPSS 16.0软件进行t检验, 确定潜在生物标志物, 各组实验数据用 x±s表示。
结果 1 GQD饮片与煮散指纹图谱 1.1 方法学考察 1.1.1 精密度14个共有峰相对保留时间和相对峰面积的RSD分别为0.01%~1.45%和0.36%~1.90%, 说明各主要色谱峰的相对保留时间和峰面积比值基本一致, 表明仪器精密度良好。
1.1.2 稳定性GQD饮片样品中14个共有峰相对保留时间和相对峰面积的RSD分别为0.05%~1.48%和0.20%~1.90%, 表明饮片样品在24 h内稳定。煮散样品的结果显示共有峰相对保留时间和相对峰面积的RSD分别为0.47%~1.82%和0.04%~1.73%, 表明煮散样品在24 h内稳定。
1.1.3 重复性同一批GQD样品14个共有峰相对保留时间和相对峰面积的RSD分别为0.05%~1.42%和0.07%~1.37%;煮散样品的结果显示各共有峰相对保留时间和相对峰面积的RSD分别为0.12%~1.64%和0.85%~1.71%, 表明提取方法的重复性良好。
1.2 GQD指纹图谱的建立及相似度计算评价6批GQD煮散的HPLC指纹图谱及对照指纹图谱见图 1。采用“中药色谱指纹图谱相似度评价系统(2008版)”软件分别对6批GQD饮片与煮散样品HPLC指纹图谱进行数据处理, 结果显示6批GQD饮片样品相似度在0.993~1.000之间, 6批GQD煮散的相似度在0.994~0.998之间, 表明GQD饮片和煮散实验样品质量均匀可控。

|
Figure 1 HPLC fingerprints of 6 batches of Gegen Qinlian Decoction (GQD) Boiled powder (1: 3'-Hydroxypuerarin; 2: Puerarin; 3: Daidzin; 4: Liquiritin; 5: Coptisine; 6: Berberine; 7: Palmatine; 8: Baicalin; 9: Liquiritigenin; 10: Daidzein; 11: Wogonoside; 12: Baicalein; 13: Ammonium glycyrrhizinate; 14: Wogonin) |
依据对照品和色谱保留行为对14个共有峰进行了鉴定。14个共有峰包括10个黄酮类、3个生物碱类和1个三萜皂苷类化合物。
2 药效学研究 2.1 大鼠一般情况及体质量分析造模前大鼠生长发育良好, 精力旺盛, 活动频繁, 毛发顺滑有光泽, 摄食量、饮水量均正常; 造模成功后, 大鼠陆续出现精神萎靡, 活动迟缓, 毛发凌乱失去光泽, 伴有多饮、多尿症状, 个别大鼠出现足部溃疡。给药后, 正常对照组大鼠表现如常, 模型组依旧精神萎靡, 不喜动, 毛发蓬松无光泽, 阳性药组、GQD饮片和煮散组随着时间推移, 精神状态逐渐好转, 活动次数增加, 尿量逐渐减少, 尤以阳性药组和GQD煮散组改善最为明显。另外, 实验过程中共有10只大鼠死亡, 其中模型组3只、阳性药组2只、GQD饮片组3只、GQD煮散组2只。
造模(注射STZ)前, 模型组大鼠体质量明显高于正常对照组(P < 0.05);造模(注射STZ)后, 阳性药组、GQD饮片和煮散组体质量均迅速降低, 显著低于正常对照组(P < 0.01), 说明STZ对大鼠胰腺造成化学性损伤, 出现了体质量减轻的症状。与模型组比较, 给药后各组大鼠体质量均有上升趋势, 从第6周开始, 阳性药组大鼠体质量明显升高(P < 0.05), 从第8周开始, GQD煮散组大鼠体质量明显升高(P < 0.05)。
2.2 大鼠空腹血糖分析造模(注射STZ)前, 各组大鼠FBG均保持在5.0~6.5 mmol·L-1之间, 且各组间无显著性差异; 造模(注射STZ)后, 各组FBG均显著高于正常对照组(P < 0.01), 说明单纯高脂饮食并未能造成高血糖模型, 只有通过高脂饮食联合STZ方可造成T2DM模型, 且各组FBG均值 > 11.1 mmol·L-1, 符合T2DM的诊断标准, 造模成功。分别给予阳性药、GQD饮片和煮散后, 大鼠FBG呈现下降趋势, 且具有显著性改变(P < 0.05, P < 0.01), 说明阳性药、GQD两种剂型均具有降血糖作用。
3 大鼠血清1H NMR图谱归属通过分析化学位移、偶合常数及峰型等信息, 结合文献及HMDB (http://www.hmdb.ca/)数据库对本实验图谱进行指认, 共鉴定37种化合物, 如图 2所示, 主要包括糖类、脂类、氨基酸和有机酸等, 其化学位移及谱峰归属见表 1。
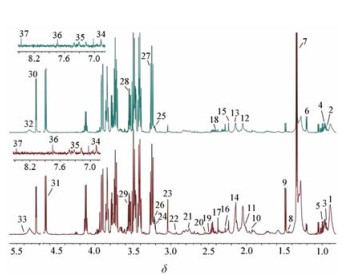
|
Figure 2 The typical1H NMR spectra of rat serum. A: Model group; B: Control group. The metabolites marked with numbers are shown in Table 1 |
| Table 1 Peak assignment in the 1H NMR spectra for endogenous metabolites in rat serum |
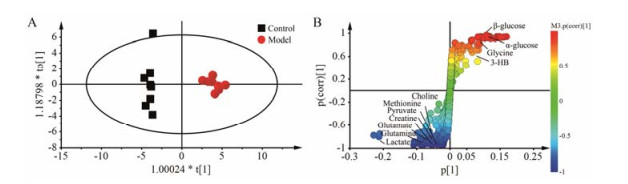
1H NMR图谱提供了血清中丰富的内源性代谢物信息, 为了进一步确定各组间代谢物的差异, 首先采用PCA分析方法对正常对照组、模型组、阳性药组、GQD饮片组和煮散组代谢轮廓进行分析。由图 3可知, 正常对照组与模型组沿t[2]轴明显分开, 表明模型复制成功; 给药组位于正常对照组与模型组之间, 表明阳性药、GQD饮片和煮散对T2DM大鼠的代谢轮廓均有回调, 该结果与行为学结果一致。

|
Figure 3 PCA scores plot derived from 1H NMR spectra of rat serum |
为了发现能够表征T2DM大鼠的潜在生物标志物, 对正常对照组与模型组进行有监督的OPLS-DA分析, 结果见图 4A。图 4B中“S”曲线中每一个点代表 1个变量, 依据图中离原点越远的点VIP (variable importance in the projection)值越大且变量VIP值越大对分组的贡献就越大的原则, 筛选到VIP > 1的代谢物作为潜在生物标志物的候选物, 对这些候选物所属的相对峰面积进行t检验, 得到15个峰面积具有显著差异(P < 0.05) 的潜在生物标志物, 结果见表 2。
|
Figure 4 OPLS-DA score plot (A) and corresponding S-plot (B) between control group and model group |
| Table 2 The change of endogenous metabolites in different groups. n = 8, x±s. #P < 0.05, ###P < 0.001 vs control group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
与正常对照组比较, 模型组大鼠血清3-羟基丁酸、氧化三甲胺、甘氨酸、β-葡萄糖和α-葡萄糖的含量升高, 乳酸、极低密度脂蛋白、醋酸、谷氨酸、蛋氨酸、谷氨酰胺、丙酮酸、肌酸、胆碱和甘油的含量降低。与模型组比较, 阳性药、GQD饮片和煮散均能不同程度地回调14种潜在生物标志物的含量, 其中GQD饮片和煮散均显著回调氧化三甲胺、甘氨酸、β-葡萄糖、乳酸、极低密度脂蛋白、谷氨酸、蛋氨酸、丙酮酸、肌酸和甘油等10种标志物, 且GQD饮片也对谷氨酰胺、胆碱和α-葡萄糖具有显著性回调作用, 结果见表 2。
5 代谢通路分析将15个差异代谢物输入到MetPA (http://www.metaboanalyst.ca/)数据库中进行通路分析, 通过Impact > 0.1筛选得到高糖高脂饲料联合STZ诱导的T2DM大鼠有6条代谢通路发生显著变化, 分别为甘氨酸、丝氨酸和苏氨酸代谢(0.29);甘油酯代谢(0.28);丙酮酸代谢(0.24);丙氨酸、天冬氨酸和谷氨酸代谢(0.15);糖酵解和糖异生代谢(0.13);半胱氨酸、甲硫氨酸代谢(0.12), 见图 5。
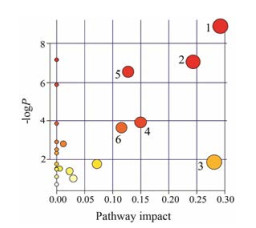
|
Figure 5 Summary diagram of pathway analysis with MetPA. 1: Glycine, serine and threonine metabolism; 2: Pyruvate metabolism; 3: Glycerolipid metabolism; 4: Alanine, aspartate and glutamate metabolism; 5: Glycolysis or gluconeogenesis; 6: Cysteine and methionine metabolism |
T2DM主要由于靶细胞膜上受体减弱或缺陷引起的胰岛素抵抗(IR)[13], 涉及到糖类和脂质代谢异常。体质量降低属于糖尿病的典型症状, 本研究中模型组大鼠造模成功后, 体质量均值比正常对照组低40.83 g, 且持续呈降低趋势, 实验结束时, 模型组大鼠的体质量均值比正常对照组低147.73 g。可能是由于机体无法充分利用葡萄糖产生能量, 致脂肪和蛋白质分解加强, 体质量逐渐下降。随着给药时间推移, 给药组体质量有升高趋势, 说明GQD饮片和煮散均能明显改善T2DM引起的大鼠体质量下降的现象。检测FBG是诊断糖尿病的依据, 也是判断病情和治疗效果的重要指标。本实验给予T2DM大鼠GQD, 经过8周的治疗, 可以有效降低FBG, 第8周实验结束时, 给药组FBG均显著低于模型组, 尤以煮散组更接近阳性药组。
血液中含有多种代谢物, 能够较为全面反映生物体的代谢状况。本研究采用1H NMR代谢组学结合多元统计分析找到T2DM大鼠血清中15个潜在生物标志物。GQD饮片、煮散和阳性药干预后均能不同程度地回调其中14个。与正常对照组相比, T2DM大鼠血清中丙酮酸和乳酸含量明显降低; α-葡萄糖和β-葡萄糖含量显著升高, 提示糖酵解途径受阻, 机体不能有效利用葡萄糖, 导致其水平增加, 而代谢产物丙酮酸和乳酸随之减少, 显示出典型的IR。给予GQD饮片和煮散干预后, 乳酸和丙酮酸含量明显升高, α-和β-葡萄糖含量降低。文献报道[14,15], 肌酸可以提高胰岛素敏感性, 促进胰岛素释放, 提高血糖利用率。本研究中T2DM大鼠血清中肌酸含量明显降低, 给予GQD饮片和煮散后, 其含量显著升高。由此可见, GQD饮片和煮散干预后均能影响糖酵解和丙酮酸代谢通路, 提示两种剂型可促进外周组织对糖的利用, 进而改善IR; 并可提高肌酸含量, 进而增强胰岛素敏感性, 降低血糖。
胆碱可降解为三甲胺, 它是胃肠道微生物产生氧化三甲胺(TMAO)的前体物质, 与肠道细菌紊乱有关[16]。Diaz等[17]发现2型糖尿病妊娠妇女尿液代谢物中TMAO含量异常增加。本研究中T2DM大鼠血清中胆碱含量降低, TMAO含量升高, 与上述研究结果一致。GQD饮片和煮散干预后TMAO和胆碱均回调并趋于正常, 但煮散对胆碱的回调作用未表现出显著性差异。甘油是葡萄糖合成的重要前体, 同时也是脂质的分解产物。文献报道[18], 高果糖饲喂可引起大鼠血浆脂质含量的升高和甘油含量的降低。本研究中T2DM大鼠血清中甘油和极低密度脂蛋白含量降低, 提示机体脂肪代谢发生紊乱。GQD饮片和煮散干预后两者明显上调, 提示GQD饮片和煮散可能通过调节甘油酯代谢和改变胃肠道微环境而发挥作用。
谷氨酰胺是人体含量最丰富的氨基酸, 在体内脱氨生成谷氨酸。谷氨酰胺作为糖代谢和氨基酸代谢的重要中间体, 能够改善IR, 减轻急性肾小管损伤[19]。本研究中T2DM大鼠血清中谷氨酰胺和谷氨酸含量降低, 可能是由于机体对T2DM高血糖肾损伤而做出的反应。给予GQD饮片和煮散干预后两者含量均升高。另外, 模型大鼠血清中甘氨酸含量升高, 可能是由于糖尿病高血糖引起某些细胞或器官存在一定程度的损伤。GQD饮片和煮散干预后甘氨酸含量明显降低。GQD饮片和煮散均可调节甘氨酸和谷氨酸代谢通路, 其作用机制尚需进一步研究。
综上, GQD饮片和煮散均能增加T2DM大鼠体质量, 并能有效降低FBG。代谢组学分析结果显示, 两种剂型均可通过调节能量代谢、脂质代谢和氨基酸代谢等途径而发挥作用, 未表现出显著差异。中药煮散剂是采用现代粉碎技术将药材制成的颗粒状饮片, 具有活性成分易于煎出、调配方便、配伍灵活、可随症加减、提高药材利用率等特点。本研究结果从代谢组学的角度为GQD煮散的临床应用提供了实验数据和理论基础。
| [1] | Tong XL, Zhao LH, Lian FM, et al. Clinical observations on the dose-effect relationship of Gegen Qin Lian Decoction on 54 out-patients with type 2 diabetes[J]. J Tradit Chin Med, 2011, 31: 56–59. DOI:10.1016/S0254-6272(11)60013-7 |
| [2] | Wen J, Zhao QH, Zhang J, et al. Optimization of boiled powder decoction technology for Gegen Qin Lian Decoction[J]. Chin Tradit Pat Med (中成药), 2016, 38: 2070–2073. |
| [3] | Li YM, Fan XM, Wang MY, et al. Therapeutic effects of Gegen Qinlian decoction and its mechanism of action on type 2 diabetic rats[J]. Acta Pharm Sin (药学学报), 2013, 48: 1415–1421. |
| [4] | Chen LH, Tang YP, Wang Q. Advances in studies on Gegen Qinlian Decoction[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 676–680. |
| [5] | Li R, Zhai HQ, Tian WL, et al. Comparative analysis between origin of cooked traditional Chinese medicine powder and modern formula granules[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 965–969. |
| [6] | Tong XL, Zhang JH, Mu LC, et al. Boiling powder of traditional Chinese medicine afresh for saving the resource[J]. Chin New Drugs J (中国新药杂志), 2012, 21: 470–474. |
| [7] | Chen SL, Huang ZH, Qiu XH, et al. Precise powder decoction pieces in traditional Chinese medicine[J]. Mod Tradit Chin Med Mater-World Sci Technol (世界科学技术:中医药现代化), 2016, 18: 1430–1440. |
| [8] | Wen J, Zhao QH, Zhang J, et al. Influence of different boiling methods and values on quality of Gegen Qinlian Decoction[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 58–61. |
| [9] | Zhang JH, Zhang J, Liu F, et al. Influence of decocting time and water amount on dissolution of main ingredients from Gegen Qinlian Decoction[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 13–17. |
| [10] | Zhang Y. Compared the Difference of Effection of Ge Gen Qin Lian Decoction and Improved Boiled Powder on Reducing Blood Glucose of T2DM Rats (葛根芩连汤饮片煎煮与改良煮散对T2DM大鼠降糖疗效的对比研究)[D]. Beijing: China Academy of Chinese Medicine Sciences, 2013. |
| [11] | Li J. A Research into Gegen Qinlian Decoction Fermentation Broth's Functions of Declining T2DM rats' Sugar and Fat and Its Mechanism (葛根芩连汤发酵液对T2DM大鼠降糖降脂作用及机理研究)[D]. Wuhan: Hubei University of Chinese Medicine, 2016. |
| [12] | Yue YH, He P, Sun YN, et al. Anti-inflammatory active fraction screening and mechanism of unripe Forsythiae Fructus based on 1H NMR metabolomics[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 3443–3450. |
| [13] | Rabbani N, Thornalley PJ. The critical role of methylglyoxal and glyoxalase in diabetic nephropathy[J]. Diabetes, 2014, 63: 50–52. DOI:10.2337/db13-1606 |
| [14] | Wu H, Feng MY. Effects of creatine supplement on metabolism of diabetic rats[J]. J Beijing Univ Phys Edu (北京体育大学学报), 2001, 24: 323–325+327. |
| [15] | Wallimann T, Riek U, Möddel M. Intradialytic creatine supplementation:a scientific rationale for improving the health and quality of life of dialysis patients[J]. Med Hypotheses, 2017, 99: 1–14. DOI:10.1016/j.mehy.2016.12.002 |
| [16] | Ma H, Wang YJ, Dong JG, et al. NMR-based metabonomics study of patients with cerebral infraction complication in type 2 diabetes mellitus[J]. Chin J Arterioscler (中国动脉硬化杂志), 2013, 21: 63–68. |
| [17] | Diaz SO, Pinto J, Graca G, et al. Metabolic biomarkers of prenatal disorders:exploratory NMR metabonomics study of second trimester maternal urine and blood plasma[J]. J Proteome Res, 2011, 10: 3732–3742. DOI:10.1021/pr200352m |
| [18] | Wang LL. The Metabonomic Study of Huanglian Jiedu Decoction on Improving Insulin Resistance (黄连解毒汤改善胰岛素抵抗的代谢组学研究)[D]. Guangzhou: Guangdong Pharmaceutical University, 2015. |
| [19] | Wang XF, Li MJ, Ge YC, et al. Serum and urinary metabolomic analysis in patients with diabetic nephropathy[J]. Chin J Nephrol Dialysis Transpl (肾脏病透析与肾移植杂志), 2016, 21: 201–209. |
 2017, Vol. 52
2017, Vol. 52


