2. 湖南中医药大学药学院, 湖南 长沙 410208
2. College of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
人参皂苷Rg1 (ginsenoside Rg1, Rg1, 图 1)是人参(Panax ginseng C.A. Meyer)的重要生物活性成分之一[1-3]。研究[1, 4-6]证实Rg1对多种神经递质的释放均起着调节作用, 如增加啮齿类动物大脑皮层中多巴胺和去甲肾上腺素的浓度。此外, Rg1可增加皮层及海马组织中乙酰胆碱的含量并促进其释放, 对学习记忆和长时程增强效应(LTP)具有明显易化和增强作用[2, 7-10]。本课题组前期研究发现, Rg1具有显著改善大鼠抑郁样行为的作用, 改善抑郁行为伴随的睡眠障碍、认知障碍和性功能障碍等优势, 但其抗抑郁作用机制尚未完全阐明。氟西汀是一种选择性5-羟色胺再摄取抑制剂(SSRI), 它经由强效地抑制神经元从突触间隙中摄取5-羟色胺(5-HT), 从而增加间隙中可供利用的神经递质5-HT, 以此用来改善情感状态, 是目前临床常用的治疗抑郁性精神障碍的药物, 并且常用来作为抑郁模型有效性的一个重要指标。为了进一步阐明Rg1抗抑郁的作用机制, 本实验选用氟西汀作为阳性药。

|
Figure 1 Chemical structure of ginsenoside Rg1 |
缝隙连接(gap junction, GJ)又称间隙连接、通讯连接, 是由连接相邻2个细胞之间的连接通道对接而成的一种特殊膜结构[11-13]。其中, 连接蛋白43 (connexins, Cx43) 细胞间隙连接通讯(gap junctional intercellular communication, GJIC)分布广泛, Cx43通道的开放和关闭决定了细胞间的耦联和缝隙连接通道功能[14-16]。本实验室前期研究表明, 前额皮质区星形胶质细胞缝隙连接蛋白Cx43介导GJIC功能异常可导致大鼠抑郁样行为发生, 并且与抗抑郁药物作用密切相关[17]。Cx43磷酸化调控Cx43缝隙连接通道的开放和关闭, 目前研究表明Cx43的C端241~382为主要磷酸化区, 相关的蛋白激酶有PKA、PKC、蛋白酪氨酸激酶(PTK)、丝氨酸/苏氨酸蛋白激酶、钙调蛋白激酶Ⅱ (CaMKⅡ)和Akt[13, 18]。Cx43丝氨酸368位点的磷酸化介导缝隙连接通道的关闭, 阻断细胞间的物质交换[2, 19]。因而, 本研究的目的是探讨Rg1发挥抗抑郁作用是否与Cx43磷酸化相关的蛋白激酶活性相关, 为Rg1作为抑郁症治疗药物的研究提供理论基础。
材料与方法材料 Rg1由吉林大学化学学院教研室提供, 纯度≥98%, 用生理盐水溶解稀释, 过滤除菌。DMEM/ F12培养基、胎牛血清和马血清购自美国Gibco公司; PKA特异性抑制剂H89、Src抑制剂PP2、PKC抑制剂GO6076、ERK抑制剂PD98059、p38抑制剂SB203580、JNK抑制剂SP600125、CaMKII抑制剂KN-62、Akt抑制剂BAY1125976、皮质酮(corticosterone, CORT)和氟西汀(fluoxetine, FLX)购自美国Sigma公司; anti-Cx43抗体和anti-Cx43-pS368抗体购自美国Cell Signaling Technology公司; 胞浆胞膜胞核蛋白提取试剂盒、ECL发光液购自北京普利莱基因生物技术公司。
细胞培养 将新生2~4天大鼠置于无菌条件下断头, 取鼠脑组织转移至预冷的DMEM/F12培养基中, 用尖镊去除脑膜, 分离前额叶皮质区和海马区组织, 将其剪成碎块, 用巴斯德移液管转移至分离消化液, 37 ℃消化10 min后用胎牛血清终止消化, 室温1.1 r·min-1离心, 5 min后弃上清。用含10%胎牛血清DMEM/F12培养基重悬沉淀, 在37 ℃, 5% CO2条件下培养[11]。每周更换培养基2次。10天后在37 ℃恒温摇床上180 r·min-1, 4 h后去除上清, 即得到纯净的原代星形胶质细胞, 并采用免疫荧光染色鉴定纯度。
药物干预及实验分组 将培养细胞分成5组检测细胞生存率。① 正常组:不加任何处理因素; ② 溶剂对照组:在正常组基础上, 加入CORT的溶剂无水乙醇; ③ 药物处理组:在正常组基础上, 加入终浓度为1 μmol·L-1氟西汀或10 μmol·L-1 Rg1和200 μmol·L-1 CORT; ④ 抑制剂不同浓度处理组:在正常组基础上, 加入H-89 (10、20和30 μmol·L-1)、GO6076 (0.1、1和10 μmol·L-1)、PD98059 (0.5、1和2 μmol·L-1)、SB203580 (0.5、1和2 μmol·L-1)、SP600125 (10、20、30和40 μmol·L-1)、KN-62 (0.1、1和10 μmol·L-1)、PP2 (0.5、1和2 μmol·L-1)、BAY1125976 (1、5和10 μmol·L-1)。⑤ 不同的抑制剂处理组:在正常组基础上, 加入终浓度为10 μmol·L-1 Rg1和于④ 组中筛选的不同浓度的抑制剂。
细胞生存率检测 通过Cell Counting Kit (CCK8, Dojindo, Japan)检测细胞生存率, 细胞接种于96孔板中, 给予药物处理24 h, 加入CCK8溶液于37 ℃孵育1 h。在450 nm酶标仪检测吸光度值。
细胞形态学观察 细胞经药物干预后, 在倒置荧光显微镜(奥林巴斯IX70, 日本)下观察细胞形态。
Western blot测定蛋白表达 将药物处理后的细胞置于冰上, 利用胞膜胞浆胞核蛋白提取试剂盒提取胞膜蛋白。10% SDS-PAGE分离样品, 转膜1 h, 3%牛血清白蛋白溶液室温封闭2 h, 加入anti-Cx43抗体和anti-Cx43-pS368抗体4 ℃孵育过夜。洗膜后, 加入二抗室温孵育2 h。再加入ECL发光液, 凝胶成像系统采集图像。
统计学分析 数据以x±s表示, 各组间用单因素方差分析和组间t检验进行统计差异性检验, P < 0.05认为存在显著性差异。
结果 1 Rg1对皮质酮介导星形胶质细胞毒性的影响通过皮质酮造成的海马和前额叶皮质星形胶质细胞损伤模型, 并检测Rg1对细胞生存率的影响。由图 2可知, 与正常组比较, 用CORT诱导的模型组细胞生存率下降(P < 0.001);与CORT组相比, 预孵育Rg1 (10 μmol·L-1)或FLX (1 μmol·L-1)时, 细胞生存率明显增加(P < 0.01, P < 0.001)。说明预孵育FLX (1 μmol·L-1)和Rg1 (10 μmol·L-1)可以发挥抗皮质酮损伤的作用。

|
Figure 2 Ginsenoside Rg1 and antidepressants fluoxetine (FLX) protect the hippocampal astrocytes from the damage by corticosterone (CORT). n = 6, x±s. ###P < 0.001 vs Ctrl group; **P < 0.01, ***P < 0.001 vs CORT group |
Cx43丝氨酸368位点磷酸化(p-Cx43) 介导缝隙连接通道关闭, 因此本实验对原代星形胶质细胞膜上p-Cx43含量进行检测。结果显示, CORT上调前额皮质星形胶质细胞和海马星形胶质细胞膜上Cx43丝氨酸368位点磷酸化水平; 与CORT组相比, 给予Rg1降低前额皮质星形胶质细胞和海马星形胶质细胞膜上p-Cx43含量(图 3)。

|
Figure 3 Ginsenoside Rg1 decreased the phosphorylation of connexins43 (Cx43) at serine368. Effects of ginsenoside Rg1 on the phosphorylation of Cx43 in prefrontal cortical (A) and hippocampal (B) astrocytes. n = 3, x±s. #P < 0.05 vs Ctrl group; *P < 0.05, ***P < 0.001 vs CORT group |
为了选取不影响细胞生存率的合适蛋白激酶抑制剂浓度, 选取常用的作用于细胞的蛋白激酶抑制剂, 给予正常的原代海马星形胶质细胞。如图 4所示, 与正常组相比, GO6976 (0.1、1和10 μmol·L-1)、PD98059 (0.5、1和2 μmol·L-1)、SB203580 (0.5、1和2 μmol·L-1)、KN-62 (0.1、1和10 μmol·L-1)及BAY1125976 (1、5和10 μmol·L-1)对细胞的生存率没有影响; H-89 (10和20 μmol·L-1)、SP600125 (10 μmol·L-1)及PP2 (1和5 μmol·L-1)对细胞的生存率没有影响, 但H-89 (30 μmol·L-1)、SP600125 (20、30、40 μmol·L-1)和PP2 (10 μmol·L-1)对细胞的生存率均有非常显著的影响(P < 0.001)。因此, 选择合适的蛋白激酶抑制剂的浓度为H-89 (20 μmol·L-1)、GO6076 (1 μmol·L-1)、PD98059 (1 μmol·L-1)、SB203580 (1 μmol·L-1)、SP600125 (10 μmol·L-1)、KN-62 (1 μmol·L-1)、PP2 (1 μmol·L-1)和BAY1125976 (1 μmol·L-1)。

|
Figure 4 Effects of different protein kinase inhibitors in hippocampus astrocytes. Effects of H-89, GO6976, PD98059, SB203580, SP600125, KN-62, PP2, BAY1125976 on cell viability in hippocampal astrocytes was shown as A-H. n = 3, x±s. ###P < 0.001 vs Ctrl group. H-89, GO6976, PD98059, SB203580, SP600125, KN-62, PP2, BAY1125976 were protein kinase inhibitors of PKA, PKC, ERK, p38, JNK, CaMKII, Src, Akt, respectively |
在海马星形胶质细胞上, 通过CCK8法检测不同蛋白激酶抑制剂对Rg1作用的影响。如图 5A所示, 与正常组相比, CORT模型组细胞生存率显著下降(P < 0.001);与模型组相比, FLX (1 μmol·L-1)和Rg1 (10 μmol·L-1)组细胞的生存率均显著升高(P < 0.001);与单独Rg1 (10 μmol·L-1)相比, 加入SB203580 (1 μmol·L-1)、PP2 (1 μmol·L-1)和BAY1125976 (1 μmol·L-1)后细胞的生存率明显下降(P < 0.001)。

|
Figure 5 Effects of different protein kinase inhibitors on the cell viability (A) and morphology (B) in the hippocampus astrocytes. n = 6, x±s. ###P < 0.001 vs Ctrl group; ***P < 0.001 vs CORT group; &&& P < 0.001 vs Rg1 group |
此外, 通过倒置相差显微镜观察各组细胞形态。由图 5B形态学观察可见, 正常组海马星形胶质细胞胞体多呈树突状, 胞体饱满、折光度好, 胞桨均匀、透亮, 大多数伸出微小的突起。皮质酮造模后, 细胞胞体萎缩、相邻细胞间隙扩大, 造模同时给予FLX (1 μmol·L-1)和Rg1 (10 μmol·L-1)对皮质酮损伤所致海马星形胶质细胞形态变化可显著缓解。而加入SB203580 (1 μmol·L-1)、PP2 (1 μmol·L-1)和BAY1125976 (1 μmol·L-1)后细胞多呈现细丝状, 胞体明显变小, 胞核突出。结果表明, 在海马星形胶质细胞上, PP2、BAY1125976和SB203580可以抑制Rg1的保护作用。提示Rg1在海马星形胶质细胞上抗皮质酮损伤作用与p38、Src和Akt蛋白激酶相关。
5 蛋白激酶抑制剂对Rg1介导的前额叶皮质星形胶质细胞保护作用的影响在前额叶皮质星形胶质细胞上, 通过CCK8法检测不同蛋白激酶抑制剂对Rg1作用的影响。如图 6A所示, 与正常组相比, CORT组细胞生存率显著下降(P < 0.001);与CORT组相比, FLX (1 μmol·L-1, P < 0.01) 和Rg1 (10 μmol·L-1, P < 0.05) 组细胞的生存率显著升高; 与单独Rg1 (10 μmol·L-1)相比, 加入PP2 (1 μmol·L-1, P < 0.001)、BAY1125976 (1 μmol·L-1, P < 0.05) 后细胞的生存率显著下降。此外, 通过倒置相差显微镜观察各组细胞形态。由图 6B形态学观察可见, 正常组海马星形胶质细胞胞体多呈树突状, 胞体饱满、折光度好, 胞桨均匀、透亮, 大多数伸出微小的突起。皮质酮造模后, 细胞胞体萎缩、相邻细胞间隙扩大, 造模同时给予FLX (1 μmol·L-1)和Rg1 (10 μmol·L-1)对皮质酮损伤所致海马星形胶质细胞形态变化可显著缓解。加入PP2 (1 μmol·L-1)和BAY1125976 (1 μmol·L-1)后细胞多呈现细丝、颗粒状, 胞体明显变小, 胞核突出。结果表明, 在前额叶皮质星形胶质细胞上, PP2和BAY1125976可以抑制Rg1的保护作用。提示Rg1在前额叶皮质星形胶质细胞上抗皮质酮损伤作用与Src、Akt蛋白激酶相关。
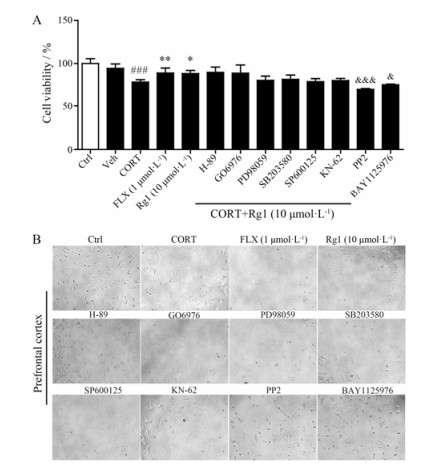
|
Figure 6 Effects of different protein kinase inhibitors on the cell viability (A) and morphology (B) in prefrontal cortex astrocytes. n = 6, x±s. ###P < 0.001 vs Ctrl group; *P < 0.05, **P < 0.01 vs CORT group; &P < 0.05, &&&P < 0.001 vs Rg1 group |
近年来, 越来越多的研究表明人参皂苷Rg1在大鼠抑郁模型中发挥抗抑郁作用, 但其作用机制尚未完全阐明。慢性应激大鼠抑郁模型中星形胶质细胞缝隙连接功能损伤, 另损伤缝隙连接功能可诱导大鼠抑郁样行为发生[7, 16]。本研究证明皮质酮上调星形胶质细胞胞膜上缝隙连接通道蛋白Cx43磷酸化水平, 给予人参皂苷Rg1后缝隙连接通道蛋白Cx43磷酸化水平显著下调, 提示Rg1可能通过下调星形胶质细胞膜上缝隙连接通道蛋白Cx43磷酸化水平促进缝隙连接通道开放发挥抗抑郁作用[15]。
缝隙连接通道的开放和关闭由缝隙连接蛋白的磷酸化调节, Cx43丝氨酸368位点的磷酸化介导缝隙连接通道关闭[16, 19]。缝隙连接通道介导相邻细胞间物质交换, 如离子(Ca2+、K+和Na+等), 小分子代谢物质(葡萄糖和谷氨酸等), 第二信使(cAMP和IP3等)及其他分子质量小于1.5 kDa的物质[12]。此外, 缝隙连接通道也介导正常细胞与即将死亡细胞之间的物质交换, 但缝隙连接通道在促进细胞生存和介导细胞死亡方面的作用仍然存在争议[18, 19]。结果显示, Rg1可抑制皮质酮介导的Cx43丝氨酸368位点磷酸化, 促进缝隙连接通道开放; 皮质酮促进星形胶质细胞死亡, 给予Rg1后显著增加星形胶质细胞生存率。提示在皮质酮介导的细胞损伤中, 促进缝隙连接通道开放发挥细胞保护作用。
Cx43磷酸化相关的蛋白激酶有PKA、PKC、蛋白酪氨酸激酶(PTK)、丝氨酸/苏氨酸蛋白激酶、CaMII和Akt[18]。同时给予蛋白酶抑制剂, 海马星形胶质细胞中SB203580、PP2和BAY1125976可消除Rg1的保护作用, 表明在海马星形胶质细胞中Rg1细胞保护作用与p38、Src和Akt蛋白激酶相关; 前额叶星形胶质细胞中PP2和BAY1125976可消除Rg1的保护作用, 表明在前额叶皮质星形胶质细胞中Rg1细胞保护作用与Src、Akt蛋白激酶相关。此外, 显微结构表明给予p38、Src和Akt蛋白激酶抑制剂可阻断Rg1对海马星形胶质细胞形态的改善作用; 前额叶皮质星形胶质细胞在给予Src、Akt蛋白激酶抑制剂后逆转Rg1保护作用, 形态学发生明显变化。本文结果显示人参皂苷Rg1在皮质酮介导的星形胶质细胞损伤模型中的细胞保护作用机制与细胞内p38、Src和Akt信号通路有关, 但其上、下游的信号级联尚有待进一步阐明。
综上所述, 本研究阐明了人参皂苷Rg1改善CORT所致的星形胶质细胞缝隙连接通道蛋白Cx43活性降低的现象; 在海马星形胶质细胞上, 人参皂苷Rg1通过激活Src、p38与Akt信号通路, 减轻皮质酮对细胞毒性作用; 在前额叶星形胶质细胞是通过激活Src、Akt信号通路, 减轻皮质酮对细胞毒性作用。本研究结果为进一步研究人参皂苷Rg1抗抑郁作用机制提供新的思路。
| [1] | Cheng Y, Shen LH, Zhang JT. Anti-amnestic and anti-aging effects of ginsenoside Rg1 and Rb1 and its mechanism of action[J]. Acta Pharmacol Sin, 2005, 26: 143–149. DOI:10.1111/aphs.2005.26.issue-2 |
| [2] | Attele AS, Wu JA, Yuan CS. Ginseng pharmacology:multiple constituents and multiple actions[J]. Biochem Pharmacol, 1999, 58: 1685–1693. DOI:10.1016/S0006-2952(99)00212-9 |
| [3] | Lu XZ, Wang JH, Wu X, et al. Ginsenoside Rg1 promotes bone marrow stromal cells proliferation via the activation of the estrogen receptor-mediated signaling pathway[J]. Acta Pharmacol Sin, 2008, 29: 1209–1214. DOI:10.1111/aphs.2008.29.issue-10 |
| [4] | Chen XM, Zhu JB, Sun WD, et al. Effect of absorption enhancers on nasal ginsenoside Rg1 delivery and its nasal ciliotoxicity[J]. Acta Pharm Sin (药学学报), 2006, 41: 149–155. |
| [5] | Shen LH, Zhang JT. Culture of neural stem cells from cerebral cortex of rat embryo and effects of drugs on the proliferation ability of stem cells[J]. Acta Pharm Sin (药学学报), 2003, 38: 735–738. |
| [6] | Krysko DV, Leybaert L, Vandenabeele P, et al. Gap junctions and the propagation of cell survival and cell death signals[J]. Apoptosis, 2005, 10: 459–469. DOI:10.1007/s10495-005-1875-2 |
| [7] | Decrock E, Vinken M, De Vuyst E, et al. Connexin-related signaling in cell death:to live or let die?[J]. Cell Death Differ, 2009, 16: 524–536. DOI:10.1038/cdd.2008.196 |
| [8] | Moreno AP, Lau AF. Gap junction channel gating modulated through protein phosphorylation[J]. Prog Biophys Mol Biol, 2007, 94: 107–119. DOI:10.1016/j.pbiomolbio.2007.03.004 |
| [9] | Morioka N, Suekama K, Zhang FF, et al. Amitriptyline up-regulates connexin43-gap junction in rat cultured cortical astrocytes via activation of the p38 and c-Fos/AP-1 signalling pathway[J]. Br J Pharmacol, 2014, 171: 2854–2867. DOI:10.1111/bph.2014.171.issue-11 |
| [10] | Yamada A, Futagi M, Fukumoto E, et al. Connexin43 is necessary for salivary gland branching morphogenesis and FGF10-induced ERK1/2 phosphorylation[J]. J Biol Chem, 2016, 291: 904–912. DOI:10.1074/jbc.M115.674663 |
| [11] | Sun JD, Liu Y, Yuan YH, et al. Gap junction dysfunction in the prefrontal cortex induces depressive-like behaviors in rats[J]. Neuropsychopharmacology, 2012, 37: 1305–1320. DOI:10.1038/npp.2011.319 |
| [12] | Solan JL, Lampe PD. Connexin43 phosphorylation:structural changes and biological effects[J]. Biochem J, 2009, 419: 261–272. DOI:10.1042/BJ20082319 |
| [13] | Lampe PD, TenBroek EM, Burt JM, et al. Phosphorylation of connexin43 on serine368 by protein kinase C regulates gap junctional communication[J]. J Cell Biol, 2000, 149: 1503–1512. DOI:10.1083/jcb.149.7.1503 |
| [14] | Zhang CZ, Mu XF, Xu XX, et al. The effect of connexin43 downregulation on biological functions of HUVEC[J]. Acta Pharm Sin (药学学报), 2015, 50: 298–304. |
| [15] | Jin C, Wang ZZ, Zhou H, et al. Ginsenoside Rg1-induced antidepressant effects involve the protection of astrocyte gap junctions within the prefrontal cortex[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2017, 75: 183–191. DOI:10.1016/j.pnpbp.2016.09.006 |
| [16] | Dere E, Zlomuzica A. The role of gap junctions in the brain in health and disease[J]. Neurosci Biobehav Rev, 2012, 36: 206–217. DOI:10.1016/j.neubiorev.2011.05.015 |
| [17] | Xue JF, Hu JF, Liu ZJ, et al. The mechanism of ginsenosides Rg1 and Rb1 promoting glutamic acid release from PC12 cells[J]. Acta Pharm Sin (药学学报), 2006, 41: 1141–1145. |
| [18] | Quesseveur G, Portal B, Basile JA, et al. Attenuated levels of hippocampal connexin43 and its phosphorylation correlate with antidepressant-and anxiolytic-like activities in mice[J]. Front Cell Neurosci, 2015, 9: 490. |
| [19] | Vinken M, Vanhaecke T, Papeleu P, et al. Connexins and their channels in cell growth and cell death[J]. Cell Signal, 2006, 18: 592–600. DOI:10.1016/j.cellsig.2005.08.012 |
 2017, Vol. 52
2017, Vol. 52


