胰腺癌是一种恶性程度高、进展迅速、死亡率高的肿瘤, 据统计, 在美国每年约4万人死于胰腺癌, 且发病率和死亡率呈逐年上升趋势[1]。临床上, 胰腺癌对化疗不敏感, 术后复发率高, 有研究发现这可能与传统的治疗策略只针对普通的肿瘤细胞, 而对肿瘤干细胞不敏感, 使得治疗后还残存少数肿瘤干细胞, 而这些干细胞的分化能力很强, 仍可分化产生新的肿瘤细胞从而导致肿瘤的复发[2]。
肿瘤干细胞学说认为, 在肿瘤组织中存在一小部分细胞起着干细胞的功能, 具有很强的分化能力, 可以分化成不同功能的肿瘤细胞, 也是肿瘤的发生、化疗药物抗性、生长、复发、和转移等各个恶性侵袭过程的“源头”, 对肿瘤结构的维持和稳定具有重要意义, 因此研究人员开始考虑把肿瘤干细胞作为治疗的靶点[3, 4]。人胰腺癌干细胞(pancreatic cancer stem cells, Pan CSC)最初是在2007年由Li及其团队[5]在人胰腺癌移植免疫缺陷鼠模型中分离出来的, 而后, 针对这群细胞开发抗肿瘤药物成了一大研究热点[2, 6], 并有相关研究对肿瘤的发生、增殖和侵袭等深入到机制层面, 期望能从肿瘤的“源头”着手达到治愈胰腺癌的目的。
虫草素(cordycepin)又名3'-脱氧腺苷(3'-deoxyadenosine), 是一种由腺苷和脱氧戊糖组成的核苷类物质, 也是我国传统名贵中药材北冬虫夏草和冬虫夏草的主要活性成分之一, 具有抗肿瘤、抗菌、抗衰老、免疫调节和清除体内自由基等多种药理作用[7, 8]。尤其对恶性肿瘤具有很好的治疗作用, 在肿瘤的发生、发展及转移等多个过程中都起到抑制和调节作用, 但是其具体的分子机制还有待进一步研究[9, 10]。Xu等[11]和Yu等[12]研究发现虫草素对胰腺癌细胞株BxPc3及其传代高转移潜能细胞株BxPc3-LNS均有显著的生长抑制作用, 并能影响转录调控因子MBD1和E2F5等多个基因的表达。但虫草素是否对胰腺癌干细胞也有抑制作用目前尚不清楚, 本文以胰腺癌干细胞为实验材料, 研究虫草素对其增殖和转移的抑制效果, 并探究可能的分子机制。
材料与方法主要试剂 虫草素购于Sigma公司; DMEM培养液购于Hyclone公司; RT-PCR试剂盒、N2 supple ment、细胞因子B27 supplement、碱性成纤维生长因子bFGF、表皮生长因子EGF购于美国Gibco公司; 本研究所用抗体均购于Cell Signaling Technology公司。
细胞株及细胞培养 人胰腺癌干细胞(CD133+/CD44+/CD24+/ESA+)由美国堪萨斯大学医学中心Dr. Rakesh Srivastava教授实验室分离并鉴定获得, 该干细胞具有较强的分化能力与转移潜力, 已应用于多项药物干预治疗胰腺癌的研究报道[13-16]。细胞用DMEM无血清培养基培养, 并添加1% N2 supplement、2% B27 supplement、20 ng·mL−1 bFGF、100 ng·mL−1 EGF和1% (v/v)青霉素−链霉素。于37 ℃、5% CO2及饱和湿度环境的培养箱中培养。
MTT法检测细胞毒性 常规培养胰腺癌干细胞, 选取对数生长期的细胞以5×103个/孔接种于96孔板。细胞贴壁后加入不同浓度的虫草素(0、20、40、60和80 μmol·L−1), 同时设调零孔, 每组设4个复孔, 分别作用24和48 h; 以每孔加入MTT (5 g·L−1) 20 μL, 继续培养4 h后1 000 r·min−1离心5 min; 弃上清, 每孔再加入DMSO 200 μL, 37 ℃震荡15 min, 直至紫褐色沉淀完全溶解。采用酶标仪测定各孔在570 nm波长处各孔吸收度(OD)值, 并计算胰腺癌干细胞存活率。细胞存活率(%) = (OD处理组 − OD空白组) /(OD对照组 − OD空白组) ×100%。
显微观察细胞形态 取对数生长期的胰腺癌干细胞, 接种于6孔板中培养, 待细胞贴壁后, 处理组加入虫草素使终浓度为40和60 μmol·L−1, 对照组加入等体积的溶剂, 于37 ℃、5% CO2饱和湿度培养箱中培养。待药物分别作用24和48 h后在40倍显微镜下观察记录胰腺癌干细胞的生长情况。
碘化丙啶(PI)单染检测细胞凋亡率 设置对照组、虫草素浓度40和60 μmol·L−1处理组, 给药培养24和48 h后, 收集细胞用预冷的70%乙醇固定, 置于4 ℃下过夜; PBS离心洗涤(1 000 r·min−1, 10 min) 2次, 加入1 mg·mL−1 RNase 80 µL, 振荡混匀后于37 ℃水浴中温育30 min; 置于冰上2 min以终止RNase作用; 加入PI单标染液1 mL, 振荡混匀, 4 ℃避光放置2 h, 然后用流式细胞仪检测。
细胞划痕愈合实验 将生长状态良好的胰腺癌干细胞用胰蛋白酶消化并重悬为单细胞悬液后, 细胞计数后将细胞稀释至每毫升5×106个, 接种于6孔细胞培养板中, 待细胞单层铺满约80%后弃去培养基; 用灭菌枪头垂直于标记线划痕, PBS液冲洗3次; 加入含40和60 μmol·L−1虫草素的无血清培养液, 并设置空白对照组; 置于CO2培养箱中培养24和48 h, 并在显微镜下拍照。
RT-PCR检测相关基因的表达变化 用终浓度为0、40和60 μmol·L−1虫草素处理胰腺癌干细胞24 h, 按试剂盒说明书提取RNA, 然后取2 μL总RNA逆转录合成cDNA。本实验RT-PCR引物序列见表 1, 严格按照Quanti Fast SYBR-Green RT-PCR试剂盒说明书进行操作, cDNA 2 μL、引物3 μL、SYB 5 μL体系检测caspase-3、Bcl-2、Bax、p53、E-cadherin和N-cadherin的表达情况, 以β-actin作为内参校正, 用StepOneTM V1.0系统软件分析实验结果。mRNA相对表达量用2−ΔΔCt法计算[17], 以3次独立重复实验平均结果作为实验结果。
| Table 1 Primer sequence used for real-time quantitative PCR |
Western blot检测相关蛋白的表达变化 离心收集细胞, 加入细胞裂解液150 μL, 充分裂解后离心取上清, BSA法测定蛋白浓度, 每孔分别取20 μg蛋白上样, 用10% SDS聚丙烯酰胺凝胶电泳分离蛋白, 电转移至PVDF膜上, 5% BSA室温封闭2 h后, 分别用一抗(1:1 000) 4 ℃孵育过夜, HRP标记二抗(1:5 000) 室温孵育2 h, 采用ECL显色液显色。
统计学分析 采用SPSS 23.0统计软件包进行数据处理, 不同处理组间比较采用one-way ANOVA检验, 实验数据以x±s表示, P < 0.05表示差异有统计学意义。
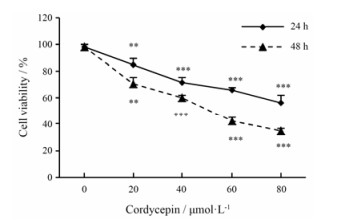
结果 1 虫草素对人胰腺癌干细胞增殖的抑制作用MTT结果显示(图 1), 与对照组相比, 不同浓度虫草素(20、40、60和80 μmol·L−1)分别作用于胰腺癌干细胞24和48 h后, 均能显著抑制细胞的增殖(P < 0.01), 随处理浓度和时间的增加, 胰腺癌干细胞存活率显著下降, 呈浓度和时间依赖性。80 μmol·L−1虫草素作用48 h后, 细胞存活率降低到0.352 ± 0.014。再通过SPSS软件回归分析得到24和48 h的半数有效抑制浓度(IC50)分别为107.364和48.472 μmol·L−1。
|
Figure 1 Anti-proliferation effects of cordycepin on pancreatic cancer stem cells. n = 4, x±s. **P < 0.01, ***P < 0.001 vs control group |
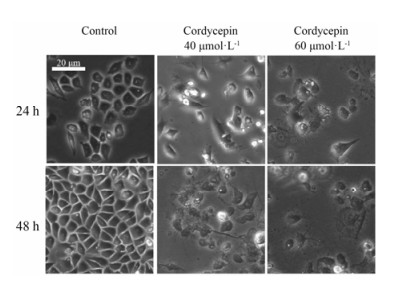
为了更直观地反映虫草素对胰腺癌干细胞的毒性作用, 还进行显微观察细胞形态变化。经40和60 μmol·L−1虫草素分别处理24和48 h后, 在40倍倒置显微镜下观察细胞的形态变化:对照组中胰腺癌干细胞生长旺盛, 48 h后布满整个视野; 而经不同浓度虫草素处理后, 胰腺癌干细胞的生长增殖明显受到了抑制, 并且随着虫草素浓度和时间的增加, 贴壁细胞的密度变得越低, 细胞脱壁逐渐增多, 60 μmol·L−1虫草素处理48 h后大部分细胞漂浮在培养基中; 在细胞形态方面, 对照组中的细胞呈多边形, 融合成片, 细胞透亮, 胞体肥厚, 细胞间相互连接, 边界清晰, 在40 μmol·L−1虫草素处理24 h后, 细胞的形态已经出现明显的变化, 细胞间连接逐渐疏松, 细胞表面渐凸起小膜泡, 边界不清晰, 折光性增强, 而随着浓度和时间的增加, 细胞胞体逐渐固缩, 细胞膜局部破损, 出现胞内容物泄出的现象(图 2)。
|
Figure 2 Effect on the shape of pancreatic cancer stem cells after cordycepin treatment 24 or 48 h (magnification 200×) |
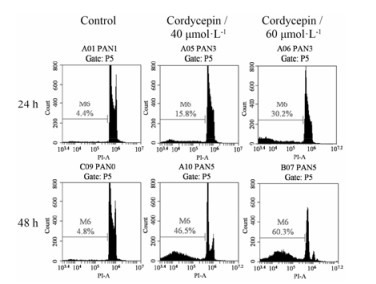
在明确虫草素对胰腺癌干细胞的毒性作用后, 再采用PI单染验证虫草素的凋亡诱导作用。正常细胞核为二倍体, 当细胞发生凋亡时, 细胞染色体断裂或降解, 进行PI染色检测时会出现亚二倍体, 也称凋亡峰, 图 3中的M6期细胞比例即为亚二倍体百分率。从PI单染结果可以看出, 对照组中胰腺癌干细胞培养24和48 h后, M6期亚二倍体细胞百分率仅为4.4%和4.8%;经虫草素处理后各组的亚二倍体百分率均比对照组高, 40 μmol·L−1虫草素作用24和48 h后亚二倍体百分率为15.8%和46.5%, 60 μmol·L−1虫草素作用24和48 h后亚二倍体百分率为30.2%和60.3%, 说明虫草素对胰腺癌干细胞具有诱导凋亡作用。
|
Figure 3 Propidium iodide staining showed characteristic features of apoptosis in cordycepin-exposed cells |
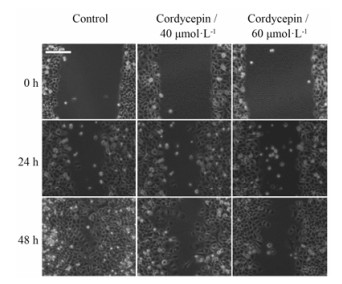
划痕实验分为对照组、虫草素40和60 μmol·L−1处理组, 分别在0、24和48 h时拍照记录划痕大小, 观察细胞的迁移情况。从划痕结果(图 4)可以看出, 只加无血清培养基的对照组中, 细胞不断向划痕区域迁移, 在培养48 h后几乎将划痕全部愈合; 经40和60 μmol·L−1虫草素作用的细胞, 划痕愈合速度明显比对照组低, 48 h还能清晰地看到划痕区域, 表明虫草素能抑制胰腺癌干细胞的迁移。
|
Figure 4 Observe the migration of pancreatic cancer stem cells after cordycepin treatment 24 or 48 h (magnification 100×) |
人体抑癌基因p53的失活对肿瘤形成起重要作用, p53主要通过与Bcl-2家族蛋白相互作用发挥促凋亡或抗凋亡的作用[18]。RT-PCR和Western blot检测结果显示(图 5), p53基因的相对表达量随着虫草素浓度的增加而上调, 60 μmol·L−1处理24 h后, mRNA相对表达量达到2.98, 蛋白的表达也明显被上调; 促细胞凋亡因子Bax和抗凋亡因子Bcl-2基因的表达也受到虫草素的影响, 其中Bax被上调, Bcl-2被显著下调, 导致Bcl-2/Bax比例失衡; 细胞凋亡的启动者和执行者caspase-3基因和蛋白的表达最终被显著上调, 60 μmol·L−1作用24 h后, mRNA相对表达量为2.55, 蛋白的表达也明显被上调。
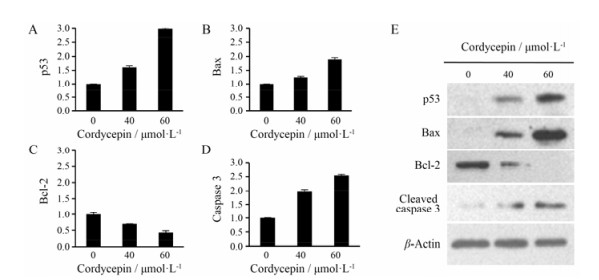
|
Figure 5 Effect of cordycepin on p53 (A), Bax (B), Bcl-2 (C) and caspase-3 (D) mRNA and protein expression (E). n = 3, x±s |
Cadherin家族是一类主要分布于上皮组织中的黏附分子, 对于生长发育过程中细胞的选择性聚集具有至关重要的作用, 也将直接影响肿瘤发生EMT转化过程。E-Cadherin即钙黏附蛋白E, 是一种介导细胞间同质黏附的钙依赖性跨膜糖蛋白, 在肿瘤组织中表达降低易发生侵袭和转移[19]。从图 6可以看出, 经虫草素处理24 h后, E-cadherin的mRNA和蛋白表达量被明显上调, 而N-cadherin的表达量被下调, 当虫草素浓度达到60 μmol·L−1时, E-cadherin和N-cadherin的mRNA相对表达量分别为2.19和0.36。
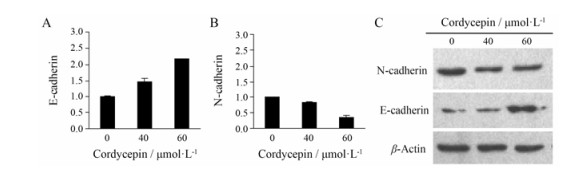
|
Figure 6 Effect of E-cadherin, N-cadherin mRNA (A, B) and protein expressions (C) on cordycepin-treated pancreatic cancer stem cells. n = 3, x±s |
本研究通过MTT法、细胞形态观察和PI染色流式细胞技术研究虫草素对胰腺癌干细胞的细胞毒性和诱导凋亡作用, 发现虫草素能有效地抑制胰腺癌干细胞的生长增殖, 并诱导其凋亡。60 μmol·L−1虫草素处理48 h后大部分细胞漂浮在培养基中, 细胞形态也出现明显的变化, 胞体固缩, 细胞膜局部破损, 出现胞内容物泄出的现象, 24和48 h的IC50分别为107.364和48.472 μmol·L−1。
Bcl-2和Bax是一对相互拮抗的细胞凋亡因子, 其比值变化是影响细胞凋亡的重要因素[20]。Bcl家族是被研究最多的一类细胞凋亡调控因子, 其中Bcl-2是细胞内一个作用较广泛的抗凋亡因子, 与肿瘤的发生及耐药性密切相关; 而Bax是一种促细胞凋亡因子, 在病理条件下, 其过表达可以诱导细胞凋亡, 同时还可以促进其他因素诱导细胞凋亡[21]。Caspase-3是caspase信号通道中关键的效应分子, 是大部分哺乳动物细胞凋亡的启动者和执行者。本研究发现, 虫草素作用胰腺癌干细胞后, 能上调促凋亡因子Bax基因的表达, 并下调Bcl-2, caspase-3基因在经60 μmol·L−1虫草素处理24 h后, 其mRNA相对表达量达到2.98, 与对照组相比具有显著性差异(P < 0.05), 且Western blot结果显示蛋白的表达也明显被上调。进一步检测上游转录因子p53的表达情况, 发现它能被虫草素显著上调。p53是细胞凋亡过程中一个重要调控因子, 在维持细胞正常生长和抑制恶性增殖过程中起着重要作用[22]。p53作为一个转录因子对DNA损伤做出反应, 调控下游蛋白如Bcl-2、Fas和Bax的表达, 这些下游蛋白进而调节细胞周期和凋亡[23]。以上研究提示虫草素诱导胰腺癌干细胞凋亡的分子机制可能与活化p53, 并调控其下游的凋亡因子Bcl-2/Bax的表达, 诱导caspase-3活化, 最终引起细胞凋亡有关。
恶性肿瘤的转移扩散主要是通过EMT使其在结构、黏附和迁移能力等方面实现上皮细胞向间质细胞的过渡, 而E-cadherin和N-cadherin蛋白分别是上皮表型和间质表型的标志分子[24]。E-cadherin是细胞维持上皮表型的重要黏附分子, 可介导细胞黏附, 抑制肿瘤的侵袭和转移, 当它的表达下调时, 细胞骨架改变, 基底膜降解, 继而细胞连接松散, 使肿瘤细胞更易迁移到细胞外基质, 而N-cadherin是一个连接蛋白, 它可以调节细胞间黏附能力。E-cadherin表达降低, N-cadherin表达升高是细胞发生EMT转化的一个重要机制[17]。本研究通过细胞划痕愈合实验和检测E-cadherin、N-cadherin基因表达情况进一步研究虫草素对胰腺癌干细胞侵袭转移能力的影响, 结果显示, 虫草素能抑制胰腺癌干细胞的迁移, 并具有浓度和时间的依赖性; 同时, 发现60 μmol·L−1虫草素能显著上调E-cadherin, 并下调N-cadherin基因的表达。结果提示虫草素可能通过调控E-cadherin/N-cadherin蛋白的平衡从而抑制胰腺癌干细胞侵袭和转移。而胰腺癌的侵袭转移是一个多基因参与、多因素影响的多步骤复杂过程, 对于E-cadherin和N-cadherin在侵袭转移中的机制及可能存在的其他与转移相关的信号分子还有待进一步发掘和探讨。
综上所述, 虫草素可以激活p53, 下调抗凋亡基因Bcl-2, 上调促凋亡基因Bax, 并活化caspase-3, 从而诱导胰腺癌干细胞凋亡; 并且能通过上调E-cadherin, 下调N-cadherin的表达来抑制胰腺癌干细胞迁移。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64: 9–29. DOI:10.3322/caac.21208 |
| [2] | Liu JL, Tong CY. Inhibition effect of metformin on the growth of pancreatic cancer stem cells[J]. J Chin Oncol (肿瘤学杂志), 2016, 22: 467–472. |
| [3] | Vries RGJ, Huch M, Clevers H. Stem cells and cancer of the stomach and intestine[J]. Mol Oncol, 2010, 4: 373–384. DOI:10.1016/j.molonc.2010.05.001 |
| [4] | Wang Y. The Basic Research on the Differentiation and Invasion of Pancreatic Cancer Stem Cells Induced by Panaxynol (人参炔醇对胰腺癌干细胞分化及侵袭转移作用的基础研究)[D]. Zhenjiang:Jiangsu University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10299-1016727599.htm |
| [5] | Li CW, Heidt DG, Dalerba P, et al. Identification of pancreatic cancer stem cells[J]. Cancer Res, 2007, 67: 1030–1037. DOI:10.1158/0008-5472.CAN-06-2030 |
| [6] | Wang ZW, Li YW, Ahmad A, et al. Pancreatic cancer:understanding and overcoming chemoresistance[J]. Nat Rev Gastroenterol Hepatol, 2011, 8: 27–33. DOI:10.1038/nrgastro.2010.188 |
| [7] | Paterson RR. Cordyceps-a traditional Chinese medicine and another fungal therapeutic biofactory[J]. Phytochemistry, 2008, 69: 1469–1495. DOI:10.1016/j.phytochem.2008.01.027 |
| [8] | Tuli HS, Sharma AK, Sandhu SS, et al. Cordycepin:a bioactive metabolite with therapeutic potential[J]. Life Sci, 2013, 93: 863–869. DOI:10.1016/j.lfs.2013.09.030 |
| [9] | Lee SY, Debnath T, Kim SK, et al. Anti-cancer effect and apoptosis induction of cordycepin through DR3 pathway in the human colonic cancer cell HT-29[J]. Food Chem Toxicol, 2013, 60: 439–447. DOI:10.1016/j.fct.2013.07.068 |
| [10] | Nakamura K, Shinozuka K, Yoshikawa N. Anticancer and antimetastatic effects of cordycepin, an active component of Cordyceps sinensis[J]. J Pharmacol Sci, 2015, 127: 53–56. DOI:10.1016/j.jphs.2014.09.001 |
| [11] | Xu WY, Long J, Tang L, et al. The research of the inhibition of cordycepin on human pancreatic cell cancer Bx Pc3 and cell Bx Pc3-LN5[J]. China Med Pharm (中国医药科学), 2011, 1: 24–26. |
| [12] | Yu BC, Long J, Tang L, et al. Effects of cordycepin on pancreatic tumor-related genes expression by cDNA array analysis[J]. World Clin Drug (世界临床药物), 2015, 36: 31–34, 67. |
| [13] | Shankar S, Nall D, Tang SN, et al. Resveratrol inhibits pancreatic cancer stem cell characteristics in human and KrasG12D transgenic mice by inhibiting pluripotency maintaining factors and epithelial-mesenchymal transition[J]. PLoS One, 2011, 6: e16530. DOI:10.1371/journal.pone.0016530 |
| [14] | Fu JS, Rodova M, Roy SK, et al. GANT-61 inhibits pancreatic cancer stem cell growth in vitro and in NOD/SCID/IL2R gamma null mice xenograft[J]. Cancer Lett, 2013, 330: 22–32. DOI:10.1016/j.canlet.2012.11.018 |
| [15] | Verma RK, Yu W, Singh SP, et al. Anthothecol-encapsulated PLGA nanoparticles inhibit pancreatic cancer stem cell growth by modulating sonic hedgehog pathway[J]. Nanomedicine, 2015, 11: 2061–2070. DOI:10.1016/j.nano.2015.07.001 |
| [16] | Sharma N, Nanta R, Sharma J, et al. PI3K/AKT/mTOR and sonic hedgehog pathways cooperate together to inhibit human pancreatic cancer stem cell characteristics and tumor growth[J]. Oncotarget, 2015, 6: 32039–32060. DOI:10.18632/oncotarget.v6i31 |
| [17] | Livak JK, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2002, 25: 402–408. |
| [18] | Zhang QQ, Long LM, Wang WJ, et al. Inhibitory effect of total flavonoids from Lysimachia clethroides Duby (ZE4) on xenograft human cervical cancer in nude mice[J]. Chin Pharmacol Bull (中国药理学通报), 2012, 28: 62–66. |
| [19] | Liang WL, Song L, Li ZY. Effect of PCB118 on cell adhesion of human hepatocellularcarcinoma cells BEL-7402[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2016, 30: 79–84. |
| [20] | Wnek A, Andrzejewskaa E, Kobosb J, et al. Molecular and immunohistochemical expression of apoptotic proteins Bax, Bcl-2 and caspase 3 in infantile hemangioma tissues as an effect of propranolol treatment[J]. Immunol Lett, 2017, 185: 27–31. DOI:10.1016/j.imlet.2017.03.005 |
| [21] | Qi SQ, De S, Li DM, et al. Expressions of PARP-1, caspase-3, survivin and Bax in cervical squamous cell carcinoma tissues and their clinical significances[J]. J Jilin Univ (Med Ed) (吉林大学学报(医学版)), 2013, 39: 512–516. |
| [22] | He JL, Ji XY, Li YF, et al. Subchronic exposure of benzo(a) pyrene interferes with the expression of Bcl-2, Ki-67, C-myc and p53, Bax, caspase-3 in sub-regions of cerebral cortex and hippocampus[J]. Exp Toxicol Pathol, 2016, 68: 149–156. DOI:10.1016/j.etp.2015.11.007 |
| [23] | Demirovic A, Ulamec M. Apoptotic markers (p53, Bcl-2 and Bax) expression in renal oncocytoma and chromophobe renal cell carcinoma[J]. Period Biol, 2014, 116: 173–176. |
| [24] | Zhang YN, Ma W, Wang F, et al. Curcumin inhibits epithelialmesenchymal transformation of human esophageal cancer KYSE70 cells[J]. Tumor (肿瘤), 2016, 36: 1203–1211. |
 2017, Vol. 52
2017, Vol. 52


