玫瑰树碱(ellipticine, 1, 图 1)天然存在于夹竹桃科植物椭圆玫瑰树(Ochrosia ellipticaLabill.)的叶、巴兰玫瑰树(O.balansae)及莫氏玫瑰树(O.moorei)的树皮和叶中。美国研究者Goodwin与他的同事们[1]在1959年率先分离并确定了玫瑰树碱的结构, 玫瑰树碱的分子中含有共平面的3个六元环和1个五元环, 是结构最简单的天然生物碱之一。同年Woodward等[2]首次实现了玫瑰树碱的全合成, 此后许多研究者开展了玫瑰树碱及其衍生物的全合成及药理作用的研究工作。玫瑰树碱具有抗肿瘤和抗艾滋病活性[3], 对许多肿瘤细胞如白血病、黑色素瘤、肉瘤、淋巴瘤、结肠癌、肺癌、乳腺癌、脑瘤、骨肉瘤、神经母细胞瘤等肿瘤细胞都有生长抑制作用[4], 其半数抑制浓度(IC50)在1×10−10到1×10−6 mol·L−1。1977年, 玫瑰树碱衍生物(9-羟基-N2-甲基玫瑰树碱, NSC264-137, 2, 图 1)首次在法国进行临床研究, 之后在欧洲、美国也进行了多次临床Ⅰ期、Ⅱ期抗癌试验[5]。在法国, 衍生物2作为治疗乳腺癌的药物进行研究, 多数患者为每周给药100 mg·m−2, 静脉滴注1 h以上, 这一剂量相当于每周给药2.5 mg·kg−1。共有600多例各种恶性肿瘤患者接受了NSC264-137的治疗, 临床结果显示NSC264-137对乳腺癌疗效较好, 特别是本药与多柔比星无交叉耐药性, 可用于其他治疗失败的晚期患者。后因两位患者在连续使用15个月和18个月后因肾功能衰竭死亡, 加之其具有致突变作用而终止临床研究。有研究表明, 玫瑰树碱在不同介质中存在多种共振结构[6] (图 2), 在介质中形成氢键的能力影响其溶解性和其与作用位点的结合。在溶剂中较差的溶解性以及基因毒性[7, 8]是限制玫瑰树碱成药的主要原因。
|
Figure 1 Chemical structures of ellipticine (1) and NSC264-137 (2) |

|
Figure 2 Different forms of ellipticine |
本文根据其合成方法中采用的起始原料不同, 总结了玫瑰树碱及其衍生物的合成方法、抗肿瘤作用机制和构效关系。其中玫瑰树碱的经典合成方法经过几代药学研究者的改进已日趋完善, 一些合成方法对于其衍生物的合成有借鉴意义。
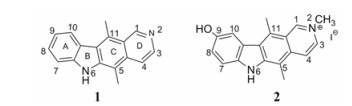
1 玫瑰树碱及衍生物的合成 1.1 以吲哚或吲哚衍生物为起始原料 1.1.1 以吲哚为原料Cranwell和Saxton[9]在1962年采用吲哚为起始原料和2, 5-己二酮缩合, 再用N-甲基-N-甲酰基苯胺(MFA)在咔唑3位甲酰化, 和氨基乙醛缩二乙醇缩合得到化合物6, 在雷尼镍作用下被还原得到席夫碱7, 在氯化氢作用下环合得到玫瑰树碱(合成路线1)。
|
Scheme1 Five steps synthesis route from indole |
此合成路线基于Woodward的合成思路设计, 该合成路线的缺陷是最后一步产率非常低(约10%), 然而其中间步骤设计简捷独特、原料易得, 这条路线的主要步骤一直沿用至今并被后人逐渐优化。澳大利亚的研究者Dalton[10]将最后的闭环条件用98%磷酸替代氯化氢加热反应, 使闭环反应收率提高至44%。
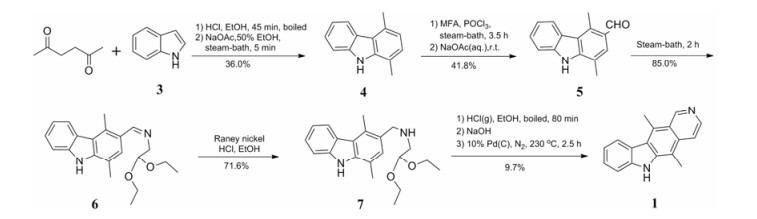
Guthrie[11]在上述路线的基础上, 对还原后的亚胺用对甲苯磺酰氯(TsCl)进行保护, 可以采用更温和的闭环条件, 用6 mol·L−1盐酸加热来构造D环(合成路线2)。
|
Scheme2 Cyclization in hydrochloric acid |
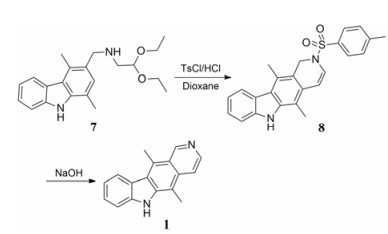
Lee等[12]基于合成路线1, 在咔唑环和吡啶环的形成过程中使用微波辅助反应, 缩短了每步反应的时间, 同时也相应提高了反应收率(合成路线3), 使玫瑰树碱5步合成反应的总收率达到21.3%。该路线在吡啶环的形成过程中, 经过保护胺的环合收率显著高于未保护胺的收率。
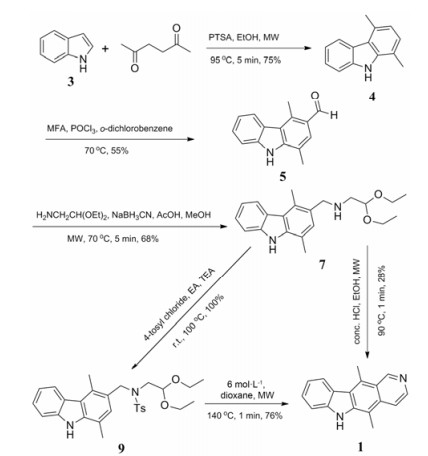
|
Scheme3 Microwave mediated reactions in ellipticine synthesis |
2007年Dracinsky[13]的研究显示, 将保护氨基的对甲苯磺酰基替换成苯磺酰基, 不仅能大大加快闭环反应速率(由6 h缩减到20 min)而且终产物能达到97%的纯度。2011年, Deane[14]将Vilsmeier-Haack甲酰化反应的原料由MFA替换为N, N-二甲基甲酰胺(DMF), 并通过实验确定了最佳的反应温度、时间和溶剂, 提高了3-甲酰化反应的选择性, 使6-甲酰化副产物在目标产物中所占的比例降低到9%。
1.1.2 以吲哚与3-酰基吡啶缩合构造C环Modi等[15]选择以吲哚为起始原料经5步反应得到中间体10, 化合物10中与双键共轭的羰基与甲基锂加成得到化合物11。化合物11与氢氧化锂在四氢呋喃中室温反应得到化合物12, 再与甲基锂反应后经过硼氢化钠作用可得到目标产物玫瑰树碱。同时, 若将化合物12与硼氢化钠回流反应可得到11位碳无甲基取代的玫瑰树碱(13), 而与金属锂化合物反应后可得到11位碳取代的衍生物。与前人不同的是, 他们设计的合成路线以不同的方式拼合吲哚与吡啶环, 合成出玫瑰树碱及C环修饰的衍生物(合成路线4), 但该路线多次使用了易自燃的甲基锂试剂和低温反应条件, 反应不易操作。
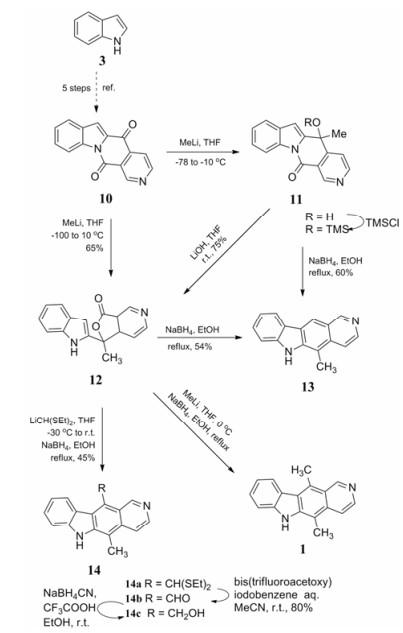
|
Scheme4 Lithium compounds used in synthesis of ellipticine and its C-11 derivates |
为了合成更多A、C、D环取代玫瑰树碱衍生物, Hibino等[16]用已有的取代吡啶与吲哚环进行拼合, 构造C环来合成玫瑰树碱及衍生物。苯磺酰基取代吲哚15先与二异丙基氨基锂(LDA)反应, 形成的中间产物16直接与化合物17的羰基反应得到化合物18, 在460~500 ℃条件下反应得到目标产物1, 并且通过改变反应物的取代基可以得到多种衍生物(合成路线5)。该路线的不足之处在于反应中使用了易燃的LDA试剂, 并采用低温和高温等苛刻的反应条件。
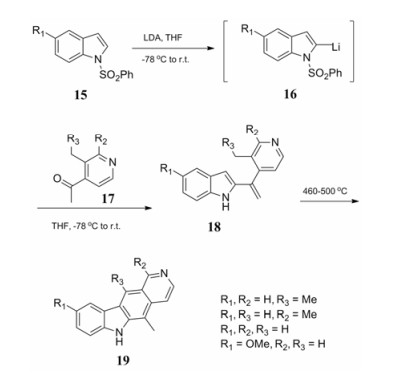
|
Scheme5 High temperature structured C ring |
Sha等[17]将Staudinger反应和Diels-Alder反应运用到玫瑰树碱的合成中(合成路线6)。2-乙基吲哚20先与N, N-二甲基乙酰胺在三氯氧磷作用下在吲哚3位进行乙酰化, 随后21的乙基α位溴代、叠氮化后环合、Boc保护得到吡咯并吲哚化合物23, 最后与吡啶炔发生Diels-Alder形成D环, 接着在碱作用下开环、还原, 在三氟乙酸作用下芳香化得到玫瑰树碱1和异玫瑰树碱27。与Gribble不同的是, 此路线中含氮环戊二烯与吡啶直接稠合, 吡啶环中氮原子的位置与双键连接的位置决定了产物的种类, 因此形成的产物包括玫瑰树碱和异玫瑰树碱两种。该合成路线总共需要10步反应。
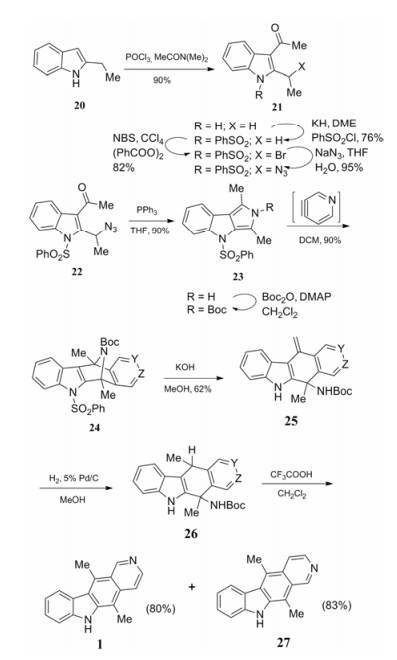
|
Scheme6 Diels-Alder reaction used in synthesis of ellipticine and isoellipticine |
Backvall等[18]采用[4+2]环加成反应的思路, 使吲哚与取代戊二烯环合构建C环并进行芳构化。碘镁基取代吲哚28与3-苯磺酰基-2, 5-己二烯29在甲苯中常温反应得到化合物30, 再与氰化甲基锂在−78 ℃加成得到化合物31, 经钠汞齐还原脱掉苯磺酰保护基后进行芳构化得到化合物32。化合物32在氯化钴作用下用硼氢化钠氢化、再和甲酸乙酯反应得到了化合物33, 经过环合反应得到目标化合物1 (合成路线7)。环加成反应与Diels-Alder反应相比, 更直接的实现了C环构建, 而对D环没有影响。与传统方法相比, 这种方法使用了更多的金属化合物试剂, 含氰基的化合物通常毒性较大。
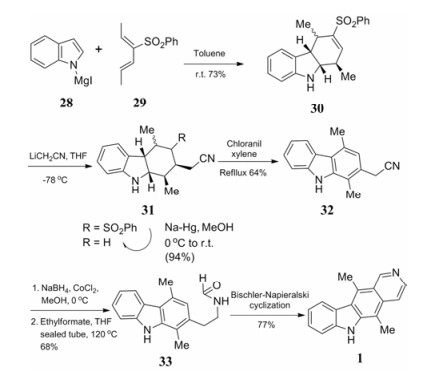
|
Scheme7 [4+2] Cycloaddition reaction in synthesis of ellipticine |
Gribble[19]将Diels-Alder反应运用到玫瑰树碱的合成中, N-取代二氢吡啶酮的双键与含氧环戊二烯发生Diels-Alder反应形成C环, 再进行芳构化得到玫瑰树碱。化合物34作为双键给体, 化合物35作为双键受体, 两者先发生Diels-Alder反应得到中间体36, 再在碱性条件下脱保护得到化合物37, 最后经过氢化铝锂还原以及钯碳脱氢得到目标产物1 (合成路线8)。这种反应策略为此后以Diels-Alder反应构造天然产物母核的研究打下良好的基础, 但是这条反应路线原料不易得且总收率较低, 不适合大量制备。
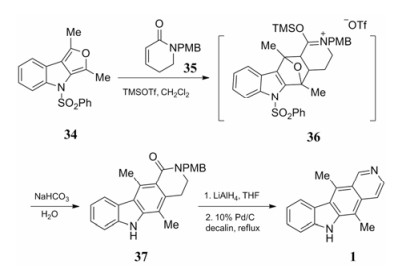
|
Scheme8 Diels-Alder reaction in C ring cyclization |
Díaz等[20]通过控制反应条件, 利用氟化物催化消去反应来提高选择性, 从而更好地控制了产物的种类, 实现了区域专一性的环加成反应, 合成了玫瑰树碱与异玫瑰树碱(合成路线9)。以化合物38为起始原料, LDA拔去4位的氢后TMS发生迁移而得到化合物39, 与三氟甲磺酸酐反应后用许尼希碱处理得到化合物40。在氟离子作用下得到炔中间体与吲哚并呋喃化合物34加成, 由于加成反应方向不同产物也分为两种即化合物41和42 (1:2.4)。两种化合物经制备色谱柱分离后分别用硼氢化钠氢化、钯碳氢气还原裂解醚桥得到异玫瑰树碱和玫瑰树碱。
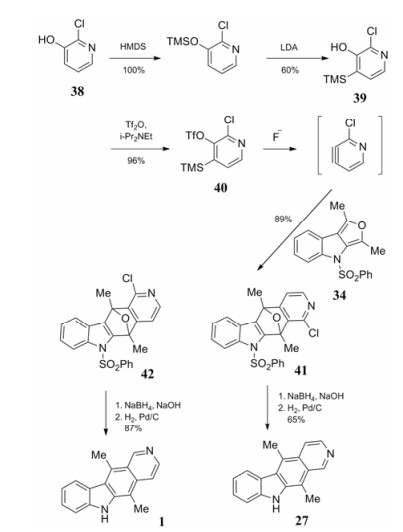
|
Scheme9 Formation of ellipticine and isoellipticine via Diels-Alder reaction |
Pedersen等[21]开发了玫瑰树碱的新合成路线(合成路线10), 利用自由基引发级联反应, 以全新的方式合成了玫瑰树碱。以吡啶酸酯43为起始原料, 与碘甲烷反应引入甲基得到有光学异构的混合产物44, 在三甲基铝的作用下与碘苯胺反应得到偶联产物亚胺45, 进而与丙炔偶联得到化合物46。在叔丁基硼氢化钾和氯化钴作用下与苯化硒脱水缩合得到化合物47, 在叔丁基锡烷存在下闭环得到目标化合物。该方法优点在于反应过程较短、总收率较高(19%), 反应过程中也没有过多苛刻条件, 不足在于使用较多的有机金属试剂, 尤其是叔丁基锡烷毒性较大。
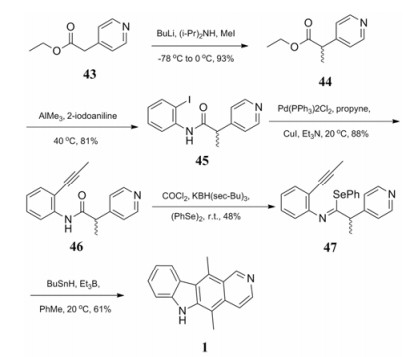
|
Scheme10 Free radical cause cascade reaction in synthesis of ellipticine |
Miki等[22]使用2, 3-吲哚酸酐与取代吡啶缩合构建C环(合成路线11)。以1-苄基-2, 3-二酸酐吲哚48为起始原料与吡啶衍生物49缩合得到化合物50, 用高氯酸和氯化铝脱羧基和苄基得到化合物51, 与磷叶立德和氧化铂反应将羰基置换为甲基得到52, 经取代反应得到化合物53, 最后酸性条件下闭环得到目标化合物。这条路线缺点在于原料不易得, 使用了磷叶立德试剂、有机锡试剂和贵金属试剂, 且总收率较低等缺陷, 不适用于放大量制备。
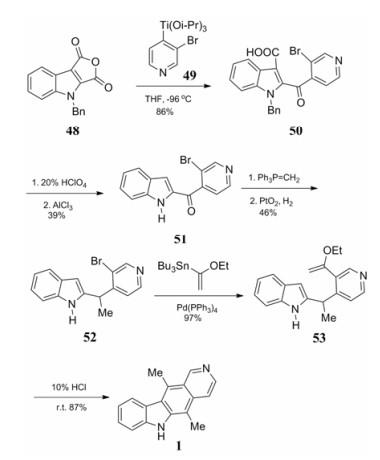
|
Scheme11 Phosphorus ylide involved in the reaction |
Miller等[23]以取代异喹啉为起始原料经由苯并三唑中间体合成玫瑰树碱, 以4-卤代邻硝基苯胺54为起始原料, 与溴代二甲基异喹啉反应生成56, 在雷尼镍催化下硝基被肼还原成氨基得到中间体57, 经乙酸和亚硝酸钠环合形成芳基三氮化合物58, 经过高温反应脱除卤素并闭环得到目标化合物。尽管该反应路线较短, 但闭环反应温度太高(500 ℃)且起始原料不易获得(合成路线12)。
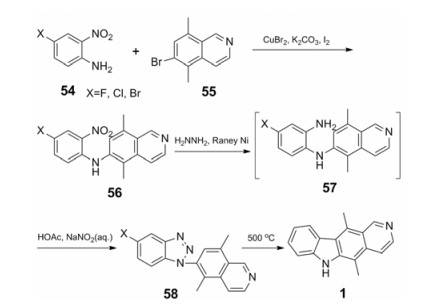
|
Scheme12 Synthesis of ellipticine via benzotriazole intermediates |
Liu等[24]将芳基三氮化合物叠氮化, 参与B环的构建(合成路线13)。以芳基三氮化合物为起始原料, 可以通过改变起始原料的种类得到多种A环修饰的衍生物。以三氮烯59为起始原料, 在−40 ℃下与格氏试剂反应, 碘与氯化镁进行交换, 而后与溴化锌发生金属置换反应, 得到的中间体与7-溴-5, 8-二甲基异喹啉发生交叉偶联得到化合物60。化合物60在叠氮化钠和三氟化硼乙醚作用下迅速转化为芳香叠氮化合物61, 在均三甲苯中回流6小时可得到目标化合物1。该反应路线的优势在于实验步骤较少且反应时间较短, 不足之处使用了较危险的反应试剂如格氏试剂、叠氮化钠等。
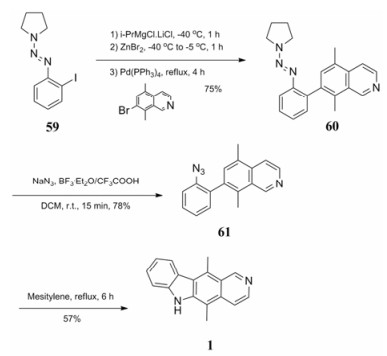
|
Scheme13 Azide in synthesis of ellipticine |
Ho等[25]优化了区域选择性反应的条件, 设计了一条8步总产率为13%的反应路线(合成路线14)。这条反应路线的设计思路不同于常见的以吲哚或吲哚类似物为起始原料, 而是先确定C环, 再从两侧分别构建A、B、D环得到玫瑰树碱。以化合物62为起始原料, 用硼氢化钠还原酮羰基得到化合物63, 经碘取代得到化合物64, 邻硝基苯硼烷与64发生Suzuki偶联反应得到化合物65, 在亚磷酸三乙酯作用下闭环得到化合物66。用DDQ氧化得到酮的乙酸盐, 经氢化铝锂还原得到化合物67的顺反异构体混合物, 两种物质可以经过色谱分离, 也可以用高碘酸钠处理后与醋酸铵直接反应得到目标化合物1。这种方法比较新颖, 用到了一些新的反应, 但是该路线涉及的反应试剂较多且起始原料不易得, 不适合大量制备。
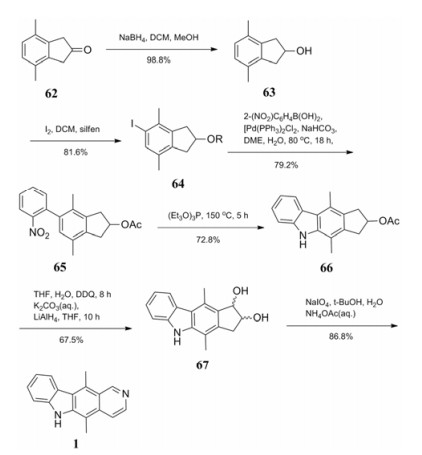
|
Scheme14 Regioselective synthesis of ellipticine |
通过上述各种玫瑰树碱合成路线对比, 基于对原料来源、反应条件、后处理与收率的考虑, 作者建议以吲哚为起始物的合成方法(合成路线15) 为玫瑰树碱的合成路线。该路线具有原料易得、反应条件温和及总收率较高等优点, 有可能成为一种大量合成玫瑰树碱的简便方法。
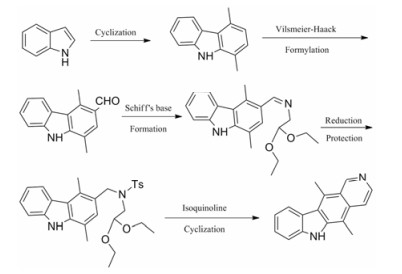
|
Scheme15 Appropriate reaction route of ellipticine |
对于玫瑰树碱的抗肿瘤作用机制, 受到广泛关注的主要有以下几点: ① 作为结构类似物插入DNA互补双螺旋结构, 抑制DNA复制转录过程; ② 抑制DNA拓扑异构酶Ⅱ的活性; ③ 抑制细胞色素P450酶的氧化作用。不少人对此作了相关研究, Vann等[26]合成了5-去甲基-6-N-甲基玫瑰树碱, 发现该类衍生物具有显著拓扑异构酶Ⅱα抑制活性; Kotrbova等[27]认为其抗肿瘤机制是玫瑰树碱在细胞色素P450和细胞色素b5的氧化作用下形成氧化产物特别是13-羟基玫瑰树碱, 与DNA结合形成的玫瑰树碱-DNA加合物而损伤DNA。Banerjee等[28]发现玫瑰树碱能结合核染色质中的组氨酸, 以此作为分子内靶标实现抗肿瘤活性。Zsila等[29]发现, 在弱酸性条件下, 玫瑰树碱可与肿瘤组织细胞外间质中的粘多糖结合, 实现抗肿瘤作用。
2.2 玫瑰树碱的构效关系根据计算机辅助设计的化合物与靶标的配对结果, 易于形成分子内氢键的衍生物的结合度更高[30]。为了探索玫瑰树碱的抗肿瘤构效关系, 研究人员设计并合成了许多新的玫瑰树碱衍生物, 较常见的修饰位点有2位氮、6位氮、13位甲基和9位碳上。2位氮的碱性侧链有助于提高玫瑰树碱的亲和力。Deane等[31]的研究表明2位氮形成链状季铵盐, 其末端具有酰胺或腈时, 相比于对应的酸和盐对DNA亲和力更强, 而碳链的长短对活性影响不大; Vehar等[32]的结果显示9位苯环有吖啶胺取代时其抗肿瘤活性低于玫瑰树碱; 玫瑰树碱6位氮被酰基取代后活性降低; 而2位氮成盐后活性略高于未成盐化合物。Reddy等[33]合成了多种9位芳稠环苯并咪唑环的玫瑰树碱衍生物, 对于特定癌细胞的抗肿瘤活性显著高于玫瑰树碱。Devraj等[34]将雌二醇通过己二胺分别连接2位氮、6位氮和9位羟基玫瑰树碱时, 2位氮和9位羟基连接对雌性激素受体表现较弱的亲和力, 而当6位氮连接时不具备亲和力, 这从侧面说明了6位氮游离对玫瑰树碱抗肿瘤活性是重要的。Banerjee等[35]从玫瑰树碱的物理化学性质出发, 认为玫瑰树碱同时具有质子给体和质子受体的性质, 在不同极性的溶剂中会通过氢键形成多种复合物。Sappati等[36]则认为核量子作用会强化氢键的形成。Honda等[37]为解决玫瑰树碱类化合物的溶解性问题, 使之与糖相连接, 多种衍生物对白血病细胞L1210具有良好的抑制活性, 其中糖与9位羟基相连的活性优于2位氮直接连接。Prudent等[38]报道了玫瑰树碱及衍生物对于蛋白激酶CK2的抑制作用与抗肿瘤活性的构效关系。研究表明, 咔唑环本身不具有抗肿瘤活性, 因此四环骈合的母核是活性必须的结构。9位碳和2位氮是影响其抗肿瘤活性的重要位点, 9位有游离羟基时活性相对较好, 2位氮被烷基或酰基取代会降低对CK2的抑制作用而对Top Ⅱ及c-Kit无明显影响; 在1位碳上, 大位阻的基团取代会影响对c-Kit的活性; 6位氮上的取代不会影响Top Ⅱ的活性, 但会抑制c-Kit和CK2α的作用。研究人员认为, 玫瑰树碱和衍生物的细胞毒作用可能与CK2的抑制作用相关, 因此对于新衍生物的设计最好是9位有游离羟基取代, 而且在2位和6位氮上无取代。Russell合成的7位羟基取代的异玫瑰树碱具有抑制急性骨髓性白血病细胞生长的作用[39]。7-酰基-10-甲基异玫瑰树碱具有诱导线粒体内活性氧的作用, 在小鼠体内表现出抗白血病活性[40]。
作者合成了不同取代的玫瑰树碱衍生物[41], 并探索和验证了其抗肿瘤构效关系(SAR)。合成的衍生物结构如图 3所示。
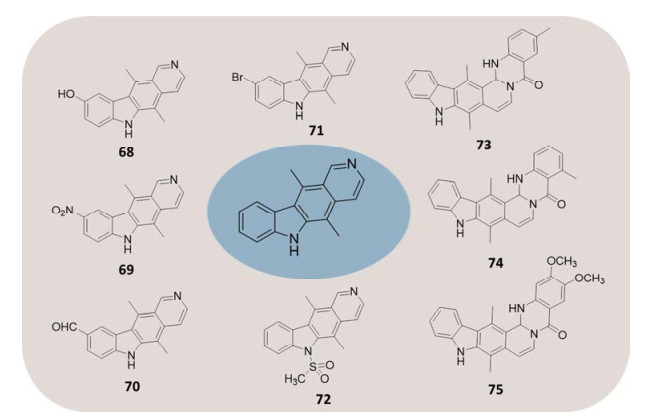
|
Figure 3 Prepared ellipticine derivatives by author |
由表 1可知, 玫瑰树碱对三种人肿瘤细胞(结肠癌细胞HT29、胃癌细胞BGC823、非小细胞肺癌H1650) 均有显著的细胞毒作用, 其半数抑制浓度(IC50)在1.0~3.0 μmol·L−1之间。玫瑰树碱9位取代产物如9-羟基(68)、9-硝基取代产物(69)和9-甲酰基(70)活性基本保留或稍有下降, 9位溴取代产物(71)基本无细胞毒; 玫瑰树碱1, 2位与邻氨基苯甲酸缩合形成的化合物(73、74、75)活性显著降低或丧失抗肿瘤活性; 其6位氮甲磺酰化产物(72)也显著降低细胞毒。初步的抗肿瘤构效关系研究显示, 玫瑰树碱2位氮和6位氮是抗肿瘤活性关键部位。
| Table 1 Biological evaluation of ellipticine derivatives. HT29: Colonic cancer cell, BGC823: Gastric carcinoma cell, H1650: Non-small cell lung cancer cell |
由于玫瑰树碱的共平面四环结构, 其A、B、C、D环均可进行结构修饰。目前已有的结构改造主要集中在玫瑰树碱的2位、6位、9位及5、11位。从体外抗肿瘤活性试验来看, 修饰后的玫瑰树碱细胞毒均有不同程度的下降。考虑到玫瑰树碱C环的5, 11-甲基易在体内被细胞色素P450氧化成羟甲基[42], 可对5位和11位甲基进行改造; 从构效关系来看, A环的小基团取代基本不影响抗肿瘤活性, 其9、10位也是可修饰的位点; 玫瑰树碱还是基因导向细胞色素和过氧化物酶的治疗的合适先导物; 另外可根据相应的载体对玫瑰树碱进行载药实现靶向治疗[43, 44]。
3 前景与展望天然产物及其衍生物是新药先导物的主要来源, 从1983年到1994年, 在已批准的药物中, 42%的药物源于天然产物。玫瑰树碱是传统植物玫瑰树的主要生物碱成分, 从合成角度分析, 玫瑰树碱的结构并不是非常复杂, 目前采用全合成方法可以方便低廉地制备。癌症是我国死亡率第一大疾病, 开发玫瑰树碱新作用机制抗肿瘤药是药学工作者当务之急。玫瑰树碱是一种吲哚并异喹啉类生物碱, 由于它具有较广谱的抗肿瘤活性, 以玫瑰树碱作为抗肿瘤药物先导物, 设计合成新的玫瑰树碱衍生物, 并进行抗肿瘤活性筛选, 研制出具有自主知识产权抗肿瘤新药。
| [1] | Goodwin S, Smith AF, Horning EC. Alkaloids of Ochrosia clliptica Labill[J]. J Am Chem Soc, 1959, 81: 1903–1908. DOI:10.1021/ja01517a031 |
| [2] | Woodward R, Iacobucci G, Hochstein I. The synthesis of ellipticine[J]. J Am Chem Soc, 1959, 81: 4434–4435. DOI:10.1021/ja01525a085 |
| [3] | Sappati S, Hassanali A, Gebauer R, et al. Nuclear quantum effects in a HIV/cancer inhibitor:the case of ellipticine[J]. J Chem Phys, 2016, 145: 205102. DOI:10.1063/1.4968046 |
| [4] | Isah T. Anticancer alkaloids from trees:development into drugs[J]. Pharmacogn Rev, 2016, 20: 90–99. |
| [5] | Paoletti C, Le Pecq JB, Dat-Xuong N, et al. Antitumor activity, pharmacology, and toxicity of ellipticines, ellipticinium, and 9-hydroxy derivatives:preliminary clinical trials of 2-methyl-9-hydroxy ellipticinium (NSC 264-137)[J]. Recent Results Cancer Res, 1980, 74: 107–123. DOI:10.1007/978-3-642-81488-4 |
| [6] | Fung SY, Duhamel J, Chen P. Solvent effect on the photophysical properties of the anticancer agent ellipticine[J]. J Phys Chem A, 2006, 40: 11446–11454. |
| [7] | Kim JY, Lee SG, Chung JY, et al. Ellipticine induces apoptosis in human endometrial cancer cells:the potential involvement of reactive oxygen species and mitogen-activated protein kinases[J]. Toxicology, 2011, 289: 91–102. DOI:10.1016/j.tox.2011.07.014 |
| [8] | Stiborová M, Poljaková J, Martínková E, et al. Ellipticine oxidation and DNA adduct formation in human hepatocytes is catalyzed by human cytochromes P450 and enhanced by cytochrome b5[J]. Toxicology, 2012, 302: 233–241. DOI:10.1016/j.tox.2012.08.004 |
| [9] | Saxton JE, Canwell PA. A synthesis of ellipticine[J]. J Chem Soc, 1962, 1962: 3482–3487. |
| [10] | Dalton LK, Demerac S, Elmes BC, et al. Synthesis of the tumour-inhibitory alkaloids, ellipticine, 9-methoxyellipticine, and related pyrido[4, 3-b] carbazoles[J]. Aust J Chem, 1967, 20: 2715–2717. DOI:10.1071/CH9672715 |
| [11] | Robert W, Guthrie AB, Francis A, et al. Ellipticine derivatives[J]. J Med Chem, 1975, 18: 755–760. DOI:10.1021/jm00241a023 |
| [12] | Lee HY, Chen GS, Chen CS, et al. Efficient microwaveassisted synthesis of ellipticine through N-(1, 4-dimethyl-9Hcarbazol-3-ylmethyl)-N-tosylaminoacetaldehyde diethyl acetal[J]. J Heterocyclic Chem, 2010, 47: 454–458. |
| [13] | Dračínský M, Sejbal J, Rygerová B, et al. An efficient modification of ellipticine synthesis and preparation of 13-hydroxyellipticine[J]. Tetrahedron Lett, 2007, 48: 6893–6895. DOI:10.1016/j.tetlet.2007.07.160 |
| [14] | Deane FM, Miller CM, Maguire AR, et al. Modifications to the Vilsmeier-Haack formylation of 1, 4-dimethylcarbazole and its application to the synthesis of ellipticine[J]. J Heterocyclic Chem, 2011, 48: 814–823. DOI:10.1002/jhet.v48.4 |
| [15] | Modi SP, Michael MA, Carey JJ, et al. An efficient synthesis of C-11 substituted 6H-pyrido[4, 3-b] carbazoles[J]. Tetrahedron, 1991, 47: 6539–6548. DOI:10.1016/S0040-4020(01)82308-5 |
| [16] | Hibino S, Sugino E. Synthesis of ellipticine and olivacine by the thermal electrocyclic reaction via pyridine 3, 4-quinodimethane intermediates[J]. J Heterocycle Chem, 1990, 27: 1751–1755. DOI:10.1002/jhet.v27:6 |
| [17] | Sha CK, Yang JF. Total syntheses of ellipticine alkaloids and their amino analogues[J]. Tetrahedron, 1992, 48: 10645–10654. DOI:10.1016/S0040-4020(01)88360-5 |
| [18] | Backvall JE, Plobeck NA. New synthesis of the 6 H-pyrido[4, 3-b] carbazoles ellipticine and olivacine via cycloaddition of 2-phenylsulfonyl 1, 3-dienes to indoles[J]. J Org Chem, 1990, 55: 4528–4531. DOI:10.1021/jo00302a013 |
| [19] | Gribble GW, Saulnier MG, Sibi MP, et al. Synthesis and Diels-Alder reactions of 1, 3-dimethy l-4-(phenylsulfonyl)-4 Hfuro[3, 4-b] indole. A new annulation strategy for the construction of ellipticine and isoellipticine[J]. J Org Chem, 1984, 49: 4518–4523. DOI:10.1021/jo00197a039 |
| [20] | Díaz MT, Cobas A, Guitián E, et al. Polar control of the regioselectivity of hetaryne cycloadditions. Synthesis of ellipticine[J]. Syn Lett, 1998, 1998: 157–158. |
| [21] | Pedersen JM, Bowman WR, Elsegood RJ, et al. Synthesis of ellipticine:a radical cascade protocol to aryl-and heteroarylannulated[b]carbazoles[J]. J Org Chem, 2005, 70: 10615–10618. DOI:10.1021/jo0519920 |
| [22] | Miki Y, Tada Y, Yanase N, et al. Reaction of lndole-2, 3-dicarboxylic anhydride with (3-bromo-4-pyridyl) triisopropoxytitanium:synthesis of ellipticine[J]. Tetrahedron Lett, 1996, 37: 7753–7754. DOI:10.1016/0040-4039(96)01768-6 |
| [23] | Miller RB, Stowell JG. Total synthesis of ellipticine and 9-methoxyellipticine via benzotriazole intermediates[J]. J Org Chem, 1983, 48: 886–888. DOI:10.1021/jo00154a030 |
| [24] | Liu CY, Knochel P. Preparation of polyfunctional aryl azides from aryl triazenes. A new synthesis of ellipticine, 9-methoxyellipticine, isoellipticine, and 7-carbethoxyisoellipticine[J]. J Org Chem, 2007, 72: 7106–7115. DOI:10.1021/jo070774z |
| [25] | Ho TL, Hsieh SY. Regioselective synthesis of ellipticine[J]. Helv Chim Acta, 2006, 89: 111–117. DOI:10.1002/(ISSN)1522-2675 |
| [26] | Vann KR, Ergün Y, Zencir S, et al. Inhibition of human DNA topoisomerase Ⅱ a by two novel ellipticine derivatives[J]. Bioorg Med Chem Lett, 2016, 26: 1809–1812. DOI:10.1016/j.bmcl.2016.02.034 |
| [27] | Kotrbová V, Mrázová B, Moserová M, et al. Cytochrome b5 shifts oxidation of the anticancer drug ellipticine by cytochromes P4501A1 and 1A2 from its detoxication to activation, thereby modulating its pharmacological efficacy[J]. Biochem Pharmacol, 2011, 82: 669–680. DOI:10.1016/j.bcp.2011.06.003 |
| [28] | Banerjee A, Sanyal S, Majumder P, et al. Recognition of chromatin by the plant alkaloid, ellipticine as a dual binder[J]. Biochem Biophys Res Commun, 2015, 462: 352–357. DOI:10.1016/j.bbrc.2015.04.140 |
| [29] | Zsila F. The anticancer agent ellipticine binds to glycosaminoglycans at mildly acidic pH characteristic of the extracellular matrix of tumor tissues[J]. RSC Adv, 2016, 6: 810–814. DOI:10.1039/C5RA23437A |
| [30] | Mamgain S, Sharma P, Pathak RK, et al. Computer aided screening of natural comppunds targeting the E6 protein of HPV using molecular docking[J]. Bioinfomation, 2015, 115: 236–242. |
| [31] | Deane FM, O'Sullivan EC, Maguire AR, et al. Synthesis and evaluation of novel ellipticines as potential anti-cancer agents[J]. Org Biomol Chem, 2013, 11: 1334–1344. DOI:10.1039/c2ob27186a |
| [32] | Vehar B, Hrast M, Kovac A, et al. Ellipticines and 9-acridinylamines as inhibitors of D-alanine:D-alanine ligase[J]. Bioorg Med Chem, 2011, 19: 5137–5146. DOI:10.1016/j.bmc.2011.07.020 |
| [33] | Reddy NB, Burra VR, Ravindranath LK, et al. Synthesis and biological evaluation of benzimidazole fused ellipticine derivatives as anticancer agent[J]. Monatsh Chem, 2016, 147: 599–604. DOI:10.1007/s00706-016-1684-z |
| [34] | Devraj R, Barrett JF, Fernandez JA, et al. Design, synthesis, and biological evaluation of ellipticine-estradiol conjugates[J]. J Med Chem, 1996, 39: 3367–3374. DOI:10.1021/jm9602930 |
| [35] | Banerjee S, PabbathiA, Sekhar MC, et al. Dual fluorescence of ellipticine:excited state proton transfer fromsolvent versus solvent mediated intramolecular proton transfer[J]. J Phys Chem A, 2011, 115: 9217–9225. DOI:10.1021/jp206232b |
| [36] | Sappati S, Hassanali A, Gebauer R, et al. Nuclear quantum effects in a HIV/cancer inhibitor:the case of ellipticine[J]. J Chem Phys, 2016, 145: 205102. DOI:10.1063/1.4968046 |
| [37] | Honda T, Kato M, Inoue M, et al. Synthesis and antitumor activity of quaternary ellipticine glycosides, a series of novel and highly active antitumor agents[J]. J Med Chem, 1988, 31: 1295–1305. DOI:10.1021/jm00402a007 |
| [38] | Prudent R, Moucadel V, Nguyen CH, et al. Antitumor activity of pyridocarbazole and benzopyridoindole derivatives that inhibit protein kinase CK2[J]. Cancer Res, 2010, 23: 9865–9874. |
| [39] | Russell EG, O'Sullivan EC, Miller CM, et al. Ellipticine derivative induces potent cytostatic effect in acute myeloidleukaemia cells[J]. Invest New Drugs, 2014, 32: 1113–1122. DOI:10.1007/s10637-014-0140-3 |
| [40] | Russell EG, Guo J, O'Sullivan EC, et al. 7-Formyl-10-methylisoellipticine, a novel ellipticine derivative, induces mitochondrial reactive oxygen species (ROS) and shows antileukaemic activity in mice[J]. Invest New Drugs, 2016, 1: 15–23. |
| [41] | LinJ, Du G, Pan X. Synthesis Optimization and Bioassay of Ellipticine Derivatives[C]. Shanghai:CCS 11th National Symposium on Natual Organic Chemistry (第十一届中国天然有机化学会议论文集), 2016:376. |
| [42] | Montoia A, Silva LFR, Torres ZE, et al. Antiplasmodial activity of synthetic ellipticine derivatives and an isolated analog[J]. Bioorg Med Chem Lett, 2014, 24: 2631–2634. DOI:10.1016/j.bmcl.2014.04.070 |
| [43] | Studenovský M, Sedláček O, Hrubý M, et al. Multiresponsive polymer micelles as ellipticine delivery carriers for cancer therapy[J]. Anticancer Res, 2015, 35: 753–758. |
| [44] | Koninti RK, Palvai S, Satpathi S, et al. Loading of an anticancer drug into mesoporous silica nano-channels and its subsequent release to DNA[J]. Nanoscale, 2016, 43: 18436–18445. |
 2017, Vol. 52
2017, Vol. 52


