信号传导与活化转录因子(signal transducers and activators of transcription, STATs)家族是一种存在于胞浆、通过激活转入核内结合DNA的蛋白家族, 在细胞中起到传递信号和启动基因转录的双重作用[1]。STAT3是信号传导与转录激活因子家族的重要成员, 广泛表达于不同类型的组织和细胞中[2]。近年来, STAT3信号通路与肿瘤的关系日益受到人们的重视。STAT3在肿瘤的发生发展中起了至关重要的作用。
1 STAT3的结构和生物功能STAT家族具有信号转导和转录激活的双重作用, 是JAK-STAT信号途径的重要环节。STAT家族已被确认的成员有7个, 分别是STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6, 它们各由不同的基因编码。而STAT1和STAT3的C端缺失会形成野生型STAT蛋白, 比如STAT1β和STAT3β[3]。
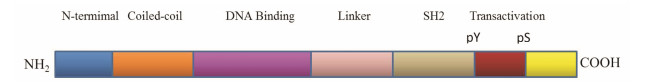
1.1 STAT3的结构STAT3的编码基因定位于人类第17号染色体中, STAT3蛋白由750~795个氨基酸组成, 分子质量为89~92 kDa。STAT3的结构与其他STAT蛋白类似, 主要由7个部分构成(图 1): ① Src同源功能域2区(Src homology 2, SH2), 位于第600~700位氨基酸, 主要促使STAT3与活化的受体形成复合物, 使STAT3形成二聚体, 转移至细胞核, 识别并结合DNA, 诱导特定靶基因的转录; ② Src同源功能域3区, 位于第500~600位氨基酸, 保守性较差, 功能尚不清楚; ③ 羧基端第705位的酪氨酸磷酸化位点, 该位点磷酸化后激活STAT3并形成STAT3二聚体, 转入核内调节靶基因的转录; ④ DNA结合区, 位于分子中部第400~500位氨基酸之间, 这个区域决定了STAT3与DNA结合的特异性; ⑤ 保守性较差的羧基端, 含有转录激活区, 与转录激活有关; ⑥ 第727位的丝氨酸磷酸化位点; ⑦ 保守的氨基酸序列[4]。
|
Figure 1 The domain structure of STAT3 |
在正常细胞中, STAT3的活化被严格控制以防止基因调控异常。在生理条件下, 受体诱导的STAT3活化是一个紧密调控的瞬间过程, STAT3磷酸化的高峰期发生在细胞因子刺激后15~60 min内, 之后即使细胞因子持续刺激, STAT3的活化依然会持续衰减[5]。这个过程由几个负调节蛋白家族紧密调节, 包括细胞因子蛋白抑制剂(suppressor of cytokine signaling proteins, SOCS1-7)、STATs蛋白活化抑制剂(protein inhibitors of activated STATs, PIAS)及蛋白质酪氨酸磷酸酶(protein tyrosine phosphatases, PTPs)等[6]。
STAT3可被多种细胞因子, 如IL-6、LIF、cardiotrophin-1 (心肌营养素-1)、IL-5、IL-9、IL-10、IL-11、IL-12、IL-21、IL-22、IFN-γ、TNF-α和生长因子(如EGF、TGFα、PDGF、IGF-1、G-CSF和M-CSF)等活化[7], 可激活STAT3的生长因子受体包括表皮生长因子受体(EGFRs)、成纤维细胞生长因子受体(FGFRs)、胰岛素样生长因子受体(IGFRs)、肝细胞生长因子受体(HGFRs)、血小板衍生生长因子受体(PDGFRs)及血管内皮生长因子受体(VEGFRs)[8]。STAT3与受体磷酸化位点结合导致了STAT3 C末端区域705位酪氨酸位点磷酸化, 从而活化STAT3[9]。同时, 其他非受体蛋白酪氨酸激酶也被报道可以激活STAT3, 比如Src激酶家族, 包括Src、Lck、Hck、Lyn和Fyn等。Tyr705位的磷酸化使得STAT3从非活化形式向活化形式转变, 磷酸化的Tyr705位与另一个STAT3的SH2域结合从而发生二聚化[10]。
二聚化的STAT3从受体上解离出来, 并且转位到细胞核内。输入蛋白α5/NPI-1的C端有一个STAT3结合区域, 可以转运STAT3入核。在细胞核内, 二聚化的STAT3与DNA结合, 并识别特殊DNA反应元件的大沟区, 这些反应元件包括与细胞增殖、分化和凋亡有关的目的基因启动子[11]。STAT3二聚体可以识别一个8~10个碱基对的反向重复序列DNA元件, 这个序列有一致的5-TT (N) AA-3碱基[12]。
此外, 也已观察到潜在的或者非磷酸化形式的STAT二聚体在细胞信号的各个方面扮演重要角色。与其他STATs不同的是, STAT3能够以非磷酸化形式进入细胞核内, 但是活化的STATs穿梭核孔更加频繁[13, 14]。
2 STAT3在肿瘤发生中的作用 2.1 STAT3与肿瘤生物功能的关系进展在所有STAT家族成员中, STAT3与肿瘤发生发展紧密相关, 属于致癌基因[15]。有报道认为, 在人类肿瘤细胞系中STAT3与正常细胞中STAT3的短暂激活相反, 呈持续活化状态, 这些肿瘤包括白血病、淋巴瘤、多发性骨髓瘤、神经胶质瘤、黑色素瘤、头颈部瘤、乳腺癌、卵巢癌、子宫内膜癌、宫颈癌、结肠癌、胰腺癌、肺癌、脑癌、肾癌及前列腺癌等[16]。
2.1.1 增殖STAT3蛋白在细胞因子诱导的增殖中起到重要作用。在乳腺癌细胞中, 自分泌调节的STAT3活化与细胞增殖有关。活化后的STAT3促进增殖主要是通过激活肿瘤细胞中细胞周期相关基因如cyclin D1、cyclin B和Cdc2的转录。活化的STAT3通过上调cyclin D1的表达促进G1/S期的过渡, cyclin D1与Cdk4或Cdk6协同促进胃癌和结直肠癌细胞G1期到S期的进程[17]。针对膀胱癌细胞中的STAT3信号通路, 抑制STAT3可以下调cyclin D1的表达, 进而抑制细胞生长并诱导细胞凋亡[18]。在人头颈部鳞癌细胞中, STAT3的持续活化对cyclin D1的持续表达起到关键的作用[19]。研究发现组成型STAT3的磷酸化可以诱导结直肠癌和乳腺癌中目的基因如Cdc2、cyclin B1、m-Ras和E2F-1的过表达。在细胞因子诱导的G1到S期细胞周期过渡中, STAT3起着重要的作用, 这个过程伴随着cyclin D2、D3、A和Cdc25A的上调及p21和p27的下调, p21的抑制由STAT3调控的几个信号分子控制[20, 21]。
2.1.2 生存肿瘤细胞特性之一是可以避免细胞程序性死亡。Bcl-2蛋白家族是重要的一类细胞凋亡调节因子, 在众多种类的肿瘤中, Bcl-2家族成员异常表达[22]。发现在多个骨髓瘤细胞中STAT3信号通路能促进组织凋亡信号通路, 其中组成型STAT3能够促进Bcl-xL表达。STAT3的靶基因如survivin和Bcl家族成员(Bcl-xL、Bcl-2和Mcl-1), 对细胞的生存至关重要[23]。人骨髓瘤细胞U266能表达高水平的抗凋亡蛋白Bcl-xL, 抵抗Fas介导的凋亡。抑制Jak2/ STAT3信号通路, 可抑制Bcl-xL的表达, 诱导凋亡, 这表明STAT3对骨髓瘤细胞的生存是必不可少的。
Mcl-1是Bcl-2家族的另一个抗凋亡蛋白。抑制人肿瘤细胞中的STAT3可下调Mcl-1, 进而引起肿瘤细胞凋亡。Survivin是凋亡蛋白家族的抑制因子, 既能阻止凋亡, 又可调控有丝分裂。Survivin在G2/M期选择性表达, 磷酸化后与Cdc2协同发挥作用。抑制STAT3可明显降低survivin表达, 而在人胃癌细胞中过表达survivin能够拮抗由STAT3抑制引起的细胞凋亡[24-26]。
2.1.3 侵袭迁移STAT3主要是在细胞骨架重组和细胞黏附两方面参与调节细胞运动[27]。最近的研究表明STAT3活性的增加能增强细胞间接触, 这提示STAT3可能是肿瘤细胞相互接触的传感器, 能够上调肿瘤细胞侵袭和转移相关基因的表达[27, 28]。
在人皮肤鳞状细胞癌中, STAT3磷酸化水平与肿瘤抑制基因E-cadherin的表达呈负相关[29]。整合素是肿瘤生长、黏附和侵袭的重要介质, STAT3能够阻断上皮黏附并且激活下游的ErbB2/integrins β4信号通路, 使得乳腺癌大量增生。前列腺上皮细胞中持续活化的组成型STAT3-C变体能降低E-cadherin水平, 增加板状伪足和应力纤维的含量, 同时通过诱导整合素β6和纤连蛋白促进肿瘤形成及其迁移[30, 31]。细胞间黏附分子1 (intercellular adhesion molecule-1, ICAM-1/CD54) 是调节细胞间相互作用的细胞表面糖蛋白, 它的高表达与肿瘤的侵袭和恶化相关。据文献[32]报道, 射线能显著增加人胶质瘤细胞核中磷酸化p65和磷酸化STAT3的相互作用, 并伴随着细胞黏附分子-1水平的增高, 肿瘤细胞迁移和侵袭能力的增强。
肿瘤细胞分泌的金属基质蛋白酶(matrix metal loproteinases, MMPs)在肿瘤细胞的侵袭转移中扮演重要角色。STAT3的靶基因包括多种MMP家族蛋白, 其对肿瘤的侵袭、血管再生和迁移有重要贡献。STAT3与Fra-1/c-Jun相互作用, 并结合到MMP-9基因的启动子区域, 导致乳腺癌细胞系中MMP-9转录激活。在高转移的黑色素瘤细胞中, STAT3能够直接结合到MMP-2基因的启动子并上调基因表达[33]。阻断STAT3能明显下调MMP-2表达进而抑制裸鼠中肿瘤的生长和侵袭。活化的STAT3与c-Jun相互作用, 结合到MMP-1的启动子区域, 诱导膀胱癌中MMP-1的表达[34]。STAT3与结直肠癌恶性肿瘤的进展紧密相关, 激活STAT3既能提高MMP-1 mRNA水平, 又能增加MMP-1分泌酶的活性。而通过利用RNAi抑制STAT3活性, 能够降低人乳腺癌细胞的迁移和侵袭[35]。
2.1.4 血管生成肿瘤细胞的内在能力不止是过度增殖和抵抗凋亡。肿瘤要满足自身的生长, 就需要从新形成的血管中得到氧和营养素的供养。活化的癌基因在刺激血管生成方面起到关键的作用, 其中VEGF起着至关重要的作用。STAT3在胶质瘤和成神经管细胞瘤中组成型表达, 并且被认为在自分泌活化VEGF中起到核心作用。最早支持STAT3与血管生成相关的证据来源于粒细胞−巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GM-CSF), 它能刺激鸡绒毛膜尿囊膜表面, 诱导鸡主动脉环上血管大量生成[36]。将组成型的STAT3-C变体转入细胞, 增加VEGF的表达, 同时诱导体内的血管生成。在诸多的血管前因子中, VEGF和缺氧诱导因子1α (hypoxia-inducible factor-1α, HIF-1α)是STAT3的主要转录靶点, 并且HIF-1α行使功能需要STAT3的参与。阻断STAT3信号通路能够抑制Src调节的VEGF上调, 并且能完全抑制肿瘤细胞VEGF依赖的血管渗透性。在非小细胞肺癌中, STAT3信号通路活化后通过上调VEGF和bFGF来调节肿瘤血管生成[37]。HIF-1α是肿瘤VEGF上调的最后关卡, STAT3也会直接与HIF-1α相互作用, 然后在低氧环境下被招募到人VEGF启动子上, 这说明在人肾癌细胞中STAT3能促进低氧诱导的血管生成。组成型STAT3通过结合到p53启动子上抑制p53表达, 同样, 阻断STAT3信号通路可能会增加HIF-1α的降解从而降低HIF-1α的活性[38]。
2.2 STAT3与肿瘤免疫微环境的关系进展 2.2.1 炎症STAT3信号通路是一条很重要的内源性肿瘤炎症通路, 它经常在与肿瘤相关的免疫和炎症细胞中被激活。细胞因子、趋化因子及调节剂, 例如IL-6、IL-1β、巨噬细胞集落刺激因子、前列腺素和环氧酶-2 (COX-2) 对于诱导和维持肿瘤炎症环境至关重要, 而STAT3对这些因子的分泌起到关键作用。在肿瘤微环境中, 肿瘤细胞激活的STAT3使得细胞因子、趋化因子和生长因子大量产生, 这些因子与基质炎性细胞的受体结合后又会反过来激活STAT3, 从而释放炎性介质到肿瘤微环境中。IL-6是个重要的炎症介质, 它的下游产物导致慢性炎症的产生, 而这与很多种类的肿瘤有着密切的联系。IL-6通过激活gp130/JAK/STAT3信号通路发挥调节作用。STAT3诱导鞘氨醇-1-磷酸受体1 (S1PR1) 上调, 该受体能反馈激活STAT3, 导致IL-6不断生成从而刺激黑色素瘤B16和膀胱癌MB49的生长和侵袭[27]。IL-11能够促进慢性胃炎和胃上皮细胞中肿瘤的发生, 而这与STAT3过度激活密切相关。在非小细胞肺癌中, IL-6诱导的STAT3活化具有COX-2依赖性。在大鼠巨噬细胞系中, LPS介导的IL-1β和IL-6生成依赖于STAT3的磷酸化。转基因鼠肺泡Ⅱ型细胞中STAT3C变异体的过表达会导致严重的肺部炎症, 包括免疫细胞的渗透及肺部免疫前细胞因子和趋化因子的表达上调, 从而自发地导致支气管肺泡腺癌的发生[28]。
2.2.2 免疫逃逸经过对多种实体瘤的研究发现, p-STAT3能促进一些肿瘤源性因子如IL-6、IL-10、TGF-β、VEGF和CCL22等产生, 对细胞毒性T淋巴细胞(CTLs)和NK细胞的活性及树突状细胞(dendritic cells, DCs)的成熟起着抑制作用, 同时又可促进肿瘤微环境中DCs、髓样来源的抑制细胞(MDSC)、肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)和调节性T细胞(Treg)等细胞的募集和活化, 释放更多的免疫抑制性分子, 招募更多的免疫抑制性细胞, 从而形成一个恶性循环的免疫抑制肿瘤微环境。在B16肿瘤细胞和成纤维细胞中, STAT3的活化形式STAT3C能作用于VEGF的启动子从而加强VEGF的表达, VEGF诱导DC中的STAT3活化, 从而抑制DC的分化成熟, 使用VEGF抗体可以解除对DCs分化成熟的抑制[39]。
在体内正常的巨噬细胞可以吞噬肿瘤细胞, 向T淋巴细胞呈递抗原, 并表达细胞因子从而活化T淋巴细胞及NK细胞。而在肿瘤微环境中, 巨噬细胞会转变为M2型巨噬细胞。M2型巨噬细胞可以产生Th2型细胞因子, 促进肿瘤免疫逃逸的发生, 如M-CSF、IL-4、IL-13和IL-10; M2型巨噬细胞还可产生直接促进肿瘤细胞增殖的IL-1β、TNF-α和IL-6, 此外还分泌与血管生成相关的因子, 如TNF-α、CXCL8、IL-6和IL-23, 促进了肿瘤血管的生成。TAMs中表达的STAT3能抑制宿主的抗肿瘤免疫反应, 从黑色素瘤小鼠模型肿瘤组织中分离出的巨噬细胞中存在STAT3过度活化, 通过VEGF和bFGF诱导了血管生成[40]。
Treg细胞是具有特定表型(CD4+ CD25+ FOXP3+)和免疫抑制功能的T淋巴细胞亚群, 在肿瘤的免疫逃逸中发挥重要的作用。肿瘤浸润的Treg细胞中STAT3活性明显增加, 其分泌的TGF-β和IL-10能够直接抑制CD8+ T淋巴细胞活化或间接通过DCs抑制CD8+ T淋巴细胞活化。此外, Treg细胞能促进抗原提呈细胞失活, 并抑制Th1细胞和细胞毒性T淋巴细胞的抗肿瘤活性。肿瘤微环境中产生的IL-23, 通过IL-23受体依赖STAT3途径增强了Treg细胞的免疫抑制作用。STAT3可能通过IL-10、TGF-β及IL-23等细胞因子参与Treg细胞的分化及活化, 促进肿瘤免疫逃逸的发生[41]。
MDSC是由未成熟的骨髓细胞因分化受阻所形成的一群异质性细胞, 在肿瘤微环境中参与免疫抑制和促进肿瘤血管生成, 其分化和功能也受到STAT3的调节。肿瘤微环境中CCL2、CXCL2、IL-1β、钙结合蛋白S100A9和S100A8的表达将MDSC招募到肿瘤灶, 同时抑制MDSC向成熟的DC细胞分化, 使得MDSC的数量不断增多[42]。
3 STAT3合成特异性小分子抑制剂如前所述, STAT3的异常活化在不同肿瘤的发生、发展和转移中起了关键作用, STAT3已经成为肿瘤治疗的新靶点。
Stattic (图 2)是非肽类的小分子抑制剂, 通过结合到SH2区域选择性抑制STAT3, SH2区域对于STAT3的活化和核转位至关重要。10 μmol·L−1 stattic使STAT3依赖性的MDA-MB-231细胞G1期阻滞增加7.6倍, 而MDA-MB-435s细胞G1期阻滞增加14.4倍, 而在STAT3非依赖性的MDA-MB-453中则只有轻微的增长。TUNEL结果表明stattic处理24 h后, MDA-MB-435s发生了显著的凋亡。Stattic能抑制酪氨酸磷酸化位点与STAT3 SH2区域结合, 阻止二聚化以及STAT3的DNA结合[43]。

|
Figure 2 Several small molecular targeted STAT3 inhibitors |
阿斯利康的AZD9150是一种反义寡核苷酸, 可抑制STAT3表达, 最近临床数据表明, 系统给药的反义寡核苷酸能作用于肝脏的基因。体内给予AZD9150后, 能够降低一系列临床前肿瘤模型的STAT3表达, 并且在淋巴瘤和肺癌模型中表现出抗肿瘤效果[44]。
小分子化合物STA-21 (图 2)在细胞中能抑制STAT3的DNA结合活性、STAT3二聚化及STAT3依赖性的荧光素酶活性。STA-21有效地抑制了乳腺癌肿瘤细胞系的生长和存活, 如表达持续活化STAT3的MDA-MB-231、MDA-MB-435s及MDA-MB-468细胞。在RH30和RD2细胞中, STA-21通过对caspase 3、caspase 8和caspase 9的调节抑制细胞的活性和生长, 同时诱导了细胞凋亡[45]。
日本大冢公司开发的口服STAT3抑制剂OPB-51602, 正在进行治疗难治复发淋巴瘤的Ⅰ期临床试验, 20例临床患者使用不同的剂量分别为1、2、3、4和6 mg。结果表明, 最大耐受剂量为6 mg, 患者在1~4 mg内能够很好地耐受。
小分子化合物napabucasin (图 2)是一种口服有效的STAT3和癌细胞多能性抑制剂, 半数抑制浓度(IC50)范围为0.291~1.19 μmol·L−1。Napabucasin能显著抑制肿瘤细胞增殖, 下调肿瘤基因的表达。同时也能抑制结直肠癌的自发性肝转移, 延缓胰腺癌的复发。目前, napbucasin已经进入Ⅲ期临床试验, 用于胰腺癌、非小细胞肺癌和结直肠癌的治疗[46]。
4 天然产物STAT3抑制剂除了合成的小分子抑制剂外, 从天然产物中提取分离的小分子化合物也能很好地抑制肿瘤中STAT3信号通路的活化。下面介绍几种能阻止STAT3活化和肿瘤生长侵袭的天然小分子化合物(图 3)。
|
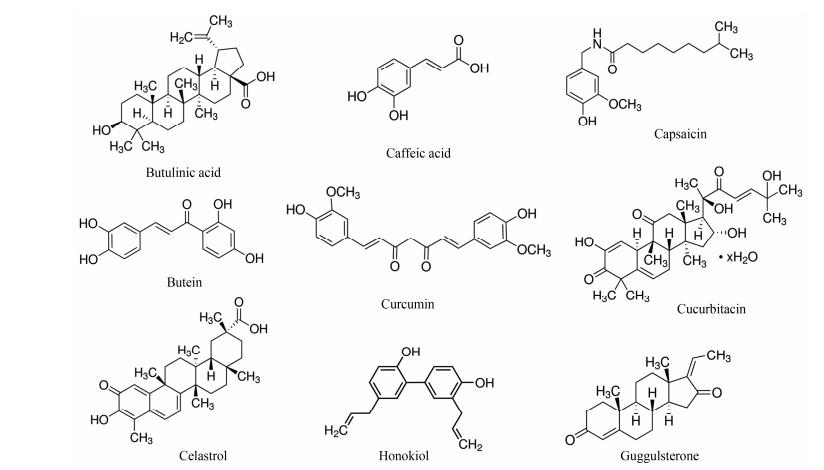
Figure 3 Chemical structures of selected natural blockers of STAT3 activation cascade |
白桦脂酸(betulinic acid)是从台湾青枣中提取出来的五环三萜烯, 最先被报道对黑色素瘤有特异性细胞毒性。另外, 在过去的10年中, 大量的研究发现其能诱导甲状腺癌、乳腺癌、肺癌、结肠癌、白血病和多发性骨髓瘤的细胞凋亡。白桦脂酸同样可以下调STAT3下游产物的表达, 如Bcl-xL、Bcl-2、cyclin D1和survivin。它还能增加caspase-3诱导的PARP剪切, 诱导凋亡和G1期细胞周期阻滞[47]。
4.2 紫铆花素紫铆花素(butein)在韩国、日本和中国等地区被广泛用于治疗疼痛、血栓、胃炎和胃部肿瘤等。有报道指出紫铆花素能抑制乳腺癌、结肠癌、骨肉瘤、淋巴瘤、急性骨髓性白血病和黑色素瘤等肿瘤的增殖。紫铆花素能抑制HepG2细胞中STAT3的活化, 并且呈浓度和时间依赖性[48]。
4.3 咖啡酸咖啡酸(caffeic acid)的抗氧化和抗炎作用已被广泛研究。咖啡酸及其衍生物显著抑制STAT3活性。STAT3 Tyr705在低氧条件下磷酸化增加, 而在咖啡酸作用下呈剂量依赖性降低[49]。
4.4 辣椒素辣椒素(capsaicin)被报道在肿瘤化学预防上有积极作用。辣椒素通过下调STAT3相关下游蛋白, 如Bcl-2、Bcl-xL和survivin的表达来诱导多种肿瘤细胞的凋亡。辣椒素抑制多种肿瘤细胞中的STAT3活性, 且呈现剂量和时间依赖性。辣椒素下调cyclin D1、Bcl-2、Bcl-xL、survivin和VEGF的表达, 而且能诱导细胞G1期阻滞, 从而抑制细胞增殖, 诱导凋亡[50]。
4.5 南蛇藤醇南蛇藤醇(celastrol)是从中药植物昆明山海棠中提取获得, 据报道体内外均能抑制多种肿瘤细胞增殖、诱导凋亡、抑制侵袭转移及血管生成。HepG2细胞与不同浓度的南蛇藤醇共培养6 h, 可剂量依赖性地抑制组成型STAT3的活化。此外, 南蛇藤醇也能时间依赖性抑制STAT3的DNA结合能力, 同时抑制STAT3的核转位, 从而抑制转录因子功能[51]。
4.6 葫芦素类葫芦素(cucurbitacins)是很多中药含有的成分, 具有抗炎、抗微生物和抗肿瘤的作用。最近有报道葫芦素B能抑制多种人肿瘤细胞和异位移植瘤的生长。在人肝癌细胞中, 葫芦素B能降低STAT3磷酸化水平, 并下调下游产物cyclin B1和Bcl-2等表达[52]。
4.7 其他除了上述几种天然化合物外, 还有如姜黄素(curcumin)、没药甾酮(guggulsterone)与和厚朴酚(honokiol)等也表现出STAT3抑制活性。脑胶质瘤是最常见和最致命的脑部肿瘤。姜黄素能剂量依赖性抑制鼠脑胶质瘤细胞中JAK1、JAK2和STAT3酪氨酸磷酸化。下调STAT3靶基因, 如c-Myc、MMP-9、Snail、Twist和Ki67的转录。此外, 姜黄素能诱导G2/M期细胞周期阻滞, 从而抑制细胞增殖。没药甾酮能呈剂量和时间依赖性地抑制U266肿瘤细胞中组成型STAT3的活性, 10~25 μmol·L−1作用4 h时抑制效果最强。和厚朴酚能够剂量和时间依赖性地抑制HepG2细胞中组成型的STAT3活化, 最大抑制浓度为50 μmol·L−1, 最大抑制时间在6 h。和厚朴酚呈时间依赖性下调HepG2细胞中细胞周期蛋白cyclin D1和抗凋亡蛋白Bcl-2、Bcl-xL、survivin、Mcl-1和VEGF的表达, 最大抑制效果在24 h左右[53]。
5 总结与展望肿瘤细胞STAT3异常活化会打乱正常的细胞生长、增殖、血管生成和免疫功能, 相反, 阻断了STAT3的活化则会导致细胞凋亡、抑制细胞增殖、抑制血管生成和刺激免疫反应。由于STAT3二聚化和结合到DNA上才能发挥作用, 所以针对能消除蛋白相互作用或者减弱DNA结合能力的STAT3抑制剂可能会更有前景。STAT3抑制剂的临床前研究已经有10多年, 但是进入到临床阶段的却很少, 所以设计和发现真正有针对性的STAT3抑制剂依然是一个很有挑战的过程。很多对STAT3有抑制活性的天然产物可以用作先导化合物, 以此为基础合成更有效的小分子化合物。进一步筛选、综合、评价和选择最优的阻断抑制剂, 将中西药物治疗与传统的放疗、化疗结合进一步研发低毒高效的治疗药物和方法, 可能是今后的研究方向之一, 这将为人类治疗肿瘤揭开新的篇章。
| [1] | Aggarwal BB, Sethi G, Ahn KS, et al. Targeting signal transducer and activator of transcription 3 for prevention and therapy of cancer:modern target but ancient solution[J]. Ann N Y Acad Sci, 2006, 1091: 151–169. DOI:10.1196/annals.1378.063 |
| [2] | Yu H, Jove R. The STATs of cancer-new molecular targets come of age[J]. Nat Rev Cancer, 2004, 4: 97–105. DOI:10.1038/nrc1275 |
| [3] | Turkson J, Jove R. STAT proteins:novel molecular targets for cancer drug discovery[J]. Oncogene, 2000, 19: 6613–6626. DOI:10.1038/sj.onc.1204086 |
| [4] | Yi Z, James T, Christin C, et al. Activation of STAT3 in v-Src transformed fibroblasts requires cooperation of Jak 1 kinase activity[J]. Biol Chem, 2000, 275: 24–35. |
| [5] | Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer:role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1854: 136–154. |
| [6] | Jarnicki Al, Putoczki T, Ernst M. STAT3:linking inflammation to epithelial cancer-more than a "gut" feeling?[J]. Cell Div, 2010, 17: 14. |
| [7] | Heinrich PC, Behrmann I, Müller-Newen G, et al. Interleukin-6-type cytokine signaling through the gp130/Jak/STAT pathway[J]. Biochem, 1998, 334: 297–314. DOI:10.1042/bj3340297 |
| [8] | Debnath B, Xu S, Neamati N. Small molecule inhibitors of signal transducer and activator of transcription 3(STAT3) protein[J]. Med Chem, 2012, 55: 6645–6668. DOI:10.1021/jm300207s |
| [9] | Johnston PA, Grandis JR. STAT3 signaling:anticancer strategies and challenges[J]. Mol Interv, 2011, 11: 18–26. DOI:10.1124/mi.11.1.4 |
| [10] | Silva CM. Role of STATs as downstream signal transducers in Src family kinase-mediated tumorigenesis[J]. Oncogene, 2004, 23: 8017–8023. DOI:10.1038/sj.onc.1208159 |
| [11] | Ma J, Cao X. Regulation of STAT3 nuclear import by importin α5 and importin α7 via two different functional sequence elements[J]. Cell Signal, 2006, 18: 1117–1126. DOI:10.1016/j.cellsig.2005.06.016 |
| [12] | Subramaniam A, Shanmugam MK, Perumal E, et al. Potential role of signal transducer and activator of transcription (STAT) 3 signaling pathway in inflammation, survival, proliferation and invasion of hepatocellular carcinoma[J]. Biochim Biophys Acta, 2013, 1835: 46–60. |
| [13] | Masciocchi D, Gelain A, Villa S, et al. Signal transducer and activator of transcription 3(STAT3):a promising target for anticancer therapy[J]. Future Med Chem, 2011, 3: 567–597. DOI:10.4155/fmc.11.22 |
| [14] | Ivanov VN, Krasilnikov M, Ronai ZE. Regulation of Fas expression by STAT3 and c-Jun is mediated by phosphatidylinositol 3-kinase-AKT signaling[J]. Biol Chem, 2002, 277: 4932–4944. DOI:10.1074/jbc.M108233200 |
| [15] | Chai SK, Nichols GL, Rothman P. Constitutive activation of JAKs and STATs in BCR-Abl-expressing cell lines and peripheral blood cells derived from leukemia patients[J]. Immunol, 1997, 159: 4720–4728. |
| [16] | Abdulghani J, Gu L, Dagvadorj A, et al. STAT3 promotes metastatic progression of prostate cancer[J]. Pathol, 2008, 172: 1717–1728. |
| [17] | Bollrath J, Phesse TJ, Burstin VA, et al. gp130-mediated STAT3 activation in enterocytes regulates cell survival and cell-cycle progression during colitis-associated tumorigenesis[J]. Cancer Cell, 2009, 15: 91–102. DOI:10.1016/j.ccr.2009.01.002 |
| [18] | Chen CL, Cen L, Kohout J, et al. Signal transducer and activator of transcription 3 activation is associated with bladder cancer cell growth and survival[J]. Mol Cancer, 2008, 7: 78. DOI:10.1186/1476-4598-7-78 |
| [19] | Masuda M, Suzui M, Yasumatu R, et al. Constitutive activation of signal transducers and activators of transcription 3 correlates with cyclin D1 overexpression and may provide a novel prognostic marker in head and neck squamous cell carcinoma[J]. Cancer Res, 2002, 62: 3351–3355. |
| [20] | Jinsu K, Seungho C, Nishant S, et al. Regulation of STAT3 and NF-κB activations by S-nitrosylation in multiple myeloma[J]. Free Radic Biol Med, 2017, 106: 245–253. DOI:10.1016/j.freeradbiomed.2017.02.039 |
| [21] | Fukada T, Ohtani T, Yoshida Y, et al. STAT3 orchestrates contradictory signals in cytokine-induced G1 to S cell-cycle transition[J]. EMBO J, 1998, 17: 6670–6677. DOI:10.1093/emboj/17.22.6670 |
| [22] | Zhao SH, Zhao F, Zheng JY, et al. Knockdown of STAT3 expression by RNAi inhibits in vitro growth of human ovarian cancer[J]. Radiol Oncol, 2011, 45: 196–203. |
| [23] | Xiong H, Zhang ZG, Tian XQ, et al. Inhibition of JAK1, 2/STAT3 signaling induces apoptosis, cell cycle arrest, and reduces tumor cell invasion in colorectal cancer cells[J]. Neoplasia, 2008, 10: 287–297. DOI:10.1593/neo.07971 |
| [24] | Kanda N, Seno H, Konda Y, et al. STAT3 is constitutively activated and supports cell survival in association with survivin expression in gastric cancer cells[J]. Oncogene, 2004, 23: 4921–4929. DOI:10.1038/sj.onc.1207606 |
| [25] | Zorzi E, Bonvini P. Inducible Hsp70 in the regulation of cancer cell survival:analysis of chaperone induction, expression and activity[J]. Cancer, 2011, 3: 3921–3956. DOI:10.3390/cancers3043921 |
| [26] | Nicholas D, Felicia M, Ilsa C, et al. Expression of STAT3 in prostate cancer metastases[J]. Eur Urol, 2017, 71: 313–316. DOI:10.1016/j.eururo.2016.06.018 |
| [27] | Lee H, Deng J, Kujawski M, et al. STAT3-induced S1PR1 expression is crucial for persistent STAT3 activation in tumors[J]. Nat Med, 2010, 16: 1421–1428. DOI:10.1038/nm.2250 |
| [28] | Li Y, Du H, Qin Y, et al. Activation of the signal transducers and activators of the transcription 3 pathway in alveolar epithelial cells induces inflammation and adenocarcinomas in mouse lung[J]. Cancer Res, 2007, 67: 8494–8503. DOI:10.1158/0008-5472.CAN-07-0647 |
| [29] | Emily J, Huiyuan Z, Haiyan S, et al. STAT3 signaling in immunity[J]. Cytokine Growth Factor Rev, 2016, 31: 1–15. DOI:10.1016/j.cytogfr.2016.05.001 |
| [30] | Dauer DJ, Ferraro B, Song L, et al. STAT3 regulates genes common to both wound healing and cancer[J]. Oncogene, 2005, 24: 3397–3408. DOI:10.1038/sj.onc.1208469 |
| [31] | Wu HX, Yan SX, Chen JY, et al. JAK1-STAT3 blockade by JAK inhibitor SHR0302 attenuates inflammatory responses of adjuvant-induced arthritis rats and decreases Th17 and total B cells[J]. Joint Bone Spine, 2016, 83: 525–532. DOI:10.1016/j.jbspin.2015.09.002 |
| [32] | Kesanakurti D, Chetty C, Maddirela DR, et al. Essential role of cooperative NF-κB and STAT3 recruitment to ICAM-1 intronic consensus elements in the regulation of radiationinduced invasion and migration in glioma[J]. Oncogene, 2012, 32: 5144–5155. |
| [33] | Song Y, Qian L, Song S, et al. Fra-1 and STAT3 synergistically regulate activation of human MMP-9 gene[J]. Mol Immunol, 2008, 45: 137–143. DOI:10.1016/j.molimm.2007.04.031 |
| [34] | Daniel J, Garama, Christine L, et al. Mitochondrial STAT3:powering up a potent factor[J]. Cytokine, 2016, 87: 20–25. DOI:10.1016/j.cyto.2016.05.019 |
| [35] | Xie TX, Wei D, Liu M, et al. STAT3 activation regulates the expression of matrix metalloproteinase-2 and tumor invasion and metastasis[J]. Oncogene, 2004, 23: 3550–3560. DOI:10.1038/sj.onc.1207383 |
| [36] | Valdembri D, Serini G, Vacca A, et al. In vivo activation of JAK2/STAT-3 pathway during angiogenesis induced by GMCSF[J]. FASEB J, 2002, 16: 225–227. |
| [37] | Edna Z, Muthu K, Frank A, et al. Targeting transcription factor STAT3 for cancer prevention and therapy[J]. Pharmacol Ther, 2016, 162: 86–97. DOI:10.1016/j.pharmthera.2015.10.004 |
| [38] | Niu G, Wright KL, Ma Y, et al. Role of STAT3 in regulating p53 expression and function[J]. Mol Cell Biol, 2005, 25: 7432–7440. DOI:10.1128/MCB.25.17.7432-7440.2005 |
| [39] | Bauer K, Binder S, Klein C, et al. Inhibition of dendritic cell maturation and activation is mediated by STAT3[J]. Cell Commun Signal, 2009, 7: 68. DOI:10.1186/1478-811X-7-S1-A68 |
| [40] | Sansone P, Bromberg J. Environment, inflammation and cancer[J]. Curr Opin Genet Dev, 2012, 21: 80–85. |
| [41] | Marcin K, Hong X, Maciej K, et al. Regulation of the IL-23 and IL-12 balance by STAT3 signaling in the tumor microenvironment[J]. Cancer Cell, 2009, 15: 81–83. DOI:10.1016/j.ccr.2009.01.008 |
| [42] | Thomas C, Dmity I. Gabrilovich molecular mechanisms regulating myeloid-derived suppressor cell differentiation and function[J]. Trends in Immunol, 2011, 32: 19–25. DOI:10.1016/j.it.2010.10.002 |
| [43] | Schust J, Sperl B, Hollis A, et al. Stattic:a small-molecule inhibitor of STAT3 activation and dimerization[J]. Chem Biol, 2006, 13: 1235–1242. DOI:10.1016/j.chembiol.2006.09.018 |
| [44] | Hong D, Kurzrock R, Kim Y, et al. AZD9150, a nextgeneration antisense oligonucleotide inhibitor of STAT3 with early evidence of clinical activity in lymphoma and lung cancer[J]. Clin Transl Med, 2015, 11: 314–318. |
| [45] | Song H, Wang R, Wang S, et al. A low-molecular-weight compound discovered through virtual database screening inhibits STAT3 function in breast cancer cells[J]. Proc Natl Acad Sci U S A, 2005, 102: 4700–4705. DOI:10.1073/pnas.0409894102 |
| [46] | Li Y, Roqoff HA, Keates S, et al. Suppression of cancer relapse and metastasis by inhibiting cancer stemness[J]. Proc Natl Acad Sci U S A, 2005, 2: 1839–1844. |
| [47] | Pandey MK, Sung B, Aggarwal BB. Betulinic acid suppresses STAT3 activation pathway through induction of protein tyrosine phosphatase SHP-1 in human multiple myeloma cells[J]. Int J Cancer, 2010, 127: 282–292. |
| [48] | Wang Y, Chan FL, Chen S, et al. The plant polyphenol butein inhibits testosterone-induced proliferation in breast cancer cells expressing aromatase[J]. Life Sci, 2005, 77: 39–51. DOI:10.1016/j.lfs.2004.12.014 |
| [49] | Jung JE, Kim HS, Lee CS, et al. Caffeic acid and its synthetic derivative CADPE suppress tumor angiogenesis by blocking STAT3-mediated VEGF expression in human renal carcinoma cells[J]. Carcinogenesis, 2007, 28: 1780–1787. DOI:10.1093/carcin/bgm130 |
| [50] | Bhutani M, Pathak AK, Nair AS, et al. Capsaicin is a novel blocker of constitutive and interleukin-6-inducible STAT3 activation[J]. Clin Cancer Res, 2007, 13: 3024–3032. DOI:10.1158/1078-0432.CCR-06-2575 |
| [51] | Moran DM, Mattocks MA, Cahill PA, et al. Interleukin-6 mediates G0/G1 growth arrest in hepatocellular carcinoma through a STAT3-dependent pathway[J]. Surg Res, 2008, 147: 23–33. DOI:10.1016/j.jss.2007.04.022 |
| [52] | Liu T, Zhang M, Zhang H, et al. Inhibitory effects of cucurbitacin B on laryngeal squamous cell carcinoma[J]. Eur Arch Otorhinolaryngol, 2008, 265: 1225–1232. DOI:10.1007/s00405-008-0625-9 |
| [53] | Bharti AC, Donato N, Aggarwal BB. Curcumin (diferuloylmethane) inhibits constitutive and IL-6-inducible STAT3 phosphorylation in human multiple myeloma cells[J]. Immunol, 2003, 171: 3863–3871. DOI:10.4049/jimmunol.171.7.3863 |
 2017, Vol. 52
2017, Vol. 52


