干旱、盐渍、极端温度等环境胁迫, 制约植物的生长发育[1]。在长期的进化过程中, 植物为了抵抗和适应各种环境胁迫, 在形态、细胞、生理生化等方面形成了一系列独特的防御机制[2-4]。受到逆境胁迫时, 植物通过诱导表达胁迫响应蛋白等降低环境胁迫引起的损害[3, 5]。晚期胚胎发育富集蛋白(late embryogenesis abundant protein, LEA)是一种防御蛋白, 多参与植物抗逆境响应过程[6, 7]。
LEA基因首次发现是在胚胎发育后期的陆地棉(Gossypium hirsutum)子叶中, 经研究发现种子、幼苗及其他组织均存在, 受环境胁迫后表达量可达到较高水平, 广泛分布于高等植物、藻类、真菌、细菌及动物[8-11]。LEA蛋白一般为小分子量的蛋白多肽(10~30 kDa), 具有良好的亲水性、热稳定性[7]。根据氨基酸序列, Pfam数据库将LEA蛋白家族分为LEA_1、LEA_2、LEA_3、LEA_4、LEA_5、Dehydrin和SMP (seed maturation protein) 7个亚家族[12]。LEA_2家族对应以往分类法中的LEA14、D95蛋白等[12]。研究发现, LEA2蛋白在盐、干旱、脱落酸等逆境胁迫时可大量表达, 具有耐冻、耐高温、耐盐等抑制渗透性损伤的功能, 能够提高植物对逆境胁迫的抵御和适应[13-16]。虽然, 部分植物中LEA2蛋白的研究已有报道, 但兰科植物中还未见相关报道。
铁皮石斛(Dendrobium officinale), 为兰科石斛属多年生附生草本植物, 为我国传统中药材中最珍稀名贵的品种之一, 具有一定的观赏及经济价值, 其多生长于海拔500~1 600 m的山地半阴湿的岩石或原始森林的树干上, 野生环境下, 繁殖率极低, 生长缓慢, 易受逆境胁迫影响[17-19]。因此, 清楚了解其胁迫响应机制、提高其抗逆性尤为重要。前期, 作者通过铁皮石斛全基因组和转录组数据综合分析, 对克隆得到的铁皮石斛LEA基因进行分类研究[20]。鉴于LEA2蛋白在植物抗逆境胁迫中的重要作用, 本研究利用RACE技术首次从铁皮石斛中分离得到一个LEA2基因cDNA全长DoLEA2, 并进行生物信息学和表达模式分析, 同时, 在重组型DoLEA2大肠杆菌体内进行耐盐胁迫实验, 为进一步揭示其抗逆胁迫分子机制奠定基础。
材料与方法材料 铁皮石斛组培苗及种子均购自江苏常州, 经郭顺星研究员鉴定为铁皮石斛(Dendrobium officinale)。铁皮石斛苗盐胁迫实验处理方法:两组铁皮石斛组培苗分别用10 mol·L-1 NaCl溶液、水处理两天, 取样。
pTOPO vector购自北京艾德莱生物技术有限公司; pET-28a vector购自北京华越洋生物有限公司; E. coli trans H5α、BL21(DE3) 感受态细胞均购自北京全式金生物有限公司; RNeasy Plant Mini Kit购自德国QIAGEN公司; DL2000 DNA Marker、限制性内切酶EcoRI和NdeI、T4 DNA连接酶、PrimeScriptTM RT reagent Kit、SYBR® Premix Ex TaqTM (TliRNaseH Plus)购自大连宝生物公司; SMARTerTM RACE 5'/3' Kit购自日本Clontech公司; Phanta® Max Super-Fidelity DNA聚合酶购自南京诺唯赞生物技术有限公司。
仪器 NanoDropTM 2000分光光度计(美国Thermo Fisher公司); LightCycler® 480Ⅱ实时荧光定量PCR仪(瑞士Roche公司); T100TM thermal cycler PCR仪、Powerpac Universal电泳仪、SmartSpecTM Plus分光光度计(美国Bio-Rad公司); MB100-2A微孔板恒温振荡器(杭州奥盛仪器公司); SorvallST8R高速冷冻离心机(美国Thermo scientific公司)。
总RNA提取和cDNA合成 按照RNeasy Plant Mini Kit操作说明提取各样品总RNA, 采用分光光度计法测定RNA质量和纯度, 1%琼脂糖凝胶电泳鉴定RNA完整性。反转录合成cDNA第一链, -20 ℃保存备用。
3'RACE与RT-PCR验证 经NCBI Blastx和ORF finder分析, 发现一条1 241 bp的CL6357.contig2序列被注释为LEA2, 其具有完整的开放阅读框(open reading frame, ORF)和完整的5'UTR。根据此序列设计特异性引物(表 1), 进行3'-RACE PCR反应。以铁皮石斛种子3'-RACE ready cDNA为模板, 反应体系: 2.0 μL 10×Advantage 2 PCR buffer、0.4 μL 10 mmol·L-1 dNTPs、0.4 μL DoLEA2-3’-GPS-F (10 mmol·L-1)、2.0 μL 10×UPM、1.5 μL 3'-RACE ready cDNA、0.4 μL 50×Advatange 2 Polymerase Mix (5 U·μL-1), 补充ddH2O至20 μL。PCR产物经电泳分析, 回收目的条带、克隆并测序, 与原序列拼接分析后, 设计ORF、5'UTR引物(表 1), 克隆、测序及验证基因cDNA全长的可靠性。
| Table 1 Primers used to clone full-length gene and expressionin the D. officinale |
序列分析 通过NCBI Blastx和ORF Finder分析cDNA序列; Protparam各种氨基酸含量、相对分子质量和等电点等理化性质; Protscale分析蛋白的亲、疏水性; SOPMA分析二级结构; ExPASyProteomics Server的InterProScan分析蛋白质保守结构域; SWISS-MODEL进行蛋白质三维结构预测; SignalP 4.0和TMHMM预测信号肽和跨膜区域; WoLF PSORT进行亚细胞定位分析。通过DNASTAR 7.0进行氨基酸序列比对分析; 利用MEGA 7.0的UPGMA法构建系统进化树(Boot strap = 1 000)[20]。
DoLEA2表达载体构建 根据载体序列选择两个酶切位点EcoRI和NdeI, 在DoLEA2的ORF两端设计含有酶切位点的特异性引物(表 1), 进行PCR扩增, 经纯化后克隆于pTOPO载体并进行筛选, 挑取白色单菌落提取质粒, 经双酶切验证获得阳性克隆, 送至北京金唯智生物技术公司测序, 验证基因序列。测序后无突变、无移码的pT-DoLEA2-ORF重组质粒, 与pET-28a表达载体, 分别进行双酶切实验, 经琼脂糖凝胶回收载体片段和目的基因片段, 16 ℃过夜连接, 转化E. coli trans H5α细胞中, 经PCR检测, 挑取单克隆提取质粒经特异性引物鉴定后送公司测序。
DoLEA2诱导表达及条件优化 将测序无突变、无移码pET28a-DoLEA2重组质粒和pET28a空载体质粒同时转化到E. coli BL21(DE3) 感受态细胞中, 获得表达型重组大肠杆菌BL21(DE3)/pET28a-DoLEA2。挑取阳性单克隆菌落, 37 ℃、180 r·min-1条件下培养过夜, 按照1:100比例扩大培养至OD600 = 0.6~0.8。分别对诱导时间(1、2、3、4 h)、异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside, IPTG)浓度(0、0.1、0.5、1 mmol·L-1)、诱导温度(16、25、37 ℃)进行优化。获取菌液在4 ℃条件下12 000 r·min-1离心2 min, 收集菌体, 重悬于pH 6.8的PBS缓冲液中, 一部分直接加入5×loading buffer混匀, 煮沸5 min, 4 ℃条件下12 000 r·min-1离心5 min, 取上清; 另一部分经超声破碎2 min (200 W, 5 s/5 s), 4 ℃ 12 000 r·min-1离心5 min, 取上清、沉淀混合loading buffer处理后, 分别进行12% SDS-PAGE电泳检测。
荧光定量PCR 分别用正常及经盐胁条件下的铁皮石斛根、茎、叶、种子总RNA反转录合成cDNA, 18S rRNA基因作为内参, Real-time PCR分析基因表达模式。引物为qPCR-F和qPCR-R (表 1)扩增产物长208 bp, 进行扩增, 反应体系: 7.5 μL 2×SYBR® Premix Ex TaqTMMaster Mix、0.3 μL正/反向引物(10 mmol·L-1)、1 μL cDNA, 补充ddH2O到15 μL, 生物学重复与技术重复均3次。PCR程序为95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 20 s, 40个循环, 反应结束绘制融解曲线。根据LightCycler®480 Ⅱ HTC1软件生成的循环阈值(cycle threshold, CT), 运用2-ΔΔCt法计算基因相对表达量。
盐胁迫下生长曲线测定 重组菌株BL21(DE3)/ pET28a-DoLEA2和对照菌株BL21(DE3)/pET28a经37 ℃过夜培养的单克隆菌液(OD600 = 0.8), 按1:100比例分别接种于LB+ (Kan)液体培养基, 37 ℃、200 r·min-1振荡培养2 h, 添加终浓度为0.5 mmol·L-1的IPTG, 同时分别添加终浓度为0.5、0.8 mol·L-1 NaCl, 37 ℃孵育, 每隔2 h测定其OD600值, 技术重复3次, 绘制生长曲线。
结果 1 DoLEA2基因克隆及全长验证经过3'-RACE反应, 克隆、测序获得435 bp的序列, 经RT-PCR扩增克隆、测序获得包含完整ORF、5'UTR的序列(图 1), 与原序列拼接分析获得了一条1 224 bp的cDNA。该基因ORF长942 bp, 5'-UTR长99 bp, 3'-UTR长183 bp, Blastx分析表明其与多种植物LEA2基因有较高的相似性(73%~88%), 命名为DoLEA2 (GenBank登录号: KY626329)。
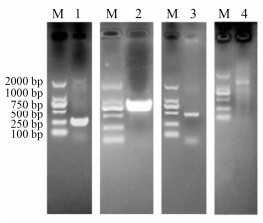
|
Figure 1 Clone the full length cDNA of DoLEA2 gene from Dendrobium officinale. M: Maker; 1: 5'-UTR product; 2: ORF; 3: 3'-Race product; 4: Full cDNA product |
Protparam预测DoLEA2基因编码蛋白313个氨基酸, 分子式为C1573H2504N402O481S5, 等电点pI为4.98、相对分子质量34 903.89; DoLEA2蛋白带正电残基(Arg+Lys)为42, 负电残基(Asp+Glu)为58, 该蛋白的不稳定系数为24.11, 属于稳定蛋白, 脂肪系数为95.56, 疏水性系数为-0.392, 后经Protscale验证为亲水性。经SOPMA分析, DoLEA2蛋白的二级结构主要由α螺旋(27.48%)、延伸链(23.64%)、β转角(9.58%)和随机卷曲(39.30%)组成。
3 DoLEA2蛋白结构域、定位、跨膜区分析和三维建模InterProScan分析显示, DoLEA2基因编码蛋白含有晚期胚胎富集蛋白(LEA_2) 结构域(78-173、203-297) 和水分胁迫高敏感响应结构域(57-174、183-299)。SignalP 4.1分析DoLEA2蛋白不含信号肽。利用TMHMM 2.0分析DoLEA2蛋白不含跨膜结构域, 由此推断该蛋白不经过跨膜转运, 与信号肽分析相吻合。PSORT预测DoLEA2蛋白定位于细胞质的可能性较高。
在蛋白质结构数据库(Protein Data Bank, PDB)中绝大多数LEA2蛋白的三维结构通过核磁共振波谱法获得, 以拟南芥LEA2 (SMTL id: 1xo8.1) 蛋白三维结构作为参考蛋白[21], 对DoLEA2蛋白进行三维结构建模(图 2), 结果显示, DoLEA2与该蛋白有34.72%的空间结构相似性。

|
Figure 2 Three-dimensional structure of DoLEA2 protein using SWISS-MODEL Model information: modeled residue range: 29 to 178; based on template: 1xo8.1.A (NMR); sequence identity [%]: 34.72; GMQE: 0.27; QMEAN: -7.14 |
氨基酸多序列比对结果(图 3)显示, DoLEA2与单子叶植物蝴蝶兰(XP_020587558.1)、油棕(XP_010927880.1)、小果野蕉(XP_009414646.1)、石刁柏(XP_020262013.1)、海枣(XP_008812863.1)、花烛(JAT64495.1)、凤梨(OAY76998.1) 和水稻(BAG87622.1) 的LEA2蛋白相似性分别为88%、88%、83%、80%、87%、87%、81%和73%。

|
Figure 3 Multiple sequence alignment of DoLEA2 and LEA2 protein in other species |
系统进化分析(图 4)表明, 系统树明显分为两大类群, 2条双子叶植物的LEA2蛋白序列聚为一支, 组成外类群; 10条单子叶植物的LEA2蛋白序列同源性较高, 聚为一支, 其中, DoLEA2与兰科植物蝴蝶兰LEA2亲缘关系最近, 处于同一分支中。
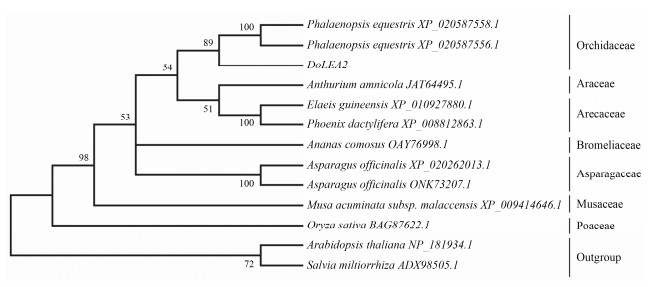
|
Figure 4 Phylogenetic tree of DoLEA2 and LEA2 from other species |
Real-time PCR结果(图 5)显示, DoLEA2在种子、根、茎、叶组织中均有表达, 相对表达量存在差异。以种子为参考样本, 显示铁皮石斛叶的表达量最高, 根和茎次之; 在1 mol·L-1盐胁迫处理中, 分别以未经盐胁迫处理组为参考样本, 显示经盐胁迫的根、茎、叶中LEA2的表达量均升高, 且叶升高最明显, 其次为茎、根。
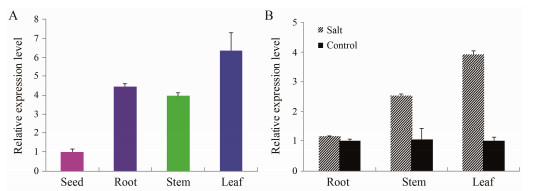
|
Figure 5 Expression patterns of DoLEA2gene using qPCR analysis. A: Expression patterns in different tissue; B: Expression pattern sunder 1 mol·L-1 salt |
SDS-PAGE电泳结果显示, 重组蛋白分子量约为35 kDa左右, 与理论值相符, 随着诱导温度、时间的增加, 表达量均增加(图 6A、C), IPTG浓度为0.1和0.5 mmol·L-1表达量较高, 但无明显差别(图 6B), 其中, 37 ℃、0.5 mmol·L-1 IPTG条件下, 可溶性重组蛋白的量约为总重组蛋白表达量的1/2 (图 6D)。
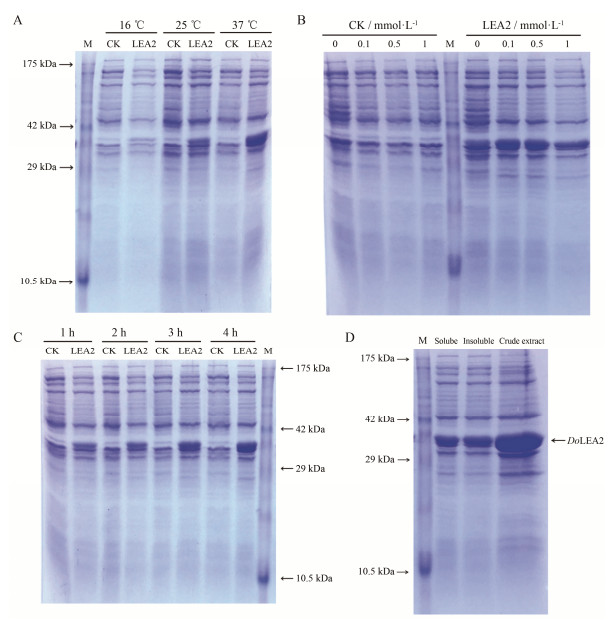
|
Figure 6 12% SDS-PAGE analysis of the expression of recombinant protein of DoLEA2 and empty vector protein. M: Protein maker; CK: pET-28a; LEA2: pET28a-DoLEA2. A: Induced by 0.5 mmol·L-1 IPTG with 4 h under different temperature; B: Induced by different IPTG concentration with 4 h at 37 ℃; C: Induced by 0.5 mmol·L-1 IPTG with different time at 37 ℃; D: The detection of soluble recombinant protein induced by 0.5 mmol·L-1 IPTG with 4 h at 37 ℃ |
重组型BL21(DE3)/pET28a-DoLEA2和对照菌株BL21(DE3)/pET28a盐胁迫下的生长曲线分析结果显示, 无盐胁迫条件下, 0.5 mmol·L-1 IPTG诱导表达的重组菌株和对照菌株的生长情况基本一致(图 7A)。0.5 mol·L-1 NaCl胁迫条件下(图 7B), 对照菌株的生长明显受到抑制, 4~24 h菌液OD600值均低于0.8, 重组菌株生长未受盐胁迫影响, 生长趋势较平稳, 4~24 h菌液OD600值均高于0.8。0.8 mol·L-1 NaCl胁迫条件下(图 7C), 重组菌株生长也未受盐胁迫影响, 但对照菌株生长活力明显降低, 甚至出现死亡现象。由此可见, DoLEA2蛋白可提高大肠杆菌的耐盐胁迫性。
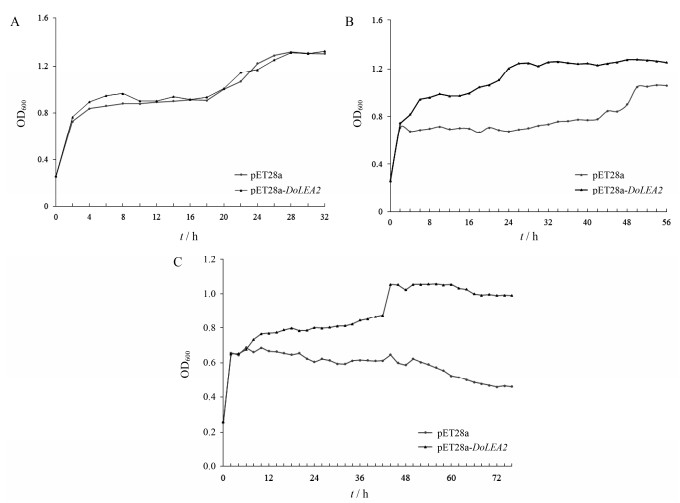
|
Figure 7 Growth curves of E. coli under salt stress. Control: pET28a; Experiment: pET28a-DoLEA2. A: Incubated without salt at 37 ℃; B: Incubated with 0.5 mol·L-1 NaCl at 37 ℃; C: Incubated with 0.8 mol·L-1 NaCl at 37 ℃ |
LEA蛋白为亲水、热稳定性的小分子蛋白多肽[7], 环境胁迫下诱导产生具有稳定细胞膜结构[22, 23]、抗氧化活性自由基[24, 25]、结合金属离子[26-28]等保护植物细胞、维持生理代谢过程的一类重要蛋白, 在干旱、高盐及极端温度等环境胁迫过程中发挥着重要作用, 但主要胁迫响应机制尚未清晰。本研究利用RACE技术首次从珍稀药用植物铁皮石斛中分离得DoLEA2全长cDNA序列, 编码313个氨基酸, 具有LEA_2和WHy保守结构域, 与多种植物LEA2蛋白序列具有较高的同源性, 经系统进化分析, 归入单子叶植物的LEA2蛋白分支, 且与蝴蝶兰亲缘关系最近。表明, DoLEA2是编码铁皮石斛晚期胚胎富集蛋白的基因。
LEA蛋白早期主要在种子中发现, 陆续在其他组织中发现, 无组织专一性, 经环境胁迫或外源物质可诱导产生并达到较高水平, LEA基因的分子特异表达差异与植物的生理代谢、所处环境影响关系紧密。高盐属于渗透性环境胁迫, 是限制植物正常生长发育的主要影响因子, 通过水势、离子分布等影响植物细胞乃至整个植物体内生理平衡, 引起细胞脱水, 破坏细胞膜系统、结构及功能, 导致植物生长抑制或死亡[29, 30]。已有报道[31], 海滨锦葵(Kosteletzkya virginica)中KvLEA基因在根、茎、叶、种子中均有表达, 其中, 根的表达量最高, 且高盐胁迫可诱导积累其表达, 随盐离子浓度的升高而升高, 受高盐胁迫2~24 h表达量均处于较高水平。本研究分析了DoLEA2基因在正常条件、盐胁迫条件下不同组织的表达模式, 正常条件下, DoLEA2在铁皮石斛根、茎、叶、种子中均有表达, 相对表达量存在差异, 叶中表达量最高, 符合LEA蛋白无组织专一性的特点; 盐胁迫条件下, 该基因在根、茎、叶中表达量均明显上调, 且叶 > 茎 > 根, 与小麦(Triticum aestivum) TaLEA2基因受盐胁迫时根中表达无变化、叶中表达上调的表达模式相似[32]。推测高盐胁迫可能对植物叶片组织影响较大, 以防细胞严重失水、萎蔫甚至死亡, 诱导DoLEA2蛋白表达积累, 通过缓解细胞内Na+、调节细胞渗透压和稳定内膜系统等方式, 将足够的水分运输到细胞内部, 以免细胞失水破裂, 导致植物缺水干枯而死[33]。表明DoLEA2基因参与了铁皮石斛的相关环境胁迫响应过程。
同时, 本研究成功构建pET28a-DoLEA2原核表达系统, 并进行耐盐实验, 受高盐胁迫时, 重组型菌株生长较为正常, 未明显受到高盐胁迫影响, 而对照菌株生长抑制甚至出现死亡现象, 但相关研究仅发现对照菌株达到生长对数期的时间晚于重组菌株, 生长受到抑制, 但未发现其出现死亡现象[16, 33]。表明DoLEA2蛋白的积累可提高大肠杆菌对高盐浓度的耐受性。
综上所述, DoLEA2蛋白无组织专一性, 参与了铁皮石斛正常条件下的生长发育, 且在高盐胁迫条件下表达积累以响应环境胁迫, 降低环境胁迫引起的损害, 在环境胁迫过程中发挥重要作用, 但其胁迫响应分子机制尚不清楚。本研究后续将通过转基因技术深入研究具体功能, 为揭示LEA蛋白与铁皮石斛生长发育及抗环境胁迫响应分子机制奠定理论基础。
| [1] | Sengupta S, Majumder AL. Insight into the salt tolerance factors of a wild halophytic rice, Porteresia coarctata:a physiological and proteomic approach[J]. Planta, 2009, 229: 911–929. DOI:10.1007/s00425-008-0878-y |
| [2] | Parida AK, Das AB. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicol Environ Safety, 2005, 60: 324–349. DOI:10.1016/j.ecoenv.2004.06.010 |
| [3] | Umezawa T, Fujita M, Fujita Y, et al. Engineering drought tolerance in plants:discovering and tailoring genes to unlock the future[J]. Curr Opin Biotechnol, 2006, 17: 113–122. DOI:10.1016/j.copbio.2006.02.002 |
| [4] | Krasensky J, Jonak C. Drought, salt, and temperature stressinduced metabolic rearrangements and regulatory networks[J]. J Exp Bot, 2012, 63: 1593–1608. DOI:10.1093/jxb/err460 |
| [5] | Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annu Rev Plant Biol, 2008, 59: 651–681. DOI:10.1146/annurev.arplant.59.032607.092911 |
| [6] | Hand SC, Menze MA, Toner M, et al. LEA proteins during water stress:not just for plants anymore[J]. Annu Rev Physiol, 2011, 73: 115–134. DOI:10.1146/annurev-physiol-012110-142203 |
| [7] | Tunnacliffe A, Wise MJ. The continuing conundrum of the LEA proteins[J]. Naturwissenschaften, 2007, 94: 791–812. DOI:10.1007/s00114-007-0254-y |
| [8] | Dure L, Chlan C. Developmental biochemistry of cottonseed embryogenesis and germination:XⅡ. Purification and properties of principal storage proteins[J]. Plant Physiol, 1981, 68: 180–186. DOI:10.1104/pp.68.1.180 |
| [9] | Battaglia M, Olvera-Carrillo Y, Garciarrubio A, et al. The enigmatic LEA proteins and other hydrophilins[J]. Plant Physiol, 2008, 148: 6–24. DOI:10.1104/pp.108.120725 |
| [10] | SilveiraV, Santa-Catarina C, Balbuena TS, et al. Endogenous abscisic acid and protein contents during seed development of Araucaria angustifolia[J]. Biol Plant, 2008, 52: 101–104. DOI:10.1007/s10535-008-0018-3 |
| [11] | Wise MJ, Tunnacliffe A. POPP the question:what do LEA proteins do?[J]. Trends Plant Sci, 2004, 9: 13–17. DOI:10.1016/j.tplants.2003.10.012 |
| [12] | Hundertmark M, Hincha DK. LEA (late embryogenesis abundant) proteins and their encoding genes in Arabidopsis thaliana[J]. BMC Genomics, 2008, 9: 118. DOI:10.1186/1471-2164-9-118 |
| [13] | Jayaprakash TL, Ramamohan G, Krishnaprasad BT, et al. Genotypic variability in differential expression of lea2 and lea3 genes and proteins in response to salinity stress in Fingermillet (Eleusine coracana Gaertn) and Rice (Oryza sativa L.) seedlings[J]. Ann Bot, 1998, 82: 513–522. DOI:10.1006/anbo.1998.0712 |
| [14] | Soulages JL, Kim K, Arrese EL, et al. Conformation of a group 2 late embryogenesis abundant protein from soybean. Evidence of poly (L-proline)-type Ⅱ structure[J]. Plant Physiol, 2003, 131: 963–975. DOI:10.1104/pp.015891 |
| [15] | Kasuga M, Miura S, Shinozaki K, et al. A combination of the Arabidopsis DREB1A gene and stress-inducible rd29A promoter improved drought-and low-temperature stress tolerance in tobacco by gene transfer[J]. Plant Cell Physiol, 2004, 45: 346–350. DOI:10.1093/pcp/pch037 |
| [16] | Wang HQ, Wu YC, Yang XB, et al. SmLEA2, a gene for late embryogenesis abundant protein isolated from Salvia miltiorrhiza, confers tolerance to drought and salt stress in Escherichia coli and S. miltiorrhiza[J]. Protoplasma, 2017, 254: 685–696. DOI:10.1007/s00709-016-0981-z |
| [17] | Zhao MM, Zhang G, Zhang DW, et al. ESTs analysis reveals putative genes involved in symbiotic seed germination in Dendrobium officinale[J]. PLoS One, 2013, 8: e72705. DOI:10.1371/journal.pone.0072705 |
| [18] | Huang C, Wang D, Sun L, et al. Effects of exogenous salicylic acid on the physiological characteristics of Dendrobium officinale under chilling stress[J]. Plant Growth Regul, 2016, 79: 199–208. DOI:10.1007/s10725-015-0125-z |
| [19] | Zhang G, Liu SS, Yang XJ, et al. Molecular cloning and characterization of a novel DoSWEET1 gene from Dendrobium officinale[J]. Acta Pharm Sin (药学学报), 2016, 51: 991–997. |
| [20] | Ling H, Zeng X, Guo S. Functional insights into the late embryogenesis abundant (LEA) protein family from Dendrobium officinale(Orchidaceae) using an Escherichia coli system[J]. Sci Reports, 2016, 6: 39693. DOI:10.1038/srep39693 |
| [21] | Singh S, Cornilescu CC, Tyler RC, et al. Solution structure of a late embryogenesis abundant protein (LEA14) from Arabidopsis thaliana, a cellular stress-related protein[J]. Protein Sci, 2005, 14: 2601–2609. DOI:10.1110/(ISSN)1469-896X |
| [22] | Gao J, Lan T. Functional characterization of the late embryogenesis abundant (LEA) protein gene family from Pinus tabuliformis (Pinaceae) in Escherichia coli[J]. Sci Reports, 2016, 6: 19467. DOI:10.1038/srep19467 |
| [23] | Koag MC, Wilkens S, Fenton RD, et al. The K-segment of maize DHN1 mediates binding to anionic phospholipid vesicles and concomitant structural changes[J]. Plant Physiol, 2009, 150: 1503–1514. DOI:10.1104/pp.109.136697 |
| [24] | Hara M, Fujinaga M, Kuboi T. Radical scavenging activity and oxidative modification of citrus dehydrin[J]. Plant Physiol Biochem, 2004, 42: 657–662. DOI:10.1016/j.plaphy.2004.06.004 |
| [25] | Shanlin FU, Stocker R, Davies MJ. Biochemistry and pathology of radical-mediated protein oxidation[J]. Biochem J, 1997, 324: 1–18. DOI:10.1042/bj3240001 |
| [26] | Zhao X, Zhan LP, Zou XZ. Improvement of cold tolerance of the half-high bush Northland blueberry by transformation with the LEA gene from Tamarix androssowii[J]. Plant Growth Regul, 2011, 63: 13–22. DOI:10.1007/s10725-010-9507-4 |
| [27] | Hughes S, Graether SP. Cryoprotective mechanism of a small intrinsically disordered dehydrin protein[J]. Protein Sci, 2011, 20: 42–50. DOI:10.1002/pro.534 |
| [28] | Hara M, Shinoda Y, Tanaka Y, et al. DNA binding of citrus dehydrin promoted by zinc ion[J]. Plant Cell Environ, 2009, 32: 532–541. DOI:10.1111/pce.2009.32.issue-5 |
| [29] | Serrano R, Rodriguez-Navarro A. Ion homeostasis during salt stress in plants[J]. Curr Opin Cell Biol, 2001, 13: 399–404. DOI:10.1016/S0955-0674(00)00227-1 |
| [30] | Zhu JK. Plant salt tolerance[J]. Trends Plant Sci, 2001, 6: 66–71. |
| [31] | Tang X, Wang H, Chu L, et al. KvLEA, a new isolated late embryogenesis abundant protein gene from Kosteletzkya virginica responding to multiabiotic stresses[J]. BioMed Res Int, 2016, 2016: 9823697. DOI:10.1155/2016/9823697 |
| [32] | Long X, Pu Z, Yang L, et al. Molecular cloning, expression and bioinformatic analysis of TaLEA2 gene from wheat[J]. J South China Agric Univ (华南农业大学学报), 2014, 35: 88–92. |
| [33] | Chen J, Jiang Y, Zhang Y, et al. Cloning and expression analyses of LEA2 gene from Ipomoea batatas[J]. Chin J Appl Environ Biol (应用与环境生物学报), 2014, 20: 204–210. |
 2017, Vol. 52
2017, Vol. 52


