2. 国家食品药品监督管理总局高级研修学院, 北京 100073;
3. 黑龙江中医药大学, 黑龙江 哈尔滨 150040;
4. 中国中医科学院医学实验中心, 北京 100700
2. China Food and Drug Administration Institute of Executive Development, Beijing 100073, China;
3. Heilongjiang University of Chinese Medicine, Harbin 150040, China;
4. The Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing 100700, China
溃疡性结肠炎(UC)是常见的炎症性肠病, 以腹痛腹泻、黏液脓血便持续或反复发作为主要症状[1]。该病被认为是结肠癌的癌前病变, 被世界卫生组织列为难治病之一, 因此受到国内外医学界的普遍重视。目前普遍认为UC是由多种因素, 包括遗传基因、胃肠道菌群失调及炎症过度反应共同作用的结果[2-4]。黄芩汤(HQT, 由黄芩、芍药、炙甘草和大枣组成)来源于汉代张仲景《伤寒论》, 为历代清热止痢、和中止痛的经典方剂, 本课题组对此复方长期研究, 发现其对UC大鼠模型肠黏膜炎症有较好的改善作用[5, 6]。
近年来, 代谢组学已广泛应用于中药成分及中药作用机制的研究, 以独特的视角解释生命现象, 为寻找疾病早期诊断的生物标志物提供了重要技术支持[7-9]。使用超高液相色谱质谱联用(UHPLC-MS)进行代谢组学分析, 生物样品不需要衍生化, 并且能够检测众多的化合物, 已成为非靶标代谢产物分析的有效方法。UHPLC-MS与UC结合的代谢组学研究相关报道较少, 因此本研究采用代谢组学UHPLC-MS技术, 寻找与UC相关的生物标志物, 并分析HQT对UC大鼠紊乱代谢物的影响, 揭示大鼠体内可能受影响的代谢途径, 以期进一步阐明HQT治疗UC的作用机制。
材料与方法药品与仪器 黄芩(Scutellaria baicalensis Georgi.)、芍药(Paeonia lactiflora Pall.)、炙甘草(Glycyrrhiza uralensis Fisch.)和大枣(Ziziphus jujuba Mill.)均购自北京仟草药业有限公司, 经中国中医科学院中药研究所李先端研究员鉴定为合格药材。HQT水提物按照文献[10]方法提取得到。经指纹图谱相似度和多成分含量分析, 提取率约为39.39%, 与对照图谱相似系数为0.998, 主要含黄酮和萜类化合物, 其中主要活性成分质量分数黄芩苷为10.41%、汉黄芩苷为2.42%、千层纸素A-苷为0.82%, 符合课题组确定的质量要求[10]。
2, 4, 6-三硝基苯磺酸(TNBS, 美国Sigma公司); DIONEX Ultimate 3000超高效液相色谱仪; 仪器名称: Thermo Q EXACTIVE; GL-20A全自动冷冻高速离心机(湖南仪器仪表总厂离心机厂); -80 ℃超低温冰箱(Thermo Fisher Scientific, USA)。
动物 6~8周龄、体重180~200 g的清洁级雄性Wistar大鼠, 北京军事医学科学院实验动物中心提供(生产许可证号: SCXK 2012-0004)。动物饲养室保持23±1.5 ℃, 相对湿度45%±15%。动物实验操作过程依照中国中医科学院动物实验伦理委员会的要求执行。
造模方法 采用Morris等[11]报道的方法制备大鼠UC模型, 大鼠禁食24 h后一次性将TNBS (100 mg·kg-1)和50%乙醇溶液0.25 mL用橡胶输液管缓慢注入距肛门约8 cm处的肠腔内, 捏紧肛门, 倒置几分钟。正常组注入相同体积的生理盐水, 术后常规饲养。
实验分组及样品采集 大鼠按体重随机分为正常组、模型组、HQT组, 每组10只。造模3天后开始给药, HQT按20 g·kg-1灌胃给药(生药量/大鼠体重, 按照临床每天人用剂量0.385 g·kg-1进行大鼠给药剂量换算), 正常组和模型组灌胃等剂量的生理盐水, 每日1次, 连续10天。
血清样品采集与处理 末次给药后所有大鼠禁食不禁水24 h, 第二天各组大鼠腹主动脉取血, 以3 500 r·min-1转速离心15 min, 分离血清, 置超低温冰箱冷冻保存。分析前将血清样品于室温下解冻, 取50 μL, 加入乙腈450 μL, 涡流30 s, 13 000 r·min-1离心10 min, 取上清液直接进样分析。
色谱条件 Dionex Ultimate 3000超高效液相色谱仪, 色谱柱: Thermo Syncronis C18 (2.1 mm × 100 mm, 1.7 µm); 液相条件: A:水(含0.1%甲酸及2 mmoL·L-1甲酸铵), B:乙腈; 梯度洗脱: 0~1 min, 95%~95% A; 1~15 min, 95%~5% A; 15~16 min, 5%~5% A, 16~17 min, 5%~95% A; 17~18 min, 95%~95% A。时间0~18 min, 进样量5 μL, 流速0.3 mL·min-1。
质谱条件 电喷雾离子源(ESI), 采用正负离子同时扫描模式, 电喷雾电压2.8 kV; 鞘气流速为35 arb; 辅助气流速为10 arb; 毛细管温度320 ℃; 一级全扫描(Full scan)分辨率: 70 000;扫描范围: m/z 50~750;二级数据依赖性扫描(Full MS/dd-MS2):分辨率: 17 500; Stepped NCE值: 20、40、60 V。
数据处理与分析 采用Trace Finder软件自建数据库, 包含对代谢组学技术方法、UC模型及其代谢标志物进行研究、总结归纳所得差异代谢物的录入。计算组内每个代谢物峰面积的RSD值, 剔除组内峰面积RSD值大于30%的数据。使用SIMCA-P (version 11.5, Umetrics AB, Sweden)软件对数据进行中心化和归一化处理, 采用主成分分析(principal component analysis, PCA)进行无监督的数据分析, 观察各组数据的聚类并剔除离群样本。然后选用偏最小二乘判别分析法(partial least squares-discriminant analysis, PLS-DA)进行有监督的数据分析。最后通过载荷图中变量重要性投影值(variable importance projection, VIP) ( > 1) 及P < 0.05, 筛选与UC相关的潜在生物标志物(此研究中视模型组与正常组比较得出P < 0.05的代谢物为候选差异代谢物)。所有数据采用SPSS 19.0软件中one-way ANOVA进行分析, 并用x±s表示。
结果 1 HQT对UC大鼠精神、活动状况及饮食量的影响经TNBS造模给药的大鼠3天内先后出现不同程度的精神萎靡, 双目暗淡、嗜卧扎堆、竖毛、毛泽无光、体重减轻、进食饮水减少、大便溏或软粒状伴黏冻、个别出现脓血, 提示造模成功。HQT给药10天后, 上述症状均得到不同程度的改善, 精神萎靡好转、体重增加、大便脓血消失。而模型组大鼠症状未出现显著改善。
2 大鼠血清指纹图谱的建立和多变量数据分析采用UHPLC-MS进行血清样品的分离和数据采集, 图 1为正常组大鼠血清样品中正、负离子模式下的总离子流色谱图(TIC)。
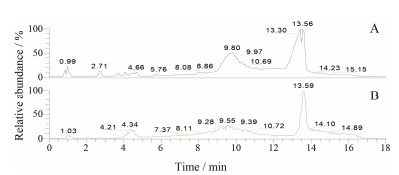
|
Figure 1 Representative total ion current chromatograms of serum sample of normal group in negative (A) and positive (B) modes |
利用无监督的PCA对正常组、模型组之间的差异进行分析, 发现各组数据的聚类情况较好, 无可剔除的样本。为了获取更加理想的组间分离及增强对分类贡献大的变量的识别, 进一步进行了有监督的PLS-DA分析。如图 2A所示, 模型组与正常组明显分开, 说明造模后大鼠血清内源性代谢物水平发生了变化。图 2B中, 正常组、模型组与HQT组三组之间没有重叠, HQT组较模型组渐渐接近于正常组, 表明给予HQT后UC大鼠血清部分内源性代谢模式发生改变, 从一定程度上说明HQT对调节UC大鼠的代谢异常有一定的作用; 在空白组VS模型组中, R2Y = 0.959, Q2 = 0.747, 可见该模型的稳定性、预测能力均较好。
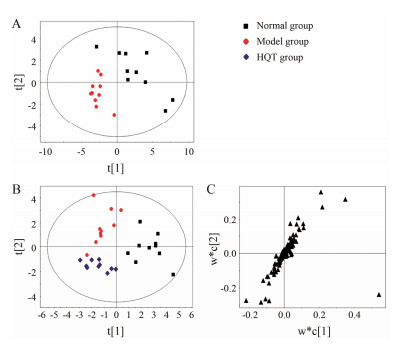
|
Figure 2 PCA score and loading plots. A and B: PLS-DA derived from spectra of serum from rats in normal group, model group and HQT group. The black point denotes normal group, the red point denotes model group, the blue point denotes HQT group. C: PCA loading plot on the serum metabolic profiling of control group and model group |
PLS-DA分析后, 通过PCA载荷图(图 2C)结合VIP > 1及P < 0.05的筛选条件筛选出潜在的生物标志物。潜在的生物标志物根据质荷比在Metlin、HMDB及KEGG数据库中进行检索和确认, 并与文献进行比较, 共鉴定出16个潜在的生物标志物, 其质谱数据信息见表 1。然后使用SPSS19.0软件将16种潜在生物标志物的相对峰面积归一化处理并进行单因素方差分析, 研究HQT的治疗作用。16种潜在分子标志物见表 1。
| Table 1 Potential biomarkers of ulcerative colitis (UC) rats. ↑ and ↓ represent higher and lower level in model rats in comparison with control group, separately |
与正常组相比, 缬氨酸、异亮氨酸、色氨酸、花生四烯酸、尿素、胞嘧啶在模型组中明显降低, γ-氨基丁酸、乳酸、肌酸、硬脂酸、棕榈酸、苯甲酸、胆碱在模型组明显升高。经HQT干预后, 上述13个差异代谢物都有向正常水平靠近的趋势, 说明HQT对上述代谢物具有调节作用, 见表 2。而β-羟基丁酸、乙酸、三甲胺在给予HQT干预后, 并无回调趋势。利用R语言制图, 本研究以热图的形式展现了与正常组相比, 模型组中潜在分子标志物变化趋势之间的相关性。相关性值越接近1表明两个分子物之间变化趋势越接近, 反之, 相关性小于零, 表明两个分子标志物之间变化趋势相反。图中氨基酸在模型组中整体表达降低, 两两之间变化趋势接近。脂肪酸中除花生四烯酸外在模型组中以升高的变化趋势呈簇状相关性接近, 见图 3。
| Table 2 Relative peak areas of potential biomarkers in UHPLC-MS spectra of serum. n = 10, x±s. *P < 0.05, **P < 0.01 vs normal group; #P < 0.05, ##P < 0.01 vs model group |
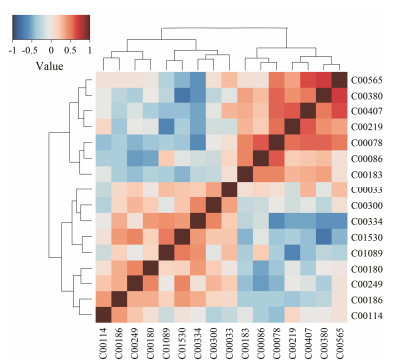
|
Figure 3 The correlation analysis of change trend of potential molecular markers in the model compared to normal group |
利用Metabo Analyst网站对16个代谢产物进行代谢通路的富集分析, 选择KEGG作为数据库, 代谢通路影响值的临界设置为0.10, 高于这个值, 认为是潜在的靶标路径, 共得到4条UC相关的潜在代谢靶标路径。它们分别为缬氨酸、亮氨酸、异亮氨酸的生物合成; 花生四烯酸代谢; 色氨酸代谢; 丙氨酸、天冬氨酸和谷氨酸代谢, 见图 4。表明在UC发病过程中, 上述4个靶标路径受到了较大干扰。
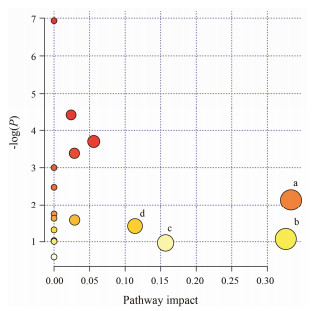
|
Figure 4 Summary of pathway analysis. a: Valine, leucine and isoleucine biosynthesis; b: Arachidonic acid metabolism; c: Tryptophan metabolism; d: Alanine, aspartate and glutamate metabolism |
利用Metabo Analyst的通路富集结果与KEGG数据库中相关信息的查阅, 对16种潜在生物标志物进行了归纳总结, 构建了UC大鼠差异代谢物的体内代谢通路网络图(图 5), 以便更加清晰直观地了解UC大鼠的体内代谢路径。图 5显示, UC模型大鼠主要与脂代谢、氨基酸代谢和能量代谢等相关通路有关, 将几条主要代谢发生紊乱的通路串联起来, 可见UC是一种涉及多个代谢紊乱的疾病。经HQT治疗后部分代谢物出现回调趋势, 代谢通路的紊乱相应得到有效调节。
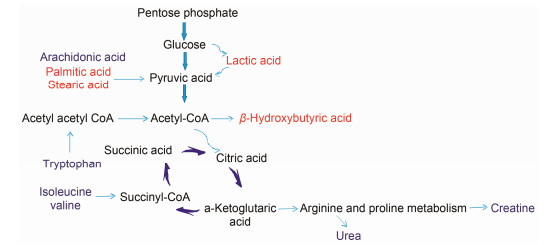
|
Figure 5 The metabolic network of serum endogenous metabolites. The red color represents up-regulated, and the blue color repre sents down-regulated in the normal group compared to the model group |
本研究借助UHPLC-MS高灵敏检测平台试图从代谢的角度阐明这一复杂的病理生理过程。对这些差异代谢物的监测有利于进一步理解HQT对UC的作用机制。以下围绕部分潜在分子标志物的生物学意义展开讨论。
氨基酸在肠道炎症性疾病中起着重要的生物学作用[12]。异亮氨酸、缬氨酸通过转化成为葡萄糖后氧化分解, 为机体提供必要能量, 参与修复组织、调节血糖、提升体能等。这些氨基酸的含量在模型组中降低, 提示UC存在能量代谢障碍。说明氨基酸在UC的发生发展中具有重要的作用。色氨酸为5-羟色胺(5-HT)的前体, 是一种在肠道中广泛表达的代谢物和递质[13]。5-HT信号系统异常可导致胃肠道动力及分泌功能异常, 与胃肠道功能性疾病密切相关[14]。模型组中低表达的差异性代谢物色氨酸及候选差异代谢物5-HT, 可能是导致UC大鼠腹泻及精神萎靡的相关因素。而HQT干预后的UC大鼠色氨酸、5-HT均有不同程度的回调。
γ-氨基丁酸(简称GABA)是胃肠神经系统中重要的抑制性神经递质[15]。GABA主要受中枢神经系统的控制, 它参与消化吸收、肠胃道运动等生理活动, 并调节中枢神经系统, 促进大脑皮质功能及自主神经功能的恢复, 增强胃肠蠕动[16]。模型组中GABA含量显著性升高, 说明胃肠神经系统存在异常, 这也可能是模型组UC大鼠出现胃肠功能紊乱的主要因素。HQT组GABA含量下降, 分析HQT可能通过对GABA的调节, 降低大鼠胃肠道敏感性, 从而改善腹泻状况。
在本研究中, 许多差异代谢物与能量代谢密切相关。乳酸、肌酸在模型组的水平显著升高。正常情况下, 肠屏障能阻止肠道内细菌及其分解产物经肠壁扩散至机体内[17], 当结肠黏膜受损致肠黏膜通透性增加时, 肠道中的大量乳酸通过受损的结肠黏膜进入血中, 使血中乳酸水平升高。因此血清中的乳酸浓度可反映肠黏膜通透性变化, 具体表现为肠黏膜受损。肌酸是体内能量储存、利用的重要化合物, 模型组大鼠血清中乳酸、肌酸含量的升高提示模型组大鼠体内能量代谢的紊乱。HQT干预后, 乳酸及肌酸含量显著下降, 暗示大鼠受损的UC黏膜出现修复迹象, 紊乱的能量代谢得到调节。
大量的脂类及其衍生代谢物在本次研究中被检测并鉴定, 包括硬脂酸、棕榈酸、花生四烯酸、β-羟基丁酸及胆碱。研究[18]发现, 脂肪酸与炎症发病密切相关。造模后, 观察到硬脂酸、棕榈酸大量堆积, 分析可能是细胞生物膜持续被破坏, 无法及时修复或转运所致, 为此部分脂肪酸的堆积加重了炎症反应。HQT干预后, 棕榈酸含量显著下调。β-羟基丁酸又称为酮体, 是脂肪酸在肝细胞线粒体中进行β-氧化所生成的特殊中间产物, 酮体分子在肝细胞生成后进入血液循环。机体正常情况下利用葡萄糖的氧化供能获得能量, 血液中酮体含量极少。而在模型组中, β-羟丁酸含量显著高于正常组, 分析为在UC病理情况下, 大鼠糖代谢受阻、脂肪动员增强, 从而脂肪酸β-氧化的产物—酮体的生成增加。
胆碱代谢与脂类代谢关系密切, 胆碱也是细胞膜和磷脂脂蛋白的重要组成成分, 对细胞膜的完整性及脂类代谢发挥着重要作用[19, 20], 同时, 胆碱也参与脂肪代谢的平衡调控, 其含量升高也是脂代谢紊乱的证据。三甲胺是由胆碱和肉碱在肠道细菌酶作用下的降解产物, 肠道菌群代谢的改变与炎症相关的疾病有关[21, 22]。模型组中三甲胺含量降低, 表明肠道菌群代谢可能发生紊乱。尿素是蛋白质代谢的主要最终产物, 在大鼠结肠炎发病后尿素水平的降低可认为是炎症状态下蛋白质的代谢受到了干扰, 考虑为病理状态下蛋白分解变缓所致。
综上所述, 响应UC扰动导致了大鼠机体内一系列代谢途径的激活与紊乱。而HQT干预后的UC大鼠, 其紊乱的代谢通路得到有效调节, 表明HQT对UC具有治疗作用, 其机制可能与HQT调节大鼠体内紊乱的氨基酸代谢、能量代谢及脂代谢等有关。
| [1] | Wang B, Zhu XD, Duan YQ, et al. Effect of paeoniflorin on colon tissue pathological morphology and the balance of anti-inflammatory and proinflammatory factors in rats with ulcerative colitis[J]. Chin J Integr Tradit West Med Dig (中国中西医结合消化杂志), 2013, 21: 1–4. |
| [2] | Hammer HF. Gut microbiota and inflammatory bowel disease[J]. Dig Dis, 2011, 29: 550–553. DOI:10.1159/000332981 |
| [3] | Cooney R, Jewell D. The genetic basis of inflammatory bowel disease[J]. Dig Dis, 2009, 27: 428–442. DOI:10.1159/000234909 |
| [4] | Leone V, Chang EB, Devkota S. Diet, microbes, and host genetics:the perfect storm in inflammatory bowel diseases[J]. J Gastroenterol, 2013, 48: 315–321. DOI:10.1007/s00535-013-0777-2 |
| [5] | Wang DF, Wang YL, Wang YW, et al. Effect of Huangqin Tang on the function of regulatory TLR4/MyD88 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2016, 51: 1558–1563. |
| [6] | Wang YW, Zhang HH, Wang YL, et al. Effect of Huangqin Tang on the regulatory NF-κB p65 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2015, 50: 21–27. |
| [7] | Wang J, Chen Y, Yuan ZM. Differences in effective mechanisms of Coptidis Rhizoma and bile processed Coptidis Rhizoma on heat syndrome based on urinary metabonomics[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2638–2645. |
| [8] | Zhong LJ, Zhang WQ, Ji P, et al. Metabolomic evaluation for anti-inflammatory effect of volatile oils from different preparations of Angelicae Sinensis Radix[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2061–2069. |
| [9] | Xue ZY, Hua YL, Li JX, et al. Effect of different processed volatile oils from Angelica sinensis on urinary metabolomics rats[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 928–939. |
| [10] | Li T, Zhuang S, Wang Y, et al. Flavonoid profiling of a traditional Chinese medicine formula of Huangqin Tang using high performance liquid chromatography[J]. Acta Pharm Sin B, 2016, 6: 148–157. DOI:10.1016/j.apsb.2016.01.001 |
| [11] | Morris GP, Beck PL, Herridge MS, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J]. Gastroenterology, 1989, 96: 795–803. DOI:10.1016/S0016-5085(89)80079-4 |
| [12] | Wang WW, Qiao SY, Li DF. Amino acids and gut function[J]. Amino Acids, 2009, 37: 105–110. DOI:10.1007/s00726-008-0152-4 |
| [13] | Keszthelyi D, Troost FJ, Masclee AA. Understanding the role of tryptophan and serotonin metabolism in gastrointestinal function[J]. Neurogastroenterol Motil, 2009, 21: 1239–1249. DOI:10.1111/nmo.2009.21.issue-12 |
| [14] | Ding JH, Fu CG, Zhao RH. The research status of serotonin in the gastrointestinal tract functional disease[J]. World Chin J Digestol (世界华人消化杂志), 2005, 13: 2405–2408. |
| [15] | Yang SY, Lu Z, et al. Research progress on microbial glutamate decarboxylase[J]. Food Sci (食品科学), 2005, 26: 528–533. |
| [16] | Zhang K, Ren L, Li D, et al. Influence of metabonomics of liver depression functional dyspepsia rats on electric acupuncture[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2016, 18: 110–114. |
| [17] | Yuan YZ, Tang YM. Paying attention to studying on gut barrier function[J]. Chin J Dig (中华消化杂志), 2006, 26: 577–578. |
| [18] | Wei YF. Protective Effect of Huang-Lian-Jie-Du-Tang Against CLP-induced Polymicrobial Sepsis and Its Influence on Metabolome Profile in Rats (黄连解毒汤对CLP诱导的脓毒症大鼠的保护作用及其代谢组学研究)[D]. Shanghai: The Second Military Medical University, 2014. |
| [19] | Ye HQ, Gan L, Yang XL, et al. Membrane-associated cytotoxicity induced by realgar in promyelocytic leukemia HL-60 cells[J]. J Ethnopharmacol, 2006, 103: 366–371. DOI:10.1016/j.jep.2005.08.014 |
| [20] | Zeisel SH, Blusztajn JK. Choline and human nutrition[J]. Ann Rev Nutr, 1994, 14: 269–296. DOI:10.1146/annurev.nu.14.070194.001413 |
| [21] | Wang WZ, Tian FS. Review the connection between trimethylamine oxide and atherosclerosis[J]. Tianjin Med J (天津医药), 2015, 43: 443–445. |
| [22] | Biagi E, Nylund L, Candela M, et al. Correction:through ageing, and beyond:gut microbiota and inflammatory status in seniors and centenarians[J]. PLoS One, 2010, 5: e10667. DOI:10.1371/journal.pone.0010667 |
 2017, Vol. 52
2017, Vol. 52


