过氧化物酶体增殖物激活受体(peroxisome pro liferators activated receptors, PPARs)是一类由配体激活的核受体[1], 可分为PPARα、PPARβ (或PPARδ)及PPARγ三种亚型[2], 不同亚型具有不同的组织分布模式和代谢调控功能[3, 4]。PPARs调控靶基因的作用模式与其他核受体类似: PPARs首先与维甲酸X受体(retinoid X receptor, RXR)形成异二聚体, 然后在CBP/p300等共激活因子的辅助下, 特异性结合靶基因启动子中的过氧化物酶体增殖物反应元件(perox isome proliferator response elements, PPRE), 从而调控靶基因的转录[5]。研究发现, PPARs参与脂质代谢、脂肪生成、胰岛素敏感、炎症反应、细胞生长和分化等重要生化反应及生物调节过程[6]; 一系列代谢综合征与PPARs相关, 包括胰岛素抵抗、糖耐量受损、肥胖、高脂血症、高血压病、动脉粥样硬化症和微量蛋白尿等; PPARα和PPARγ与脂质代谢紊乱、糖尿病等代谢相关疾病密切相关, 分别为贝特类(fibrates)降脂药物和噻唑烷二酮类(thiazolidinediones, TZDs) 2型糖尿病药物的作用靶点[7, 8]。TZDs药物中罗格列酮(rosiglitazone)[9]激活PPARγ能力最强、吡格列酮(pioglitazone)[10]的作用相对较弱, 二者均于1990s成功上市, 成为2型糖尿病治疗的重要药物。虽然TZDs药物治疗了成千上万糖尿病患者, 但长期服用存在体重增加、浮肿、低密度脂蛋白胆固醇水平升高等不良反应[11]。因此, 理想PPARγ激动剂的发现, 已成为目前糖尿病领域的重要研究方向之一。
临床应用的TZDs类药物, 可认为由3个结构单元组成(图 1)。对TZDs药物的结构修饰, 至今主要集中在B和C结构单元。本实验室前期研究中, 设计合成了较多含TZD结构单元的化合物, 发现了不少体外PPRE相对激动活性超过100%的化合物(阳性对照为吡格列酮)[12, 13] (图 1)。
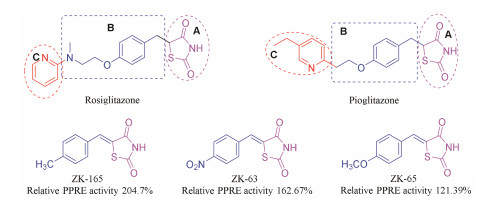
|
Figure 1 The structures of clinical drugs and highly active molecules |
一般认为, A结构单元是TZD药物的药效团。为研究构效关系, 本研究首先尝试对前期获得的活性分子的A结构单元进行修饰, 考察TZD环的变化对PPAR活性的影响。基于此, 设计了目标分子TM1, TM1水解得TM2 (图 2)。
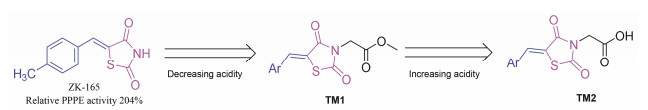
|
Figure 2 Design of target molecules TM1 and TM2 |
治疗糖尿病并发症的有效药物依帕司他(epalrestat)[14], 与TM2结构非常类似。依帕司他含有的绕丹宁结构单元, 是TZD的生物电子等排体。根据生物电子等排原理, 将TM2中的2位-C=O替换为-C=S, 即为目标化合物TM3(图 3)。为了研究取代基大小及亲疏水性对活性的影响, 进一步设计了TM3的衍生物TM4~TM6(图 3)。
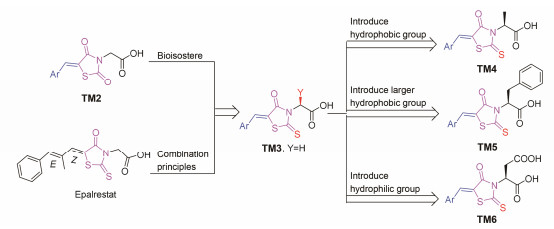
|
Figure 3 Design of target molecules TM3-TM6 |
为了研究分子各个结构单元对生物活性的影响, 同时保留A结构单元的3-NH修饰, 设计了C结构单元用疏水性大体积咔唑进行修饰的目标化合物TM7 (图 4)。TM7的结构接近于传统的TZDs药物。

|
Figure 4 Design of target molecules TM7 |
活性测定发现, 目标分子PPRE激动活性与α-葡萄糖苷酶抑制活性均较弱, 但蛋白质酪氨酸磷酸酶-1B (PTP-1B)抑制活性很强。该研究对糖尿病药物的后续研究有一定的参考意义。
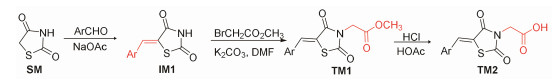
结果与讨论 1 目标化合物的合成 1.1 目标分子TM1与TM2的合成2-(5-芳亚甲基噻唑烷-2, 4-二酮-3-基)乙酸(TM2)可由IM1与溴乙酸在碱性条件下直接反应得到(一步法); 也可用IM1与溴乙酸甲酯反应, 先得到2-(5-芳亚甲基噻唑烷-2, 4-二酮-3-基)乙酸甲酯(TM1), 然后再水解得到(二步法)[15]。二步法的优势为可以同时得到目标化合物TM1和TM2, 且溴乙酸甲酯的反应活性高于溴乙酸, 收率也相对较高, 故选用第二种方法(合成路线1)。其中, IM1的合成采用固相合成法, 即SM、芳香醛和无水醋酸钠研磨后, 加热至熔融状态, 出现黏稠即停止加热, 加水后处理即可, 简便易行。
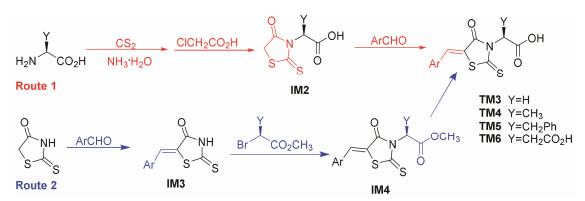
1.2 目标分子TM3~TM6的合成路线TM3~TM6有2条合成路线(合成路线2), 区别在于引入芳亚甲基或氨基酸的顺序:路线1以氨基酸与CS2、氯乙酸发生成环反应得到IM2, 再与芳醛缩合得到TM3~TM6, 该法简便易行, 原料易得; 路线2以绕丹宁为起始原料与芳醛缩合得到IM3, 再与α-溴代烃基乙酸甲酯发生取代反应得到IM4, 进一步水解得到TM3~TM6。路线2中手性原料α-溴代烃基乙酸甲酯不易得到, 且合成步骤长而繁琐, 故采用路线1合成TM3~TM6。
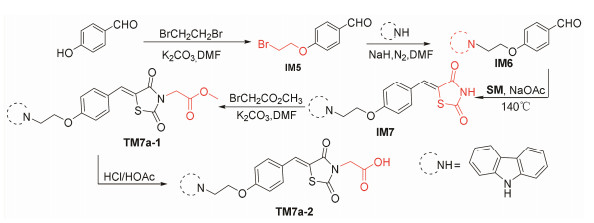
1.3 目标分子TM7的合成路线TM7a和TM7b的主要差别在右端杂环, 前者为TZD结构单元, 后者以绕丹宁为基本结构。它们都可以有多条合成路线, 考虑到原料的易得性、合成难易、反应步骤及反应位点数, TM7a的合成路线见合成路线3。与TM3相似, TM7b的合成路线如合成路线4所示。
|
Scheme1 Synthetic routes of target molecules TM1 and TM2 |
|
Scheme2 Synthetic routes of target molecules TM3-TM6 |
本实验共合成51个目标化合物, 收率59.3%~96.4%。所得化合物经熔点测定、1HNMR或13CNMR确证(表 1)。分子中TZD的5位双键构型, 参照文献[16-18]确定。
| Table 1 The physical and spectral data of target molecules |
分别以吡格列酮(0.39 μg·mL-1, 100%)、阿卡波糖(100 μg·mL-1, 74.12%)、矾酸钠(100 μg·mL-1, 93.31%)为阳性对照, 测定10 μg·mL-1目标化合物的PPRE相对激动活性、α-葡萄糖苷酶抑制活性、PTP-1B抑制活性, 测试结果见表 2~4。
| Table 2 Antidiabetic activity of target molecules TM1 and TM2. *The cLogP data is calculated by the online software Plexus provided by Eli Lilly and Company. The value in parentheses is the antidiabetic activation at the equal molar concentration converted by(antidiabetic/Conc.) ×37.13 |
| Table 3 Antidiabetic activity of target molecules TM3-TM6. *The cLogP data is calculated by the online software Plexus provided by Eli Lilly and Company. The value in parentheses is the antidiabetic activation at the equal molar concentration converted by(antidiabetic/ Conc.) ×33.86 |
| Table 4 Antidiabetic activity of target molecules TM7. *The cLogP data is calculated by the online software Plexus provided by Eli Lilly and Company. The data in parentheses is the antidiabetic activation at the equal molar concentration converted by(antidiabetic/Conc.) ×24.13 |
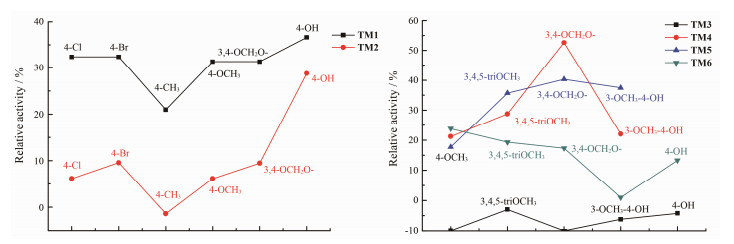
10 μg·mL-1TM1~TM2的PPRE相对激动活性、α-葡萄糖苷酶抑制活性、PTP-1B抑制活性结果见表 2。10 μg·mL-1浓度下, TM1与TM2的PPRE相对激动活性在-3.30%~ 37.25%, 低于前期研究的活性分子, 表明在TZDs药物分子的A结构单元修饰, 不一定能达到提高活性的目的; 整体看, PPRE活性TM1系列(羧酸酯型)较TM2(羧酸型)好, 表明TZD型分子的酸性强弱不是决定其PPRE高低的主要因素。分析芳环上取代基对PPRE活性的影响, 发现含有供电子取代基化合物的活性普遍强于吸电子取代基者(图 5), 如PPRE相对激动活性TM1-1(4-NO2)为8.15%、TM1-14(4-HO)为33.62%;进一步, 吸电子作用越强PPRE相对激动活性越小, 如TM1-1(4-NO2, 8.15%) < TM1-2(3,4-2Cl, 17.89%) < TM1-3(4-Cl, 27.97%), 供电子作用越强PPRE相对激动活性越大, 如TM1-7(4-Me, 19.42%) < TM1-9(4-MeO, 27.45%), TM1-10(4-BuO, 30.96%) < TM1-12(3,4-OCH2O, 37.25%)。此外, 芳杂环(如TM1-5、TM1-6)的活性结果整体较好, 这与上市药物中亦含有杂环结构相一致。
|
Figure 5 Comparison graph of PPRE relative agonistic activity of different series compounds |
α-葡萄糖苷酶抑制剂是通过抑制小肠α-葡萄糖苷酶来阻断碳水化合物分解, 延缓葡萄糖的生成和吸收, 降低餐后血糖峰值[19]。10 μg·mL-1测试浓度下, 目标分子α-葡萄糖苷酶抑制活性在-8.76%~52.82%, 其中TM1-4(4-Br)的抑制活性达到52.82%。比较目标化合物活性发现, TM1(羧酸酯型)活性较TM2(羧酸型)好, 且芳环上含有溴或供电子取代基时活性相对较好。对TM1而言, 同一类型的取代基, 其活性强度相近, 如TM1-1~TM1-3的活性在11%~14%之间, TM1-8~TM1-10及TM1-12的活性在30%~34%之间。
|
Scheme3 Synthetic route of target molecules TM7a |
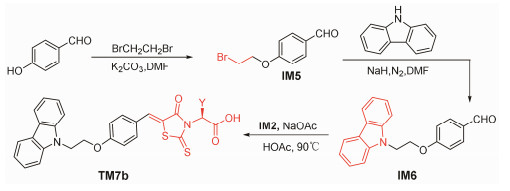
|
Scheme4 Synthetic route of target molecules TM7b |
PTP-1B通过催化去磷酸作用阻碍胰岛素在体内的信号表达, 导致胰岛素抵抗, 而胰岛素抵抗是大多数糖尿病发生的原因。由于PTP-1B抑制剂可以提高机体对胰岛素的敏感度, 从而成为糖尿病治疗的药物[20]。10 μg·mL-1浓度下大部分化合物对PTP-1B有抑制活性; 分析构效关系发现, 同一类型的分子其PTP-1B活性相近, 如TM1-3与TM1-4、TM2-3与TM2-4、TM1-5与TM1-6、TM1-7~TM1-10与TM2-4及TM2-5, 表明电性不是影响PTP1-B的主要因素。TM2-6(3,4-OCH2O)抑制活性达到96.71%, 超过20倍浓度的阳性对照矾酸钠, 但其羧酸酯型的TM1-12的抑制活性仅有7.47%, 具体原因尚不清楚。虽然如此, 上述结果可以表明, 5-芳亚甲基噻唑烷-2, 4-二酮结构单元对PTP-1B有一定的抑制作用, 为研发PTP-1B药物提供了新的思路。
2.2 目标化合物TM3~TM6的活性10 μg·mL-1TM3~TM6的PPRE相对激动活性、α-葡萄糖苷酶抑制活性、PTP-1B抑制活性结果见表 3, TM3~TM6系列分子的PPRE相对激动活性、α-葡萄糖苷酶抑制活性、PTP-1B抑制活性整体较弱。与TM2对比, TM3~TM6的α-葡萄糖苷酶抑制活性、PTP-1B抑制活性与TM2相近, 但PPRE活性顺序为TM5 > TM4-7~TM4-11 > TM6 > TM2 > TM3 > TM4-1~TM4-6, 表明C=O到C=S的生物电子等排, 对TM3~ TM6系列分子的PPRE活性影响为有的增强有的减弱, 并且无论分子右端为何种氨基酸结构, 只要左端苯环上的取代基为同一类型—供电子基或吸电子基时, 则每一系列分子的PPRE活性各自相近; 特别是TM4-1~TM4-6六个分子左端苯环上的取代基为吸电子基时, 它们的PPRE都为负值且差别不大。此外, 左端苯环上的取代基相同时, TM3~TM6系列分子的PPRE激动活性强弱顺序为TM5或TM4 > TM6 > TM3(图 5), 表明右端氨基酸的N-α取代基体积愈大则活性愈好。
2.3 目标化合物TM7活性结果与讨论目标化合物TM7结构更接近于传统的TZDs化合物, 仅TZD环上3位的N-H作了修饰, 活性数据见表 4。
对比TM7与TM1~TM6系列目标化合物的PPRE相对激动活性, 发现它们的活性数据差别较小, 表明在前6个系列的基础上引入大体积的咔唑基对活性的影响较小; 但对比IM7与TM1~TM7的PPRE相对激动活性数据, 发现IM7活性强于所有目标化合物, 这进一步表明在TZD环3位的N-H进行修饰以改变酸性, 并不能增强PPAR活性, 这可能就是TZDs上市药物及临床活性分子中无A结构单元修饰的原因。
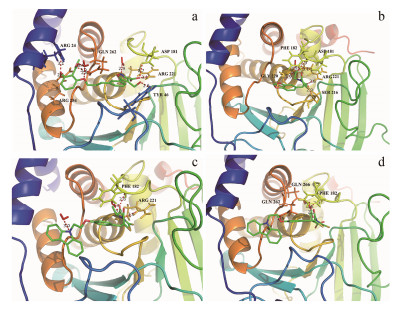
TM7系列的α-葡萄糖苷酶抑制活性较弱, 与其他几类化合物的活性差别较小。但TM7系列化合物的PTP-1B抑制活性总体较好, 特别是TM7b-2与TM7b-4的抑制活性分别达到98.22%与92.35%。用SimBioSys公司的eHiTS软件计算活性分子与蛋白质(PTP-1B, PDB code 1XBO[21])的对接函数, 后用PyMOL软件获取对接图(图 6, a为蛋白复合物中配体分子[22]CAS: 745079-21-4, b为TM2-6, c为TM7b-2, d为TM7b-4)。
|
Figure 6 Docking figures of compounds and protein. a: CAS:745079-21-4, b: TM2-6, c: TM7b-2, d: TM7b-4 |
图 6显示高活性分子与蛋白质的结合区域同配体分子一致, 但作用的氨基酸残基有所不同。配体分子与氨基酸残基Gln262、Arg254、Arg221、Asp181、Tyr46、Arg24形成氢键。目标化合物TM2-6与氨基酸残基Arg221、Gly220、Ser216、Phe182、Asp181形成氢键, 目标化合物TM7b-2与氨基酸残基Arg221、Phe182形成氢键, 目标化合物TM7b-4与氨基酸残基Gln266、Gln262、Phe182形成氢键, 且目标化合物的B结构单元中的苯环结构与Phe182有疏水相互作用。目标化合物TM2-6与TM7b-2的羧基与Arg221之间的电荷-电荷相互作用是一种强驱动力的结合。这种相互作用模式在许多已知的PTP-1B抑制剂中是常见的[23]。
2.4 化合物PTP-1B抑制活性IC50值与毒性预测值本研究还测定了PTP-1B高活性分子的IC50值, 见表 5。
| Table 5 In vitro IC50 for highly inhibitory active compounds. The normal range of toxic predictions: TOX-hERG pIC50≤6 mol·L-1; TOX-MUT risk≤2; TOX-BRM-rat TD50≥4 mg·kg-1·d-1; TOX-BRM-mouse TD50≥25 mg·kg-1·d-1; TOX-RAT LC50≥300 mg·kg-1 |
糖尿病是慢性疾病, 需要长期服药, 因而糖尿病类药物必须无毒或低毒性。为预知高抑制活性化合物的安全性, 使用美国Simulations Plus公司的毒性预测软件ADMET Predictor 8.0预测化合物的毒性(表 5)。
表 5表明, 大部分高活性目标化合物的最大抑制率高于钒酸钠, 且高活性目标化合物的IC50值均小于高浓度下钒酸钠。毒性预测结果也表明, 高抑制活性化合物可能无毒性, 因而有待更深层次的研究。
3 结论本文从TZDs类药物基本结构入手, 设计了7个系列目标化合物; 选用适宜的合成方法, 合成了51个目标化合物。体外抗糖尿病活性测试发现3个PTP-1B抑制活性很好的目标分子, 其中TM2-6抑制活性高达96.71%、IC50低至1.48 mg·L-1, 优于阳性对照物; 毒性预测显示, 高活性分子可能无毒性, 可作为新型抗糖尿病药物的先导分子进一步研究。
实验部分硫脲(成都化学试剂厂, AR); 无水醋酸钠(温州东升化学化工试剂厂, AR); 溴乙酸甲酯(西南合成制药股份有限公司赠送, > 98%); 溴乙酸(北京力德士化工有限公司, 99%); 二硫化碳、1, 2-二溴乙烷、氢氧化钠、4-硝基苯甲醛、4-溴苯甲醛(成都科龙化学试剂厂, AR); 碳酸钾(重庆川东化工有限公司, AR); 甘氨酸、丙氨酸、苯丙氨酸、天冬氨酸(成都凯泰新技术有限责任公司, CP); 3, 4, 5-三甲氧基苯甲醛、2-噻吩甲醛、4-甲基苯甲醛(Alfa Acear, AR); 2-呋喃甲醛(天津瑞金特化学品有限公司, CP); 氢化钠(J & K Chemical ltd., 60% mineral oil); 氢氧化锂(重庆东方红试剂厂, CP); DMF (Samsung Fine Chemicals, AR); 4-氯苯甲醛(Fluka, AR); 咔唑、4-甲氧基苯甲醛、2, 4-二氯苯甲醛、4-羟基苯甲醛、氯乙酸(国药集团试剂总厂, AR); 6-甲氧基-2-萘醛(浙江佳斯化工有限公司, CP); 氧化胡椒醛(上海双喜香料助剂厂, CP); 苯甲醛(上海试剂一厂, CP); 其余试剂均为市售化学纯或分析纯产品。
超导核磁波谱共振仪(AV-300, Bruker); 精密显微熔点测定仪(X-6, 福凯仪器有限公司)。
1 目标化合物的合成 1.1 噻唑烷2, 4-二酮(SM)的合成在1 L三颈瓶中加入氯乙酸236 g (2.5 mol)、硫脲209 g (2.75 mol)和浓盐酸625 mL, 搅拌下加热回流3 h, 冷却搅拌析晶, 过滤, 晶体用少量H2O洗涤2次, 得2-亚氨基-4-噻唑酮盐酸盐晶体; 向晶体中加入H2O 380 mL及活性炭6 g, 加热回流30 min, 趁热过滤, 滤液冷却搅拌析晶, 过滤, 晶体用少量H2O洗涤2次, 60 ℃干燥8 h, 得噻唑烷-2, 4-二酮白色针状晶体SM184.5 g。Yield: 60%; mp: 125.6~127.1 ℃; IR (KBr, cm-1): 3 134 (s, νNH), 3 047 (s, ν=CH), 2 949, 2 825 (s, νCH2), 1 739 (s, νC=O), 1 655 (s, νC=O), 618.0 (m, νC-S); 1H NMR (300 MHz, CDCl3): δ 4.14 (s, 2H, CH2), 12.02 (s, 1H, NH)。
1.2 目标分子TM1的合成通法于研钵中加入醛11 mmol、SM 10 mmol和无水NaOAc 10 mmol, 混合研磨至粉末状后, 转入100 mL圆底烧瓶, 油浴125 ℃反应, 固体原料迅速熔化, 随即变稠, 直到完全固化时停止反应, 趁热加入二甲基甲酰胺(DMF)使固体完全溶解, 再加50 mL H2O析出大量固体, 用2 mol·L-1 HCl溶液调节pH 5~6, 室温搅拌30 min后于4 ℃静置, 抽滤, 滤饼用H2O洗涤, 100 ℃干燥, 用Et2O-EA=2: 1 (v/v)混合溶剂6~8 mL分散过夜, 抽滤, 干燥, 即得中间体IM1。
5-芳亚甲基噻唑烷-2, 4-二酮(IM1)、溴乙酸甲酯和K2CO3按物质量比1: 1.2: 2投料。于50 mL圆底烧瓶中依次加入IM1、DMF、K2CO3, 搅拌10 min后加入溴乙酸甲酯, 室温搅拌反应, TLC检测反应进程。反应完成后用H2O淬灭反应, 冷藏静置数小时, 抽滤, H2O洗2次。95%乙醇重结晶, 得目标化合物TM1。
1.3 目标分子TM2的合成通法50 mL圆底烧瓶中加入2-(5-芳亚甲基噻唑烷-2, 4-二酮-3-基)乙酸甲酯(TM1) 1 mmol、HOAc 10 mL、HCl 3 mL, 80 ℃水浴加热反应, TLC检测反应进程。反应完成后, 冷却放置, 抽滤, 固体用50%乙醇重结晶, 得目标化合物TM2。
1.4 目标分子TM3~TM6的合成通法在250 mL反应瓶中依次加入NH3·H2O 60 mmol、CS2 60 mmol与0.192 g苄基三乙基溴化铵, 混合搅拌均匀后, 缓慢滴加15 mL氨基酸的NaOH水溶液(由60 mmol氨基酸, 70 mmol NaOH加蒸馏水在冰浴下溶解得到), 大约搅拌反应4 h后在70 ℃水浴下加热蒸馏除去多余的CS2。在冰浴下加入15 mL氯乙酸钠水溶液(冰浴下由72 mmol氯乙酸和72 mmol NaOH加蒸馏水溶解得到)。室温搅拌约2 h后在冰浴下浓盐酸调pH=1, 移入室温搅拌约1 h, 沸水浴加热约30 min, 停止反应, 冷藏静置至析出晶体, 抽滤。50%乙醇重结晶, 得中间体IM2。
将1.1 mmol芳香醛、1.0 mmolIM2和1.2 mmol无水NaOAc加入50 mL圆底烧瓶中, 加3~4 mL醋酸溶解, 90 ℃水浴回流, TLC监测反应进程, 反应完成后用H2O淬灭反应, 冷藏静置数小时, 抽滤, H2O洗2次。固体用50%乙醇重结晶, 得到目标化合物TM3~TM6。
1.5 目标分子TM7a的合成通法于100 mL圆底烧瓶中依次加入4-羟基苯甲醛1 mmol、DMF 3 mL、K2CO3 4 mmol、1, 2-二溴乙烷4 mmol, 室温搅拌反应, TLC监测反应进程, 约24 h反应结束, 抽滤, 加H2O 15 mL稀释, 2 mol·L-1 HCl溶液调至中性, EA萃取, 饱和NaCl洗涤, 有机相无水Na2SO4干燥, 旋蒸。PE/EA (v/v, 8:1) 柱色谱分离得无色晶体IM5。收率74.2%, mp 75~77 ℃。1H NMR (300 MHz, CDCl3) δ 3.68 (2H, t, J = 5.6 Hz, BrCH2), 4.38 (2H, t, J = 5.6 Hz, OCH2), 7.03 (2H, d, J = 8.6 Hz, Ar-H), 7.86 (2H, d, J = 8.6 Hz, Ar-H), 9.91 (1H, s, CHO)。
于100 mL圆底烧瓶中将NaH 1.2 mmol分散到2 mL DMF中, N2保护下加入1.2 mmol咔唑的DMF溶液, 加热至90 ℃搅拌1 h左右, 冰浴下加入1 mL IM5 1 mmol的DMF溶液, 50 ℃搅拌反应, TLC监测反应进程。反应毕, 加H2O淬灭反应, 加EA提取3次, 有机相饱和NaCl洗涤至中性。无水Na2SO4干燥, 旋蒸。PE/EA (v/v, 8:1) 柱色谱分离得纯品IM6。收率54.3%。mp 139~143 ℃。1H NMR (300 MHz, CDCl3) δ 4.43 (2H, t, J = 5.6 Hz, OCH2), 4.76 (2H, t, J = 5.6 Hz, NCH2), 6.89 (2H, d, J = 8.6 Hz, Ar2-H), 7.26~7.29 (2H, m, Ar1-H), 7.46~7.51 (4H, m, 2Ar1-H and 2Ar2-H), 7.75 (2H, d, J = 8.6 Hz, Ar1-H), 8.10 (2H, d, J = 7.7 Hz, Ar1-H), 9.84 (1H, s, CHO)。
以IM6和噻唑烷-2, 4-二酮为原料合成中间体IM7, 实验步骤同5-芳亚甲基噻唑烷-2, 4-二酮(IM1)的合成。收率86.2%。1H NMR (300 MHz, DMSO-d6) δ 4.41~4.45 (2H, m, OCH2), 4.83 (2H, t, J = 4.4 Hz, NCH2), 6.96 (2H, d, J = 8.5 Hz, Ar2-H), 7.19~7.23 (2H, m, Ar1-H), 7.44~7.49 (4H, m, 2Ar1-H and 2Ar2-H), 7.68~7.71 (3H, m, 2Ar1-H and ArCH=C), 8.14 (2H, d, J = 7.7 Hz, Ar1-H), 12.50 (1H, s, NH); 13C NMR (75 MHz, DMSO-d6) δ 41.9, 66.8, 109.6, 115.1, 115.2, 118.9, 120.1, 122.2, 125.7, 126.7, 131.2, 131.6, 140.2, 159.7, 167.5, 167.9。
TM7a的合成由IM7与溴乙酸甲酯反应得到, 实验步骤同TM1和TM2的合成。
1.6 目标分子TM7b的合成通法TM7b的合成由IM6与IM2反应得到, 实验步骤同TM3~TM6。
2 生物活性测试 2.1 PPRE-Luc报告基因筛选实验方法[24-27]HepG2细胞接种于96孔板, 培养过夜; 用转染试剂参照说明书将相应的质粒转染进细胞中, 24 h后换用含待测样品的低糖DMEM培养基, 同时设立正常对照(未转染的细胞)和模型对照(转染的细胞)不加样品。继续培养24 h后检测荧光素酶活性。根据检测到的化学发光强度L值计算激活率, 激活率= [(L样品-L正常) / (L模型-L正常)-1] × 100;每个样品每个浓度设双复孔, 重复两次。
2.2 α-葡萄糖苷酶抑制剂筛选实验方法[28]100 μL反应体系中含0.02 U葡萄糖苷酶(Sigma公司, G-0660) 或适量哺乳动物来源的葡萄糖苷酶(由大鼠小肠组织中提取)、67 nmol·L-1磷酸钠缓冲液(pH = 6.8) 和样品, 同时设立空白对照(不含酶和样品)和阴性对照(不含样品), 37 ℃反应10 min后, 加入0.1 mol·L-1麦芽糖, 室温反应10 min, 再加入200 μL的葡萄糖检测试剂(南京建成公司), 混匀后490 nm测定OD值。根据OD值计算抑制率, 抑制率= 1 -(OD样品-OD空白) / (OD阴性-OD空白)。
2.3 蛋白质酪氨酸磷酸酶1B抑制活性筛选实验方法[29]200 μL反应体系中含PTP-1B (重组表达)、100 mmol·L-1醋酸钠缓冲液(1 mmol·L-1 EDTA, 0.1% Triton-X-100, 15 mmol·L-1 β-巯基乙醇, pH = 6.0) 和样品, 同时设立空白对照(不含酶和样品)和阴性对照(不含样品), 37 ℃反应10 min, 加入蛋白质酪氨酸磷酸酶底物PNPP, 37 ℃继续反应30 min, 加入1 mol·L-1 NaOH终止反应, 405 nm测定OD值。根据OD值计算抑制率, 抑制率= [1-(OD样品-OD空白) / (OD阴性-OD空白)]×100%。初筛时每个样品单浓度设双复孔, 抑制率大于70%的样品测定IC50值, 每个样品梯度稀释6个浓度, 每个浓度设双复孔。根据抑制率, 应用Xlfit软件中的4 Parameter Logistic Model计算IC50。
致谢: 感谢王宁老师测试核磁数据; 感谢成都地奥晏菊芳等测试糖尿病活性数据。| [1] | Filzen GF, Bratton L, Cheng XM, et al. Synthesis and SAR of selective benzothiophene, benzofuran, and indole-based peroxisome proliferator-activated receptor δ agonists[J]. Bioorg Med Chem Lett, 2007, 17: 3630–3635. DOI:10.1016/j.bmcl.2007.04.047 |
| [2] | Kasuga J, Yamasaki D, Ogura K, et al. SAR-oriented discovery of peroxisome proliferator-activated receptor pan agonist with a 4-adamantylphenyl group as a hydrophobic tail[J]. Bioorg Med Chem Lett, 2008, 18: 1110–1115. DOI:10.1016/j.bmcl.2007.12.001 |
| [3] | Guerre MM, Rouault C, Poulain P, et al. PPAR α null mice are protected from high-fat diet-induced insulin resistance[J]. Diabetes, 2001, 50: 2809–2814. DOI:10.2337/diabetes.50.12.2809 |
| [4] | Rami HK, Smith SA. Synthetic ligands for PPAR γ-review of patent literature 1994-1999[J]. Expert Opin Ther Pat, 2005, 10: 623–634. |
| [5] | Desvergne B, Wahli W. Peroxisome proliferator activated receptors nuclear control of metabolism[J]. Endocr Rev, 1999, 20: 649–688. |
| [6] | Mohler ML, He YL, Wu ZZ, et al. Recent and emerging antidiabetes targets[J]. Med Res Rev, 2009, 29: 125–195. DOI:10.1002/med.v29:1 |
| [7] | Huang Y, Zhang HB, Zhou JP, et al. Advances in antidiabetic agents targeted PPAR[J]. Prog Pharm Sci (药学进展), 2004, 28: 193–198. |
| [8] | Fracchiolla G, Lavecchia A, Laghezza A, et al. Synthesis, biological evaluation, and molecular modeling investigation of chiral 2-(4-chloro-phenoxy)-3-phenylpropanoic acid derivatives with PPARα and PPARγ agonist activity[J]. Bioorg Med Chem, 2008, 16: 9498–9510. DOI:10.1016/j.bmc.2008.09.045 |
| [9] | Piemontese L, Cerchia C, Laghezza A, et al. New diphenylmethane derivatives as peroxisome proliferator activated receptor alpha/gamma dual agonists endowed with antiproliferative effects and mitochondrial activity[J]. Eur J Med Chem, 2016, 127: 379–397. |
| [10] | Yasmin S, Jayaprakash V. Thiazolidinediones and PPAR orchestra as antidiabetic agents:From past to present[J]. Eur J Med Chem, 2017, 126: 879–893. DOI:10.1016/j.ejmech.2016.12.020 |
| [11] | Uchiyama M, Iwabuchi H, Tsuruta F, et al. Pharmacokinetics, metabolism, and disposition of rosiglitazone, a novel peroxisome proliferator-activated receptor agonist, in rats and monkeys[J]. Drug Metab Dispos, 2011, 39: 653–666. DOI:10.1124/dmd.110.036194 |
| [12] | Huang M, Zhang K, Fan L, et al. Design synthesis and PPAR activities of 5-arylmethylene and 5-heteroaromatic methylene thiazolidine-2, 4-diones[J]. Sci Sin Chim, 2017, 47: 1–9. DOI:10.1360/N032017-00087 |
| [13] | Zhang K. Design, Synthesis and Antidiabetic Activities of L-Tyrosine Derivatives and 5-Arylmethylene Thiazolidine-2, 4-dione (L-酪氨酸衍生物及5-芳(杂环)亚甲基噻唑烷-2, 4-二酮类化合物的设计、合成及其抗糖尿病活性研究)[D]. Chongqing: Southwest University, 2011. |
| [14] | Antony P, Vijayan R. Identification of novel aldose reductase inhibitors from spices:a molecular docking and simulation study[J]. PLoS One, 2015, 10: e0138186. DOI:10.1371/journal.pone.0138186 |
| [15] | Maccari R, Ottana R, Curinga C. Structure-activity relationships and molecular modelling of 5-arylidene-2, 4-thiazolidinediones active as aldose reductase inhibitors[J]. Bioorg Med Chem, 2005, 13: 2809–2823. DOI:10.1016/j.bmc.2005.02.026 |
| [16] | Xia ZP, Knaak C, Ma J, et al. Synthesis and evaluation of novel inhibitors of Pim-1 and Pim-2 protein kinases[J]. J Med Chem, 2009, 52: 74–86. DOI:10.1021/jm800937p |
| [17] | Heng S, Tieu W, Hautmann S, et al. New cholesterol esterase inhibitors based on rhodanine and thiazolidinedione scaffolds[J]. Bioorg Med Chem, 2011, 19: 7453–7463. DOI:10.1016/j.bmc.2011.10.042 |
| [18] | Żesławska E, Nitek W, Tejchman W. The synthesis and crystal structures of the homologues of epalrestat[J]. J Chem Crystallogr, 2015, 45: 1–7. DOI:10.1007/s10870-014-0556-9 |
| [19] | Jing Z, Zeng WC, Luo JW, et al. In vitro and in vivo inhibitory effect of methanol extract from Terminalia chebula Tetz fruits on α-glucosidase[J]. Food Sci (食品科学), 2010, 31: 284–287. |
| [20] | Mahapatra MK, Kumar R, Kumar M. Synthesis, biological evaluation and in silico studies of 5-(3-methoxybenzylidene) thiazolidine-2, 4-dione analogues as PTP1B inhibitors[J]. Bioorg Chem, 2017, 71: 1–9. DOI:10.1016/j.bioorg.2017.01.007 |
| [21] | Zhao HY, Liu G, Xin ZL, et al. Isoxazole carboxylic acids as protein tyrosine phosphatase 1B (PTP1B) inhibitors[J]. Bioorg Med Chem Lett, 2004, 14: 5543–5546. DOI:10.1016/j.bmcl.2004.08.063 |
| [22] | Maccari R, Paoli P, Ottanà R, et al. 5-Arylidene-2, 4-thiazolidinediones as inhibitors of protein tyrosine phosphatases[J]. Bioorg Med Chem, 2007, 15: 5137–5149. DOI:10.1016/j.bmc.2007.05.027 |
| [23] | Liu G, Xin ZL, Pei ZH, et al. Fragment screening and assembly:a highly efficient approach to a selective and cell active protein tyrosine phosphatase 1B inhibitor[J]. J Med Chem, 2003, 46: 4232–4235. DOI:10.1021/jm034122o |
| [24] | Yang Y, Yan JF, Fan L, et al. Synthesis and PPAR activities of novel phenylacetic acid derivatives containing sulfonamide moiety[J]. Acta Pharm Sin (药学学报), 2012, 47: 1630–1639. |
| [25] | Zhou LJ, Yan JF, Yang DC, et al. Design, synthesis and PPAR agonist activities of novel L-tyrosine derivatives containing phenoxyacetyl moiety[J]. Acta Pharm Sin (药学学报), 2013, 48: 1570–1578. |
| [26] | Zhang K, Yan JF, Yang DC, et al. Synthesis of novel β-aminoalcohols containing nabumetone moiety with potential antidiabetic activity[J]. Acta Pharm Sin (药学学报), 2011, 46: 412–421. |
| [27] | Yang DC, Yan JF, Xu J, et al. Synthesis and investigation on antidiabetic activity of 4-(1-aryl-3-oxo-5-phenylpentylamino) benzenesulfonamide[J]. Acta Pharm Sin (药学学报), 2010, 45: 66–71. |
| [28] | Xu J, Yan JF, Yang DC, et al. Synthesis and α-glucosidase inhibitory activity of N-(1, 5-diaryl-3-pentone-1-yl)-4-aminobenzoic acid[J]. Acta Pharm Sin (药学学报), 2009, 44: 48–55. |
| [29] | Zhang YX, Yan JF, Yang DC, et al. Synthesis and preliminary evaluation of antidiabetic activity of 4-(3-(4-bromophenyl)-3-oxo-1-arylpropylamino)-N-(5-methylisoxazol-3-yl) benzenesulfonamide[J]. Acta Pharm Sin (药学学报), 2009, 44: 1244–1251. |
 2017, Vol. 52
2017, Vol. 52