2. 辽宁师范大学生命科学学院, 辽宁 大连 116081;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. School of Life Science, Liaoning Normal University, Dalian 116081, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
小檗碱(berberine, BBR)的降血糖作用已在临床试验中得到证实[1, 2]。有研究显示, BBR降糖作用可能与其增加肌肉和脂肪等组织中细胞对葡萄糖的摄取和利用有关; 体外的葡萄糖消耗实验(glucose consumption assay)能直观地反映BBR处理后, 这些细胞对葡萄糖利用的增加; 而BBR增加组织的葡萄糖利用可能与其抑制线粒体的有氧呼吸有关[3]。另有文献报道, BBR抑制线粒体的有氧呼吸, 将增加细胞内AMP/ATP的比例, 进而激活AMPK (AMP-activated protein kinase)[4]。但是, 对于BBR是否通过激活AMPK而发挥降糖作用, 尚有争论。有研究认为, BBR增加肌肉糖摄取的作用与AMPK的激活以及Glut4 (glucose transporter type 4, 葡萄糖转运蛋白4) 的转位有关[5]。但另有研究发现, BBR不影响Glut4介导的糖摄取; 在不表达Glut4的肝细胞中, BBR可以增加其糖消耗[3]。还有研究显示, BBR增加细胞糖消耗的作用与AMPK无关[6]。为更全面地评价BBR衍生物的体外降糖活性, 本文同时使用了糖消耗和AMPK激活两个活性评价指标。
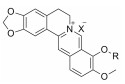
本课题组前期研究表明, BBR结构中的9位引入亲电子基团有利于提升其体外降糖活性[7]。因此, 本研究以BBR为先导化合物, 着重考察了9位取代基变化对其体外降糖活性的影响。使用的20个BBR衍生物包括9-简单醚(4a~4e)、9-杂烷醚(包括乙氧酰亚甲醚4f、特戊酰氧亚甲醚5、苄氧酰亚甲醚6a和异丁氧酰亚甲醚6b)、9-酯基(乙氧酯6c和简单酯6d~6m)。同时, 本研究选取重点化合物开展了糖消耗活性的量效关系以及AMPK活性研究。
结果与讨论 1 化合物的合成本研究以BBR为先导化合物, 在其9位引入醚类取代基, 共合成7个BBR类似物并首次评价了它们对肌管细胞糖消耗水平的影响。目标化合物的合成如合成路线1所示。以BBR为起始原料, 在高温减压条件下选择性脱去9-位甲基获得关键中间体[8], 后者在无水碳酸钾的催化作用下与相应卤代烷反应, 以30%~72%的收率生成目标化合物2a~2f (路线A), 其中。在制备目标化合物9-特戊酰氧亚甲醚5[9]的过程中, 特戊酰氯与多聚甲醛加成生成特戊酸氯甲酯3的反应是关键步骤, 严格控制反应温度在95~100 ℃之间有助于提高收率。3在无水NaI的作用下发生碘代反应生成中间体4, 后者与中间体1发生取代反应生成目标化合物5, 总收率为34% (路线B)。目标化合物的结构均经1H NMR、13C NMR和HR-ESI-MS确证(表 1)。化合物6a~6m (表 2)按照已报道的方法合成[8]。
| Table 1 Physical properties and spectra data of compounds |
| Table 2 Glucose consumption activity of BBR derivatives in L6 myotubes. aL6 myotubes were treated with or without 20 μmol·L−1 BBR or its analogs for 48 h. n = 4, x±s |
以L6肌管细胞为筛选模型, BBR为阳性对照, 本论文系统评价了9-烷醚(2a~2e)、9-杂烷醚(2f、5和6a~6c[8])以及9-酯基小檗碱衍生物(6d~6m[8])在20 μmol·L-1的剂量下的体外糖消耗活性。目标化合物的结构与活性如表 2所示。9-烷醚小檗碱类似物2a~2e的活性随烷基链长度的增加而减弱, 其中, 9-乙氧小檗碱2a的活性略优于BBR。类似的, 9-杂烷醚小檗碱化合物(2f、5和6a~6c)均未显示出明显的增加糖消耗的活性, 这可能是由于碳链增加的缘故。显然, 在9位引入酯基不利于活性, 所形成的化合物6d~6m的活性均有不同程度的降低或消失。以上结果表明, 在9位引入乙氧基有利于体外糖消耗活性的增加。通过本轮筛选获得了阳性化合物9-乙氧小檗碱类似物2a。
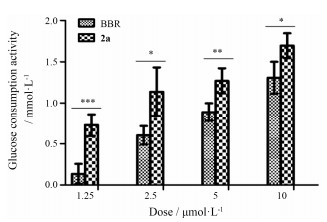
为进一步证实2a的作用, 本研究比较了BBR和2a在多个剂量下的糖消耗活性。结果如图 1所示, 在1.25、2.5、5和10 μmol·L-1 4个剂量下, BBR和2a的糖消耗活性均呈剂量依赖性的增高。同时看到, 在这4个剂量下, 2a的活性都显著优于BBR。在10、5.0和2.5 μmol·L-1的剂量下, 2a的活性较BBR分别提高了30%、43%和88%, 而在更低的1.25 μmol·L-1剂量下, BBR刚达到起效浓度, 此时2a的活性达到了BBR的5.4倍。由于BBR的生物利用度较低, 其在人体各组织内可达到的药物浓度有限。2a在低剂量下比BBR活性提高更显著, 提示其可能在体内发挥更好的降血糖效果, 这一结果具有一定的应用价值。
|
Figure 1 Compound 2a showed a stronger activity on glucose consumption than BBR in vitro. After differentiation, L6 myotubes were treated with compound 2a and BBR at the indicated dosage for 48 h independently. Glucose consumption was calculated as follows: glucose level in medium of cells treated with compound 2a or BBR minus the level of cells treated with vehicle (DMSO). n= 4, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs that of BBR |

|
Scheme1 Synthetic routes of target compounds. BBR: Berberine |
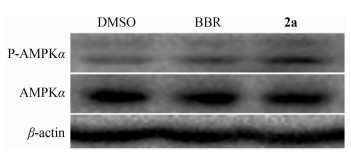
本课题组前期构建了以AMPK激活为评价指标的筛选模型[10], 但截至目前, 尚未筛选出体外活性优于BBR的结构类似物。因此, 本文进一步研究了化合物2a在体外对AMPK的激活作用。结果如图 2所示, 在10 μmol·L-1剂量下, 化合物2a激活AMPK的活性显著高于BBR。通过灰度扫描和计算得到2a激活AMPK的活性是BBR的2.8倍(详见实验部分3), 这与糖消耗活性的变化趋势是一致的。这一结果提示, 对于评价BBR类似物的体外降糖活性而言, AMPK的激活强度可以在一定程度上代表糖消耗活性的强弱。
|
Figure 2 Compound 2a had a stronger potency on AMPK activation than BBR in vitro. HepG2 cells were starved over night, and treated with or without 10 μmol·L-1 BBR or its analog 2a for 24 h respectively. P-AMPKα, AMPKα, and the reference protein β-actin expression were detected by Western blot. The bands were scanned and the potency on AMPK activation (P-AMPKα/β-actin ratio) was calculated as mentioned in the methods |
本研究系统评价了20个9-取代小檗碱类似物的糖消耗活性。结果表明, 在9位引入乙氧基有利于体外糖消耗活性的增加。9-乙氧小檗碱化合物2a在5个剂量水平(1.25、2.5、5、10和20 μmol·L-1)下的糖消耗活性均高于阳性对照BBR; 在1.25 μmol·L-1剂量下, 2a的糖消耗活性达到BBR的5.4倍。同时, 2a在10 μmol·L-1剂量下激活AMPK的活性是BBR的2.8倍。因此, 化合物2a是活性更优的BBR衍生物, 可作为进一步改造的母核。
实验部分熔点用CXM-300型精密熔点仪测定, 温度未校正; 核磁共振氢谱用Varian Mercury Plus 400测定(400 MHz), 核磁共振碳谱用Bruker Avance Ⅲ 500核磁共振仪测定(126 MHz), 溶剂均为DMSO-d6, TMS为内标; HR-MS用AutospecUltima-TOF质谱测定仪测定; 荧光检测用ZF-20D暗箱式紫外分析仪; 薄层色谱(TLC)采用E-Merck公司预铺硅胶铝箔卷; 所用试剂为Acros公司和国产分析纯或化学纯的试剂。
1 化学合成 1.1 2,3-亚甲二氧基-9-苄氧-10-甲氧基原小檗碱溴化物(2a)室温下, 将1[8] (0.50 g, 1.4 mmol)混悬于DMF (50 mL)中, 加入无水K2CO3 (0.15 g, 1.1 mmol)和溴乙烷(2 mL), 升温至60 ℃继续反应10 h, 薄层色谱监测反应完全。减压浓缩除去溶剂, 残余物用稀盐酸酸化, 抽滤收集析出的黄色固体, 以二氯甲烷-甲醇(40:1) 为流动相用减压快速硅胶柱分离纯化, 无水乙醇重结晶, 得到黄色固体2a(0.14 g, 33%)。
以1和卤代烷或溴乙酸乙酯为原料, 参照化合物2a制备方法, 得化合物2b~2f。
1.2 2,3-亚甲二氧基-9-丙氧-10-甲氧基原小檗碱碘化物(2b)以1和碘丙烷为原料, 以类似于化合物2a的方法合成, 目标产物为黄色固体, 收率72%。
1.3 2,3-亚甲二氧基-9-丁氧-10-甲氧基原小檗碱溴化物(2c)以1和溴丁烷为原料, 以类似于化合物2a的方法合成, 目标产物为黄色固体, 收率72%。
1.4 2,3-亚甲二氧基-9-戊氧-10-甲氧基原小檗碱溴化物(2d)以1和溴戊烷为原料, 以类似于化合物2a的方法合成, 目标产物为黄色固体, 收率45%。
1.5 3-亚甲二氧基-9-十二烷氧-10-甲氧基原小檗碱溴化物(2e)以1和1-溴代十二烷为原料, 以类似于化合物2a的方法合成, 目标产物为黄色固体, 收率30%。
1.6 2,3-亚甲二氧基-9-乙氧酰亚甲氧-10-甲氧基原小檗碱溴化物(2f)以1和溴乙酸乙酯为原料, 以类似于化合物2a的方法合成, 目标产物为黄色固体, 收率58%。
1.7 2,3-亚甲二氧基-9-特戊酰氧亚甲氧-10-甲氧基原小檗碱碘化物(5)将多聚甲醛(0.16 g, 5.3 mmol)、氯化锌(0.072 g, 0.53 mmol)与特戊酰氯(0.60 mL, 5.3 mmol)加入至25 mL茄形瓶中, 反应体系升温至95~100 ℃反应4 h, 逐渐变澄清。向反应体系中加入无水乙腈(12 mL), 同时加入NaI (0.80 mL, 5.3 mmol), 室温搅拌过夜, 生成中间体4。以1和4为原料, 以类似于化合物2a的方法合成目标产物5, 为黄色固体, 收率34%。
2 糖消耗活性的测定和计算使用含10%胎牛血清的DMEM培养基培养L6细胞。检测糖消耗时, 将L6细胞接种于96孔板, 用含2%胎牛血清的DMEM培养基, 培养5~7天, 期间每隔两天换液一次。药物溶解于DMSO后处理肌管细胞。检测时, 取2 μL培养基上清, 加入200 μL检测试剂(Randox公司, 葡萄糖氧化法), 通过标准曲线计算出培养基的葡萄糖浓度, 进而得到细胞消耗的葡萄糖含量, 即糖消耗量。加药组的糖消耗量减去溶剂对照组的糖耗量, 得到的差值, 即药物增加的糖消耗值, 作为药物的糖消耗活性。把BBR组的活性值设为1, 其他药物的活性表示为该药物处理组增加的糖消耗值与BBR处理组增加糖消耗值的比值。
3 AMPK活性的检测和计算HepG2细胞使用含10%胎牛血清的EMEM培养基培养。细胞接于6孔板24 h后, 换用无血清的EMEM培养基继续培养过夜。药物溶解于DMSO并处理细胞18 h后, 裂解细胞并进行SDS-PAGE电泳。经转印(Mini-PROTEAN转印系统, Bio-rad公司)后, 蛋白被转至PVDF膜上, 并分别与P-AMPKα、AMPKα和β-actin抗体及对应的二抗(所有抗体购自Cell Signaling公司)结合。最终经过ECL显影和灰度扫描得到Western blot的条带影像和蛋白表达的相对定量值(Image Lab 4.0软件, Bio-rad公司)。AMPK活性α亚基172位苏氨酸的磷酸化即P-AMPKα的表达水平可以代表AMPK的激活水平[5]。因此用P-AMPKα与β-actin灰度值的比值来表示化合物激活AMPK的活性强弱。
对于DMSO对照, BBR和2a处理组P-AMPKα和β-actin条带的灰度扫描值分别为78、157.2、313.4, 以及2 006.3、1 808.7、1 810.2;则对应二者的比值P-AMPKα/β-actin分别为0.039 (78/2 006.3)、0.087 (157.2/1 808.7) 和0.173 (313.4/1 810.2)。BBR和2a加药组的P-AMPKα/β-actin比值减去DMSO对照组的比值, 即为药物激活AMPK的活性值, 则BBR和2a激活AMPK的活性值分别为0.048 (0.087~0.039) 和0.134 (0.173~0.039)。将BBR处理组的活性值设为1, 则2a的活性值为2.8 (0.134/0.048)。
致谢: 核磁共振氢谱和碳谱由中国医学科学院药物研究所分析测试中心测定, 高分辨质谱由中国医学科学院医药生物技术研究所分析测试中心测定。| [1] | Zhang H, Wei J, Xue R, et al. Berberine lowers blood glucose in type 2 diabetes mellitus patients through increasing insulin receptor expression[J]. Metabolism, 2010, 59: 285–292. DOI:10.1016/j.metabol.2009.07.029 |
| [2] | Kong W, Wei J, Abidi P, et al. Berberine is a novel cholesterollowering drug working through a unique mechanism distinct from statins[J]. Nat Med, 2004, 10: 1344–1351. DOI:10.1038/nm1135 |
| [3] | Yin J, Gao Z, Liu D, et al. Berberine improves glucose metabolism through induction of glycolysis[J]. Am J Physiol Endocrinol Metab, 2008, 294: E148–E156. |
| [4] | Turner N, Li JY, Gosby A, et al. Berberine and its more biologically available derivative, dihydroberberine, inhibit mitochondrial respiratory complex I:a mechanism for the action of berberine to activate AMP-activated protein kinase and improve insulin action[J]. Diabetes, 2008, 57: 1414–1418. DOI:10.2337/db07-1552 |
| [5] | Lee YS, Kim WS, Kim KH, et al. Berberine, a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states[J]. Diabetes, 2006, 55: 2256–2264. DOI:10.2337/db06-0006 |
| [6] | Xu M, Xiao Y, Yin J, et al. Berberine promotes glucose consumption independently of AMP-activated protein kinase activation[J]. PLoS One, 2014, 9: e103702. DOI:10.1371/journal.pone.0103702 |
| [7] | Ren G, Wang Y, Li Y, et al. Structure-activity relationship of berberine derivatives for their glucose-lowering activities[J]. Int J Clin Exp Med, 2017, 10: 5054–5060. |
| [8] | Li YH, Li Y, Yang P, et al. Design, synthesis, and cholesterollowering efficacy for prodrugs of berberrubine[J]. Bioorg Med Chem, 2010, 18: 6422–6428. DOI:10.1016/j.bmc.2010.06.106 |
| [9] | Iyer PR, Yu D, Ho NH, et al. Synthesis of iodoalkylacylates and their use in the preparation of s-alkyl phosphorothiolates[J]. Syn Commun, 1995, 25: 2739–2749. DOI:10.1080/00397919508011821 |
| [10] | Wang YX, Kong WJ, Li YH, et al. Synthesis and structureactivity relationship of berberine analogues in LDLR upregulation and AMPK activation[J]. Bioorg Med Chem, 2012, 20: 6552–6558. DOI:10.1016/j.bmc.2012.09.029 |
 2017, Vol. 52
2017, Vol. 52