2. 军事医学科学院卫生学环境医学研究所, 北京 100850;
3. 北京清华长庚医院麻醉科, 北京 102218
2. Institute of Health and Environmental Medicine, Academy of Military Medical Science, Beijing 100850, China;
3. Anesthesia Department of Beijing Tsinghua Chang Gung Hospital, Beijing 102218, China
疼痛是一种临床常见症状, 也是当今困扰人类健康最严重的问题之一[1]。术后疼痛是机体受到手术创伤后的一种反应, 包括生理、心理和行为上的一系列反应[2], 已引起麻醉医生的高度重视。对乙酰氨基酚(acetaminophen, Ace)是临床常用的一种镇痛药物, 但其明显的胃肠道和肾脏等不良反应[3]及过量使用引起严重的肝脏毒性[4]已日益引起人们的关注。胆碱(choline, Cho)是天然α7烟碱型乙酰胆碱受体(α7nAChR)特异性激动剂, 主要通过激活α7nAChR, 抑制核因子κB (NF-κB)抑制蛋白激酶(IKK)活性, 阻断核因子κB抑制蛋白(IκB)磷酸化和NF-κB活化, 从而抑制炎症介质的产生[5], 发挥抗炎镇痛作用。鉴于疼痛机制的复杂性, 联合用药在临床疼痛治疗领域应用日趋广泛, 将两种不同机制的镇痛药物联合应用, 不仅可以产生协同或者相加的镇痛效果, 降低镇痛药物用量及其不良反应发生率, 是临床疼痛治疗的一种策略[6, 7]。目前尚缺乏Cho和Ace联合应用于疼痛治疗的相关研究, 对其作用机制的研究更知之甚少。本实验采用小鼠醋酸扭体疼痛模型, 通过扭体次数和等辐射分析法研究了Cho和Ace的联合镇痛作用并从二者联合应用对细胞因子和炎症介质释放的影响对其机制进行初步探讨。
材料与方法 实验动物SPF级KM小鼠, 雄性, 体重18~ 22 g, 由军事医学科学院实验动物中心提供, 动物合格证号为SCXK-军2002-001。适应环境2天, 室温20~24 ℃, 湿度50%~65%, 自由饮水和进食。
主要药品、试剂与实验仪器重酒石酸胆碱(CAS号: 87-67-2)、Ace (D1513003) (上海阿拉丁生物科技股份有限公司), 生理盐水(石家庄四药有限公司), 醋酸(国药集团化学试剂有限公司), 酶标仪(美国Molecular Devices公司, FlexStation 3), 离心机(美国SCLLOGEX公司, D3024R), 天平(天津市天马仪器厂), 生化培养箱(上海一恒科学仪器有限公司), 肿瘤坏死因子α (TNF-α)、白细胞介素6 (IL-6)、前列腺素E2 (PGE2)和NF-κB ELISA试剂盒(普利莱基因技术有限公司)。
小鼠疼痛模型的建立本实验采用0.6%醋酸溶液, 腹腔注射, 每20 g注射0.4 mL, 计数20 min内扭体次数, 作为疼痛评价指标, 以此建立模型进行实验。
实验分组随机分组, ① 对照组(control组):经腹腔给予等体积生理盐水预处理后造模并计数扭体次数; ② 单用Cho组:设5个浓度梯度, 每组10只, 分别经腹腔给予6、12、24、48和96 mg·kg-1 Cho预处理30 min后并计数扭体次数; ③ 单用Ace组:设5个浓度梯度, 每组10只, 分别经腹腔给予6.25、12.5、25、50和100 mg·kg-1 Ace预处理20 min后并计数扭体次数; ④ 合用组:设4个浓度梯度, 每组10只, 分别经腹腔给予两药各自ED50的1/2、1/4、1/8、1/16合用, 预处理后并计数扭体次数。
小鼠血清中TNF-α、IL-6、PGE2和NF-κB含量的检测将40只小鼠随机分为4组, 即control组、Cho组、Ace组和联合用药组(Cho+Ace组), 每组10只, 造模后取血, 3 000 r·min-1离心10 min, 取上清液保存。按ELISA试剂盒说明加入各反应液, 酶标仪读取450 nm波长OD值, 计算可得小鼠血清中TNF-α、IL-6、PGE2和NF-κB含量。
数据处理实验数据处理采用SPSS 17.0软件, 结果以均数±标准差表示, 组间比较采用单因素方差分析, 药物ED50的计算采用OriginPro8.5软件, P < 0.05则具有统计学意义。
结果 1 不同剂量Cho对小鼠扭体次数的影响分别给予小鼠不同剂量Cho预处理后, 计数扭体次数并计算抑制率。表 1结果显示, Cho各剂量组小鼠扭体次数均显著低于对照组(P < 0.01), 且在6~96 mg·kg-1内, 随着Cho剂量增加, 扭体次数减少, 抑制率升高。采用OrginPro8.5软件求得Cho ED50为19.47 mg·kg-1, 95%可信限为18.19~20.75 mg·kg-1。
| Table 1 Effects of choline (Cho) on the writhing times in acetic acid writhing model. n = 10, x±s. **P < 0.01 vs control group |
分别给予小鼠不同剂量Ace预处理后, 观察小鼠扭体次数。表 2结果显示, Ace各剂量组小鼠扭体次数均显著低于对照组(P < 0.01), 且在6.25~100 mg·kg-1内, 随着Ace剂量增加, 扭体次数减少, 抑制率升高。采用OrginPro8.5软件分析求得Ace ED50为20.56 mg·kg-1, 95%可信限为18.72~22.40 mg·kg-1。
| Table 2 Effects of acetaminophen (Ace) on the writhing times in acetic acid writhing model. n = 10, x±s. **P < 0.01 vs control group |
分别给予小鼠不同剂量Cho和Ace合用预处理后, 观察小鼠扭体次数。表 3结果显示, Cho和Ace合用各剂量组小鼠扭体次数均显著低于对照组(P < 0.01), 且在1/16~1/2 (Cho+Ace)剂量范围内, 随着合用药物剂量增加, 扭体次数减少, 抑制率升高。采用OrginPro8.5软件分析求得两药合用ED50为Cho 2.94 (2.75~3.13) mg·kg-1 + Ace 3.15 (2.91~3.39) mg·kg-1。
| Table 3 Effects of Cho combined with Ace on the writhing times in acetic acid writhing model. n = 10, x±s. **P < 0.01 vs control group |
等辐射分析法是一种简单、精确的用于分析药物之间相互作用的方法。在图 1的等辐射图中, 坐标轴上A、C分别是Ace和Cho单用时的ED50, 虚线为其95%可信限, A、C两点相连即为相加线, B点为两药合用的ED50。根据合用的ED50所在位置判断两药相互作用, 如其落在相加线的左侧, 则两药为协同作用; 如其落在相加线右侧, 则两药为拮抗作用; 如其落在相加线上, 则为相加作用。由于B点落在相加线95%可信限左侧(P < 0.05), 因此, 可以判定两药具有协同镇痛效果。
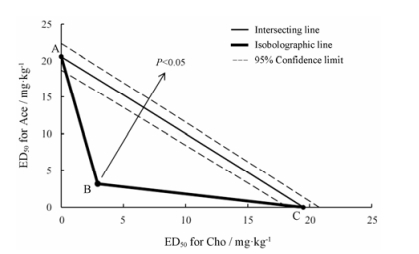
|
Figure 1 Isobolograms for the interaction of Cho and Ace |
分别给予小鼠Cho、Ace和其联合应用预处理后, 检测小鼠血清中TNF-α、IL-6、PGE2和NF-κB含量。图 2结果显示, Cho组、Ace组和Cho+Ace组TNF-α、IL-6、PGE2和NF-κB含量均较control组明显降低, 差异具有统计学意义(P < 0.05), 而与Cho组和Ace组相比, Cho+Ace组TNF-α、IL-6、PGE2和NF-κB含量均进一步降低, 且差异具有统计学意义(P < 0.05)。
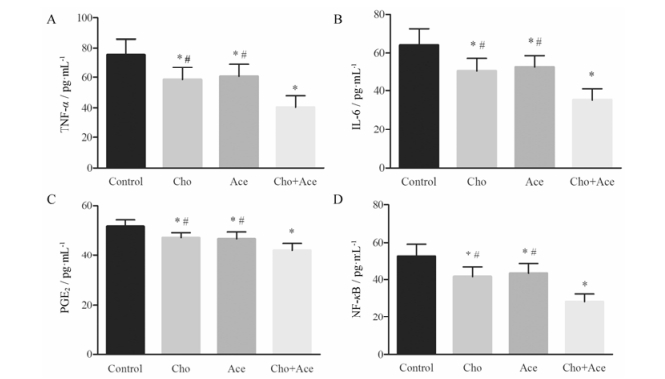
|
Figure 2 Effects of Cho, Ace and their combination on the content of TNF-α, IL-6, PGE2 and NF-κB. n = 10, x±s. *P < 0.05 vs control group; #P < 0.05 vsCho+Ace group |
疼痛是组织损伤或与潜在的组织损伤相关的一种不愉快的躯体主观感觉和情感体验[8]。术后疼痛会对患者产生十分不利的影响, 包括呼吸系统、心血管系统症状以及焦虑、睡眠不良等精神影响, 而有效的镇痛能够缓解术后疼痛, 提高舒适度, 还能防治疼痛的相关并发症, 加快术后康复。Ace是经典的用于退热和止痛的非甾体抗炎类药物, 常用于轻、中度疼痛的缓解[9]。本研究中, 在6.25~100 mg·kg-1内, 随着Ace剂量增加, 扭体次数减少, 抑制率升高, 这证实了Ace具有显著的镇痛作用。Cho是α7受体的特异性激动剂[10], 近年有研究[11, 12]报道Cho在多种疼痛模型上具有镇痛作用。本研究中, 在6~96 mg·kg-1内, 随着Cho剂量增加, 扭体次数减少, 抑制率升高, 进一步证实了Cho的镇痛作用。
Ace在各种不同类型成药中均有存在, 在使用中极有可能服用过量[13], 导致胃肠道和肝肾等不良反应[14]。寻找一种具有不同作用机制的抗炎药物与Ace合用可以增强抗炎镇痛疗效, 降低镇痛药物用量, 从而减少不良反应发生[15, 16]。Cho是机体必需的营养物质之一, 是细胞卵磷脂和鞘磷脂的重要组成部分, 口服安全无毒, 同时为天然的α7受体特异性激动剂, 是一个非常具有发展前景的镇痛药物[5]。本研究中, 在一定剂量范围内, 随着Cho和Ace合用剂量增加, 扭体次数减少, 抑制率升高。采用等辐射分析法结果显示, 两药合用的ED50所在点显著低于两药单用ED50拟合的理论点, 且其差异具有统计学意义, 因此可以判定两药具有协同镇痛作用。等辐射分析法是一种用于分析药物之间相互作用的方法, 能对两种或多种药物间的相互作用进行定性、定量分析。Tverskoy等[17]首次使用该方法来研究作用于人体的药物相互作用。近年来, 大量基础和临床研究[18, 19]采用该方法评价药物间的相互作用, 等辐射分析法已成为评价药物相互作用的“黄金标准”。Pan等[20]研究表明, Cho和低剂量阿司匹林具有协同抗炎作用, α7受体参与了二者的协同效应。Ramachandran等[21]研究发现, 醋氯芬酸和Ace合用能通过中枢和外周途径抑制前列腺素释放, 具有协同抗炎镇痛效果。本研究在醋酸扭体模型上证实了Cho和Ace具有协同镇痛作用, 能够增强镇痛效果, 降低药物用量, 为其临床应用提供了理论依据。
大量研究[22, 23]提出Cho的抗炎镇痛作用与胆碱能抗炎通路有关, 胆碱能抗炎通路是近年来发现的一种神经免疫调节机制, 通过释放的乙酰胆碱与巨噬细胞等免疫细胞上表达的α7nAChR结合, 抑制IKK的活性, 阻止IκB磷酸化, 从而抑制免疫细胞合成和释放肿瘤坏死因子、白介素等促炎细胞因子, 起到抗炎镇痛的作用[24]。IL-6和TNF-α是介导急性期炎症反应最重要的细胞因子。IL-6在炎症反应过程中属于次级因子, 可由TNF-α诱导产生并进而增强TNF-α的致炎作用, 最终催化和放大炎症反应[25]。在本研究中, Cho组和Ace组血清TNF-α和IL-6含量均较control组明显降低, 而与Cho组和Ace组相比, Cho+Ace组血清TNF-α和IL-6含量进一步降低, 这也与上述研究结论相互印证。PGE2作为前列腺素的一种, 是花生四烯酸环氧合酶代谢产物, 是一种重要的炎症介质, 可引起炎症反应[26]。Ace同时通过中枢和外周途径抑制体内前列腺素合成酶, 减少组织损伤或炎症时致痛物质前列腺素的产生和释放[27], 从而发挥抗炎镇痛作用。本研究也证实了以上结果, 与control组相比, Cho组和Ace组PGE2含量明显降低, 而Cho+Ace组血清PGE2含量显著低于Cho组和Ace组。有研究[28]指出早期炎症因子, 如TNF-α、IL-1β和IL-6等均可影响PGE2含量, 分析本研究中PGE2含量的降低可能与炎症介质TNF-α、IL-6含量降低有关。
NF-κB是一个转录因子蛋白家族, 当细胞受细胞外信号刺激后, IKK活化将IκB磷酸化, 使NF-κB暴露核定位位点, 游离的NF-κB迅速移位到细胞核, 与特异性κB序列结合, 诱导相关基因转录[29]。有研究[30]表明, TNF-α和IL-1刺激炎性致痛物质PGE2生成增多主要是通过NF-κB基因的激活介导的。NF-κB对PGE2和缓激肽这两种重要的炎性致痛物质均有上调的效应, 且三者均可激活敏化伤害性感受器, 降低痛阈。近年还发现, Ace可通过影响NF-κB的活性抑制IL-1诱导的IκB降解和NF-κB的转移[31, 32]。本研究结果发现, Cho组和Ace组血清NF-κB含量降低, 而与Cho组和Ace组相比, Cho+Ace组血清NF-κB含量进一步降低。因此, 在小鼠醋酸扭体疼痛模型中, Cho和Ace可能通过抑制NF-κB的合成转录进而减少炎症介质和经典疼痛介质的释放, 减轻疼痛, 这也与上述研究结论相符。
综上所述, Cho和Ace联合应用对急性炎性疼痛具有协同镇痛作用, 且联合应用时可减少单一药物的用量。Cho可通过激活NF-κB抑制多种促炎细胞因子的释放, 而Ace也可影响NF-κB的活性, 推测二者协同镇痛作用机制可能与抑制NF-κB信号通路的激活有关, 但其更全面的作用机制还有待进一步研究。
| [1] | Hochberg U, Elgueta MF, Perez J. Interventional analgesic management of lung cancer pain[J]. Front Oncol, 2017, 7: 17. |
| [2] | Watts R, Thiruvenkatarajan V, Calvert M, et al. The effect of perioperative esmolol on early postoperative pain:a systematic review and meta-analysis[J]. J Anaesthesiol Clin Pharmacol, 2017, 33: 28–39. DOI:10.4103/0970-9185.202182 |
| [3] | Sjoukes A, Venekamp RP, van de Pol AC, et al. Paracetamol (acetaminophen) or non-steroidal anti-inflammatory drugs, alone or combined, for pain relief in acute otitis media in children[J]. Cochrane Database Syst Rev, 2016, 12: CD011534. |
| [4] | Chan AL, Liu WT, Lin SJ, et al. Interaction between traditional Chinese medicine and Western medicine in rats-In-Chen-How and acetaminophen[J]. Acta Pharm Sin (药学学报), 2007, 42: 342–346. |
| [5] | Safronova VG, Vulfius CA, Shelukhina Ⅳ, et al. Nicotinic receptor involvement in regulation of functions of mouse neutrophils from inflammatory site[J]. Immunobiology, 2016, 221: 761–772. DOI:10.1016/j.imbio.2016.01.016 |
| [6] | McMillan DM, Tyndale RF. Nicotine increases codeine analgesia through the induction of brain CYP2D and central activation of codeine to morphine[J]. Neuropsychopharmacology, 2015, 40: 1804–1812. DOI:10.1038/npp.2015.32 |
| [7] | Yamamoto A, Kiguchi N, Kobayashi Y, et al. Pharmacological relationship between nicotinic and opioid systems in analgesia and corticosterone elevation[J]. Life Sci, 2011, 89: 956–961. DOI:10.1016/j.lfs.2011.10.004 |
| [8] | Wolkerstorfer A, Handler N, Buschmann H. New approaches to treating pain[J]. Bioorg Med Chem Lett, 2016, 26: 1103–1119. DOI:10.1016/j.bmcl.2015.12.103 |
| [9] | Singla A, Sloan P. Pharmacokinetic evaluation of hydrocodone/acetaminophen for pain management[J]. J Opioid Manag, 2013, 9: 71–80. DOI:10.5055/jom |
| [10] | Uteshev VV. The therapeutic promise of positive allosteric modulation of nicotinic receptors[J]. Eur J Pharmacol, 2014, 727: 181–185. DOI:10.1016/j.ejphar.2014.01.072 |
| [11] | Rowley TJ, Mc Kinstry A, Greenidge E, et al. Antinociceptive and anti-inflammatory effects of choline in a mouse model of postoperative pain[J]. Br J Anaesth, 2010, 105: 201–207. DOI:10.1093/bja/aeq113 |
| [12] | Wang Y, Su DM, Wang RH, et al. Antinociceptive effects of choline against acute and inflammatory pain[J]. Neuroscience, 2005, 132: 49–56. DOI:10.1016/j.neuroscience.2004.12.026 |
| [13] | Wise J. True risks of paracetamol may be underestimated, say researchers[J]. BMJ, 2015, 350: h1186. DOI:10.1136/bmj.h1186 |
| [14] | Wiliński J, Lechowicz M, Kameczura T, et al. Non-steroidal anti-inflammatory drugs and paracetamol in self-therapy of various disorders in students of different fields of study[J]. Folia Med Cracov, 2015, 55: 49–59. |
| [15] | Ali MA, Siddiqui S. To compare methods used in our operating room for alleviating tourniquet pain[J]. J Pak Med Assoc, 2013, 63: 432–435. |
| [16] | Kraglund F. Acetaminophen plus a nonsteroidal antiinflammatory drug decreases acute postoperative pain more than either drug alone[J]. J Am Dent Assoc, 2014, 145: 966–968. DOI:10.14219/jada.2014.39 |
| [17] | Tverskoy M, Fleyshman G, Bradley EL Jr, et al. Midazolamthiopental anesthetic interactions in patients[J]. Aneth Analg, 1988, 67: 342–345. |
| [18] | Ningappa MB, Dinesha R, Srinivas L. Antioxidant and free radical scavenging activities of polyphenol-enriched curry leaf (Murraya koenigii L.) extracts[J]. Food Chem, 2008, 106: 720–728. DOI:10.1016/j.foodchem.2007.06.057 |
| [19] | Jiang HW, Li HY, Yu CW, et al. The evaluation of antioxidant interactions among 4 common vegetables using isosbolographic analysis[J]. J Food Sci, 2015, 80: 1162–1169. DOI:10.1111/1750-3841.12896 |
| [20] | Pan ZY, Wang H. Synergistic interaction between choline and aspirin against acute inflammation induced by carrageenan and lipopolysaccharide[J]. Int Immunopharmacol, 2014, 20: 229–237. DOI:10.1016/j.intimp.2014.03.004 |
| [21] | Ramachandran A, Khan SI, Mohanavelu D, et al. The efficacy of preoperative oral medication of paracetamol, ibuprofen, and aceclofenac on the success of maxillary infiltration anesthesia in patients with irreversible pulpitis:a double-blind, randomized controlled clinical trial[J]. J Conserv Dent, 2012, 5: 310–314. |
| [22] | Ueno K, Kiguchi N, Kobayashi Y, et al. Possible involvement of endogenous opioid system located downstream of α7 nicotinic acetylcholine receptor in mice with physical dependence on nicotine[J]. J Pharmacol Sci, 2014, 124: 47–53. DOI:10.1254/jphs.13172FP |
| [23] | Ren C, Tong YL, Li JC, et al. The protective effect of α7 nicotinic acetylcholine receptor activation on critical illness and its mechanism[J]. Int J Biol Sci, 2017, 13: 46–56. DOI:10.7150/ijbs.16404 |
| [24] | Su X, Feng X, Terrando N, et al. Dysfunction of inflammationresolving pathways is associated with exaggerated postoperative cognitive decline in a rat model of the metabolic syndrome[J]. Mol Med, 2013, 18: 1481–1490. |
| [25] | Kalenka A, Feldmann RE Jr, Otero K, et al. Changes in the serum proteome of patients with sepsis and septic shock[J]. Anesth Analg, 2006, 103: 1522–1526. DOI:10.1213/01.ane.0000242533.59457.70 |
| [26] | Shetty N, Patil AK, Ganeshkar SV, et al. Comparison of the effects of ibuprofen and acetaminophen on PGE2 levels in the GCF during orthodontic tooth movement:a human study[J]. Prog Orthod, 2013, 14: 6. DOI:10.1186/2196-1042-14-6 |
| [27] | Lee YS, Kim H, Brahim JS, et al. Acetaminophen selectively suppresses peripheral prostaglandin E2 release and increases COX-2 gene expression in a clinical model of acute inflammation[J]. Pain, 2007, 129: 279–286. DOI:10.1016/j.pain.2006.10.020 |
| [28] | Fan TT, Feng XY, Yang YZ, et al. Downregulation of PI3K-γ in a mouse model of sepsis-induced myocardial dysfunction[J]. Cytokine, 2017, 96: 208–216. DOI:10.1016/j.cyto.2017.04.018 |
| [29] | Beutler B. Inferences, questions and possibilities in Toll-like receptor signaling[J]. Nature, 2004, 430: 257–263. DOI:10.1038/nature02761 |
| [30] | Perkins ND. Post-translational modifications regulating the activity and function of the nuclear factor κB pathway[J]. Oncogene, 2006, 25: 6717–6730. DOI:10.1038/sj.onc.1209937 |
| [31] | Pini LA, Vitale G, Ottani A, et al. Naloxone-reversible antinociception by paracetamol in the rat[J]. J Pharmacol Exp Ther, 1997, 280: 934–940. |
| [32] | Mancini F, Landolfi C, Muzio M, et al. Acetaminophen down-regulates interleukin-1β-induced nuclear factor-κB nuclear translocation in a human astrocytic cell line[J]. Neurosci Let, 2003, 353: 79–82. DOI:10.1016/j.neulet.2003.08.074 |
 2017, Vol. 52
2017, Vol. 52


