缺血性脑卒中(ischemic stroke, IS)是临床最常见的脑血管疾病之一[1, 2], 也是中老年人致死的第二大病因。IS的病理损伤机制极为复杂, 涉及多个环节, 其中, IS后的神经炎症级联反应更是使缺血后脑损伤程度远超过缺血本身, 因此, 减轻神经炎症损伤被认为是IS治疗的有效策略[3]。小胶质细胞作为脑内常驻的免疫细胞, 在IS发生后快速活化, 通过其表型的变化, 发挥促炎和抗炎的双刃剑作用[4, 5]。正常情况下, 小胶质细胞的主要功能为清除死亡的神经细胞, 恢复神经功能, 在缺血性卒中的病理过程中, 缺血可诱导小胶质细胞活化, 并产生表型的变化, 活化小胶质细胞具有M1型和M2型两种表型变化, M1型即为经典活化型, 由干扰素γ (interferon-γ, IFN-γ)或脂多糖(lipopoiysaccharides, LPS)等诱导, 可分泌一氧化氮(NO)、白介素(IL)-1β、IL-6和肿瘤坏死因子-α (TNF-α)等促炎因子, 损伤神经细胞、破坏血脑屏障并影响神经再生, 被认为是脑内炎症反应的主要发动和参与者; M2型即选择性活化型, 由IL-4或IL-13等诱导, 可分泌抗炎因子如IL-10和转化生长因子-β (TGF-β)等, 发挥抑制免疫炎症反应和促进组织修复等作用[6]。实验研究表明, 调控IS后小胶质细胞的表型变化, 抑制小胶质细胞向促炎的M1型活化和诱导促炎的M1型小胶质细胞向抗炎的M2转化均有助于减轻IS后的炎症反应从而减轻神经元的损伤[7, 8]。
米诺环素(minocycline hydrochloride, MINO)是二代半合成四环素类广谱抗菌药物, 具有较强的抗菌作用, 近年来不断有研究证实其在IS等疾病中具有重要的神经保护作用[9], 可特异性抑制脑内小胶质细胞的活化[10, 11]。
本研究从活化小胶质细胞M1/M2表型极化的角度, 对米诺环素的作用进行了研究, 并探讨其作用环节。
材料与方法 药物与试剂盐酸米诺环素(批号: WXBB4793V)、LPS (批号: 025M4040V)购自美国Sigma公司; RPMI medium 1640、胎牛血清、青链霉素双抗、0.25% trypsin-EDTA, 均购自美国Gibco公司; 一氧化氮一步法测试盒、小鼠IL-1β、TNF-α、IL-6、PGE2、TGF-β和IL-10 ELISA试剂盒, 均购自南京建成生物工程研究所; CD16/32、CD206、NF-κB p65抗体, 均购自Abcam公司; PE rat anti-mouse IgG1, 购自美国BD Biosciences公司; p-NF-κB p65、p38 MAPK、p-p38 MAPK、JNK、p-JNK、ERK、p-ERK抗体, 均购自美国Cell Signaling公司; beta tubulin、beta actin、GAPDH抗体, 均购自Proteintech公司。
细胞BV-2小鼠小胶质细胞株, 购自中国科学院典型培养物保藏中心昆明细胞库, 编号: KCB200770YJ。细胞培养于10%胎牛血清的RPMI medium 1640培养液中, 于37 ℃、5% CO2细胞培养箱中培养, 细胞单层生长达到80%左右时进行传代。
仪器酶标仪(Infinite M200 PRO), 瑞士Tecan公司; CO2细胞培养箱, 美国Thermo Scientific公司; 生物安全柜(BSC-1300Ⅱ A2), 苏州安泰空气技术有限公司; 倒置相差显微镜(Ti-S), 日本尼康。
MTS法取对数生长期的BV-2小胶质细胞制成细胞悬液, 接种于96孔培养板(每毫升0.5×104个), 每孔180 μL。48 h后加入不同浓度的含药且不含血清的培养基, 实验细胞设为空白组(只加培养基, 不加细胞)、正常组(正常培养细胞)、米诺环素组(浓度分别为0.001、0.01、0.1、1、10和100 μmol·L-1), 每组设置6个复孔, 将96孔培养板放入37 ℃、5% CO2条件下培养24 h, 每孔中加入MTS (3-(4, 5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium)溶液至终质量浓度317 μg·mL-1, 放入培养箱孵育2 h后, 选择490 nm波长, 在酶标仪上测定各孔吸光度(OD)值, 计算细胞相对存活率, 公式如下:
| $ \begin{array}{l} \;\;\;\;\;\;{\rm{细胞存活率}}\left( {\rm{\% }} \right){\rm{ = }}\left( {{\rm{O}}{{\rm{D}}_{{\rm{实验组}}}}-{\rm{O}}{{\rm{D}}_{{\rm{空白组}}}}} \right){\rm{/}}\left( {{\rm{O}}{{\rm{D}}_{{\rm{正常组}}}}} \right.-\\ \left. {{\rm{O}}{{\rm{D}}_{{\rm{空白组}}}}} \right) \times 100\% \end{array} $ |
取对数生长期的BV-2小胶质细胞制成细胞悬液, 接种于6孔培养板(每毫升1×104个), 每孔1.8 mL。48 h后加入不同浓度的米诺环素(0.1、1和10 μmol·L-1), 正常对照组和模型组给予不含血清的培养基, 继续培养24 h, 给药组和模型组加入终质量浓度为1 μg·mL-1 LPS刺激24 h, 收集细胞上清液, 一氧化氮一步法试剂盒检测细胞上清液中NO的含量, ELISA试剂盒检测细胞上清液中TNF-α、IL-1β、IL-6、PGE2、IL-10和TGF-β含量。
流式细胞法细胞培养、给药、造模方法同“ELISA法”, 给药组增设了IL-4组(10 ng·mL-1), 造模后, 收集细胞, 1 500 r·min-1离心5 min, 冷PBA离心洗涤, 计数, 流式检测的各组细胞浓度调整为每毫升1×106个。采用细胞表面直接免疫荧光染色方法, 加入用PBA稀释的荧光素标记CD16/32于4 ℃孵育1 h, PBS洗涤1次, 将细胞重新悬浮于500 μL PBS中, 混匀, 置流式管中, 4 ℃避光保存, 用流式细胞仪检测细胞膜蛋白CD16/32的表达。采用细胞表面间接免疫荧光染色方法, 加入用PBA稀释的CD206于4 ℃孵育2 h, PBS洗涤1次。加PBA稀释的荧光素标记的二抗4 ℃孵育30 min, PBS洗涤1次, 将细胞重新悬浮于500 μL PBS中, 混匀, 置流式管中, 4 ℃避光保存, 用流式细胞仪检测细胞膜蛋白CD206的表达。
Western blot法细胞培养、给药、造模方法同“ELISA法”, 米诺环素的给药浓度为0.01 μmol·L-1, 造模后, 吸去上清液, 每孔以冷PBS洗1次, 每孔加裂解液100 μL冰上裂解10 min, 收集细胞裂解液14 000 r·min-1离心5 min, 取上清测蛋白浓度, 每13 μL蛋白样品加入4倍上样缓冲液5 μL和DTT 2 μL, 密封煮沸10 min, 分装, -80 ℃保存。每30 μg蛋白样品用SDS-PAGE分离胶(p-NF-κB p65和NF-κB p65蛋白用8%分离胶, 其余蛋白均用10%分离胶)电泳, 20 V半干转膜30 min, 5%脱脂牛奶封闭1 h, 一抗封闭4 ℃过夜, TBST洗4次, 二抗封闭室温1 h, TBST洗4次, 加ECL显色液显色, 用Quantity One处理条带得到灰度值。
统计学方法数据均以x±s表示, 组间比较采用单因素方差分析法处理, 方差齐者采用LSD法检验, 方差不齐者采用Tamhane’s法检验, P < 0.05有统计学意义。
2 结果 1 米诺环素对BV-2小胶质细胞增殖作用的影响米诺环素在0.001~10 μmol·L-1内干预BV-2小胶质细胞24 h对BV-2小胶质细胞增殖无明显影响, 超过100 μmol·L-1浓度时对BV-2小胶质细胞增殖有一定的抑制作用(P < 0.01)。结果见表 1。
| Table 1 Effect on the survival rate of BV-2 cells by minocycline (MINO). n = 6, x±s. △△P < 0.01 vs control group |
LPS刺激后, BV-2小胶质细胞异常活化, 产生大量炎症因子, 模型组NO、TNF-α、IL-1β、IL-6和PGE2的含量均比正常组明显升高(P < 0.05, P < 0.01);给予米诺环素干预后, 可显著降低炎症因子NO、TNF-α、IL-6和PGE2的释放, 与模型组相比, 差异均有统计学意义(P < 0.01)。结果见表 2。
| Table 2 Effect of minocycline on the release of inflammatory cytokines (NO, TNF-α, IL-1β, IL-6, PGE2) from LPS-stimulated BV-2 cells. n = 3, x±s. △P < 0.05, △△P < 0.01 vs control group; **P < 0.01 vs model group. IL-6, Interleukin-6; IL-1β, Interleukin-1 beta; NO, Nitric oxide; PGE2, Prostaglandin E2; TNF-α, Tumor necrosis factor alpha |
IL-4 (10 ng·mL-1)和米诺环素(0.1、1和10 μmol·L-1)均可下调LPS致BV-2小胶质细胞活化后膜蛋白CD16/32的表达, 差异有统计学意义(P < 0.01), 详见图 1和表 3。
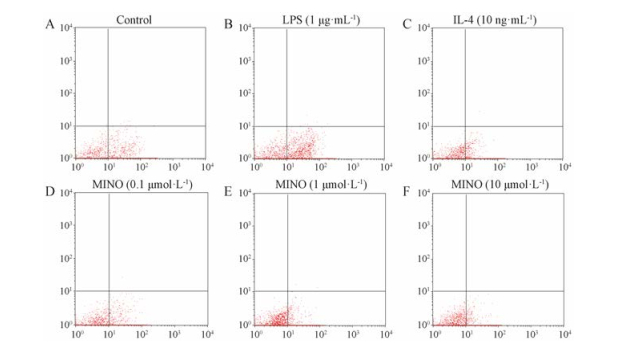
|
Figure 1 Effect of minocycline on protein expression of CD16/32 in LPS-stimulated BV-2 cells |
| Table 3 Effect of minocycline on protein expression of CD16/32 in LPS-stimulated BV-2 cells. n = 3, x±s. **P < 0.01 vs model group |
IL-4 (10 ng·mL-1)可促进正常BV-2小胶质细胞释放TGF-β和IL-10, 差异有统计学意义(P < 0.01); 0.1、1和10 μmol·L-1米诺环素均能促进正常BV-2小胶质细胞释放IL-10, 差异有统计学意义(P < 0.01); 0.1和1 μmol·L-1米诺环素均能促进正常BV-2小胶质细胞释放TGF-β, 差异有统计学意义(P < 0.05)。结果见表 4。
| Table 4 Effect of minocycline on the release of inflammatory cytokines (IL-10, TGF-β) from BV-2 cells. n = 3, x±s. △P < 0.05, △△P < 0.01 vs control group |
IL-4 (10 ng·mL-1)可促进LPS致BV-2小胶质细胞活化后释放TGF-β, 差异有统计学意义(P < 0.01);米诺环素(0.1、1和10 μmol·L-1)对LPS致BV-2小胶质细胞活化释放IL-10和TGF-β的影响, 差异无统计学意义(P > 0.05), 但有升高趋势。结果见表 5。
| Table 5 Effect of minocycline on the release of inflammatory cytokines (IL-10, TGF-β) from LPS stimulated BV-2 cells. n = 3, x±s. **P < 0.01 vs model group |
IL-4 (10 ng·mL-1)和米诺环素(0.1、1和10 μmol·L-1)均可上调LPS致BV-2小胶质细胞活化后膜蛋白CD206的表达, 差异有统计学意义(P < 0.01)。结果详见表 6和图 2。
| Table 6 Effect of minocycline on protein expression of CD206 in LPS-stimulated BV-2 cells. n = 3, x±s. **P < 0.01 vs model group |
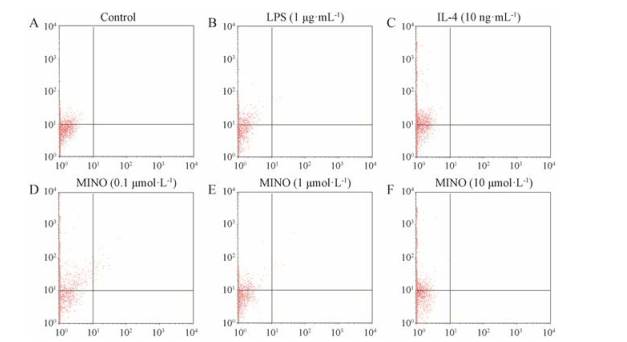
|
Figure 2 Effect of minocycline on protein expression of CD206 in LPS-stimulated BV-2 cells |
LPS刺激24 h后, MyD88蛋白表达有升高趋势, 但与正常组相比, 差异无统计学意义(P > 0.05); 0.01 μmol·L-1米诺环素能对LPS致BV-2小胶质细胞活化后MyD88蛋白表达有下调趋势, 但与模型组相比, 差异无统计学意义(P > 0.05)。结果见图 3。
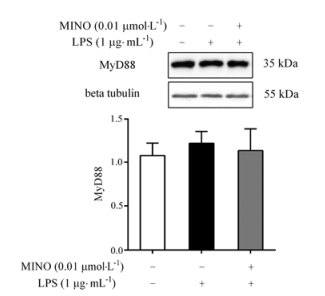
|
Figure 3 Effect of minocycline on protein expression of MyD88 in LPS-stimulated BV-2 cells. n = 6, x±s |
0.01 μmol·L-1米诺环素能下调LPS致BV-2小胶质细胞活化后蛋白p-p38 MAPK和p-NF-κB p65的表达, 差异有统计学意义(P < 0.05, P < 0.01)。结果见图 4。
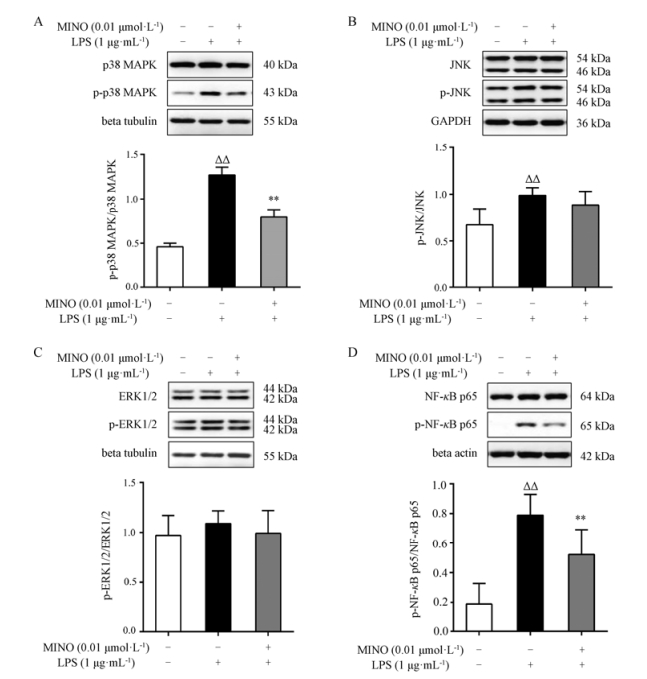
|
Figure 4 Effect of minocycline on protein expression of p-p38 MAPK, p38 MAPK (A), p-JNK, JNK (B), p-ERK1/2, ERK1/2 (C), p-NF-κB p65 and NF-κB p65 (D) in LPS-stimulated BV-2 cells. n = 6, x±s. △△P < 0.01 vs control group; **P < 0.01 vs model group |
近年来的研究表明, 炎症反应在IS的病理过程中显示了双刃剑的作用, 一方面, 持续的炎症反应增强了IS后神经元的继发性损伤; 另一方面, 其又在神经修复中发挥了潜在的推动作用[12]。因此, 调控IS后脑内的炎症反应被认为是该病治疗的有效策略之一[13]。大量研究证实, 米诺环素具有显著的减轻脑缺血后脑内神经炎症作用, 其作用与抑制脑内小胶质细胞的异常活化有关[10, 11]。本实验从活化小胶质细胞M1/M2极化的角度, 对米诺环素的作用进行了研究。采用LPS致BV-2小胶质细胞异常活化的神经炎症模型, 考察米诺环素的作用, 结果显示, 米诺环素可显著抑制M1型小胶质细胞释放炎症介质NO、TNF-α、IL-6和PGE2, 而促进正常及活化的小胶质细胞释放M2型标志物TGF-β和IL-10, 提示米诺环素可抑制小胶质细胞向M1型的极化, 而促进小胶质细胞向M2型的转化, 本实验设置的米诺环素浓度对部分小胶质细胞的细胞因子(如NO、IL-6和TGF-β)的药效缺乏剂量依赖关系, 其原因可能是药物浓度设置比例不当, 或是米诺环素对这些细胞因子的释放有特殊的影响, 其更深入的作用机制有待进一步研究。流式细胞仪检测M1型小胶质细胞膜表面标志物CD16/32和M2型小胶质细胞膜表面标志物CD206的结果也证实, 米诺环素可下调异常活化的小胶质细胞膜蛋白CD16/32的表达和上调异常活化的小胶质细胞膜蛋白CD206的表达, 提示其可抑制小胶质细胞向促炎型M1型的转化而促进其向抗炎型M2型的转化。
本研究结果与Kobayashi等[14]采用米诺环素干预小鼠原代小胶质细胞的研究结果相吻合。在本实验中, 增加了反映M1型的炎症因子IL-6、PGE2、膜蛋白CD16/32以及反映M2型的细胞因子TGF-β的考察, 进一步证实了米诺环素调节小胶质细胞M1/M2型表型变化的作用, 同时再一次证明BV-2细胞对药物的反应与原代小胶质细胞具有较高的一致性, 另外, 本研究为考察米诺环素减轻神经炎症的作用环节, 重点对LPS刺激小胶质细胞异常活化后, 米诺环素对toll样受体4介导的依赖MyD88信号转导通路的影响进行了研究。
小胶质细胞在LPS刺激时发生异常活化, 多条信号通路参与其过程, 在toll样受体4介导的依赖MyD88信号转导途径下游, MAPK信号通路和NF-κB信号通路被激活, 参与炎症因子的表达[15-18]。本研究对MAPK信号通路和NF-κB信号通路进行了研究, 结果显示, 米诺环素在设置浓度下对异常活化的小胶质细胞蛋白MyD88的表达无明显影响, 仅有下降趋势; 但米诺环素能下调异常活化的小胶质细胞蛋白p-p38 MAPK和p-NF-κB p65的表达, 提示p38 MAPK和NF-κB p65信号通路可能是米诺环素发挥减轻神经炎症作用的主要途径, 其更深入的机制有待进一步研究。
| [1] | Macrez R, Ali C, Toutirais O, et al. Stroke and the immune system:from pathophysiology to new therapeutic strategies[J]. Lancet Neurol, 2011, 10: 471–480. DOI:10.1016/S1474-4422(11)70066-7 |
| [2] | Go AS, Mozaffarian D, Roger VL, et al. Executive summary:heart disease and stroke statistics——2014 update:a report from the American Heart Association[J]. Circulation, 2014, 129: 399–410. DOI:10.1161/01.cir.0000442015.53336.12 |
| [3] | Lakhan SE, Kirchgessner A, Hofer M. Inflammatory mechanisms in ischemic stroke:therapeutic approaches[J]. J Transl Med, 2009, 7: 97. DOI:10.1186/1479-5876-7-97 |
| [4] | Kitamura Y, Yanagisawa D, Inden M, et al. Recovery of focal brain ischemia-induced behavioral dysfunction by intracerebroventricular injection of microglia[J]. J Pharmacol Sci, 2005, 97: 289–293. DOI:10.1254/jphs.SC0040129 |
| [5] | Imai F, Suzuki H, Oda J, et al. Neuroprotective effect of exogenous microglia in global brain ischemia[J]. J Cereb Blood Flow Metab, 2007, 27: 488–500. DOI:10.1038/sj.jcbfm.9600362 |
| [6] | Murray PJ, Wynn TA. Protective and pathogenic functions of macrophage subsets[J]. Nat Rev Immunol, 2011, 11: 723–737. DOI:10.1038/nri3073 |
| [7] | Pan J, Jin JL, Ge HM, et al. Malibatol A regulates microglia M1/M2 polarization in experimental stroke in a PPAR γ-dependent manner[J]. J Neuroinflammation, 2015, 12: 51. DOI:10.1186/s12974-015-0270-3 |
| [8] | Hu X, Li P, Guo Y, et al. Microglia/macrophage polarization dynamics reveal novel mechanism of injury expansion after focal cerebral ischemia[J]. Stroke, 2012, 43: 3063–3070. DOI:10.1161/STROKEAHA.112.659656 |
| [9] | Garrido-Mesa N, Zarzuelo A, Galvez J. Minocycline:far beyond an antibiotic[J]. Br J Pharmacol, 2013, 169: 337–352. DOI:10.1111/bph.12139 |
| [10] | Yrjänheikki J, Keinänen R, Pellikka M, et al. Tetracyclines inhibit microglial activation and are neuroprotective in global brain ischemia[J]. Proc Natl Acad Sci U S A, 1998, 95: 15769–15774. DOI:10.1073/pnas.95.26.15769 |
| [11] | Wang N, Mi X, Gao B, et al. Minocycline inhibits brain inflammation and attenuates spontaneous recurrent seizures following pilocarpine-induced status epilepticus[J]. Neuroscience, 2015, 287: 144–156. DOI:10.1016/j.neuroscience.2014.12.021 |
| [12] | Lee Y, Lee SR, Choi SS, et al. Therapeutically targeting neuroinflammation and microglia after acute ischemic stroke[J]. Biomed Res Int, 2014, 2014: 297241. |
| [13] | Grønberg NV, Johansen FF, Kristiansen U, et al. Leukocyte infiltration in experimental stroke[J]. J Neuroinflammation, 2013, 10: 115. |
| [14] | Kobayashi K, Imagama S, Ohgomori T, et al. Minocycline selectively inhibits M1 polarization of microglia[J]. Cell Death Dis, 2013, 4: e525. DOI:10.1038/cddis.2013.54 |
| [15] | Okun E, Griffioen KJ, Lathia JD, et al. Toll-like receptors in neurodegeneration[J]. Brain Res Rev, 2009, 59: 278–292. DOI:10.1016/j.brainresrev.2008.09.001 |
| [16] | Suzuki N, Suzuki S, Duncan GS, et al. Severe impairment of interleukin-1 and Toll-like receptor signalling in mice lacking IRAK-4[J]. Nature, 2002, 416: 750–756. DOI:10.1038/nature736 |
| [17] | Sun P, Zhang Q, Han J, et al. TLR4 signaling induced TLR2 expression in the process of mimic cerebral ischemia/reperfusion in vitro[J]. Sci China Life Sci, 2010, 53: 223–228. |
| [18] | Chang L, Karin M. Mammalian MAP kinase signaling cascades[J]. Nature, 2001, 410: 37–40. DOI:10.1038/35065000 |
 2017, Vol. 52
2017, Vol. 52


