在药物及给药系统表面修饰聚乙二醇(polyethylene glycol, PEG)是延长其在体循环时间, 增加药物生物利用度的常用方法[1]。但PEG修饰具有抑制纳米粒靶细胞摄取、妨碍pH敏感型纳米粒“核内体逃逸”(endosome escape)及重复注射后加速血液清除等缺陷, 限制了PEG的应用[2]。聚(2-乙基-2-噁唑啉) [poly (2-ethyl-2-oxazoline), PEOz]是一种具有良好生物相容性的亲水性长链聚合物, 细胞毒性低, 已被美国FDA批准作为食品添加剂使用。在酸性条件下, 其主链上的叔胺质子化而具有pH敏感性。PEOz分子链柔性好, 将其修饰于药物或载体材料表面, 可以增加后者的在体循环时间, 且能实现pH敏感递药, 是PEG潜在的替代物[3]。本文对PEOz理化性质、合成方法及在药物递送系统中的应用进行综述。
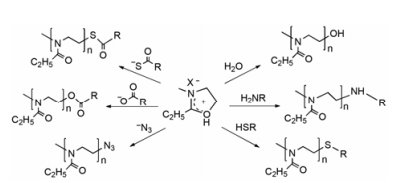
1 PEOz的物理和化学性质 1.1 PEOz的结构和合成方法2-噁唑啉类化合物可通过酰胺环化、β-氨基醇与羧酸或羧酸酯反应或以腈为原料制备[4]。其化学性质活泼, 作为单体广泛用于各种聚合物的合成。以2-乙基-2-噁唑啉为单体, 3-溴丙酸乙酯为引发剂, KOH甲醇溶液为终止剂, 进行活性阳离子开环聚合, 可以制备两端分别带羧基和羟基修饰的高分子长链聚合物PEOz, 反应机制见图 1[5]。PEOz黏度低、可溶性好, 能溶于氯仿、乙腈、乙醇、甲醇和水等多种溶剂, 具有宽溶剂选择范围。在合成过程中, 若以微波加热诱导, 与传统加热开环聚合相比, 能在不改变聚合反应机制的基础上将反应速度提升360倍, 几分钟内实现单体聚合, 极大地缩短了反应时间, 加快PEOz商业化进程[6]。采用阳离子开环聚合反应制备PEOz, 可有效控制其聚合度, 得到不同分子质量的低分散指数聚合物, 还可通过选择引发剂和终止剂, 在聚合物末端引入性质不同的官能团, 增加材料的可修饰性, 如末端引入羟基、羧基、氨基和巯基等[7], 见图 2。

|
Figure 1 Schematic of the mechanism of the living cationic ring-opening polymerization of 2-ethyl-2-oxazoline |
|
Figure 2 The terminal modification in poly(2-ethyl-2-oxazoline) (PEOz) polymerization by different initiator or terminator |
PEOz具有脂肪族侧链及类似于天然多肽的骨架结构, 有良好的生物相容性及血液相容性, 是一种安全的药物载体材料[8, 9]。在其末端偶联放射性元素18F或89Zr进行示踪, 发现分子质量小于40 kDa时其在小鼠体内主要通过肾小球消除, 随着分子质量的增加, PEOz消除速率减慢, 在体滞留时间延长[10]。将PEOz修饰纳米粒或药物, 其以刷状或蘑菇状构象存在于后者表面, 可增加后者的稳定性, 减少表面蛋白吸附, 延长在体循环时间。如Ag纳米粒表面修饰PEOz 200 kDa后其稳定性延长至2周[11]。在聚氨酯表面修饰PEOz, 蛋白(牛血清白蛋白、溶菌酶和血纤蛋白原)吸附量降低约97%[12]。
PEOz的细胞毒性依赖于聚合物浓度、分子质量及纯度等[3, 13]。与PEG类似, 低分子质量聚合物在高浓度时由于渗透压较大, 表现出更强的细胞毒性, 如60 g·L-1 PEOz 400 Da渗透压大于400 mosmol·kg-1, 其对L929小鼠成纤维细胞的细胞毒性强于80 g·L-1 PEOz 2~200 kDa[3]。聚合物中杂质含量直接影响其细胞毒性, 如成纤维细胞与5 g·L-1 PEOz 100 kDa孵育48 h, 细胞活性不受影响, 但与0.5 g·L-1 2-乙基-2-噁唑啉单体孵育48 h后细胞活性下降50%, 故需严格控制材料中杂质含量[13]。
1.3 PEOz的pH敏感性PEOz主链中独特的叔酰胺结构, 使PEOz具有接近于生理pH的pKa, 且pKa值随着聚合度的增加而降低, 因而具有可调节性。当环境pH低于pKa时, 主链叔氨基质子化, 或侧链中羰基与H+结合电子发生转移使链中N离子化, 诱导主链荷正电。电荷密度的增加使链由亲水性变为疏水性, 从而表现出pH敏感性, 如载多柔比星(doxorubicin, DOX) FA-PEOz-PCL胶束在pH 5.5介质中释药量为pH 7.4介质中的2倍[14]。PEOz修饰的碳酸甲胆甾醇(cholesteryl methyl carbonate, CHMC)脂质体在PBS 7.4中粒径约100 nm, 随着pH的下降, PEOz-CHMC脂质体粒径增加, 稳定性降低[15]。激光共聚焦显微镜显示, 在胆固醇半琥珀酸酯(cholesterol hemisuccinate, CHEMS)脂质体表面分别修饰PEOz和PEG, PEOz-CHEMS脂质体在酸性条件下, 细胞摄取量高于PEG-CHEMS脂质体, 且PEOz化脂质体的荧光信号定位于细胞核, 而PEG化脂质体多定位于溶酶体, 表明PEOz-CHEMS脂质体具有溶酶体逃逸作用[16]。
2 PEOz在药物递送系统中的应用 2.1 PEOz作为纳米递载材料PEOz作为一种具有pH敏感性的亲水性材料, 可以增加纳米递药系统在体循环时间及细胞摄取量, 实现环境敏感释药。实验中多采用2~5 kDa PEOz用于纳米粒的修饰[5, 17, 18]。在CHMC脂质体表面修饰PEOz 2 kDa, 脂质体在体循环时间延长4倍。生理条件下其以刷状排列, 当pH降低时, 链疏水性的增强使PEOz与脂质双层作用增加并吸附于脂质体表面, 导致脂质双层结构重排被破坏, 故于pH 5.0释放介质中5 min修饰组药物释放量达60%[15]。叶酸修饰的载多柔比星PEOz-二硬脂酰磷脂酰乙醇胺脂质体在pH 5.0释放介质中48 h累计释放率达90%[19]。
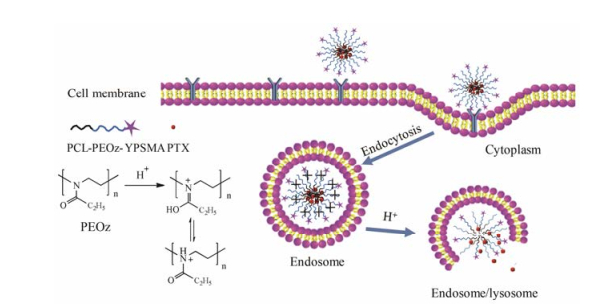
肿瘤部位因旺盛的无氧呼吸及循环受阻特性, 微环境pH一般为5.7~7.2, 溶酶体、内涵体pH更低至4.5~5.8。利用PEOz的pH敏感性及末端可修饰性强的特点, 可以实现肿瘤部位主动靶向递药, 增加细胞对纳米粒的摄取。粒径约65 nm的PEOz-hyd-DOX双酸敏感胶束接近于游离DOX的IC50值(8.58 ± 1.36 μg·mL-1), 连续给药后荷瘤小鼠肿瘤增长缓慢, 全身毒副作用降低[5]。以透析法制备的粒径约30.2 nm抗前列腺特异性膜抗原抗体(anti-prostate specific membrane antigen antibody, YPSMA)介导的载紫杉醇YPSMA-PEOz-PLA胶束, 包封率为97.1%, pKa为6.9。胶束经受体介导内吞后, 在内涵体酸性条件下, PEOz主链中的N与H+结合, 荷电PEOz链之间的排斥力使胶束结构失稳而解体, 药物快速释放, 见图 3[18]。药物的快速释放有利于增加细胞内瞬间药物浓度, 提高药物疗效, 降低耐药性的发生率。
|
Figure 3 Schematic of anti-prostate specific membrane antigen antibody modified poly(2-ethyl-2-oxazoline)-poly(D, L-lactide) (YPSMA-PEOz-PLA) polymeric micelles and pH-triggered drug release |
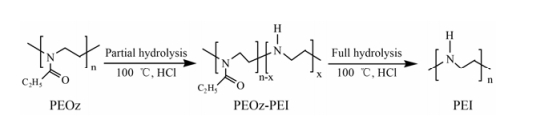
纳米凝胶是由亲水性或两亲性聚合物通过物理或化学交联形成的粒径小于200 nm的三维网状系统[20], 具有柔性结构。体外研究显示, 当外界压力接近于肾脏渗透压时, 能透过直径约为粒径1/10的小孔[21]。纳米凝胶粒径依赖于自身交联程度、环境pH值和离子强度等。PEOz在酸性条件下加热水解可以得到聚乙烯亚胺(polyethyleneimine, PEI), 如图 4所示[22]。以PEOz部分水解得到的两亲性聚合物PEOz-PEI为原料, 利用二级胺与交联剂1, 6-己二醇二缩水甘油醚化学结合, 交联得半径为78 nm的球形纳米凝胶[23]。随着水解程度的增加, 骨架中增加的二级胺原子提供了更多交联剂引入位点, 从而可以得到更为致密、粒径更小的纳米凝胶。
|
Figure 4 Schematic of the partial and full hydrolysis of PEOz |
此外, PEOz具有温度敏感性, 近年来被应用于温敏凝胶的制备。其结构中存在亲水性的酰胺基(-NHCO-)与疏水性的乙基(-CH2CH3), 当环境温度高于其最低临界溶解温度(lower critical solution temperature, LCST)时, 酰胺与氢键的相互作用被破坏, 材料中疏水作用占主导地位, 使得水溶性随着温度的升高而降低, 进而发生沉降。PEOz的LCST受聚合物分子质量、接枝的嵌段物比例、聚合物浓度及溶剂中离子种类和含量等影响[24]。相同浓度PEOz的LCST随分子质量的增加而升高, 如纯水中相同浓度的PEOz 5 kDa LCST为63 ℃, PEOz 16 kDa LCST为84 ℃。在PEOz末端引入疏水嵌段, 疏水片段间的聚集作用可使材料的LCST降低。例如, 在PEOz末端连接聚[2-(4-氨基苯基)-2-噁唑啉], 随着疏水段比例由3%上升至15%, 聚合物的LCST由64 ℃降至21 ℃[25]。PEOz-PCL-PEOz水凝胶在兔眼温度下即可以实现原位凝胶化, 且在体实验表明无毒副作用[26]。通过还原胺化反应在PEOz-PEI末端连接12%~15%碳水化合物麦芽糖时, 聚合物表现出可逆的温敏性能, 当麦芽糖比例继续增高时, 聚合物发生沉降[27]。
以动态光散射法测定聚合物浊点表征11种阴离子对PEOz溶液LCST的影响[28]。按对聚合物溶解度降低作用的大小排序如下: CO32->SO42->S2O32->H2PO4->F->Cl->Br- ≈ NO3->I->ClO4->SCN-。其中, 以Br-为界, 位于Br-之前的离子会降低聚合物的LCST, 之后的升高LCST。以1 g·L-1 PEOz 500 kDa为例, 其LCST值在纯水溶液中为61.1 ℃, 在0.2 mol·L-1 Na2CO3溶液中降至27.1 ℃, 而在0.2 mol·L-1 NaSCN中升至67.9 ℃。了解溶液中离子对LCST的影响, 有利于控制实验因素, 得到合适的相变温度。
2.3 PEOz用于递送蛋白质药物蛋白质类药物具有作用位点专一, 生物活性高和低毒等优点, 但因体内蛋白酶的存在, 易被水解失活, 导致半衰期短, 生物利用度低。以亲水性聚合物对其表面进行修饰, 能在不影响活性的同时增加在体稳定性。目前已有关于在牛血清白蛋白、过氧化氢酶、核糖核酸酶、胰岛素和胰酶等蛋白质末端偶联不同分子质量PEOz的研究。粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)是一种在酸性条件稳定、中性条件易聚集的蛋白, 以PEOz修饰G-CSF, 在PBS (pH 7.4) 下48 h G-CSF聚集率由55%降低至25%, 稳定性增加[29]。与胰岛素相比, PEOz-胰岛素降血糖作用时间由2 h提高至8 h[30]。在辣根过氧化酶末端连接聚[(2-乙基-2-噁唑啉)-嵌段-(2-丁基-2-噁唑啉)], Caco-2细胞对其摄取率提高2~3倍[31]。
分别对家兔注射以PEOz 5 kDa、PEOz 10 kDa、PEG 5 kDa和PEG 10 kDa修饰的胎牛血清蛋白(BSA), 将未修饰组BSA诱导生成的抗体量记为1, 4个修饰组生成的抗体量分别为0.180、0.034、0.110和0.016, 表明随着BSA表面PEOz或PEG分子质量的增加免疫原性屏蔽作用增强[30]。此外, 在蛋白酶末端连接PEOz, 可以改善其在有机溶剂中的溶解性, 增加在化学反应中的催化效能。如PEOz修饰的胰酶在二氯甲烷中溶解度增加至0.5 g·L-1。溶菌酶是由18个氨基酸组成的糖苷水解酶, 在有机溶剂中溶解性差, 在其表面修饰PEOz能增加在二甲基甲酰胺中溶解度约20倍, 从而增加催化活性[32]。
2.4 PEOz在基因递送中的应用基因治疗对因基因缺陷或异常引起的疾病而言, 是一种强而有力的治疗手段。裸露的基因药物细胞靶向能力差, 转染效率低, 且易被核酶降解, 需采用合适载体对其进行递送。PEI是一种具有高转染效率的阳离子型载体, 能有效递送基因, 但细胞毒性大, 以亲水聚合物对其进行修饰可以降低毒性。利用PEOz在高温、酸性条件下水解生成PEI的性质, 以PEOz部分水解产物PEOz-PEI嵌段共聚物递送基因, 既能保持材料高转染效率, 又能降低PEI的细胞毒性。例如以3种不同水解程度(30%、70%和96%)的PEOz-PEI递送siRNA, 随着水解程度的增加, 转染效率增高。分别将1 g·L-1不同水解程度的空白材料与HeLa细胞孵育24 h, PEOz-PEI 96%组细胞存活率低于20%, 而PEOz-PEI 30%组与PEOz-PEI 70%组几乎无细胞毒性, 表明70%的水解度比较适于递送基因[33]。PEOz的水解程度由水解温度、HCl的摩尔浓度和反应时间控制, 其他条件一定时, 在180 ℃水解速率最快[34]。
为进一步增加材料的环境响应性, 制备核壳结构的、具有pH敏感性及生物还原性的PEOz-PLA-g-PEI-SS胶束, 以其共递送mc-DNA及DOX, 给药20天后胶束组荷黑色素瘤小鼠的肿瘤体积约为对照组的1/2, 荧光素酶的表达也明显降低[35]。采用亲水性片段PEOz、温敏性片段聚(2-丙基-2-噁唑啉)和阳离子片段聚赖氨酸共组成的ABC型嵌段共聚物制备复合胶束, 当温度高于材料的LCST (25 ℃)时温敏片段收缩, 胶束与细胞接触增加, 以其递送pDNA, 细胞摄取量提高约40倍[36]。
2.5 PEOz在跨黏膜屏障中的应用PEOz在胃肠消化酶作用下不发生水解, 这为其用于跨黏膜屏障提供了保障。以巯基化二氧化硅(SiO2)纳米粒为模型, 在其表面分别修饰分子质量均为5 000的PEOz和PEG, 结果显示两者均可增加纳米粒跨胃黏膜能力, 但因相同分子质量的PEOz链长更短, 修饰得到的纳米粒的粒径更小, PEOz组在黏膜中扩散系数约为PEG组的1.5倍[37]。进一步考察PEOz侧链性质对跨黏膜屏障的影响, 探讨聚(2-甲基-2-噁唑啉)、聚(2-乙基-2-噁唑啉)和聚(2-丙基-2-噁唑啉)修饰的硅纳米粒跨黏膜能力, 发现侧链亚甲基数目的增加会导致扩散系数及渗透力的降低, 表明材料的亲水性是影响跨黏膜能力的重要原因[38]。
3 结语PEOz作为一种有潜力的PEG替代物, 具有类似PEG的亲水性和柔顺性。其合成简单可控, 结构易功能化, 不妨碍细胞摄取, 且具有pH敏感性, 能实现核内体逃逸。近年来, 它不仅广泛应用于药物递载系统, 也被作为电泳基质用于蛋白质的分离, 或结合其他聚合物制备成心脏支架模拟体内组织, 探讨相容性。但将PEOz应用于临床依旧面临一系列挑战, 首先需要提高生产标准, 优化工艺, 进一步探讨其在体内药代动力学及药理学特征, 以获得FDA批准的医药级PEOz。在实际应用中, 针对PEOz的疏水性随着分子质量的增加而增强的特性, 需有效选择合适的分子质量及进一步探讨烷基侧链对材料细胞摄取的影响。随着研究的深入, PEOz为载体材料提供了一个新的选择。
| [1] | Sun L, Wu QJ, Peng F, et al. Strategies of polymeric nanoparticles for enhanced internalization in cancer therapy[J]. Colloids Surf B Biointerfaces, 2015, 135: 56–72. DOI:10.1016/j.colsurfb.2015.07.013 |
| [2] | Zhang D, Xu H, Hu MN, et al. "PEG dilemma" for liposomes and its solving approaches[J]. Acta Pharm Sin (药学学报), 2015, 50: 252–260. |
| [3] | Bauer M, Lautenschlaeger C, Kempe K, et al. Poly(2-ethyl-2-oxazoline) as alternative for the stealth polymer poly(ethylene glycol):comparison of in vitro cytotoxicity and hemocompatibility[J]. Macromol Biosci, 2012, 12: 986–998. DOI:10.1002/mabi.201200017 |
| [4] | Luxenhofer R, Han Y, Schulz A, et al. Poly(2-oxazoline)s as polymer therapeutics[J]. Macromol Rapid Commun, 2012, 33: 1613–1631. DOI:10.1002/marc.201200354 |
| [5] | Li JW, Zhou YX, Li CW, et al. Poly(2-ethyl-2-oxazoline)-doxorubicin conjugate-based dual endosomal pH-sensitive micelles with enhanced antitumor efficacy[J]. Bioconjugate Chem, 2015, 26: 110–119. DOI:10.1021/bc5004718 |
| [6] | Luef KP, Hoogenboom R, Schubert US, et al. Microwaveassisted cationic ring-opening polymerization of 2-oxazolines[J]. Adv Polym Sci, 2015, 10: 183–208. |
| [7] | Rossegger E, Schenk V, Wiesbrock F. Design strategies for functionalized poly(2-oxazoline)s and derived materials[J]. Polymers, 2013, 5: 956–1011. DOI:10.3390/polym5030956 |
| [8] | Koshkina O, Westmeier D, Lang T, et al. Tuning the surface of nanoparticles:impact of poly(2-ethyl-2-oxazoline) on protein adsorption in serum and cellular uptake[J]. Macromol Biosci, 2016, 16: 1287–1300. DOI:10.1002/mabi.201600074 |
| [9] | Schlaad H, Diehl C, Gress A, et al. Poly(2-oxazoline)s as smart boinspired polymers[J]. Macromol Rapid Commun, 2010, 31: 511–525. DOI:10.1002/marc.v31:6 |
| [10] | Glassner M, Palmieri L, Monnery BD, et al. The label matters:μPET imaging of the biodistribution of low molar mass 89Zr and 18F-labeled poly(2-ethyl-2-oxazoline[J]. Biomacromolecules, 2017, 18: 96–102. DOI:10.1021/acs.biomac.6b01392 |
| [11] | Hendessi S, Güner PT, Miko A, et al. Hydrogen bonded multilayers of poly(2-ethyl-2-oxazoline) stabilized silver nanoparticles and tannic acid[J]. Eur Polym J, 2016, 88: 666–678. |
| [12] | Yang J, Li L, Ma C, et al. Degradable polyurethane with poly(2-ethyl-2-oxazoline) brushes for protein resistance[J]. RSC Adv, 2016, 6: 69930–69938. DOI:10.1039/C6RA13663J |
| [13] | Kronek J, Kroneková Z, Lustoň J, et al. In vitro bioimmunological and cytotoxicity studies of poly(2-oxazolines)[J]. J Mater Sci Mater Med, 2011, 22: 1725–1734. |
| [14] | Qiu L, Yan L, Zhang L, et al. Folate-modified poly(2-ethyl-2-oxazoline) as hydrophilic corona in polymeric micelles for enhanced intracellular doxorubicin delivery[J]. Int J Pharmaceut, 2013, 456: 315–324. DOI:10.1016/j.ijpharm.2013.08.071 |
| [15] | Xu H, Zhang W, Li Y, et al. The bifunctional liposomes constructed by poly(2-ethyl-oxazoline)-cholesteryl methyl carbonate:an effectual approach to enhance liposomal circulation time, pH-sensitivity and endosomal escape[J]. Pharm Res, 2014, 31: 3038–3050. DOI:10.1007/s11095-014-1397-0 |
| [16] | Xu H, Hu M, Yu X, et al. Design and evaluation of pHsensitive liposomes constructed by poly(2-ethyl-2-oxazoline)-cholesterol hemisuccinate for doxorubicin delivery[J]. Eur J Pharm Biopharm, 2015, 91: 66–74. DOI:10.1016/j.ejpb.2015.01.030 |
| [17] | Zhao Y, Zhou Y, Wang D, et al. pH-Responsive polymeric micelles based on poly(2-ethyl-2-oxazoline)-poly(D, L-lactide) for tumor-targeting and controlled delivery of doxorubicin and P-glycoprotein inhibitor[J]. Acta Biomater, 2015, 17: 182–192. DOI:10.1016/j.actbio.2015.01.010 |
| [18] | Gao YJ, Li YF, Li YS, et al. PSMA-mediated endosome escape-accelerating polymeric micelles for targeted therapy of prostate cancer and the real time tracing of their intracellular trafficking[J]. Nanoscale, 2015, 7: 597–612. DOI:10.1039/C4NR05738D |
| [19] | Xia GM, An ZJ, Wang Y, et al. Synthesis of a novel polymeric material folate-poly(2-ethyl-2-oxazoline)-distearoyl phosphatidyl ethanolamine tri-block polymer for dual receptor and pH-sensitive targeting liposome[J]. Chem Pharm Bull, 2013, 61: 390–398. DOI:10.1248/cpb.c12-00951 |
| [20] | Merino S, Martín C, Kostarelos K, et al. Nanocomposite hydrogels:3D polymer-nanoparticle synergies for on-demand drug delivery[J]. ACS Nano, 2015, 9: 4686–4697. DOI:10.1021/acsnano.5b01433 |
| [21] | Hendrickson GR, Lyon LA. Microgel translocation through pores under confinement[J]. Angew Chem Int Ed, 2010, 49: 2193–2197. DOI:10.1002/anie.v49:12 |
| [22] | Van Kuringen HPC, Lenoir J, Adriaens E, et al. Partial hydrolysis of poly(2-ethyl-2-oxazoline) and potential implications for biomedical applications?[J]. Macromol Biosci, 2012, 12: 1114–1123. DOI:10.1002/mabi.v12.8 |
| [23] | Legros C, Wirotius A, De Pauw-Gillet M, et al. Poly(2-oxazoline)-based nanogels as biocompatible pseudopolypeptide nanoparticles[J]. Biomacromolecules, 2015, 16: 183–191. DOI:10.1021/bm501393q |
| [24] | Konefał R, Spěváček J, Jäger E, et al. Thermoresponsive behaviour of terpolymers containing poly(ethylene oxide), poly(2-ethyl-2-oxazoline) and poly(ε-caprolactone) blocks in aqueous solutions:an NMR study[J]. Colloid Polym Sci, 2016, 294: 1717–1726. DOI:10.1007/s00396-016-3930-7 |
| [25] | Kronek J, Petrenčíková N, Mikulec M, et al. Structure analysis and thermosensitive properties of copolymers prepared from 2-ethyl-2-oxazoline and 2-(4-aminophenyl)-2-oxazoline[J]. Polym Bull, 2015, 72: 1081–1094. DOI:10.1007/s00289-015-1323-6 |
| [26] | Hwang YS, Chiang PR, Hong WH, et al. Study in vivo intraocular biocompatibility of in situ gelation hydrogels:poly(2-ethyl oxazoline)-block-poly(epsilon-caprolactone)-block-poly(2-ethyl oxazoline) copolymer, matrigel and pluronic F127[J]. PLoS One, 2013, 8: e67495. DOI:10.1371/journal.pone.0067495 |
| [27] | Mees MA, Effenberg C, Appelhans D, et al. Sweet polymers:poly(2-ethyl-2-oxazoline) glycopolymers by reductive amination[J]. Biomacromolecules, 2016, 17: 4027–4036. DOI:10.1021/acs.biomac.6b01451 |
| [28] | Güner PT, Demirel AL. Effect of anions on the cloud point temperature of aqueous poly(2-ethyl-2-oxazoline) solutions[J]. J Phys Chem B, 2012, 116: 14510–14514. DOI:10.1021/jp310648d |
| [29] | Mero A, Fang Z, Pasut G, et al. Selective conjugation of poly(2-ethyl 2-oxazoline) to granulocyte colony stimulating factor[J]. J Control Release, 2012, 159: 353–361. DOI:10.1016/j.jconrel.2012.02.025 |
| [30] | Viegas TX, Bentley MD, Harris JM, et al. Polyoxazoline:chemistry, properties, and applications in drug delivery[J]. Bioconjugate Chem, 2011, 22: 976–986. DOI:10.1021/bc200049d |
| [31] | Tong J, Luxenhofer R, Yi X, et al. Protein modification with amphiphilic block copoly(2-oxazoline)s as a new platform for enhanced cellular delivery[J]. Mol Pharmaceut, 2010, 7: 984–992. DOI:10.1021/mp100102p |
| [32] | Konieczny S, Fik CP, Averesch NJH, et al. Organosoluble enzyme conjugates with poly(2-oxazoline)s via pyromellitic acid dianhydride[J]. J Biotechnol, 2012, 159: 195–203. DOI:10.1016/j.jbiotec.2012.01.016 |
| [33] | Fernandes JC, Qiu X, Winnik FM, et al. Linear polyethylenimine produced by partial acid hydrolysis of poly(2-ethyl-2-oxazoline) for DNA and siRNA delivery in vitro[J]. Int J Nanomedicine, 2013, 8: 4091–4102. |
| [34] | de la Rosa VR, Bauwens E, Monnery BD, et al. Fast and accurate partial hydrolysis of poly(2-ethyl-2-oxazoline) into tailored linear polyethylenimine copolymers[J]. Polym Chem, 2014, 5: 4957–4964. DOI:10.1039/C4PY00355A |
| [35] | Gaspar VM, Baril P, Costa EC, et al. Bioreducible poly(2-ethyl-2-oxazoline)-PLA-PEI-SS triblock copolymer micelles for co-delivery of DNA minicircles and doxorubicin[J]. J Control Release, 2015, 213: 175–191. DOI:10.1016/j.jconrel.2015.07.011 |
| [36] | Osawa S, Osada K, Hiki S, et al. Polyplex micelles with double-protective compartments of hydrophilic shell and thermoswitchable palisade of poly(oxazoline)-based block copolymers for promoted gene transfection[J]. Biomacromolecules, 2016, 17: 354–361. DOI:10.1021/acs.biomac.5b01456 |
| [37] | Mansfield EDH, Sillence K, Hole P, et al. POZylation:a new approach to enhance nanoparticle diffusion through mucosal barriers[J]. Nanoscale, 2015, 7: 13671–13679. DOI:10.1039/C5NR03178H |
| [38] | Mansfield ED, de la Rosa VR, Kowalczyk RM, et al. Side chain variations radically alter the diffusion of poly(2-alkyl-2-oxazoline) functionalised nanoparticles through a mucosal barrier[J]. Biomater Sci, 2016, 4: 1318–1327. DOI:10.1039/C6BM00375C |
 2017, Vol. 52
2017, Vol. 52


