纤维连接蛋白(fibronectin, FN)是细胞外基质中的大分子糖蛋白, 其中的B结构域(extra-domain B, ED-B)与肿瘤发生发展密切相关, 在多种肿瘤组织血管壁和细胞外基质中高表达, 是肿瘤组织的标志性蛋白, 是肿瘤治疗的理想靶点之一[1, 2]。目前针对B结构域开发了多种应用, 且开发热度与日俱增, 预期有良好的市场前景。
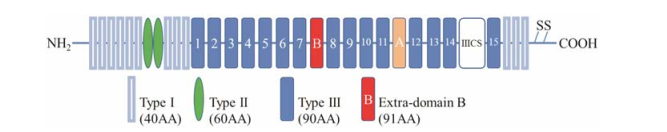
1 B结构域的生物学特征 1.1 B结构域的结构与位置FN的基因大约有75 kb, 50个外显子, 在mRNA成熟过程中经不同的剪接方式已知可产生20多种FN变构体。FN主要由Ⅰ、Ⅱ和Ⅲ型3类同源重复单元构成(12 type Ⅰ, 2 type Ⅱ, 15 type Ⅲ), B结构域包含在Ⅲ型重复序列的FNⅢ7与FNⅢ8结构域之间(图 1), 是由91个氨基酸编码的单个外显子。在基因表达过程中, FN有含B结构域和不含B结构域两种类型, 这两种类型在个体发育过程中均发挥着重要作用[3]。其中不含B结构域的FN在人体组织中广泛分布, 而含有B结构域的FN主要存在于胎儿发育阶段, 在成人正常组织中几乎检测不到。B结构域主要存在于新生组织的血管壁、细胞间质和细胞膜的FN中, 未见血液中含B结构域的报道。
|
Figure 1 Modular structure of fibronectin. The fibronectin contains three types repeat modules, type Ⅰ, Ⅱ, Ⅲ. Two disulfide bridges at carboxyl terminus link 2 monomers, the extra-domain B (ED-B) is showed in red |
B结构域具有良好的组织分布特异性。虽然健康成年人的正常组织中几乎不表达B结构域, 但在快速增生的组织中会再次出现, 例如伤口愈合[4]、骨伤[5]及部分慢性疾病引起的血管增生, 如炎性类风湿[6]、严重的动脉粥样硬化[7]。尤其在肿瘤组织中分布广泛且表达丰度很高, 包括癌症和肉瘤, 例如肺癌、结直肠癌、恶性胶质瘤、胰腺癌、转移性肝癌、头颈部癌、黑色素瘤、口腔鳞癌和乳腺癌等[1, 8-11], 在前列腺癌、甲状腺癌和胸腺癌等进展过程中表达量也有提高, 另外, B结构域在大部分淋巴瘤和白血病的病灶中也有表达[12]。
B结构域在脊椎动物的生物进化过程中高度保守, 其氨基酸序列在小鼠、大鼠、兔、狗和人中都相同[2]。因此通过动物免疫难以获得B结构域的抗体, 已报道动物来源的B结构域抗体BC-1和C6均仅识别B结构域的相邻结构域FNⅢ7、FNⅢ8, 而非直接结合在B结构域上[13]。由于其进化上的保守性, 直接识别B结构域的抗体同样可与多种哺乳动物的B结构域结合, 甚至可以识别禽类, 例如鸡的B结构域[14]。
B结构域的生物学功能及作用机制至今不明确[15], 已知其可促进血管内皮生长因子(VEGF)表达、内皮生长和血管形成[16]。含B结构域的FN可通过整合素αVβ3介导加速免疫细胞对微生物的吞噬作用, 而不含B结构域的FN功能较弱[17]。另外有研究[15]表明, B结构域是在肿瘤组织微环境中力学性能变化情况下产生的, 可促进细胞适应肿瘤微环境。通过基因敲除实验发现, FN的B结构域或A结构域(ED-A)的基因缺失不会导致明显的小鼠生理缺陷, 但若同时敲除则会产生心血管缺陷。一般而言, B结构域与新的血管形成、肿瘤和炎症等因素有密切关系。
2 靶向B结构域的武装抗体(armed antibody)药物开发B结构域在成年人体内与肿瘤发生具有良好的相关性和特异性, 适合作为抗体肿瘤靶向药物开发的靶点[1]。而且B结构域在实体瘤中广泛分布, 预期靶向B结构域的药物拥有广泛的适应证。另外, 由于B结构域在进化过程中高度保守, 其作为抗体药物靶点开发时动物实验的数据与在人体的研究数据具有较高的可比性, 比如B结构域抗体药物L19-IL2既可用于小鼠肿瘤的治疗, 也可用于人体肿瘤的治疗[18], 有利于提高药物在临床研究阶段的成功率。另外, 实体瘤的发生往往伴随新生血管的形成, 新生血管壁上富含的B结构域可顺利与其靶向药物结合, 实现药物在病灶的快速富集。不足的是, B结构域的生理功能仍不明确, 也仅适合作为肿瘤标志物使用, 已开发的抗体药物药效部分需要通过融合蛋白质药物或缀合其他药物分子来实现, 该类抗体被称之为武装抗体[19]。
武装抗体一般由3部分构成:特异靶向病变组织的抗体、药物、连接抗体与药物的连接子, 是一种兼具原药物活性和抗体特异性的主动靶向药物[20]。抗体上结合的药物可以是化学药物、重组蛋白药物和放射性同位素等, 在药物设计上具有一定的灵活性[19]。B结构域抗体也可实现细胞外释药, 将小分子药物集中释放在肿瘤组织并透膜进入肿瘤细胞发挥药效, 实现靶向性和膜透过性的统一。
2.1 融合蛋白药物瑞士Philogen公司利用噬菌体展示技术筛选出B结构域的全人源单链抗体L-19[21], 基于该抗体分别与白介素2 (interleukin-2, IL-2)、肿瘤坏死因子α (tumor necrosis factor alpha, TNF-α)、干扰素等已上市的生物药物进行基因重组形成融合蛋白, 产生了全新的基因工程药物, 部分已获得良好的临床收益。另外, 也有B结构域人源化抗体huBC-1与白介素12 (interleukin-12, IL-12) 融合蛋白AS1409的临床研究报道[22]。
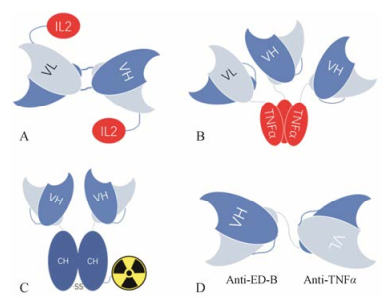
IL-2已于1992年批准上市用于黑素瘤的临床治疗, 全身给药时疾病控制率达37.7%, 且部分可获得长期缓解[23]。IL-2也可瘤内局部给药, 可获得70%的完全应答[24]。但是, 由于IL-2全身给药时需要很高剂量才能发挥药效, 在高剂量下患者往往难以耐受而放弃治疗, 因此临床使用受到严重局限。通过L-19与IL-2融合形成L19-IL2 (图 2A)重组蛋白药物, 一方面将IL-2的半衰期由13 min延长至3 h以上, 可降低给药剂量(由最大剂量每周900 Mio IU降至每周110 Mio IU), 提高患者耐受性; 另一方面融合的抗体使IL-2能够特异性靶向至肿瘤组织中, 并与组织中的B结构域稳定结合而长期滞留, 实现局部浓度的提高以提升疗效[25]。L19-IL2可通过静脉全身给药来治疗黑素瘤, 在安全剂量下获得比IL-2更积极的治疗效果[26], 而在采用瘤内给药方式的客观有效率为50%, 疾病控制率按肿瘤病灶数计算高达90%, 患者3年生存率达87.5%, 且具有全身治疗效果, 并无全身性的3~4级严重不良反应[8, 27]。目前L19-IL2已开展黑素瘤的Ⅲ期临床试验。
|
Figure 2 Derivatives of armed antibody against extra-domain B. The single-chain Fv antibody fused with interleukin-2 (IL-2), tumor necrosis factor alpha (TNF-α), and the other antibodies, or radiolabeled with iodine-131. A: L19-IL2; B: L19-TNFα; C: L19-131Ⅰ; D: Bispecific diabody (BsDb) |
TNF-α在人体血液中的半衰期约为1 h[28], 通过与L-19的融合形成L19-TNFα (图 2B)后, TNF-α有效富集于病灶部位, 延长TNF-α在病灶部位的作用时间, 实现长效目的, 并取得良好的黑素瘤治疗效果。一项与美法仑联合进行隔离肢体热灌注治疗的黑素瘤Ⅱ期临床试验结果表明, 650 μg L19-TNFα (含250 μg TNF-α)可代替4 000 μg非靶向的TNF-α (Beromun®), 获得89%的客观有效率, 其中50%患者的肿瘤实现完全消除, 可见TNF-α融合靶向抗体后给药剂量仅为原来剂量的6.25%[29]。而采用L19-TNFα与L19-IL2联合瘤内给药, 客观有效率为55%, 疾病控制率按肿瘤病灶数计算高达96%以上, 且具有全身治疗效果, 无全身性的3~4级严重不良反应[8], 可见L19-TNFα具有增强疗效的作用。目前L19-TNFα已进入两项临床Ⅲ期试验, 分别用于黑素瘤和软组织肉瘤的治疗。此外, 欧洲委员会(European Commission)已授予L19-TNFα治疗软组织肉瘤的孤儿药地位。
L19-IL2还被用于头颈部癌症、弥漫性大B细胞淋巴瘤(DLBCL)、非小细胞肺癌(NSCLC)的临床Ⅱ期试验。
特别提出的是, 已进入临床阶段的B结构域抗体药物L19-IL2, 属于肿瘤的被动免疫治疗药物, 在两项临床Ⅱ期试验中体现出瘤内注射给药可发挥全身疗效且疗效持久, 也确证了肿瘤免疫治疗的优越性[30]。上述L-19相关药物对黑素瘤的疗效数据显著优于已公开的PD-1抗体药物临床数据[31], 但尚需L-19的Ⅲ期临床试验结果进一步确认。
2.2 放射性同位素药物免疫组织化学检查发现, 几乎所有的淋巴瘤样本均呈不同程度的B结构域阳性, 且与肿瘤的恶性程度和肿瘤细胞分化程度有很高的相关性, 其骨髓样本中也同样出现B结构域阳性。L-19与同位素标记而成的靶向药物L19-131Ⅰ (图 2C)可用于霍奇金淋巴瘤的治疗, 目前已完成Ⅱ期临床试验。数据显示B结构域是比较理想的淋巴瘤治疗靶点[12]。另外L19-131Ⅰ也同样应用于前列腺癌靶向治疗[32]。
2.3 双特异抗体药物国内学者将L-19抗体用于炎症治疗, 在动物实验上取得积极的效果[33]。通过L-19与抗TNF-α抗体融合蛋白形成的双特异性抗体(bispecific diabody, BsDb)药物(图 2D), 使抗TNF-α抗体具有组织特异性, 选择性地富集于炎症关节组织中实现抗炎目的, 而BsDb在血浆和正常组织中能快速清除, 在正常组织中的毒性较低, 有望减少抗TNF-α抗体长期使用产生的严重感染和恶性肿瘤风险[33]。预期该双特异性抗体药物设计可在类风湿关节炎和其他自身免疫性疾病的治疗上有一定的应用价值。
3 用于治疗性肿瘤疫苗开发肿瘤疫苗并不直接杀死癌细胞, 而是将抗原经过免疫佐剂处理后注入人体内, 引发机体免疫反应, 激活T细胞并产生相应的抗体。杀伤性T细胞可直接杀死特定的癌细胞, 抗体则识别癌细胞表面抗原并借助免疫系统清除癌细胞。开发肿瘤疫苗的显著优势是其治疗效果来自主动免疫, 可实现免疫系统的长期记忆产生持久应答。
B结构域作为在多种实体肿瘤中高表达的蛋白结构域之一, 是人体的自身肿瘤抗原, 现已以B结构域为基础进行疫苗开发[34, 35]。经过采用不同免疫佐剂比较研究和以B结构域为核心的疫苗筛选, 已在小鼠实验中证实, 含B结构域的疫苗具有较强的免疫原性, 可激起动物体产生抗B结构域的抗体, 从而实现主动免疫治疗肿瘤的效果。由于小鼠与人B结构域氨基酸完全相同, 因此也初步证明了人用B结构域疫苗开发的可行性。
4 作为肿瘤标志物的潜在开发价值肿瘤标志物是肿瘤患者的体液或组织中出现特征性变化的代谢物, 可用于肿瘤高危人群的筛选、肿瘤的鉴别诊断、肿瘤进展的判断和肿瘤治疗的预后等。常用的肿瘤生物标志物有甲胎蛋白(AFP)、癌胚抗原(CEA)、前列腺特异抗原(PSA)和各种糖类抗原等[36-38]。但是, 临床常用的肿瘤标志物主要用于诊断人体脏器、腺体的健康状况, 尚缺少较成熟的肌肉、皮肤、黏膜和血管等方面广谱的肿瘤标志物, 而这些上皮组织和肌肉组织是人体最主要的组成部分, 尤其是血管系统遍布全身, 对其开展健康评估尤为重要。B结构域蛋白主要分布在新生组织的血管壁、细胞间质和细胞膜上, 与肿瘤的发生发展密切相关, 有望填补这一空白[39]。
4.1 用于个体化给药的伴随诊断开发伴随诊断(companion diagnostic)是与特定药物相关联的诊断技术, 包括体外诊断和体内诊断。L-19相关药物开发过程中, 其伴随诊断试剂的开发发挥了重要作用。在体外诊断方面, L-19抗体本身可用于免疫组织化学检测, 通过病理切片确认肿瘤的B结构域蛋白表达情况[40], 用于科学研究和临床诊断。L-19抗体还可以用于体内诊断, 如通过放射性同位素碘124标记L-19抗体进行体内注射, 可以清楚获得B结构域阳性的肿瘤在人体内的分布, 指示肿瘤组织在体内的位置和大小等信息, 肿瘤特异性优于氟代脱氧葡萄糖(FDG) PET诊断[41], 可指导B结构域相关抗体药物给药, 也可用于评估药物的治疗效果, 指导个体化治疗。
基于上述的体内和体外诊断, 可以辅助肿瘤的介入治疗, 实现药物在影像设备的引导下直接给入病灶部位, 减小手术创伤和全身给药的毒副作用, 可能成为一些疾病的可选治疗方法。
伴随诊断也可帮助提高药物临床研究效率, 通过伴随诊断可推测适应证或寻找最适当的患者参与临床试验, 能降低患者参加临床试验的风险并提高临床疗效, 又推动药物尽快上市。
4.2 用于常规诊断试剂开发由于B结构域已被基本证实其与组织增生有关且在肿瘤中大量表达, 因此B结构域抗体可作为病理切片免疫诊断的有效证据。
另外血浆中也检测到有微量的B结构域存在。实验证明血浆中的B结构域蛋白(plasma ED-B, pED-B)主要来源于肿瘤组织, 因此血液中的B结构域蛋白含量变化与组织病变有一定的相关性, 对健康有一定的提示作用[39]。因此利用B结构域抗体, 如L-19和B5抗体[42], 开发更灵敏的双夹心酶联免疫吸附法(ELISA)检测试剂盒, 可通过血液中游离的B结构域蛋白, 评估普通人群的组织增生状况, 或可提前发现组织的病变状况, 达到早发现早治疗的目的。
5 展望我国已系统掌握抗体药物开发技术, 具有从靶点生物学研究到药物筛选和临床研究的技术平台, 具备开发新靶点药物的客观条件。而当下抗体药物尚不能满足临床需求, 需要逐步从新靶点的生物学研究着手, 加强源头创新, 并大胆开展药物设计, 加大创新力度, 形成与既有药物互补的格局。
FN的B结构域具有适合肿瘤靶向药物开发的良好生物学特征, 其药物开发价值已基本被临床试验证实, 新药开发风险相对较小。另一方面, 国际上仅有L-19抗体及其衍生药物进入临床研究, 其诸多应用价值未被充分发挥, 临床给药方案也有待优化, 更多B结构域的生物学特征需要进一步研究。由于该靶点的药物设计灵活多样且适应证广泛, 已逐步成为新的研发热点。
| [1] | Menrad A, Menssen HD. ED-B fibronectin as a target for antibody-based cancer treatments[J]. Expert Opin Ther Targets, 2005, 9: 491–500. DOI:10.1517/14728222.9.3.491 |
| [2] | Kaspar M, Zardi L, Neri D. Fibronectin as target for tumor therapy[J]. Int J Cancer, 2006, 118: 1331–1339. DOI:10.1002/ijc.21677 |
| [3] | Bradshaw MJ, Smith ML. Multiscale relationships between fibronectin structure and functional properties[J]. Acta Biomater, 2014, 10: 1524–1531. DOI:10.1016/j.actbio.2013.08.027 |
| [4] | Ffrench-Constant C, Van de Water L, Dvorak HF, et al. Reappearance of an embryonic pattern of fibronectin splicing during wound healing in the adult rat[J]. J Cell Biol, 1989, 109: 903–914. DOI:10.1083/jcb.109.2.903 |
| [5] | Kilian O, Dahse R, Alt V, et al. Expression of EDA+ and EDB+ fibronectin splice variants in bone[J]. Bone, 2004, 35: 1334–1345. DOI:10.1016/j.bone.2004.08.008 |
| [6] | Kriegsmann J, Berndt A, Hansen T, et al. Expression of fibronectin splice variants and oncofetal glycosylated fibronectin in the synovial membranes of patients with rheumatoid arthritis and osteoarthritis[J]. Rheumatol Int, 2004, 24: 25–33. DOI:10.1007/s00296-003-0316-1 |
| [7] | Matter CM, Schuler PK, Alessi P, et al. Molecular imaging of atherosclerotic plaques using a human antibody against the extra-domain B of fibronectin[J]. Circ Res, 2004, 95: 1225–1233. DOI:10.1161/01.RES.0000150373.15149.ff |
| [8] | Danielli R, Patuzzo R, Di Giacomo AM, et al. Intralesional administration of L19-IL2/L19-TNF in stage Ⅲ or stage IVM1a melanoma patients:results of a phase Ⅱ study[J]. Cancer Immunol Immunother, 2015, 64: 999–1009. DOI:10.1007/s00262-015-1704-6 |
| [9] | Liu HW, Chen BL, Daniel M. Expression of alternatively spliced domain of the fibronectin in oral squamous cell carcinoma[J]. J Peking Univ Health Sci (北京大学学报医学版), 2001, 33: 377–379. |
| [10] | Santimaria M, Moscatelli G, Viale GL, et al. Immunoscintigraphic detection of the ED-B domain of fibronectin, a marker of angiogenesis, in patients with cancer[J]. Clin Cancer Res, 2003, 9: 571–579. |
| [11] | Kaczmarek J, Castellani P, Nicolo G, et al. Distribution of oncofetal fibronectin isoforms in normal, hyperplastic and neoplastic human breast tissues[J]. Int J Cancer, 1994, 59: 11–16. DOI:10.1002/(ISSN)1097-0215 |
| [12] | Sauer S, Erba PA, Petrini M, et al. Expression of the oncofetal ED-B-containing fibronectin isoform in hematologic tumors enables ED-B-targeted 131I-L19SIP radioimmunotherapy in Hodgkin lymphoma patients[J]. Blood, 2009, 113: 2265–2274. DOI:10.1182/blood-2008-06-160416 |
| [13] | Ventura E, Cordazzo C, Quarto R, et al. C6:a monoclonal antibody specific for a fibronectin epitope situated at the interface between the oncofoetal extra-domain B and the repeat Ⅲ8[J]. PLoS One, 2016, 11: e0148103. DOI:10.1371/journal.pone.0148103 |
| [14] | Carnemolla B, Neri D, Castellani P, et al. Phage antibodies with pan-species recognition of the oncofoetal angiogenesis marker fibronectin ED-B domain[J]. Int J Cancer, 1996, 68: 397–405. DOI:10.1002/(ISSN)1097-0215 |
| [15] | Bordeleau F, Califano JP, Negrón Abril YL, et al. Tissue stiffness regulates serine/arginine-rich protein-mediated splicing of the extra domain B-fibronectin isoform in tumors[J]. Proc Natl Acad Sci U S A, 2015, 112: 8314–8319. DOI:10.1073/pnas.1505421112 |
| [16] | Chen S, Chakrabarti R, Keats EC, et al. Regulation of vascular endothelial growth factor expression by extra domain B segment of fibronectin in endothelial cells[J]. Invest Ophthalmol Vis Sci, 2012, 53: 8333–8343. DOI:10.1167/iovs.12-9766 |
| [17] | Kraft S, Klemis V, Sens C, et al. Identification and characterization of a unique role for EDB fibronectin in phagocytosis[J]. J Mol Med (Berl), 2016, 94: 567–581. DOI:10.1007/s00109-015-1373-0 |
| [18] | Gebleux R, Wulhfard S, Casi G, et al. Antibody format and drug release rate determine the therapeutic activity of noninternalizing antibody-drug conjugates[J]. Mol Cancer Ther, 2015, 14: 2606–2612. DOI:10.1158/1535-7163.MCT-15-0480 |
| [19] | Hess C, Venetza D, Neri D. Emerging classes of armed antibody therapeutics against cancer[J]. MedChemComm, 2014, 5: 408–431. DOI:10.1039/c3md00360d |
| [20] | Gao HL, Jiang XG. The development of novel tumor targeting delivery strategy[J]. Acta Pharm Sin (药学学报), 2016, 51: 272–280. |
| [21] | Pini A, Viti F, Santucci A, et al. Design and use of a phage display library. Human antibodies with subnanomolar affinity against a marker of angiogenesis eluted from a two-dimensional gel[J]. J Biol Chem, 1998, 273: 21769–21776. |
| [22] | Rudman SM, Jameson MB, McKeage MJ, et al. A phase 1 study of AS1409, a novel antibody-cytokine fusion protein, in patients with malignant melanoma or renal cell carcinoma[J]. Clin Cancer Res, 2011, 17: 1998–2005. DOI:10.1158/1078-0432.CCR-10-2490 |
| [23] | Hughes T, Klairmont M, Broucek J, et al. The prognostic significance of stable disease following high-dose interleukin-2(IL-2) treatment in patients with metastatic melanoma and renal cell carcinoma[J]. Cancer Immunol Immunother, 2015, 64: 459–465. DOI:10.1007/s00262-014-1652-6 |
| [24] | Weide B, Derhovanessian E, Pflugfelder A, et al. High response rate after intratumoral treatment with interleukin-2:results from a phase 2 study in 51 patients with metastasized melanoma[J]. Cancer, 2010, 116: 4139–4146. DOI:10.1002/cncr.25156 |
| [25] | Pasche N, Neri D. Immunocytokines:a novel class of potent armed antibodies[J]. Drug Discov Today, 2012, 17: 583–590. DOI:10.1016/j.drudis.2012.01.007 |
| [26] | Eigentler TK, Weide B, de Braud F, et al. A dose-escalation and signal-generating study of the immunocytokine L19-IL2 in combination with dacarbazine for the therapy of patients with metastatic melanoma[J]. Clin Cancer Res, 2011, 17: 7732–7742. DOI:10.1158/1078-0432.CCR-11-1203 |
| [27] | Weide B, Eigentler TK, Pflugfelder A, et al. Intralesional treatment of stage Ⅲ metastatic melanoma patients with L19-IL2 results in sustained clinical and systemic immunologic responses[J]. Cancer Immunol Res, 2014, 2: 668–678. DOI:10.1158/2326-6066.CIR-13-0206 |
| [28] | Spitaleri G, Berardi R, Pierantoni C, et al. Phase Ⅰ/Ⅱ study of the tumour-targeting human monoclonal antibody-cytokine fusion protein L19-TNF in patients with advanced solid tumours[J]. J Cancer Res Clin Oncol, 2013, 139: 447–455. DOI:10.1007/s00432-012-1327-7 |
| [29] | Papadia F, Basso V, Patuzzo R, et al. Isolated limb perfusion with the tumor-targeting human monoclonal antibody-cytokine fusion protein L19-TNF plus melphalan and mild hyperthermia in patients with locally advanced extremity melanoma[J]. J Surg Oncol, 2013, 107: 173–179. DOI:10.1002/jso.23168 |
| [30] | Zhang M, Li G. Research progress of immunotherapy for melanoma[J]. Chin New Drug J (中国新药杂志), 2016, 25: 2569–2573. |
| [31] | Zhao YH, Song P, Gao TW. Application of the PD-1 antibody in melanoma therapy[J]. Chin J Clin Oncol (中国肿瘤临床), 2016, 43: 589–592. |
| [32] | Locher R, Erba PA, Hirsch B, et al. Abundant in vitro expression of the oncofetal ED-B-containing fibronectin translates into selective pharmacodelivery of 131I-L19SIP in a prostate cancer patient[J]. J Cancer Res Clin Oncol, 2014, 140: 35–43. DOI:10.1007/s00432-013-1538-6 |
| [33] | LI LJ, Yang YQ, Hu XP, et al. Construction and functional analysis of a bispecific antibody that targets TNF-α and ED-B[J]. Acta Pharm Sin (药学学报), 2014, 49: 1665–1673. |
| [34] | Huijbers EJ, Ringvall M, Femel J, et al. Vaccination against the extra domain-B of fibronectin as a novel tumor therapy[J]. FASEB J, 2010, 24: 4535–4544. DOI:10.1096/fj.10-163022 |
| [35] | Saupe F, Huijbers EJ, Hein T, et al. Vaccines targeting selfantigens:mechanisms and efficacy-determining parameters[J]. FASEB J, 2015, 29: 3253–3262. DOI:10.1096/fj.15-271502 |
| [36] | Li C, Nie CH, Zhang LJ, et al. Advances in research on application of tumor markers and their screening technique[J]. Prog Pharm Sci (药学进展), 2014, 38: 1–13. |
| [37] | Wang S, Li H, Li G. Molecular structure and biological function of alpha-fetoprotein[J]. World Chin J Dig (世界华人消化杂志), 2014, 22: 1487–1494. DOI:10.11569/wcjd.v22.i11.1487 |
| [38] | Zhu J, Peng KJ, He JC. Carcinoembryonic antigen (CEA) in cancer progress[J]. Int J Lab Med (国际检验医学杂志), 2015, 36: 3137–3138. |
| [39] | Ji J, Zhang M, Gao M, et al. Application of ED-B protein in the diagnosis of hyperplasia:PCT/CN2015/094727[P]. 2017-05-26. |
| [40] | Schliemann C, Palumbo A, Zuberbühler K, et al. Complete eradication of human B-cell lymphoma xenografts using rituximab in combination with the immunocytokine L19-IL2[J]. Blood, 2009, 113: 2275–2283. DOI:10.1182/blood-2008-05-160747 |
| [41] | Poli GL, Bianchi C, Virotta G, et al. Radretumab radioimmunotherapy in patients with brain metastasis:a 124I-L19SIP dosimetric PET study[J]. Cancer Immunol Res, 2013, 1: 134–143. DOI:10.1158/2326-6066.CIR-13-0007 |
| [42] | Ji J, Zhang M, Gao M, et al. Human antibody against ED-B domain of fibronectin and uses thereof:China, CN104395342A[P]. 2015-03-04. |
 2017, Vol. 52
2017, Vol. 52


