2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193;
3. 大连交通大学环境化工学院/生物技术研究所, 辽宁 大连 116028
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
3. School of Environment and Chemical Engineering/Biotechnology Institute, Dalian Jiaotong University, Dalian 116028, China
红豆杉属(Taxus)植物为常绿乔木或灌木, 全球共有12种, 自然分布极少, 主要分布于北半球温带地区, 热带、亚热带等地的高山地区也有少量分布, 起源于古老的第三纪, 是第四纪冰川后遗留下来的珍稀濒危植物, 因此又被称为植物王国里的“活化石”[1, 2]。红豆杉属植物又称“紫杉”, 其药用功效最早记载于《本草纲目》, 用于治疗霍乱、伤寒等症。《本草推陈》记载: “紫杉可入药, 利尿、通经、治肾病, 用皮易呕吐, 木部及叶不吐”。民间和传统中医药对红豆杉属植物的利用也有着悠久历史, 能消积、润燥、利尿、通经、消炎并可治疗多种肠道寄生虫病[3, 4]。
红豆杉属植物的药用价值得到人们的广泛关注和深入研究, 对提取天然抗癌产物紫杉醇的开发应用已在全球多国迅速开展[5]。多年临床试验结果表明:紫杉醇是继多柔比星、顺铂之后发现的对多种癌症疗效好、不良反应小的抗癌药物[6]。目前, 紫杉醇已成为世界销量第一的抗肿瘤药物, 仍然没有新的抗癌药物取代紫杉醇的地位。红豆杉属植物中除有紫杉醇外, 还含有300多种伴生抗癌活性化合物, 可作为半合成紫杉醇或紫杉醇类前体药物的重要母核化合物或原料, 具有较高的药用价值和广阔的应用前景[7, 8]。
红豆杉属植物对生境有严格的选择, 生长缓慢, 经过多年生长才能入药[9]。加之大规模被砍伐及其种群竞争力弱、天然更新缓慢和地理分布局限等客观因素, 导致红豆杉属植物的资源量日益减少, 尤其是随着抗癌药紫杉醇的开发利用, 对红豆杉属植物的需求量日益增大, 致使其资源遭到了严重的破坏, 个别物种已处于极度濒危状态[10-12]。然而, 盲目引种不仅造成资源、人力、物力的浪费, 并导致药材质量下降, 影响治疗效果。根据引种地与红豆杉属植物原产地气候、土壤等生态因子的相似性, 获得其在全球范围内的适宜产地, 是有效指导红豆杉属植物引种和合理规划生产布局的基本保证。由中国中医科学院中药研究所针对药用植物生长特点研发的药用植物全球产地生态适宜性区划信息系统(geographic information system for global medicinal plants, GMPGIS), 采用全球气候数据库(WorldClim)、全球生物气候学建模数据库(CliMond)和全球土壤数据库(HWSD) 3个数据库, 以及药用植物主产区、道地产区和野生分布区的分布点数据, 并根据药用植物的生长限制因子获得在全球范围内的适宜产地。本文运用GMPGIS, 详细分析红豆杉属植物的生态因子值范围和潜在生态适宜分布区域, 并提出了合理的规划和建议。此外, 本文还对目前红豆杉属植物的品质生态及资源保护等方面进行了阐述。
1 GMPGIS分析方法 1.1 GMPGIS介绍“药用植物全球产地生态适宜性区划信息系统”是以地理信息系统(GIS)为平台, 将多个学科的理论和方法有机结合, 系统定量化、可视化分析结果, 能够为药用植物的引种栽培、保护抚育及规范化种植提供有效的科学依据。目前已运用此系统对中国171种大宗、常用中药材的基原物种进行了产地生态适宜性分析, 并成功运用于人参Panax ginseng C. A. Mey.、三七Panax notoginseng (Burk.) F. H. Chen等中药材的引种栽培中[13, 14]。
GMPGIS按照药用植物引种生态相似原则进行了产地生态适宜性分析。首先将与药用植物生长环境相关的温度、湿度、降水、日照等生态因子数据进行归一化, 并采用改进的欧氏距离算法对气候因子进行聚类分析; 再将聚类结果重分类后叠加适宜土壤因子, 确定该物种的最大生态相似度区域; 最后, 结合基础地理信息数据库产生最终区划分布图。GMPGIS的工作原理如图 1所示。
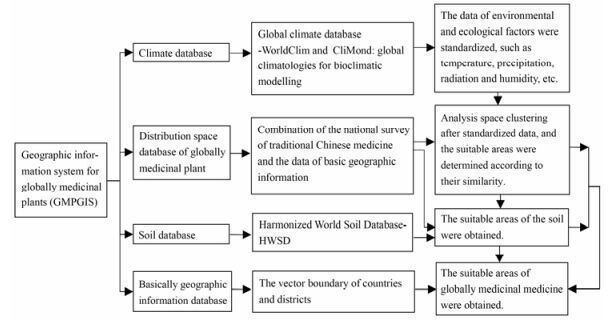
|
Figure 1 Working principle of GMPGIS |
药用植物生态适宜性系统分析过程共分为数据标准化、相似性聚类分析、栅格重分类和叠加土壤4个部分。
数据标准化 为了消除不同生态因子数据所带来的量纲影响, 采用线性标准化方法对各个数据栅格进行计算, 将范围值标准化在0~100区间内, 如公式1所示:
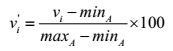
|
(1) |
相似性聚类分析 GMPGIS对传统的基于质心的加权欧式距离[15]进行了改进, 提出基于生态范围临界值的算法, 如公式2所示:
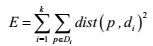
|
(2) |
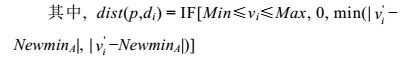
|
(3) |
其中, E是数据中所有对象误差的平方和; p是空间中的点, 表示给定的数据对象; di是簇Di的阈值(p和di都是多维的); Min(Max)为生态因子阈值中的最小值(最大值); MewminA(MewmaxA)为生态因子阈值中标准化后的最小值(最大值)。
栅格重分类 根据欧式距离计算结果(Mind, Maxd), 对栅格进行重分类, 系统将不小于99.9%相似度的区域作为具有最大生态相似度的适宜区域。
土壤叠加 将重分类后的欧式距离图层与符合生长条件的土壤图层求交集, 得到气候与土壤条件均适宜的生长区域。
1.3 GMPGIS数据库数据是开展药用植物产地生态适宜性分析的基础, 构建结构合理、数据准确、时效性强的药用植物数值分析空间数据库是进行药用植物产地生态适宜性区划的关键。基于GMPGIS的系统分析数据进行了多个数据库的整合。系统所使用的数据库主要包括: ① 基础地理信息数据库, 包括矢量数据的国界区划和城市区划等数据; ② 全球气候数据库(WorldClim global climate data)[16, 17]与全球生物气候学建模数据库(CliMond: global climatologies for bioclimatic modeling)[18, 19]; ③ 全球土壤数据库(Harmonized World Soil Database, HWSD)[20]; ④ 药用植物分布空间数据库, 整合全球野生药用植物分布数据以及第四次全国中药资源普查数据与基础地理信息数据。
1.4 红豆杉属植物生态适宜性分析应用GMPGIS对红豆杉属植物进行生态适宜性分析的工作流程为:通过开展野外调查(GPS采点)并查阅相关文献资料及数据库, 获得红豆杉属植物的分布点经纬度, 将此经纬度导入GMPGIS中, 生成物种分布点的矢量坐标文件; 在数据库支持下, 运用GMPGIS中算法对物种进行相似性计算, 最终得到该属植物的全球潜在生态适宜分布区域和生态因子值, 详细流程如图 2所示。
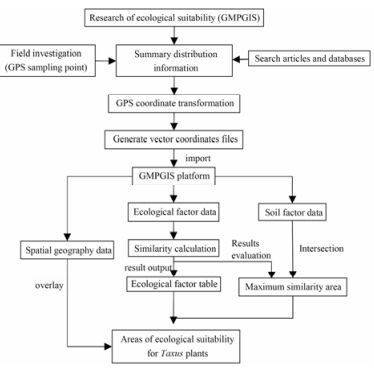
|
Figure 2 Analysis flow chart of the ecological suitability for Taxus plants |
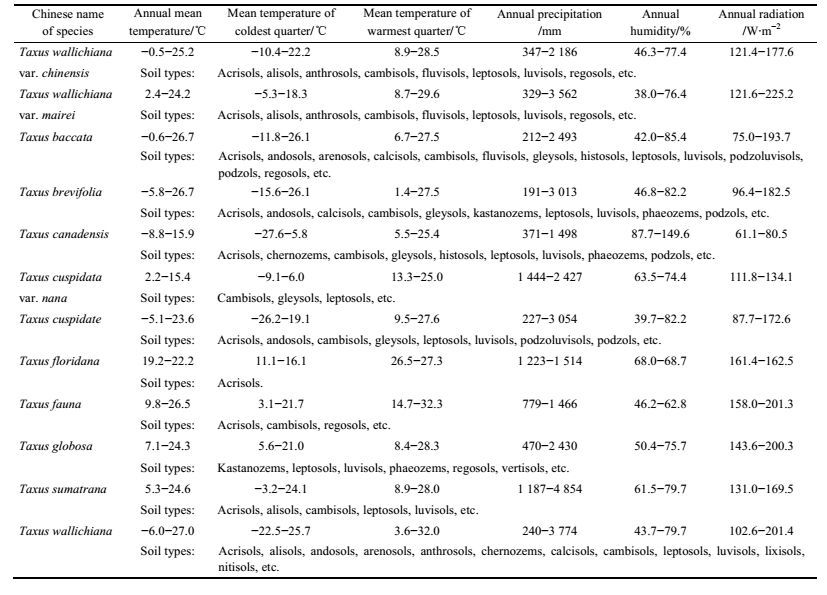
红豆杉是红豆杉科红豆杉属植物的总称, 在全球共有12种, 自然分布极少, 主要分布于北半球温带地区, 北美洲有4种、亚洲7种、欧洲1种, 红豆杉属植物采样点来源于主产区、道地产区和野生分布区, 各物种的分布情况[21-28]见表 1, 经纬度信息见图 3。
| Table 1 Distribution points of Taxus plants |
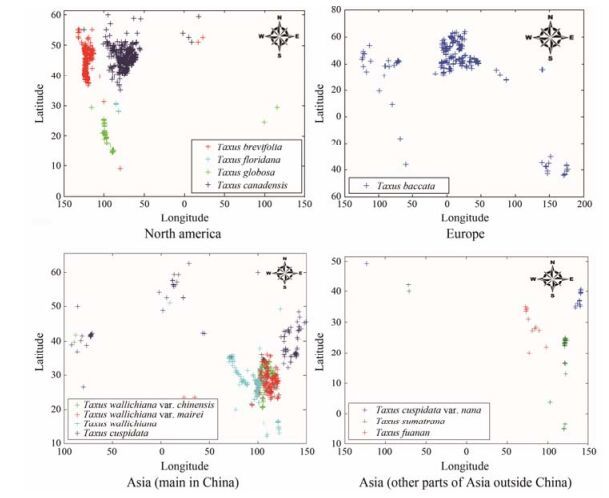
|
Figure 3 Latitude and longitude of the distribution for Taxus plants |
依据选取的红豆杉属各物种的采样点, 提取GMPGIS中生态因子数据, 获得各物种的生态因子阈值, 如表 2所示。
| Table 2 Range values of the ecological factors for Taxus plants |
由上图可知, 红豆杉属不同物种的生态因子值具有较大差异, 但多生长于森林、山脊、沟壑等温暖湿润环境, 土壤主要集中在强淋溶土、始成土、薄层土、淋溶土等类型, 各物种的生态因子值范围boxplot图如图 4所示。
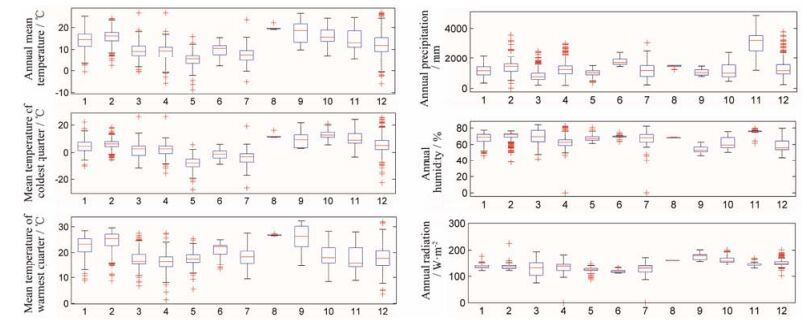
|
Figure 4 Boxplot chart of the ecological factors. 1: Taxus wallichiana var. chinensis; 2: Taxus wallichiana var. mairei; 3: Taxus baccata; 4: Taxus brevifolia; 5: Taxus canadensis; 6: Taxus cuspidata var. nana; 7: Taxus cuspidata; 8: Taxus floridana; 9: Taxus fauna; 10: Taxus globosa; 11: Taxus sumatrana; 12: Taxus wallichiana |
根据红豆杉属植物的主要生长区域生态因子阈值, 经GMPGIS分析获得红豆杉属植物全球最大生态相似度适宜产区分布图。其中, 红豆杉、南方红豆杉、欧洲红豆杉、短叶红豆杉和喜马拉雅红豆杉生态阈值范围广, 在南北半球均有较大的适生区; 东北红豆杉主要分布于北半球, 南半球仅有零星分布; 加拿大红豆杉、佛罗里达红豆杉和矮紫杉仅分布于北半球, 且后两种预测产区相对较少; 密叶红豆杉、墨西哥红豆杉和南洋红豆杉生长环境要求较苛刻, 属于小生境物种, 在全球范围内零星分布, 面积均较小, 详见图 5。
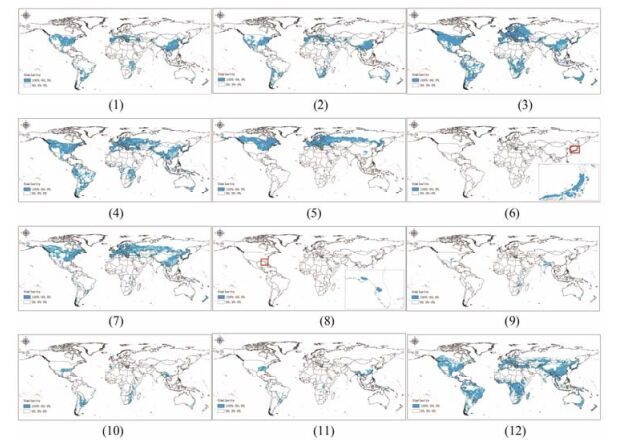
|
Figure 5 The largest ecological similarity area. 1: Taxus wallichiana var. chinensis; 2: Taxus wallichiana var. mairei; 3: Taxus baccata; 4: Taxus brevifolia; 5: Taxus canadensis; 6: Taxus cuspidata var. nana; 7: Taxus cuspidata; 8: Taxus floridana; 9: Taxus fauna; 10: Taxus globosa; 11: Taxus sumatrana; 12: Taxus wallichiana |
如图 5 (1)所示, 红豆杉是中国特有种, 其潜在分布区域面积达到461 347.3 km2, 其次为美国、阿根廷、巴西, 其潜在分布区域面积分别为348 793.1、70 412.6、69 636.3 km2; 西班牙、坦桑尼亚、墨西哥、法国、俄罗斯、土耳其在红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在30 000 km2以上。
如图 5 (2)所示, 南方红豆杉是中国亚热带至暖温带特有物种之一, 产于中国长江流域以南, 星散分布, 其潜在分布区域面积达到314 059.7 km2, 其次为美国、澳大利亚、阿根廷, 其潜在分布区域面积分别为366 468.4、108 553.6、86 345.4 km2; 南非、墨西哥、西班牙、土耳其、巴西、伊朗在南方红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在35 000 km2以上。
如图 5 (3)所示, 欧洲红豆杉原产于欧洲及北非西部、亚洲西南部, 其潜在分布区域较大的国家分别为美国、中国、俄罗斯, 其面积分别为709 798.6、345 449.4、333 937.2 km2; 巴西、阿根廷、加拿大、澳大利亚、墨西哥、土耳其在欧洲红豆杉引种方面也具有较大的发展潜力, 其潜在分布区域面积均在70 000 km2以上。
如图 5 (4)所示, 短叶红豆杉原产于美国西海岸, 其潜在分布区域面积达到597 016.9 km2, 其次为中国、俄罗斯、加拿大, 其潜在分布区域面积分别为376 057.0、300 221.0、276 384.9 km2; 巴西、哈萨克斯坦、阿根廷、秘鲁、印度尼西亚、土耳其在短叶红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在60 000 km2以上。
如图 5 (5)所示, 加拿大红豆杉原产于加拿大, 其潜在分布区域面积达到736 775.5 km2, 其次为俄罗斯、美国、乌克兰, 其潜在分布区域面积分别为786 422.0、267 754.4、62 581.3 km2; 中国、法国、德国、瑞典、波兰、芬兰在加拿大红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在30 000 km2以上。
如图 5 (6)所示, 矮紫杉原产于日本, 其潜在分布区域面积达到11 071.1 km2, 其在美国和中国也有零星潜在分布区域。
如图 5 (7)所示, 东北红豆杉原产于中国长白山区, 在日本、朝鲜及俄罗斯远东地区均有分布区域, 其潜在分布区域面积为342 761.0 km2; 其他潜在分布区域较大的国家分别为俄罗斯、加拿大、美国, 其面积分别为658 471.8、507 359.2、457 980.6 km2; 哈萨克斯坦、法国、乌克兰、西班牙、瑞典、德国在东北红豆杉引种栽培方面也具有发展潜力, 其潜在分布区域面积均在40 000 km2以上。
如图 5 (8)所示, 佛罗里达红豆杉只在美国佛罗里达州北部海拔15~30 m的阿巴拉契科拉河东侧一个10 km2的小范围面积内有发现, 其潜在分布区域面积为1 097.0 km2。
如图 5 (9)所示, 密叶红豆杉生长于西藏西南部, 在印度北部、克什米尔、巴基斯坦、尼泊尔、阿富汗至喜马拉雅山区东段也有分布, 生长于海拔2 500~ 3 400 m的地带, 密叶红豆杉潜在分布区域较大的国家分别为印度、美国、墨西哥, 其面积分别为45 074.2、16 815.3、15 817.2 km2; 澳大利亚、埃塞俄比亚、赞比亚在密叶红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在10 000 km2以上。
如图 5 (10)所示, 墨西哥红豆杉生长于墨西哥和危地马拉, 其潜在分布区域面积达到37 541.1 km2; 潜在分布区域较大的国家分别为美国、阿根廷、南非, 其面积分别为99 704.0、87 074.6、33 183.4 km2; 巴西、澳大利亚、缅甸、中国、坦桑尼亚、乌拉圭在墨西哥红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在15 000 km2以上。
如图 5 (11)所示, 南洋红豆杉生长于中国台湾和菲律宾, 其潜在分布区域较大的国家分别为美国、中国、巴西, 其面积分别为100 520.5、77 458.3、62 674.5 km2; 缅甸、老挝、印尼、刚果、巴布亚新几内亚、印度、越南在南洋红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在10 000 km2以上。
如图 5 (12)所示, 喜马拉雅红豆杉分布于阿富汗、尼泊尔以及中国西藏等地区, 其潜在分布较大的国家分别为中国、美国、巴西, 面积分别为502 980.2、500 248.1、401 765.9km2; 加拿大、刚果、哈萨克斯坦、俄罗斯、澳大利亚、印度、墨西哥在喜马拉雅红豆杉引种栽培方面也具有较大的发展潜力, 其潜在分布区域面积均在80 000 km2以上。
4 红豆杉属品质生态学研究品质生态学研究是中药材产地适宜性区划不可缺少的部分[29], 红豆杉属植物的各物种都有其最适生长区和一般生长区, 最适立地和一般立地。产地适宜性区划的分析, 为指导药用植物引种建立了有效的参照标准。生态品质特性的研究, 为培育出高含量的紫杉醇植物起到了重要的作用。因此, 药用植物基地建设必须根据产地适宜区划和生态品质进行合理引种。对此, 本文总结了红豆杉属植物品质生态学的重要特点。经研究发现, 树种、树龄、部位、采样季节、植株生长环境等均影响红豆杉属植物中的紫杉醇含量。
4.1 树种全球有12种红豆杉(包括变种, 下同), 不同种间紫杉醇含量差异一直是人们重点关注的问题。Zheng[30]分别对树龄约50年的南方红豆杉、东北红豆杉和云南红豆杉的根、茎、叶中的紫杉醇含量进行了测定, 结果表明, 按各部位平均含量计算, 云南红豆杉含紫杉醇的量最高(0.015%), 其次为南方红豆杉(0.013%), 东北红豆杉最低(0.011%)。Gao等[31]应用高效液相色谱分析了东亚产四种红豆杉和北美产三种红豆杉的紫杉醇和短叶醇含量, 结果表明, 短叶红豆杉树皮中的紫杉醇含量最高, 其次为中间红豆杉的树皮; 东亚产四种红豆杉枝叶中, 云南红豆杉枝叶中紫杉醇含量较高, 东北红豆杉和美丽红豆杉次之; 短叶醇含量则以短叶红豆杉最高, 东北红豆杉及云南红豆杉次之。
4.2 树龄紫杉醇含量与树龄密切相关。Cheng等[32]对树龄8~56年的6株东北红豆杉紫杉醇含量的测定表明, 紫杉醇含量随着树龄的增长而增加, 8年生红豆杉树皮中紫杉醇含量仅为0.000 68%, 而56年生的树皮中紫杉醇含量为0.004 65%, 增加了6.8倍, 而且紫杉醇在各年龄段的增加量明显不同, 树龄23年以下的植株平均每年的增长量可达0.000 07%, 而23~34年含量增长有所趋缓, 34年以后增长量又开始加快, 平均每年高达0.000 13%。但Su等[33]对13~223年生的10株云南红豆杉针叶中紫杉醇含量的测定发现, 紫杉醇含量并非随着树龄的增长而持续地增加, 即增加到一定程度后会出现下降趋势, 树龄对紫杉醇含量的影响主要体现在较幼嫩植株, 而对成熟植株的影响不大。
4.3 部位红豆杉不同部位(根、主茎、侧枝、树皮、针叶、木质部等)紫杉醇含量不同。Su等[33]对10个龄级和12个地理种源的云南红豆杉样品的紫杉醇含量变化进行了研究, 发现云南红豆杉树皮的紫杉醇含量分别为当年生叶和3年生小枝的3.1倍和3.8倍; Zheng对[30]南方红豆杉的研究表明, 树皮中紫杉醇平均含量为0.030 2%, 而针叶和木质部的平均含量分别仅为0.004 3%和0.003 1%, 树皮的含量分别为针叶和木质部的7倍和9.8倍; Zhao等[34]研究了紫杉醇及其重要半合成前体在中国红豆杉各个部位的含量分布及其与植物发育的关系以及季节等环境因素的影响, 并详细分析了侧枝茎中紫杉醇的分布特点, 发现在同一植株紫杉醇的含量依次为主干皮>木根皮>侧枝树皮>种子>须根>嫩枝>叶[34, 35]; Zheng[30]对南方红豆杉、东北红豆杉、云南红豆杉的研究表明, 茎皮中紫杉醇含量均略高于根皮。如东北红豆杉树干皮部的紫杉醇含量为0.041 8%, 而根皮为0.028 1%[32]。500年生中国红豆杉各器官紫杉醇平均含量为0.015%[34], 西藏红豆杉各器官紫杉醇平均含量为0.002 3%[36], 但西藏红豆杉针叶的紫杉醇含量(0.006 1%)[37], 比南方红豆杉(0.004 7%)、东北红豆杉(0.003 9%)、云南红豆杉(0.004 5%)[30]都高。Zhao等[34]研究发现, 侧枝中紫杉醇含量最高的部位是紧邻形成层的次生木质部, 而非一般认为的树皮。紫杉醇含量最高的部位不一定是其合成能力最强的部位, 紫杉醇合成后可能被转运到其他部位, 或分泌到周围特殊的组织中。
4.4 季节Zhao等[34]对30年生的中国红豆杉研究表明, 当年生针叶春季紫杉醇含量为0.003 58%, 而秋季含量为0.002 04%, 春季高于秋季, 而对于多年生针叶, 紫杉醇含量从春季到秋季变化不显著。由于特定的生长环境, 东北红豆杉生长季和非生长季紫杉醇含量差异显著, 在生长旺季(4~8月)紫杉醇含量较低, 平均为0.001 2%;进入8月, 东北红豆杉生长开始减缓, 紫杉醇含量逐渐增加, 至10月完全停止生长时紫杉醇含量较高, 到2月达到最大值(0.004 8%)[32]。紫杉醇及其前体10-DAB在不同季节含量处于动态变化之中, 春季当年生针叶紫杉醇含量高时, 10-DAB含量相对较低; 秋季则相反。
4.5 生长环境经纬度、有效积温、霜期、降雨量等因子对红豆杉中紫杉醇含量均有影响。随着纬度的增加, 有效积温降低, 降水减少使东北红豆杉生长量减少, 而其紫杉醇含量却呈增加趋势[32]。光照对红豆杉紫杉醇含量也有影响, Zhang等[38]分别取生长在背阴处和充足光照的同龄云南红豆杉树皮进行分析比较, 结果显示生长于背阴处的紫杉醇含量为0.021%, 而光照充足的树皮紫杉醇含量仅为0.014%, 可见荫蔽环境有利于紫杉醇的积累。湿度和土壤肥力是影响红豆杉中紫杉醇及其衍生物含量的两个重要因素, 红豆杉喜湿润、肥沃的土壤, 生长在湿润、寒冷环境中的红豆杉紫杉醇含量明显高于生长在温暖、干燥环境中的红豆杉[39, 40]。
4.6 天然与人工种植红豆杉紫杉醇含量很低, 且作为濒危珍稀植物, 天然红豆杉资源极为匮乏, 须严格保护。为了满足市场需求, 开展红豆杉人工种植, 并研究其人工栽培植株与天然植株紫杉醇含量的差异非常必要。总之, 人工种植的红豆杉中紫杉醇含量低于天然红豆杉。Li等[41]对人工种植与天然生长的南方红豆杉紫杉醇含量比较表明:人工栽培植株的树皮、枝条和针叶紫杉醇含量分别为0.014 8%、0.001 93%、0.001 02%, 而天然生长植株相应器官的紫杉醇含量分别为0.017 7%、0.012 8%、0.009 46%, 可见, 天然红豆杉树皮中紫杉醇含量仅略高于人工栽培红豆杉, 而枝条和针叶的含量则明显高出人工栽培红豆杉。由于该试验没有给出人工栽培南方红豆杉的树龄, 而天然南方红豆杉树龄一般较大。此外, 在对红豆杉紫杉醇及其衍生物的测定属于微量测定, 不同实验间易产生较大误差, 在对不同种和不同器官的比较中, 由于采集时间、地点以及树龄的不同, 实验结果也会产生偏差[42]。
总之, 影响红豆杉中紫杉醇含量的因素较多, 包括植株的年龄、器官、种和变种, 还包括采摘季节、生长环境等。虽然不同的研究结果存在一定差异, 但都基本反映了红豆杉中紫杉醇含量的一般规律。从树龄看, 紫杉醇含量随着植株年龄的增长而增加, 而不同部位含量并未随年龄增长呈现规律性变化[43]。同一植株不同部位之间紫杉醇含量同样存在差异, 一般认为树皮>树叶>木质部。国内外不同种红豆杉中紫杉醇含量存在一定差异, 目前研究结果表明, 云南红豆杉紫杉醇含量最高, 南方红豆杉次之, 东北红豆杉最低。采摘季节也影响了紫杉醇含量, 植株非生长季的紫杉醇含量一般会高于生长季[44]。
如何保障充足的紫杉醇原料是大量生产紫杉醇及其产品面临的关键问题, 虽然已开发出多种生产紫杉醇的途径, 包括化学全合成、化学半合成、生物合成、基因工程、细胞组织培养等, 但都难以实现产业化。相对而言, 人工种植红豆杉是最现实、最快捷和成本最低的一种生产紫杉醇的方法, 目前国内外已有多个红豆杉的人工种植基地。
5 展望作为目前十分畅销的抗癌药物之一, 紫杉醇的原料保障已经成为红豆杉产业化开发的关键。近年来盲目的砍伐使得全球野生红豆杉资源受到了极大的破坏, 急需开展人工栽培, 缓解资源危机。目前, 人工种植、细胞培养、半合成与全人工合成等是解决资源匮乏的主要途径[45]。主要可以从以下几方面开展对红豆杉属植物的保护和利用:
① 加强对全球野生红豆杉种质资源的深入调查。弄清其野生资源的分布、蕴藏量, 加强野生资源及种质资源的保存, 为红豆杉产业化的可持续发展提供种质资源保障。另外, 由于红豆杉属植物的萌蘖能力较强, 对红豆杉分布比较集中的成熟林和过熟林, 可以有计划地开展红豆杉小枝和针叶的合理采集, 实现野生资源的合理利用。
② 加快红豆杉的人工种植规模。红豆杉属植物在扦插繁殖技术上比较成熟, 可以通过公司加农户、龙头企业自建种植基地等多种形式进行人工种植。另外, 在适宜生态区结合退耕还林工程、水土保持工程等, 大力营造以红豆杉为主的生态经济林, 也是一种值得推广的种植模式。红豆杉属各物种中的紫杉醇含量均有差异, 在各地具体的引种中, 宜选择适合当地环境的高紫杉醇含量和生长较快的物种栽培。
③ 加强红豆杉中紫杉醇等有效成分的品质生态学及分子生态学研究。系统深入研究红豆杉扦插苗木的生态适应性特点, 光、温、水、肥等环境因子对紫杉醇含量的影响机制、有效成分的积累动态; 加强高含量、高稳定遗传特性的红豆杉繁殖材料的选育培育工作, 开展红豆杉的规范化种植技术研究和红豆杉的品质生态学研究。
④ 加快红豆杉细胞培养技术研究。细胞培养不仅能够缓解野生资源的破坏, 而且因周期短, 产物易于分离, 是解决红豆杉资源匮乏的有效手段[46]。
⑤ 改进紫杉醇提取分离及合成工艺。如提高紫杉醇收率, 加强副产物(如紫杉醇类似物)的利用, 优化紫杉醇的生物合成、半合成和全合成研究。
| [1] | Hao DC, Xiao PG, Peng Y, et al. Research progress and trend analysis of biology and chemistry of Taxus medicinal resources[J]. Acta Pharm Sin(药学学报), 2012, 47: 827–835. |
| [2] | Wang YF, Wang Q, Ruan X, et al. Research status and utilization strategies of rare medicinal plants in Taxus[J]. Sci Silvae Sin(林业科学), 2012, 48: 116–125. |
| [3] | Zhou H, Zhu Q, Yang YF. Progress in molecular biology study of Taxus[J]. Plant Physiol J(植物生理学报), 2014, 50: 373–381. |
| [4] | Shi WQ. Historical story on natural medicinal chemistry of Taxol[J]. Chin Tradit Herb Drugs(中草药), 2011, 42: 1878–1884. |
| [5] | Li J, Wang CM. Advances of taxol combinatorial biosynthesis[J]. Chin J Biotech(生物工程学报), 2014, 30: 355–367. |
| [6] | Kong JQ, Wang W, Zu P, et al. Recent advances in the biosynthesis of taxol[J]. Acta Pharm Sin(药学学报), 2007, 42: 358–365. |
| [7] | Tolaney SM, Barry WT, Dang CT, et al. Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer[J]. New Engl J Med, 2015, 372: 134–141. DOI:10.1056/NEJMoa1406281 |
| [8] | Hunt JR, Lawo S, Walter D, et al. Identification of novel paclitaxel sensitivity genes via lentiviral CRISPR/Cas9 screening in haploid human cells[J]. Cancer Res, 2016, 76: 2059. DOI:10.1158/1538-7445.AM2016-2059 |
| [9] | Liu WC, Gong T, Zhu P. Advances in exploring alternative Taxol sources[J]. Cheminform, 2016, 6: 48800–48809. |
| [10] | Ru WM, Zhang JT, Zhang F, et al. Eco-environmental char acteristics and endangered causes of Taxus mairei, an endemic to China[J]. Bull Bot Res(植物研究), 2006, 26: 624–628. |
| [11] | Liu C, Yu H, Chen SL. Framework for sustainable use of medicinal plants in China[J]. Plant Divers Res(植物分类与资源学报), 2011, 33: 65–68. |
| [12] | Zhang ZQ, Liu ZM. Taxus (红豆杉)[M]. Shanxi: Northwest A & F University Press, 2014. |
| [13] | Meng XX, Huang LF, Chen SL, et al. Analysis of global ecology of Panax notoginseng in suitability and quality[J]. Acta Pharm Sin(药学学报), 2016, 51: 1483–1493. |
| [14] | Shen L, Wu J, Chen SL, et al. A study of global ecological adaptability and field selection practices of Panax ginseng[J]. China J Chin Mater Med(中国中药杂志), 2016, 41: 3314–3322. |
| [15] | Sawant KB. Efficient determination of clusters in K-Mean algorithm using neighborhood distance[J]. Int J Emerg Eng Res Technol, 2015, 3: 22–27. |
| [16] | Hijmans RJ, Cameron SE, Parra JL, et al. Very high resolution interpolated climate surfaces for global land areas[J]. Int J Climatol, 2005, 25: 1965–1978. DOI:10.1002/(ISSN)1097-0088 |
| [17] | Delgado-Baquerizo M, Reich PB, García-Palacios P, et al. Biogeographic bases for a shift in crop C: N: P stoichiometries during domestication[J]. Ecol Lett, 2016, 19: 564–575. DOI:10.1111/ele.12593 |
| [18] | Kriticos DJ, Webber BL, Leriche A, et al. CliMond: global high-resolution historical and future scenario climate surfaces for bioclimatic modeling[J]. Methods Ecol Evol, 2012, 3: 53–64. DOI:10.1111/j.2041-210X.2011.00134.x |
| [19] | Kearney MR, Isaac AP, Porter WP. microclim: Global estimates of hourly microclimate based on long-term monthly climate averages[J]. Sci Data, 2014, 1: 140006. DOI:10.1038/sdata.2014.6 |
| [20] | Choi YS, Jung YH, Kim JH, et al. Soil related parameters assessment comparing runoff analysis using harmonized world soil database(HWSD)and detailed soil map[J]. J Korean Soc Agric Eng, 2016, 58: 57–66. |
| [21] | Yang YL, Song XD, Dong JX, et al. Resources and distribution of Taxus in the World[J]. Forest Eng(森林工程), 2009, 25: 5–10. |
| [22] | Peragón JLN, Matias LFB, Simón JP. Restoration of European yew(Taxus baccata L.)in Mediterranean mountains: importance of seedling nursery fertilization and post-planting light levels[J]. Forest Syst, 2015, 24: 41. |
| [23] | Windels SK, Flaspohler DJ. Considerations for conservation and restoration of Canada yew in protected areas[J]. Nat Area J, 2014, 34: 249–253. DOI:10.3375/043.034.0215 |
| [24] | Linares JC. Shifting limiting factors for population dynamics and conservation status of the endangered English yew(Taxus baccata L., Taxaceae)[J]. Forest Ecol Manag, 2013, 291: 119–127. DOI:10.1016/j.foreco.2012.11.009 |
| [25] | Gajurel JP, Werth S, Shrestha KK, et al. Species distribution modeling of Taxus wallichiana (Himalayan Yew)in Nepal Himalaya[J]. Asian J Conserv Biol, 2014, 3: 127–134. |
| [26] | Farris E, Filigheddu R. Effects of browsing in relation to vegetation cover on common yew(Taxus baccata L.)recruit ment in Mediterranean environments[J]. Plant Ecol, 2008, 199: 309–318. DOI:10.1007/s11258-008-9434-x |
| [27] | Senneville S, Beaulieu J, Daoust G, et al. Evidence for low genetic diversity and metapopulation structure in Canada yew(Taxus canadensis): considerations for conservation[J]. Can J Forest Res, 2001, 31: 110–116. |
| [28] | Ahmed E, Bibi Y, Arshad M, et al. Conservation status of Taxus floridana, a critically endangered evergreen coniferous plant[J]. Pure Appl Biol, 2014, 3: 188. DOI:10.19045/bspab |
| [29] | Huang LF, Chen SL. Quality ecology on Chinese medicines: new emerging cross discipline[J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2017, 23: 1–11. |
| [30] | Zheng DY. Study on the taxol content in different parts of Taxus growing in China[J]. J Fujian Forest Coll(福建林学院学报), 2003, 23: 160–163. |
| [31] | Gao SL, Zhu DN, Zhou RH. Content of the taxol and brevifoliol in species of genus Taxus L. from East Asia and North America[J]. J China Pharm Univ(中国药科大学学报), 1995, 26: 8–10. |
| [32] | Cheng GY, Gao F, Ge CH, el at. Variation regularity of taxol content in natural populations of Taxus cuspidata Sieb. et Zucc. in China[J]. J Beijing Forest Univ(北京林业大学学报), 2004, 27: 7–11. |
| [33] | Su JR, Zhang ZJ, Deng J. Study on the taxol content in Taxus yunnanesis of different age and different provenance[J]. Forest Res(林业科学研究), 2005, 18: 369–374. |
| [34] | Zhao CF, Yu LJ, Liu Z, et al. Distribution of taxol and taxanes in yew tree[J]. Chem Ind Forest Prod(林产化学与工业), 2005, 25: 89–93. |
| [35] | Wu L, Han T, Li W, et al. Geographic and tissue influences on endophytic fungal communities of Taxus chinensis var. mairei in China[J]. Curr Microbiol, 2013, 66: 40–48. DOI:10.1007/s00284-012-0235-z |
| [36] | Hussain A, Qarshi IA, Nazir H, et al. In vitro callogenesis and organogenesis in Taxus wallichiana Zucc. The Himalayan Yew[J]. Pak J Bot, 2013, 45: 1755–1759. |
| [37] | Nhut DT, Nguyen PLH, Don NT, et al. Induction, growth and paclitaxel content of needle-and petiole-derived calli in Himalayan yew(Taxus wallichiana Zucc.)under light-emitting diodes[J]. Acta Biol Cracov S Bot, 2015, 56: 107–114. |
| [38] | Zhang H, Yang MH. Several influence factors of yew taxol content in the bark[J]. Chin Tradit Herb Drugs(中草药), 2002, 33: 41–43. |
| [39] | Yang FJ, PANG HH, Zu YG, et al. Relationships between the growth and taxol content of Taxus chinensis var. mairei and environment factors[J]. Bull Bot Res(植物研究), 2010, 30: 742–746. |
| [40] | Wang HW, Peng SL, Li MG, et al. Review of factors affecting the taxoids content of Taxus spp.[J]. Acta Ecol Sin(生态学报), 2006, 26: 1583. |
| [41] | Li J, Ya QK, Su XJ, et al. Determination of taxol in barks, seeds, needles and twigs of cultivated Taxus chinensis var. mairei by high performance liquid chromatography[J]. J Guangxi Norm Univ: Nat Sci(广西师范大学学报:自然科学版), 2005, 23: 68–70. |
| [42] | Liu HS, Gao YH, Liu LH, et al. Inhibitory effect of 13 taxane diterpenoids from Chinese yew(Taxus chinensis var. mairei)on the proliferation of HeLa cervical cancer cells[J]. Biosci Biotechnol Biochem, 2016, 80: 1883–1886. DOI:10.1080/09168451.2016.1194182 |
| [43] | Yang FJ, Pang HH, Zu YG, et al. Relationships between the growth and Taxol content of Taxus chinensis var. mairei and environment factors[J]. Bull Bot Res(植物研究), 2010, 30: 742–746. |
| [44] | Ojima I. Strategic incorporation of fluorine into taxoid anticancer agents for medicinal chemistry and chemical biology studies [J]. J Fluor Chem, 2017. Available online 3 January 2017. |
| [45] | Chen SL, Liao BS. Sustainable utilization of Chinese material medicine resources[J]. World Sci Technol/Mod Tradit Chin Med Mater Med(世界科学技术-中医药现代化), 2000, 6: 1–8. |
| [46] | Lu MB, Li L, Yu F, et al. On the method of planting cell culture from Taxus chinensis[J]. J Huazhong Univ Sci Technol(华中理工大学学报), 1999, 27: 94–97. |
 2017, Vol. 52
2017, Vol. 52