2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Material Medica, Chinese Academy of Sciences, Shanghai 201203, China
血栓是一种常见的渐进性疾病, 它与多种心血管疾病相关, 已成为全球致死致残的首要因素[1]。当前急性血栓治疗多采用全身给药或局部有创给药, 需要迅速给药且严格控制剂量, 存在一定的出血风险。若药物递送系统可在血栓部位特异性释药, 提高血栓的治疗效果, 则可避免或减轻疾病的不良后果。脂质体是一种由磷脂等双亲性脂质材料有序排列组成的囊泡, 常用作药物载体系统[2]。近年来, “智能型”脂质体如pH敏感型脂质体、温度敏感型脂质体和氧化应激敏感型脂质体等, 因其易制备, 可在靶向部位释放药物, 在药物递送领域受到广泛关注[3, 4]。
阻塞血管和正常血管的物理特性存在显著区别, 前者血管中剪切力大于后者1~2个数量级, 正常血管中平均剪切力约为1.5 Pa, 而阻塞血管中剪切力可升至100 Pa[5, 6]。正常血小板为椭球形, 在狭窄部位受高剪切力作用, 快速被激活变形[7, 8]。已有研究制备了仿血小板的剪切力敏感型载体, 包载溶栓药物用于血栓的治疗[9], 但该载体制备较复杂, 限制了实际应用。基于此, 作者期望设计出制备简单的剪切力敏感型载体(shear-stress sensitive liposomes, SSSL)。
本研究设计了仿生型剪切力敏感型药物递送系统, 以人工合成的1, 3-二棕榈酰胺磷脂酰胆碱(1, 3-dipalmaminophospholipid, Pad-PC-Pad)为膜材[10, 11], 薄膜水化法制备了包载聚集淬灭荧光染料的脂质体。脂质体在低剪切力下稳定, 其包载的高浓度荧光染料呈淬灭状态; 高剪切力下脂质体破裂, 荧光染料释放发出荧光。在构建载体的基础上, 对Pad-PC-Pad进行了表征, 并评价了其剪切力敏感性和在狭窄部位的释放特性。
材料与方法药品、试剂和仪器 1, 3-二氯丙醇、三氯氧磷(上海安耐吉化学有限公司); 2 mol·L-1盐酸乙醚溶液(北京华威锐科化工有限公司); PC-98T (上海艾韦特医药科技有限公司); 其他试剂均为市售分析纯。Zetasizer Nano ZS粒度仪(英国Malvern公司); PB-10 pH计(德国Sartorius公司); 超声波细胞粉碎机(宁波新芝生物科技股份有限公司); JEM-2100F型透射电镜(日本JEOL公司); 酶标仪(美国BioTek公司); 全自动数字式分注器(德国Schott公司)。
Pad-PC-Pad的合成 参考文献[10, 11], 并优化条件, 化学全合成Pad-PC-Pad (图 1A)。具体步骤如下:取乙醇胺(8.97 mmol), 适量无水二氯甲烷溶解, 加入三乙胺(138 mmol), 室温搅拌30 min。(Boc)2O (89.7 mmol)溶于50 mL无水二氯甲烷, 缓慢加入, 室温搅拌10 h。加入饱和NH4Cl溶液, 适量二氯甲烷提取, 减压浓缩。柱色谱分离得到叔丁氧羰基(Boc)保护的乙醇胺。取POCl3 (3.0 mmol)溶于适量无水乙醚中, 加入三乙胺(3.0 mmol), 冰浴搅拌30 min, 再加入1, 3-二氯丙醇(化合物1, 3.0 mmol), 室温搅拌3 h。过滤除去沉淀, 适量无水乙醚洗涤, 减压浓缩。浓缩后产物复溶于45 mL二氯甲烷, 加入适量N, N-二异丙基乙胺, 室温搅拌30 min。取Boc保护的乙醇胺(8.37 mmol), 适量二氯甲烷溶解, 逐滴加入, 室温搅拌6 h。适量25%氨水终止反应, 适量无水乙醚提取, 减压浓缩。柱色谱分离得到化合物2。取化合物2 (2.85 mmol)溶于50 mL干燥DMSO, 加入NaN3 (7.65 mmol), 100 ℃反应10 h。加入冰水20 mL, 适量乙醚分次提取。减压浓缩。浓缩产物复溶于适量甲醇, 加入Pd/C催化剂(200 mg, 10 mol%)催化, H2气流下反应10 h。过滤, 减压浓缩, 浓缩产物复溶于50 mL二氯甲烷, 加入三乙胺(9.97 mmol), 室温搅拌30 min。取棕榈酰氯(7.39 mmol), 适量二氯甲烷溶解, 逐滴加入, 室温搅拌2 h, 减压浓缩。柱色谱分离得到化合物3。取化合物3 (0.145 mmol), 加入1 mol·L-1盐酸乙醚溶液2 mL, 室温搅拌1.5 h, 减压浓缩。取浓缩后产物复溶于适量甲醇中, 加入硫酸二甲酯(1.45 mmol), 40 ℃下搅拌30 min。取K2CO3 (1.45 mmol), 溶于蒸馏水2.3 mL, 快速加入, 继续搅拌30 min。浓缩后甲醇复溶, 过滤, 减压浓缩, 得到目标产物Pad-PC-Pad (化合物4)。所得产物用薄层色谱法、1H NMR和ESI-MS进行验证。
空白脂质体的制备 采用薄膜分散法分别制备SSSL和传统脂质体(traditional liposomes, TL)。取Pad-PC-Pad磷脂40 mg, TL采用PC-98T, 氯仿2 mL溶解, 转移至圆底烧瓶中, 37 ℃减压旋转蒸发1 h成均匀脂质膜。精密吸取PBS缓冲液1 mL加入到圆底烧瓶中, 60 ℃水化40 min。冰浴下探头超声5次(功率50 W, 工作2 s, 暂停2 s), 得到空白脂质体溶液。
钙黄绿素标记脂质体的制备 取Pad-PC-Pad磷脂40 mg, TL采用PC-98T, 按照上述方法成膜。精密吸取100 mmol·L-1钙黄绿素溶液1 mL加入到圆底烧瓶中, 60 ℃水化40 min。冰浴下探头超声5次(功率50 W, 工作2 s, 暂停2 s), 得到脂质体溶液。将制备得到的脂质体溶液过Sephadex G50柱, 用PBS (pH 7.4) 洗脱, 收集脂质体部分, 即得钙黄绿素标记的脂质体[12] (图 1B)。

|
Figure 1 Synthetic route of Boc group protected cholamine and target compounds 1, 3-dipalmaminophospholipid (Pad-PC-Pad) (A) and schematic illustration of the preparation of liposomes made from Pad-PC-Pad (B). Liposomes were prepared by filming-rehydration method, carbohydrate fatty amides at 1-and 3-positions were interdigitated, lenticular liposomes were formed and release of calcein from liposome was triggered by high shear stress |
脂质体制备条件筛选 为保证脂质体溶液的均一性和分散性, 对SSSL制备过程的水化温度和探头超声的时间进行考察。取Pad-PC-Pad磷脂40 mg, 按照上述方法成膜。取PBS缓冲液1 mL加入到圆底烧瓶中, 分别在40、50、60、70和80 ℃水化, 冰浴下探头超声5次(功率50 W, 工作2 s, 暂停2 s), 测定粒径及其分布。同时, 取60 ℃下水化的脂质体溶液, 分别超声0、1、3、5、10和20次(功率50 W, 工作2 s, 暂停2 s), 测定粒径及其分布。
制备稳定性 为考察脂质体在制备条件下的稳定性, 取TL和SSSL适量, 冰浴下探头超声5次(功率50 W, 工作2 s, 暂停2 s), 用PBS稀释一定倍数, 以酶标仪检测荧光强度。并取等量TL和SSSL, 1% Triton破坏脂质体, 稀释相同浓度, 用于测定荧光值总量。释放度的计算公式: Release (%) = (I -I0) / (I∞-I0) × 100, I为超声处理后荧光值, I0为空白荧光值, I∞为加入Triton后总的荧光值[13]。激发光为490 nm, 发射光为515 nm。
粒度和zeta电位 取TL和SSSL适量, 以PBS (pH 7.4) 稀释, 使用Zetasizer Nano ZS粒度测定仪于25 ℃测定粒径、粒径分布和zeta电位。
透射电子显微镜 以PBS (pH 7.4) 稀释SSSL、TL至0.5 mg·mL-1, 2%磷钨酸负染[14], 各取适量滴加在铜网上, 置于透射电镜下观察脂质体形态。
载体稳定性 通过脂质体的粒径和释放度的变化考察载体静置稳定性。取TL和SSSL适量, 用PBS稀释, 分别于1、2、3、5和7天测定载体的粒径和荧光强度。以“制备稳定性”项下方法测定总荧光强度, 计算释放度。
剪切力敏感性初步评价 利用探头超声模仿剪切力作用, 考察不同温度下脂质体在不同超声功率下的释放情况, 以评价温度和剪切力对脂质体稳定性的影响。分别于4、25和37 ℃条件下, 精确吸取脂质体溶液1.0 mL共7份, 置于5.0 mL离心管中。分别在0、10、20、50、100、200和300 W功率下探头超声1 min, 取100 μL置于量瓶中, 并用PBS定容。采用酶标仪测定样品钙黄绿素释放情况。另精密量取1份脂质体溶液100 μL置于量瓶中, 加10% Triton (PBS, pH 7.4) 溶液1 mL破坏脂质体, 并用PBS定容。用于测定荧光值总量, 计算释放度。
体外模拟 采用模拟装置研究脂质体在狭窄部位的释放特性。将脂质体溶液稀释100倍后通过模拟装置, 控制流速分别得到1、25、50、75和100 Pa的剪切力, 用酶标仪测定通过不同剪切力的脂质体内钙黄绿素的释放情况, 并用活体成像仪对狭窄管路进行成像。剪切力的计算公式: τ = 4 µQ / πr3, 其中τ为剪切力, µ为流体黏度, Q为流体流速, r为管道半径, r狭窄 = 0.25 mm, r正常 = 1 mm。
数据处理 实验所有数据以x± s表示, 如果数据符合正态分布, 统计方法采用双侧t检验, P<0.05为显著性差异, P<0.01为极显著差异; 如果数据不符合正态分布, 则采用F检验。
结果 2.1 1 Pad-PC-Pad的合成Boc保护的乙醇胺在薄层板上遇茚三酮呈现灰色斑点, Rf = 0.31 (MeOH-CH2Cl2, 1:20), 与Fedotenko等[10]的研究结果一致。由此确定合成产物即为Boc保护的乙醇胺。各中间产物和Pad-PC-Pad的1H NMR和MS分析结果如图 2所示。化合物2的1H NMR (400 MHz, CDCl3)结果表明: δ 3.70~3.24 (s, 8H, 4个亚甲基峰), 1.41 (s, 9H, Boc基团3个甲基峰) (图 2A), 说明1, 3-二氯丙醇连接上Boc保护的乙醇胺基团, 由此确定成功合成了化合物2。化合物3的1H NMR (400 MHz, CDCl3)结果表明: δ 1.43 (s, 9H, Boc基团上3个甲基峰), 1.24 (s, 48H, 棕榈酰胺基团上24个亚甲基峰), 0.87 (t, 6H, 棕榈酰胺上2个甲基峰) (图 2B), 说明成功合成棕榈酰胺结构; 化合物MS (m/z)为789.2 [M+H]+ (图 2C), 与文献[10]报道结果基本一致, 结合核磁解析结果, 进一步确定所得产物即为化合物3。Pad-PC-Pad的1H NMR (400 MHz, CD3OD)结果表明: δ 3.41 (s, 9H, 3个甲基峰) (图 2D); 说明反应物甲基化完全, 生成磷脂酰胆碱结构; 化合物MS (m/z)为733.0[M+H]+ (图 2E), 与目标产物分子质量相吻合, 可知所得产物为Pad-PC-Pad。
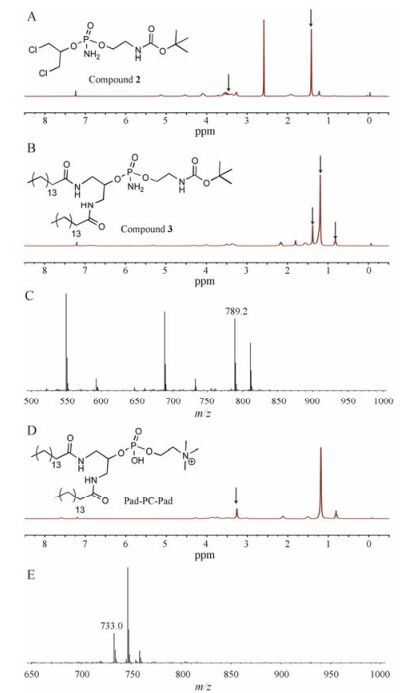
|
Figure 2 1H NMR and ESI-MS spectrum of the related intermediate products and Pad-PC-Pad. (A) 1H NMR spectrum of compound 2; (B) 1H NMR spectrum of compound 3; (C) ESI-MS spectrum of compound 3; (D) 1H NMR spectrum of Pad-PC-Pad; (E) ESI-MS spectrum of Pad-PC-Pad |
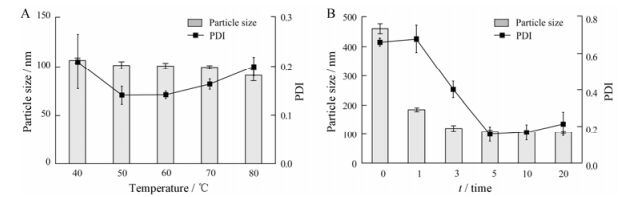
薄膜水化法制备得到SSSL。在脂质体的制备过程中, 不同水化温度下制备脂质体, 结果见图 3A。不同温度下脂质体平均粒径无明显变化, 50 ℃~70 ℃下粒径分布狭窄, 而高温和低温下粒径分布较宽, 故选择60 ℃为水化温度。低温和高温下粒径分布宽的原因可能是, 低温下磷脂处于胶态, 流动性小, 大粒子较难被分散[15]; 高温下磷脂中的部分化学键不稳定, 制备的脂质体易聚集变质。
|
Figure 3 Size and polydispersity index (PDI) value of liposome prepared at different rehydration temperature (A) and different probe ultrasonic time (50 W, work for 2 s, pause for 2 s) (B). n = 3, x± s |
改变探头超声时间, 制备的脂质体粒径分布结果见图 3B。随着探头超声(功率50 W, 工作2 s, 暂停2 s)次数增加, 粒径明显减小, 但超声5次后, 该功率下粒径基本维持不变。故选择探头超声5次制备脂质体。
通过脂质体冰浴下探头超声5次(功率50 W, 工作2 s, 暂停2 s)后释放度变化考察载体的制备稳定性。TL和SSSL超声后, 释放度分别为(2.15±1.21) %和(2.42±0.87) %, 两组无显著性差异。结果表明TL和SSSL对制备条件稳定。
3 构建和表征选择合适的水化温度和探头超声时间, 薄膜水化法制备得到SSSL和TL。使用Zetasizer Nano ZS粒度测定仪于25 ℃测定粒径, 结果如图 4A。由图可见, SSSL和TL平均粒径相近, 均为100 nm左右, 粒径分布较窄, 且呈单峰分布。

|
Figure 4 Particle size distribution (A), zeta potential distribution (B) and transmission electron micrographs (TEM) (C) of traditional liposomes (TL) and shear-stress sensitive liposomes (SSSL) |
Zeta电位用于表征粒子表面性质和大小, 可决定粒子的物理稳定性等。采用Zetasizer Nano ZS粒度测定仪测定zeta电位结果见图 4B。TL荷负电, zeta电位为-12 mV左右; SSSL荷正电, zeta电位为+15 mV左右。天然磷脂为磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰丝氨酸等的复合物, 常呈荷负电; 合成磷脂为酰胺键取代酯键的新型磷脂, 仲胺结构呈荷正电。根据电位在胶体研究中的理论[16], 两者电位绝对值相近, 胶体稳定性较为相近。
透射电镜结果(图 4C)表明, TL形态呈球形, 大小比较均匀, 粒径约在100 nm左右, 而SSSL形态呈椭球形, 此结果与文献[11]报道一致。可能因为Pad-PC-Pad不同于天然磷脂, 其脂肪酸长链为1, 3-位排列而非1, 2-位排列, 脂肪酸长链为相互交错的结构[17, 18], 膜流动性小于天然磷脂[19, 20], 易于形成椭球形脂质体。
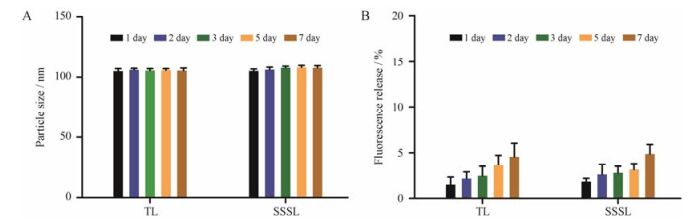
通过脂质体粒径和释放度的变化考察载体的静置稳定性。由图 5A可见, TL和SSSL两组制剂粒径均无明显变化, 未发生明显聚集; 由图 5B可见, TL和SSSL组随着静置时间延长, 内含物释放增加, 但放置7天后两组制剂释放度均小于5%, 且两组无显著性差异, 可能内含物的释放与脂质体双层膜的本身流动性有关[13]。粒径和释放度考察结果表明TL和SSSL均较稳定。
|
Figure 5 The diameter (A) and fluorescence release (B) of TL and SSSL in 1, 2, 3, 5, 7 days. n = 3, x± s |
本研究利用酶标仪测定不同剪切力下SSSL和TL钙黄绿素的释放情况, 以初步考察脂质体的剪切力敏感性, 结果如图 6所示。在4 ℃条件下(图 6A), 随着剪切力的增加, TL组无明显释放, SSSL组释放显著增加, 300 W功率下释放率约为20%;在25 ℃和37 ℃条件下(图 6B和6C), 随着剪切力的增加, TL组有少量释放, SSSL组释放增加显著, 37 ℃下300 W功率时释放度达60%以上。结果可见, SSSL在不同温度下均可表现出显著的剪切力敏感性, TL剪切力敏感性较差, 且不同温度下释放行为存在差异。在4 ℃~37 ℃内, 随着温度的升高, 两组的剪切力敏感性均呈现增加趋势。

|
Figure 6 The release profiles of calcein loaded in TL and SSSL at 4 ℃ (A), 25 ℃ (B) and 37 ℃ (C). n = 3, x± s |
有研究表明, 球形结构脂质体对高剪切力表现稳定, 而膜弯曲系数大的脂质膜所形成的脂质体对剪切力敏感[21]。本研究中Pad-PC-Pad制备的脂质体中棕榈酰胺长链相互交错, 膜弯曲系数大, 对剪切力敏感, 而PC-98T形成的脂质体为球形结构, 对剪切力不敏感。且温度升高时, 磷脂分子热运动加剧, 分子的有序性受到破坏, 脂质体稳定性降低, 造成脂质体内含物释放增加[22]。
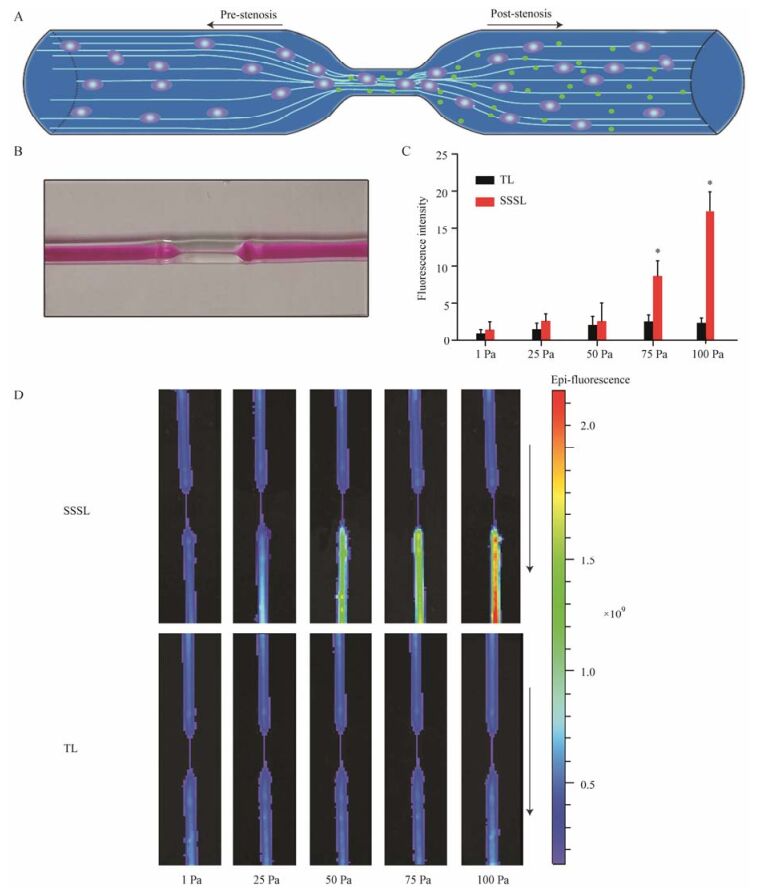
5 体外模拟本研究利用体外模拟装置进一步评价脂质体的剪切力敏感性和狭窄部位释放成像效果。研究设计了90%狭窄的微流体装置(图 7A和7B), 通过剪切力计算公式可知, 调节流体速度可用来调节剪切力大小。将脂质体制剂通过微流体装置, 狭窄部位释放成像研究结果如图 7C和7D所示。通过控制流速得到不同的剪切力条件, 利用酶标仪测定模拟装置中不同剪切力下钙黄绿素的释放情况。SSSL组钙黄绿素的释放度随剪切力增加而增加, 而TL组随剪切力增加, 释放度无明显增加。采用活体成像仪考察结果可见, 100 Pa时, TL组在狭窄部位无明显释放, SSSL组在狭窄部位快速释放。
|
Figure 7 Shear-stress sensitivity of SSSL and TL in model system. (A) A microfluidic stenosis model showing how SSSL should remain intact in the prestenotic region but then form holes to release free calcein when they flow through a constriction. (B) A photograph of the microdevice that mimics stenosis fabricated in glass. (C) The release intensity of calcein of SSSL and TL in different shear-stress after passing through the loop. n = 3, x± s. *P < 0.05 vs TL group. (D) Distribution of free calcein in local blocking lumen in different shear-stress |
结合酶标仪测定结果和活体成像仪对狭窄部位快速释放特性的考察结果, 可以看出SSSL较TL更易释放其内含物, 且其释放行为主要发生在狭窄部位, 即高剪切力部位, 证明SSSL具备剪切力敏感性。
讨论剪切力敏感性制剂是一种近年来新兴的药物递送系统[9, 11], 利用体内自身物理化学性质, 提高了制剂包载物的特异性释放。本研究利用全合成的磷脂Pad-PC-Pad构建功能性脂质膜, 制备得到一种椭球形脂质体, 具备一定的剪切力敏感性, 可达到使脂质体内含物在狭窄部位特异性释放的目的。
人工合成的Pad-PC-Pad较天然磷脂更倾向于形成非球形结构, 主要原因可能在于: Pad-PC-Pad中棕榈酰胺长链为1, 3-位排列, 天然磷脂通常为1, 2-位排列, 膜流动性小于天然磷脂[19, 20]。已有研究对Pad-PC-Pad制备得到的大单层囊泡进行结构表征, 为多面体结构, 证实其流动性较弱[11]。此外, 烃基长链1, 3-位排列时呈现交错排列状态[17], 利于引入的酰胺键在极性区域形成氢键, 增加形成囊泡的稳定性。因此合成磷脂Pad-PC-Pad可形成较为稳定的椭球形结构。
Pad-PC-Pad制备的脂质体具备一定的剪切力敏感性, 是因为该磷脂形成的双层膜流动性差, 弯曲系数大, 对剪切力表现敏感。而传统磷脂制备的球形脂质体, 其双层膜流动性好, 对剪切力表现高度稳定。另外, 椭球形脂质体内含物的释放, 可能主要归功于瞬间孔洞的形成。脂质体于高剪切力下通过狭窄部位多次, 脂质体浓度保持不变, 表明脂质体未被完全破坏, 内含物释放与高剪切力下椭球形脂质体的瞬间孔洞形成有关[11]。
本研究表明, Pad-PC-Pad制备的脂质体可作为一种剪切力敏感性药物递送系统, 在狭窄部位特异性释放内含物。该研究为剪切力敏感性的制剂在药物递送系统的应用奠定了基础, 有望用于血栓部位特异性的治疗。
| [1] | Mackman N. Triggers, targets and treatments for thrombosis[J]. Nature, 2008, 451: 914–918. DOI:10.1038/nature06797 |
| [2] | Allen TM, Cullis PR. Liposomal drug delivery systems: from concept to clinical applications[J]. Adv Drug Deliv Rev, 2013, 65: 36–48. DOI:10.1016/j.addr.2012.09.037 |
| [3] | Torchilin VP. Recent advances with liposomes as pharmaceutical carriers[J]. Nat Rev Drug Discov, 2005, 4: 145–160. DOI:10.1038/nrd1632 |
| [4] | Mellal D, Zumbuehl A. Exit-strategies-smart ways to release phospholipid vesicle cargo[J]. J Mater Chem B, 2014, 2: 247–252. DOI:10.1039/C3TB21086C |
| [5] | Bark DL Jr, Ku DN. Wall shear over high degree stenoses pertinent to atherothrombosis[J]. J Biomech, 2010, 43: 2970–2977. DOI:10.1016/j.jbiomech.2010.07.011 |
| [6] | Cheng C, Helderman F, Tempel D, et al. Large variations in absolute wall shear stress levels within one species and between species[J]. Atherosclerosis, 2007, 195: 225–235. DOI:10.1016/j.atherosclerosis.2006.11.019 |
| [7] | Nesbitt WS, Westein E, Tovarlopez FJ, et al. A shear gradient-dependent platelet aggregation mechanism drives thrombus formation[J]. Nat Med, 2009, 15: 665–673. DOI:10.1038/nm.1955 |
| [8] | Ruggeri ZM, Orje JN, Habermann R, et al. Activation-independent platelet adhesion and aggregation under elevated shear stress[J]. Blood, 2006, 108: 1903–1910. DOI:10.1182/blood-2006-04-011551 |
| [9] | Korin N, Kanapathipillai M, Matthews BD, et al. Shear-activated nanotherapeutics for drug targeting to obstructed blood vessels[J]. Science, 2012, 337: 738–742. DOI:10.1126/science.1217815 |
| [10] | Fedotenko IA, Zaffalon PL, Favarger F, et al. The synthesis of 1, 3-diamidophospholipids[J]. Tetrahedron Lett, 2010, 51: 5382–5384. DOI:10.1016/j.tetlet.2010.07.140 |
| [11] | Holme MN, Fedotenko IA, Abegg D, et al. Shear-stress sensitive lenticular vesicles for targeted drug delivery[J]. Nat Nanotechnol, 2012, 7: 536–543. DOI:10.1038/nnano.2012.84 |
| [12] | Li Qun, Wu SW, Liang WQ, et al. Cellular delivery of liposomal calcein and its mechanism study[J]. Chin Pharm J(中国药学杂志), 2014, 49: 1321–1326. |
| [13] | Shimanouchi T, Ishii H, Yoshimoto N, et al. Calcein permeation across phosphatidylcholine bilayer membrane: effects of membrane fluidity, liposome size, and immobilization[J]. Colloid Surf B Biointerfaces, 2009, 73: 156–160. DOI:10.1016/j.colsurfb.2009.05.014 |
| [14] | Li FF, Zhang XX, Guo SY, et al. Preliminary study on pH-sensitive lipid bilayer-coated mesoporous silica nanoparticles as a novel drug carrier for antitumor drug[J]. Acta Pharm Sin(药学学报), 2013, 48: 291–297. |
| [15] | Lösche M, Sackmann E, Möhwald H. A fluorescence microscopic study concerning the phase diagram of phospholipids[J]. Ber Bunsenges Phys Chem, 1983, 87: 848–852. DOI:10.1002/bbpc.v87:10 |
| [16] | Hunter RJ, Ottewill RH, Rowell RL. Zeta Potential in Colloid Science: Principles and Applications[M]. London: Academic Press, 2013: 239-246. |
| [17] | Weinberger A, Tanasescu R, Stefaniu C, et al. Bilayer properties of 1, 3-diamidophospholipids[J]. Langmuir, 2015, 31: 1879–1884. DOI:10.1021/la5041745 |
| [18] | Zumbuehl A, Dobner B, Brezesinski G. Phase behavior of selected artificial lipids[J]. Curr Opin Colloid Int Sci, 2014, 19: 17–24. DOI:10.1016/j.cocis.2014.01.003 |
| [19] | Sunamoto J, Goto M, Iwamoto K, et al. Synthesis and characterization of 1, 2-dimyristoylamido-1, 2-deoxyphosphatidylcholine as an artificial boundary lipid[J]. Biochim Biophys Acta, 1990, 1024: 209–219. DOI:10.1016/0005-2736(90)90346-P |
| [20] | Fedotenko LA, Stefaniu C, Brezesinski G, et al. Monolayer properties of 1, 3-diamidophospholipids[J]. Langmuir, 2013, 29: 9428–9435. DOI:10.1021/la401692e |
| [21] | Noguchi H. Polyhedral vesicles: a Brownian dynamics simulation[J]. Phys Rev E Stat Nonlin Soft Matter Phys, 2003, 67: 118–126. |
| [22] | Papahadjopoulos D, Nir S, Ohki S. Permeability properties of phospholipid membranes: effect of cholesterol and temperature[J]. Biochim Biophys Acta, 1972, 266: 561–583. DOI:10.1016/0005-2736(72)90354-9 |
 2017, Vol. 52
2017, Vol. 52


