2. 中南大学化学化工学院, 湖南 长沙 410083
2. College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China
中药材品种混乱、质量低劣阻碍了临床应用和中药行业发展。整体或综合的分析方法对中药及其制剂的鉴别、质控、稳定临床疗效具有重要意义。目前, 液相色谱法[1, 2]、气相色谱法[3]、色谱-质谱联用法[4, 5]、核磁共振法[6]等, 已用于分析中药及其制剂的化学成分, 成为国际公认的控制中药和天然药物质量的有效技术。但上述分析技术所使用仪器较昂贵, 通常需要对样品进行预处理, 从测定数据中提取有效的鉴别评价信息的过程较复杂。因此, 开发简单、快速、经济的中药鉴别和质量控制技术日益重要。
非线性化学指纹图谱技术是一种最近发展起来的基于化学振荡和化学湍流等非线性化学反应的全新技术, 它通过对样品整体检测化学或活性成分来反映样品的整体信息。该技术无需分离和提纯等预处理技术, 是一种简单、快速、经济的中药鉴别和质量控制技术[7, 8]。目前, 已有学者运用非线性化学反应来表征中药复杂体系成分群集特征的指纹图谱, 成功鉴别甘草、大黄、人参等中药材的混伪品及来源[9-11]。西洋参(Panax quinquefolium L.)和人参(Panax ginseng C. A. Mey)都属于五加科人参属药用植物, 是我国常用的名贵中药, 二者形态、性状、化学成分相近, 但功效存在差异, 价格差异较大[12, 13]。市场上经常出现相互混用的情况, 故鉴别这两种参以防混用意义重大[14-16]。此外, 不同产地西洋参品质不一[17, 18], 但传统外观性状鉴别很难实现产地溯源。传统外观性状鉴别主观性强、准确性差, 加工炮制后的碎片和粉末难以鉴别, 而现代分析仪器昂贵, 存在样品预处理复杂等问题。本实验应用非线性化学指纹图谱技术研究西洋参和人参, 建立了一种快速、简单的药材鉴别及药材产地溯源的方法。
材料与方法仪器设备 MZ-1B-2型非线性化学指纹图谱测定仪, 湖南尚泰测控科技有限公司生产; Waters高效液相色谱仪: 1525 HPLC系统(Milford, MA, USA); Breeze色谱工作站, 电子天平(Mettler Toledo, AL204-IC, 瑞士)。
材料与试剂 人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3和Rd购自成都曼斯特生物科技有限公司, 纯度均大于98%。乙腈(色谱纯, Fisher公司), 哇哈哈纯净水(杭州, 娃哈哈集团), 纯水(由纯水仪自制); 1.000 mol·L-1硫酸溶液, 0.800 mol·L-1丙酮溶液, 0.080 mol·L-1硫酸锰溶液, 0.800 mol·L-1溴酸钠溶液。样品: 4年生西洋参药材, 采自加拿大(编号1~10)、中国陕西汉中(编号11~20)、吉林(编号21~30) 共3个批次, 由中国医学科学院药用植物研究所黄林芳研究员鉴定; 人参为来自吉林的林下参, 由中南大学张泰铭教授提供。
非线性化学指纹图谱测定 精密称定0.4 g、过100目筛的样品并量取H2SO4溶液15.00 mL、丙酮溶液6.00 mL、硫酸锰溶液6.00 mL、蒸馏水31.00 mL于反应器中, 盖好带注射孔和电极的反应器盖, 开启仪器, 将恒温槽设置为37.0 ℃, 开启循环泵和磁力搅拌器(900 r·min-1), 打开菜单开始采集数据, 搅拌10.0 min时通过进样器迅速加入溴酸钠溶液2.00 mL。此时, 反应器中的溶液体积为60.00 mL。数据采集到所测电位E不再随时间t变化为止。
非线性化学指纹图谱技术方法学考察
稳定性 取同一批次吉林产西洋参实验样品4份, 按实验方法分别在0、6、12和24 h的相对时间后检测其指纹图谱, 以4次实验的指纹图谱的参数平均值为参照, 计算出每个指纹图谱的系统相似度。
重复性 取同一批次吉林产西洋参实验样品6份作为供试品, 以其按实验方法测得的指纹图谱考察方法的重复性, 以6次平行测定的指纹图谱的参数平均值为参照, 计算出每个指纹图谱的系统相似度。
非线性化学指纹图谱特征参数和系统相似度计算 非线性化学指纹图谱不仅有明显的直观特征, 而且有丰富的特征参数。本研究测定的特征参数包括峰谷电位(Ecan)、峰谷时间(tcan)、峰顶电位(Epet)、峰顶时间(tpet)、诱导时间(tind)、停波电位(Eune)、停波时间(tune)、平均波动周期(τund)、波动寿命(tund)、最大波幅(ΔEmax)和波动次数(nwav), 共11个参数。利用这些特征参数可计算相应非线性化学指纹图谱之间的系统相似度, 具体非线性化学指纹图谱系统相似度原理、算法等已在课题组前期研究中做了详细报道[8, 9]。系统相似度计算公式:
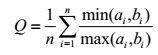
|
(1) |
式(1) 中n为相似要素的个数, ai和bi分别表示非线性化学指纹图谱A和B中的第i个相似要素, 而min(ai, bi)、max(ai, bi)则分别表示这对相似要素中特征值较小者和较大者。
色谱条件 采用Waters C18色谱柱(3.9 mm × 150 mm, 4.6 μm), 以乙腈(A)-0.1%甲酸水(B)为流动相进行梯度洗脱, 洗脱程序为: 0~15 min, 19% A, 15~20 min, 19%→21% A, 20~22 min, 21%→26% A, 22~40 min, 26%→31% A, 40~45 min, 31% A。45~57 min, 31%→43% A, 43~60 min, 43%→45% A。流速为1 mL·min-1; 紫外检测波长203 nm, 进样量10 μL, 柱温为30 ℃。
对照品溶液的制备 取人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3和Rd对照品适量, 精密称定, 加甲醇制成质量浓度分别为0.320、0.960、1.50、0.180、0.023、0.06和0.40 mg·mL-1的混合溶液作为对照品贮备液。采用倍半稀释法获得6组混合对照品溶液。
供试品溶液的制备 将药材干燥至恒重后, 粉碎, 过四号筛, 置自封袋保存。精确称取药材粉末1 g, 置100 mL具塞三角瓶中, 加色谱级甲醇20 mL, 称重, 超声提取30 min, 冷却, 称量补足减失重量, 混合均匀后, 过0.22 μm滤膜, 装入717进样器用样品瓶, 于4 ℃贮存备用。
HPLC方法学考察
线性关系及定量限、检测限考察 分别吸取对照品贮备液10 μL, 按色谱条件进样, 以峰面积为纵坐标, 浓度为横坐标, 绘制标准曲线。取倍半稀释的最低浓度的混合对照品进一步逐级稀释考察定量限(信噪比为9~11) 和检测限(信噪比为2~3)。
精密度 精密吸取同一混合对照品溶液10 μL, 按上述色谱条件重复进样6次。记录各成分色谱峰面积和保留时间, 并分别计算RSD值。
重复性 取吉林产西洋参样品(编号25), 按供试品制备方法, 平行制备供试品溶液6份, 分别进样分析。记录各成分的保留时间和色谱峰面积, 计算RSD值。
加样回收率 取已知含量的吉林产西洋参样品(编号25), 平行6份, 置于具塞锥形瓶中, 加入对照品溶液适量(使得对照品含量相当于样品中含量的100%), 按供试品溶液制备方法制备并进样分析, 计算各成分的回收率和RSD。
数据处理 应用Excel和SPSS Statistics 19软件对HPLC测定数据进行处理和分析。
结果 1 西洋参和人参的非线性化学指纹图谱 1.1 非线性化学指纹图谱技术方法学考察在0、6、12和24 h的相对时间后检测其指纹图谱, 指纹图谱的系统相似度分别为0.996 8、0.995 4、0.994 6、0.994 9, 表明方法稳定性很好。重复性考察6份样品指纹图谱的系统相似度分别为: 0.994 3、0.993 7、0.993 9、0.995 0、0.995 1和0.994 7, 表明该方法具有良好重现性, 符合测定非线性化学指纹图谱的要求。
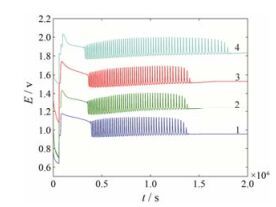
1.2 西洋参与人参非线性化学指纹图谱的特征差异在完全相同的条件下测得吉林人参以及吉林、加拿大和陕西产的西洋参非线性化学指纹图谱(图 1), 并计算各产地样品非线性化学指纹图谱的平均主要特征参数, 见表 1。由结果可知, 西洋参和人参非线性化学指纹图谱的特征之间有显著差异。人参指纹图谱的诱导曲线中出现3个明显的尖峰, 而西洋参图谱的诱导曲线中只有一个并不尖锐的峰; 人参指纹图谱的波动寿命和停波时间均比西洋参长得多; 人参指纹图谱波动曲线中平均波动周期较西洋参的平均波动周期长; 人参指纹图谱的诱导时间较短, 而西洋参的诱导时间较长。
|
Figure 1 Non-linear chemical fingerprint of P. quinquefolium (produced in Canada, 1; Shaanxi, 2 and Jilin, 3) and P. ginseng (produced in Jilin, 4) |
| Table 1 Main characteristic parameter values of nonlinear chemical fingerprints of some samples. P. quinquefolium(produced in Jilin, JL; Canada, CA and Shaanxi, SX); P. ginseng (produced in Jilin, RS). tcan: Canyon time; Ecan: Canyon potential; tpet: Peak top time; Epet: Peak top potential; tind: Inductive time; τund: Undulatory period; tund: Undulatory life; ΔEmax: Maximum undulatory amplitude; tune: Undulatory end time; Eune: Undulatory end potential; nwav: Wave number |
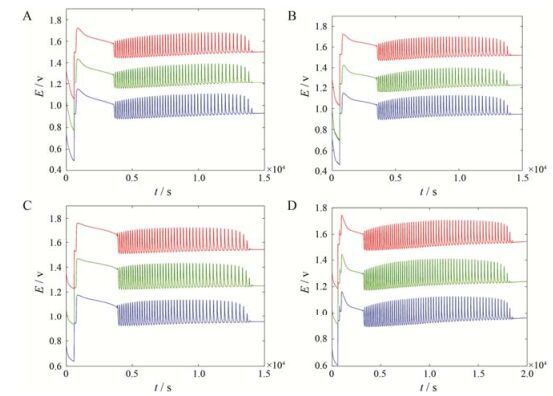
西洋参和人参指纹图谱的重现性见图 2, 显示指纹图谱均有良好的特征性和重现性。这为利用指纹图谱的直观特征鉴别西洋参和人参提供了保证。图 1和图 2表明, 因同种参属药材的有效成分或活性成分非常相似, 其指纹图谱特征变化的规律或趋势也相似, 但这种相似的程度也受样品生长环境的影响。尽管不同产地西洋参的相似度都很高, 但中国陕西和吉林两地西洋参的相似度较其与加拿大西洋参的相似度更高。由图 1和图 2可见, 加拿大西洋参指纹图谱诱导曲线的峰形比中国陕西、吉林两地西洋参指纹图谱的更平缓; 加拿大西洋参指纹图谱的诱导时间比中国陕西、吉林两地的更长; 加拿大西洋参指纹图谱中波动曲线的轮廓也与中国的明显不同。此外, 通过比较两种参属药材图谱可知, 尽管生长环境对西洋参指纹图谱也有影响, 但影响指纹图谱特征的主要因素是样品品种, 生长环境因素的影响或为次要。因此, 对西洋参来说, 还难以仅通过其指纹图谱的特征差异来直观地判断, 但可利用这种特征信息参数的差异, 通过系统相似度模式分析来准确鉴别其产地。
|
Figure 2 Reproducibility of non-linear chemical fingerprint of P. quinquefolium (produced in Jilin, A; Shaanxi, B and Canada, C) and P. ginseng (produced in Jilin, D) |
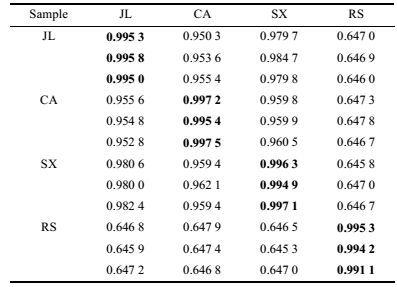
人参与西洋参、不同产地西洋参、人参与人参、同一产地西洋参样品非线性化学指纹图谱的相似度见表 2。其结果表明, 同一产地同种参非线性化学指纹图谱之间的系统相似度很高, 均≥99.11%;而不同产地西洋参指纹图谱的系统相似度均≤98.47%, 且≥95.03%, 而不同参(即西洋参和人参)系统相似度的最大值为64.79%。以相似度临界值(95.03% + 64.79%)/2 = 79.91%作判据, 当指纹图谱相似度计算值≤79.91%时, 相比较的样品不同种; 以相似度临界值(99.11% + 98.47%)/2 = 98.79%作为判据, 当指纹图谱相似度计算值≥98.79%时, 相比较的样品同种同产地; 利用系统相似度模式识别这一规律, 可方便地将西洋参和人参、或不同产地的人参或西洋参鉴别开来。按此方法, 将3个产地西洋参检验样(每个产地取30个样)指纹图谱特征参数依次与各产地西洋参指纹图谱共有模式特征参数匹配, 求出系统相似系数进行判断, 以确定西洋参检验样的产地。检验结果准确度见表 3, 平均准确度达到98.9%。
| Table 2 System similarities obtained by taking characteristic parameters of mutual mode of non-linear chemical fingerprints of P. quinquefolium (produced in Jilin, JL; Canada, CA and Shaanxi, SX) and P. ginseng (produced in Jilin, RS) as reference criterion, respectively |
| Table 3 Accuracy to identify producing area of P. quinquefolium by system similarity pattern |
方法学考察的线性关系、检测限和定量限考察结果见表 4。样品和标准品色谱图见图 3。精密度、重复性、稳定性试验的相对峰面积和保留时间的RSD值在均小于3%, 加样回收率实验的回收率在97%~102%之间, RSD值在小于3%, 表明仪器精密度良好, 方法重现性好, 样品在24 h内稳定, 样品回收率良好。
| Table 4 Calibration curves, linear range, LOD and LOQ for seven ginsenosides |
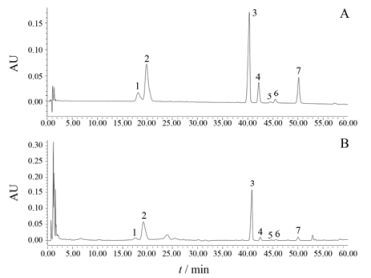
|
Figure 3 HPLC chromatogram of reference substances (A) and P. quinquefolium (B). 1: Ginsenoside Rg1; 2: Ginsenoside Re; 3: Ginsenoside Rb1; 4: Ginsenoside Rc; 5: Ginsenoside Rb2; 6: Ginsenoside Rb3; 7: Ginsenoside Rd |
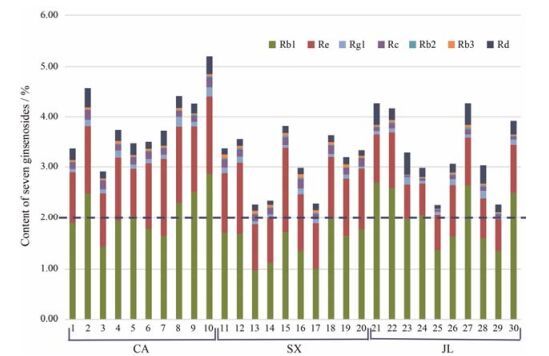
测定30批次西洋参药材中7个皂苷的含量, 并作图分析(图 4)。结果显示, 2批样品中人参皂苷Rg1、Re、Rb1的总含量未能达到15版药典标准不低于2%的规定, 其产地均为陕西。加拿大、陕西和吉林3个产地西洋参中7种人参皂苷的总平均含量分别为3.91%, 3.17%和3.33%, 表明不同产地的含量存在差异, 道地产地加拿大的西洋参品质优于吉林和陕西产的西洋参, 陕西产的西洋参平均含量最低。
|
Figure 4 The content of ginsenosides in P. quinquefolius from different habitats, CA, Canada; SX, Shaanxi, in China; JL, Jilin, in China |
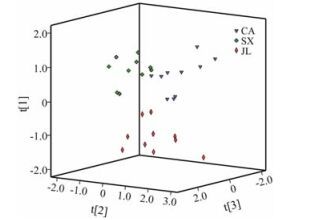
本研究采用SPSS软件对加拿大、中国陕西和吉林30个批次西洋参样品的7个人参皂苷含量进行主成分分析。实验提取了3个主成分, 其方差贡献率分别为35.664%、30.120%和12.039%, 累计贡献率为77.823%。各化合物与3个主成分的相关系数见表 5, 相关系数绝对值越大, 关系越密切。根据提取出来的3个主成分, 各批次样品三维投影分布情况如图 5所示, 可看出不同产地的西洋参可以明显区分开来, 表明不同产地西洋参的品质存在差异。
| Table 5 Component score coefficient matrix |
|
Figure 5 PCA scores plot of P. quinquefolius from different habitats, Canada (CA), Shaanxi (SX), and Jilin (JL) |
本研究对西洋参和人参的非线性化学指纹图谱进行研究, 结果表明西洋参和人参非线性化学指纹图谱的特征差异显著, 利用其直观特征的差别, 无需模式识别即可快速准确鉴别西洋参和人参。然而, 不同产地西洋参其主要活性成分种类相同, 仅其含量有相应的变化, 故指纹图谱的直观特征, 即诱导曲线、波动曲线、周期波等的形状或轮廓相似, 因此仅利用这些直观特征还难以区别不同产地的西洋参。但不同产地西洋参的一些可量化参数, 如峰顶电位及峰顶时间、峰谷电位及峰谷时间、诱导时间、波动周期、波动幅度、波动寿命、停波时间、停波电位和波动次数等存在相应程度的差别, 可采用系统相似度模式鉴别不同产地西洋参。
本实验利用HPLC含量测定法对不同产地的西洋参品质做了进一步分析和研究, 结果显示不同产地西洋参中人参皂苷的含量存在差异, 道地产地加拿大的西洋参中7种主要人参皂苷含量明显优于国内产的西洋参, 利用PCA分析可以很好地区分3个不同产地的西洋参。然而, 与非线性化学指纹图谱技术相比, HPLC法存在提取过程繁琐、实验操作复杂、仪器昂贵、分析时间较长等诸多不足。非线性化学指纹图谱技术在中药真伪鉴别和质量评控等方面显示了较好的应用前景。
总之, 本研究无需复杂费时的成分分析及分离提纯等预处理, 应用了灵敏度高、特征性强的非线性化学指纹图谱来研究西洋参和人参, 根据其直观特征很好地将两者鉴别开, 并通过指纹图谱系统相似度评价把道地产地加拿大和中国吉林、陕西产的西洋参区别开来。该研究不仅为人参、西洋参的临床用药安全性和质量控制提供了参考, 同时为中药及其制剂“快速精准鉴别”和质量评控提供了一种经济、简便和有效的方法。
| [1] | Li T, Liao JP. HPLC fingerprint analysis of Rosmarinus officinalis[J]. Chin J Pharm Anal(药物分析杂志), 2014, 34: 2181–2184. |
| [2] | Wang H, Zeng F, Xie C. Study on HPLC-UV-ELSD fingerprint for roots of Panax quinquefolius[J]. Chin Tradit Herb Drugs(中草药), 2016, 47: 143–148. |
| [3] | Li W, Guo Y, Shang C, et al. Determination of atractylodin, atractylon, and β-eudesmol and study on characteristic spectrum of Atractylodis Rhizoma[J]. Chin Tradit Herb Drugs(中草药), 2016, 47: 330–335. |
| [4] | Rui W, Feng Y, Shi Z, et al. UPLC/Q-TOF-MS study on fingerprint of Astragalus membranaceus obtained from 7 different origins[J]. Chin J Pharm Anal(药物分析杂志), 2012, 32: 607–611. |
| [5] | Ning Z, Liu Z, Song Z, et al. A single marker choice strategy in simultaneous characterization and quantification of multiple components by rapid resolution liquid chromatography coupled with triple quadrupole tandem mass spectrometry(RRLC-QqQ-MS)[J]. J Pharm Biomed, 2016, 124: 174–188. DOI:10.1016/j.jpba.2016.02.039 |
| [6] | Song X, Wang J, Wang P, et al. 1H NMR-based metabolomics approach to evaluate the effect of Xue-Fu-Zhu-Yu decoction on hyperlipidemia rats induced by high-fat diet[J]. J Pharm Biomed, 2013, 78: 202–210. |
| [7] | Zhang TM, Zhao Z, Fang XQ, et al. Determining method, conditional factors, traits and applications of nonlinear chemical fingerprint by using dissipative components in samples[J]. Sci China Chem(中国科学·化学), 2012, 55: 285–303. |
| [8] | Zhang TM, Zhao Z, Fang XQ, et al. Principle of nonlinear chemical fingerprint by using dissipative components in samples as well as calculation and evaluation of similarity[J]. Sci China Chem(中国科学·化学), 2012, 55: 304–322. DOI:10.1007/s11426-011-4385-9 |
| [9] | Fang XQ, Zhang TM, Zhao Z, et al. Application of nonlinear chemical fingerprinting to identification, evaluation and clinical use of Glycyrrhiza[J]. Chin Sci Bull(科学通报), 2010, 55: 2937–2944. DOI:10.1007/s11434-010-3285-2 |
| [10] | Chen ZH, Cheng WX, Fang CW, et al. Study on nonlinear chemical fingerprints of Rhei Radix et Rhizoma[J]. J Mol Sci(分子科学学报), 2013, 29: 190–197. |
| [11] | Bai Y, Zhang T, Zhang F. Identifying the authenticity and producing area of Panax using non-linear chemical fingerprint[J]. Sci Technol Food Ind(食品工业科技), 2015, 36: 302–308. |
| [12] | Zhan X, Tian C, Zhang Y, et al. PCR-SSCP molecular identification of Panax ginseng and P. quinquefolius based on ITS2 bar coding SNPs[J]. China J Chin Mater Med(中国中药杂志), 2012, 24: 3748–3751. |
| [13] | Pace R, Martinelli EM, Sardone N, et al. Metabolomic evaluation of ginsenosides distribution in Panax genus (Panax ginseng and Panax quinquefolius)using multivariate statistical analysis[J]. Fitoterapia, 2015, 101: 80–91. DOI:10.1016/j.fitote.2014.12.013 |
| [14] | Kim DH. Chemical diversity of Panax ginseng, Panax quinquifolium, and Panax notoginseng[J]. J Ginseng Res, 2012, 36: 1–15. DOI:10.5142/jgr.2012.36.1.1 |
| [15] | Wang Y, Choi HK, Brinckmann JA, et al. Chemical analysis of Panax quinquefolius(North American ginseng): a review[J]. J Chromatogr A, 2015, 1426: 1–15. DOI:10.1016/j.chroma.2015.11.012 |
| [16] | Schlag EM, McIntosh MS. The relationship between genetic and chemotypic diversity in American ginseng(Panax quinquefolius L.)[J]. Phytochemistry, 2013, 93: 96–104. DOI:10.1016/j.phytochem.2013.03.002 |
| [17] | Wu X, Ye Z, Guo Q, et al. Comparison on ginsenosides in Panax ginseng from different habitats in northeast China and its processed products[J]. Chin Tradit Herb Drugs(中草药), 2013, 44: 3551–3556. |
| [18] | Huang L, Suo F, Song J, et al. Quality variation and ecotype division of Panax quinquefolium in China[J]. Acta Pharm Sin(药学学报), 2013, 48: 580–589. |
 2017, Vol. 52
2017, Vol. 52