2. 西安交通大学第一附属医院, 陕西 西安 710061
2. The First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710061, China
肝癌是临床最常见的恶性肿瘤之一, 由于我国病毒感染性肝炎等慢性肝病患者较多, 且其易发展为肝纤维化甚至肝癌, 使得我国肝癌发病率及死亡率约占全球的一半。目前肝癌治疗的首选方案为外科手术, 但多数患者确诊时已是中晚期, 失去了最佳手术时期, 故化学药物治疗仍是治疗的主要方案。由于肝癌对大部分临床使用的化疗药物不敏感, 故亟需研发新的抗肿瘤药物。中医药是研发新药的巨大宝库, 目前许多临床常用的抗肿瘤药物均来源于此[1]。
虫草是昆虫病原菌侵袭昆虫寄主后所形成的一种特殊形式, 多种类型的虫草均具有良好的药用价值。虫草素(cordycepin)是从传统中医药冬虫夏草中分离出来的水溶性核苷类成分, 具有广泛的药理作用, 如抗肿瘤、抗病毒、抗菌、抗炎、调节免疫及降糖降脂等[2, 3]。虽然以往对虫草素抗肿瘤作用进行了大量研究, 但较少涉及肝癌转移方面, 而肝癌的侵袭和转移是导致患者病情恶化以及死亡的主要原因之一。本文以高转移性肝癌细胞MHCC97H为研究对象, 以期探讨虫草素体内外抗肝癌转移作用及可能的分子机制。
材料与方法药品与试剂 胰蛋白酶、RPMI1640、胎牛血清购于Gibco公司; MTT、虫草素购于Sigma公司; AKT、p-AKT、p-GSK-3β、β-catenin、N-cadherin、MMP-7、MMP-9、E-cadherin等一抗及相应的二抗均购于Cell Signaling Technology公司或碧云天公司。
细胞培养 肝癌MHCC97H细胞购于上海复旦大学肝癌研究所, 用含10%胎牛血清的RPMI1640培养基培养(含双抗), 取对数生长期的细胞用于实验。
MTT法检测细胞生长 取对数生长期的细胞, 以每孔8 000个肝癌MHCC97H细胞接种于96孔板中。12 h后加入虫草素(终浓度分别为20、40、80、160和320 μmol·L-1)置于CO2培养箱中继续培养。48 h后每孔加入10 μL MTT溶液(5 g·L-1), 4 h后每孔加入二甲基亚砜100 μL, 37 ℃振荡30 min后用酶标仪在570 nm波长处测其吸光度(OD)值, 细胞生长抑制率= (1-OD实验组/OD对照组)×100%[4]。
细胞划痕实验 在24孔板底用marker笔均匀画横线作为标记, 每孔加2×105个细胞, 细胞贴壁后用20 μL枪头垂直于背后的横线划痕, PBS洗去脱落的细胞并显微镜下拍照, 记录时间为t = 0 h, 此时的划痕宽度记录为W0 h。加入虫草素(终浓度分别为20、40、80 μmol·L-1), 用无血清的培养基培养24 h后用显微镜拍照, 记录时间为t = 24 h, 此时的划痕宽度记录为W24 h。细胞的迁移率= (W0 h-W24 h)/W0 h×100%[4]。
细胞侵袭实验 用matrigel稀释液均匀地铺在transwell上室底部膜的内表面, 37 ℃培养箱孵育30 min, 以每孔1×105个细胞重悬于200 μL含1%血清培养基中, 并分别于上室加入虫草素(终浓度分别为20、40、80 μmol·L-1), 下室加含10% FBS的培养基600 μL, 培养24 h后用镊子取出小室, 用脱脂棉签轻轻转动去除上室中残留的细胞和细胞碎片, 倒扣并置于通风处风干。用含0.1%的结晶紫甲醇溶液染色20 min后, PBS冲洗干净、风干。将聚碳酯膜切下并置于载玻片上, 显微镜下记录5个视野中穿过聚碳酯膜的细胞数目[4]。
细胞迁移实验 除不铺matrigel外, 其余步骤同细胞侵袭实验[4]。
Western blotting检测蛋白的表达 收集经虫草素处理的细胞或肺转移肿瘤结节标本, 加入细胞裂解液(碧云天公司), 在冰上裂解30 min, 于4 ℃、12 000 ×g离心15 min, 取上清液。蛋白定量后分别取50 μg蛋白加入上样缓冲液, 95 ℃变性10 min。12%聚丙烯酰胺-SDS凝胶电泳后, 电转移至硝酸纤维素膜上, 5%脱脂奶粉封闭后依次加入一抗和二抗, 室温孵育2 h, TBST缓冲液洗涤5次, 每次10 min, 凝胶成像系统获取图像并进行灰度计算[1]。
荷瘤动物实验 雄性BALB/c裸鼠购于上海斯莱克实验动物有限责任公司(实验动物合格证号: 201600548837), 日龄28~35天, 体重18~22 g。
原位肿瘤移植模型 收获对数生长期的MHCC97H细胞, 调整细胞悬液浓度为每毫升5×106个, 以每只0.1 mL接种于裸鼠右侧腋窝皮下。移植瘤生长至50 mm3左右时将裸鼠随机分成对照组(注射生理盐水)、虫草素低、中、高组(10、20和40 mg·kg-1)和5-氟尿嘧啶(5-fluorouracil, 5-Fu)组作为阳性对照(20 mg·kg-1), 每组6只, 腹腔注射每天1次, 连续20天。停药次日处死裸鼠, 手术剥取瘤块称重, 计算肿瘤生长抑制率(inhibition rate, IR), IR (%) = (1-给药组平均瘤重/模型组平均瘤重)×100%[1]。
肺转移模型 收获对数生长期的MHCC97H细胞, 调整细胞悬液浓度为每毫升5×106个, 以每只裸鼠0.2 mL尾静脉注射。15天后将裸鼠随机分组并给药, 方法同“原位肿瘤移植模型”。停药次日处死裸鼠, 手术剥取肺组织, Bouin固定液固定后检测肺结节数, 计算肺转移抑制率(%) = (1-给药组平均结节数/模型组平均结节数)×100%, 肿瘤标本进一步进行HE染色检查病理变化[5]。
统计学分析 所有数据均用x± s表示, 应用SPSS12.0统计包进行单因素方差分析, 以P<0.05表示有显著性差异。
结果 1 虫草素抑制肝癌细胞增殖MHCC97H细胞经不同浓度虫草素(图 1A)作用48 h后, 细胞增殖均受到不同程度的抑制, 并呈剂量依赖性(图 1B), 半数抑制率(IC50)为92.4 ± 8.3 μmol·L-1。

|
Figure 1 Cordycepin inhibited MHCC97H cells proliferation in vitro. A: The structure of cordycepin; B: The anti-proliferative effect of cordycepin was detected using MTT assay after treat ment with 48 h |
MHCC97H细胞经不同浓度虫草素作用24 h后, 细胞划痕实验(图 2A)及transwell (不铺matrigel)实验(图 2B)均表明虫草素剂量依赖性地抑制MHCC97H细胞的迁移; 此外, transwell (铺matrigel)实验进一步表明虫草素剂量依赖性地抑制MHCC97H细胞的侵袭能力(图 2C)。

|
Figure 2 Cordycepin inhibited MHCC97H cells migration and invasion in vitro. A: The antimigrated effect of cordycepin was detected using wound healing experiment after treatment for 24 h; B: The anti-migrated effect of cordycepin was detected after treatment for 24 h using transwell (no matrigel); C: The anti-invation effect of cordycepin was detected after treatment with 24 h using transwell (matrigel). n = 3, x± s. *P < 0.05, **P < 0.01 vs control |
经虫草素处理48 h后, 与对照组相比, AKT、p-AKT、p-GSK-3β、β-catenin、N-cadherin、MMP-7、MMP-9等蛋白的表达明显降低, 并呈剂量依赖性, 而E-cadherin的表达则呈剂量依赖性增加(图 3)。
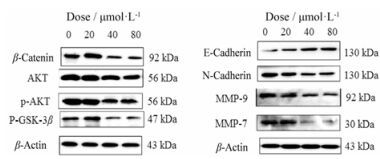
|
Figure 3 The protein expression of MHCC97H cells was detected by Western blotting after treatment with cordycepin for 48 h |
经20天治疗后, 对照组、虫草素高、中、低(40、20和10 mg·kg-1) 3个剂量组及5-氟尿嘧啶组的原位移植瘤重分别为1.52 ± 0.46、0.38 ± 0.04、0.61 ± 0.08、1.13 ± 0.36和0.65 ± 0.07 g, 虫草素高、中、低3个剂量组及5-氟尿嘧啶组的抑瘤率分别为75.2%、59.9%、25.9%及57.3% (图 4A), 与对照组相比, 除虫草素低剂量组外均具有显著性差异(P<0.01);在肺转移模型中, 对照组、虫草素高、中、低(40、20和10 mg·kg-1) 3个剂量组及5-氟尿嘧啶组的肺转移结节数分别为123.5 ± 14.5、48.9 ± 7.2、67.2 ± 9.4、106.4 ± 11.3和73.6 ± 8.6, 虫草素3个剂量组及5-氟尿嘧啶组的肺转移抑制率分别为60.4%、45.6%、13.8%及40.4% (图 4B), 与对照组相比, 除虫草素低剂量组外均具有显著性差异(P<0.01)。此外, 肺转移结节中p-AKT、N-cadherin、MMP-7和MMP-9等蛋白的表达均明显降低, 并呈剂量依赖性, 而E-cadherin的表达则剂量依赖性的增加(图 4C)。Bouin固定液固定后可见肺转移结节数随虫草素剂量增加逐渐减少(图 4D), HE染色后显微镜下可见肺转移灶数量及面积也随虫草素剂量增加逐渐减少(图 4E)。

|
Figure 4 Cordycepin inhibited tumor growth and lung metastasis in vivo. A: Mean tumor weight in subcutaneous model; B: Mean lung metastasis nodus numbers in the hepatoma pulmonary metastasis model; C: The protein expression of lung metastasis nodus after treatment with cordycepin; D: Representative images of lung metastasis nodus; E: Representative images of lung metastasis after HE staining. Bar = 200 μm. n = 6, x± s. **P < 0.01 vs control. 5-Fu: 5-fluorouracil |
体内外实验均表明虫草素抑制肝癌MHCC97H细胞的增殖及原位生长, 这与虫草素抗乳腺癌、肺癌和白血病等一致[2, 6]。虫草素可抑制MHCC97H细胞及肺转移结节中的AKT、β-catenin等蛋白的表达及AKT、GSK-3β的磷酸化, 以上结果提示虫草素通过抑制AKT信号通路从而产生抗肿瘤生长作用。
Cadherin家族共有3个成员(E-cadherin、N-cadherin和p-cadherin), 其作用为介导细胞连接、参与细胞分化、调控细胞迁移等, 其中很多种癌组织中细胞表面的E-cadherin减少或消失, 以致癌细胞易从瘤块脱落, 成为侵袭与转移的前提[7]。虫草素在体内外均引起E-cadherin上调及N-cadherin下调, 提示虫草素通过调控cadherin产生抗MHCC97H细胞转移作用。肿瘤侵袭、转移是非常复杂的过程, 如肿瘤细胞从原发部位脱离、分泌金属蛋白酶(MMPs)降解周围基质, 特别是MMP-7和MMP-9, 从而使肿瘤细胞进入血液循环或淋巴循环[8]。本实验结果表明虫草素降低MMP-7和MMP-9的表达, 提示虫草素抑制MHCC97H细胞转移的分子机制也与MMP-7和MMP-9表达降低有关。细胞划痕实验、transwell实验、原位移植肿瘤及肺转移分别从细胞实验和动物实验证明了虫草素抑制MHCC97H肝癌细胞的侵袭和转移。
综上所述, 虫草素通过干扰AKT信号通路从而产生抑制MHCC97H细胞生长及转移作用, 为虫草素进一步开发应用奠定了实验依据和理论基础。
| [1] | Liu RR, Zhang X, Xiao B, et al. Mechanism of TTF1-NP induced implanted hepatoma tumor apoptosis in nude mice by endoplasmic reticulum stress pathway[J]. Acta Pharm Sin(药学学报), 2016, 51: 403–407. |
| [2] | Gao J, Lian ZQ, Zhu P, et al. Lipid-lowering effect of cordycepin(3'-deoxyadenosine)from cordycepin militaris on hyperlipidemic hamsters and rats[J]. Acta Pharm Sin(药学学报), 2011, 46: 669–676. |
| [3] | Hueng DY, Hsieh CH, Cheng YC, et al. Cordycepin inhibits migration of human glioblastoma cells by affecting lysosomal degradation and protein phosphatase activation[J]. J Nutr Biochem, 2017, 41: 109–116. DOI:10.1016/j.jnutbio.2016.12.008 |
| [4] | Wang M, Cui HX, Sun C, et al. Effect of lupeol on migration and invasion of human breast cancer MDA-MB-231 cells and its mechanism[J]. Acta Pharm Sin(药学学报), 2016, 51: 558–562. |
| [5] | Nakamura K, Shinozuka K, Yoshikawa N. Anticancer and antimetastatic effects of cordycepin, an active component of Cordyceps sinensis[J]. J Pharmacol Sci, 2015, 127: 53–56. DOI:10.1016/j.jphs.2014.09.001 |
| [6] | Wang Z, Wu X, Liu J, et al. Advances in research on antitumor activities of cordycepin[J]. Chin Pharm J(中国药学杂志), 2015, 50: 1365–1368. |
| [7] | Maier J, Traenkle B, Rothbauer U. Visualizing epithelial-mesenchymal transition using the chromobody technology[J]. Cancer Res, 2016, 76: 5592–5596. DOI:10.1158/0008-5472.CAN-15-3419 |
| [8] | Jayachandran A, Dhungel B, Steel JC. Epithelial-to-mesenchymal plasticity of cancer stem cells: therapeutic targets in hepatocellular carcinoma[J]. J Hematol Oncol, 2016, 9: 74. DOI:10.1186/s13045-016-0307-9 |
 2017, Vol. 52
2017, Vol. 52


