2. 解放军第302医院全军中医药研究所, 北京 100039;
3. 解放军302医院中西医肝病诊疗与研究中心, 北京 100039;
4. 河南中医药大学第一附属医院, 河南 郑州 450000
2. China Military of Chinese Medicine, 302 Military Hospital, Beijing 100039, China;
3. Integrative Medical Center, 302 Military Hospital, Beijing 100039, China;
4. The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China
雷公藤Tripterygium wilfordii Hook. f. (TW)为卫矛科雷公藤属一年生藤本植物, 最早记载于《神农本草经》, 性凉, 味苦, 有大毒, 归肝、肾经。具有祛风除湿、舒筋活络、消肿止痛和杀虫解毒等功效。临床上治疗类风湿性关节炎、红斑狼疮和肾病综合征等自身免疫系统疑难病症有良好的效果, 疗效独特[1-3], 几乎没有可以完全替代的类似中药。但同时表现出明显的毒副作用, 且中毒后果严重, 成为近半个世纪以来发生中毒事件最多的中草药之一, 其所致肝毒性在相关文献报道中居单味肝损伤中药之首[4, 5]。最近发表在Cell杂志上的一项研究[6]显示:雷公藤红素在极低剂量下具有明显的减肥效果, 同时作者也明确指出了其毒性的风险。正所谓“大毒者有奇效”, 如何减毒存效是雷公藤研究的重要课题, 基于中医药理论科学认知和综合评价雷公藤的功效及毒性发生的机制, 保持或提高其疗效的前提下, 通过各种途径减低毒性, 是合理开发应用雷公藤的重要基础。
配伍和炮制是中医药减毒增效的重要途径。根据中药药性理论, 甘味药能缓和药性, 如张仲景在应用乌头类药物时, 常用甘草和炼蜜久煎以减毒。甘草(Radix glycyrrhizae, RG)能调和诸药, 有“解百药毒”的功效, 早在两千多年前就被《神农本草经》列为药之上品。“肝苦急, 急食甘以缓之”的肝证治则, 据统计, 《名医类案》中治疗“肝苦急”病证, 以甘味药的应用频率为最多, 其中又以甘草列为首位。雷公藤的肝脏毒副作用显著, 从中医脏象学说的角度, 对于峻烈药物伤脾损肝, 甘草缓和峻烈药物药性, 可起到调和脾胃、护肝保肝之效。临床实践与基础实验均证实, 雷公藤配伍甘草可有效降低其肝毒性, 并优选了配伍的比例, 分析了配伍后化学成分的变化情况[5, 6]。但雷公藤配伍甘草后的减毒机制仍不清楚。为此, 本研究拟在前期研究基础上, 在实验动物模型上评价雷公藤配伍甘草后的减毒效果, 同时采用代谢组学方法表征雷公藤配伍甘草后大鼠血清内源性代谢物的变化差异, 通过偏最小二乘法-判别(PLS-DA)分析, 筛选雷公藤配伍甘草减毒的潜在生物标志物, 并结合代谢通路数据库, 探讨可能的作用通路和机制, 为进一步阐明雷公藤配伍甘草减毒作用机制提供参考。
材料与方法实验仪器 LC-MS/MS-IT-TOF仪(日本岛津公司), Waters XBridge® C18色谱柱(100 mm × 2.1 mm, 3.5 μm), 旋转蒸发仪(RE-52AA, 上海亚荣生化仪器厂); 水循环真空泵(上海知信实验仪器技术有限公司); AL204电子天平(METTLER TOLEDO公司); Gradient A10 Mill-Q超纯水器(美国Millipore公司); 超声提取清洗器(KQ5200E, 昆山市超声仪器有限公司); 真空冷冻干燥箱、冷冻离心机(德国Sigma公司); 光学显微镜(Olympus公司); 自动生化仪(mindray BS-300, 深圳迈瑞); 酶标仪(Thermo Scientific公司); 水浴锅(AISITE, 天津市泰斯特仪器有限公司)。
实验试药 乙腈、无水乙醇(天津化学试剂厂); 纯净水(杭州娃哈哈公司); 天门冬氨酸氨基转氨酶检测试剂盒、丙氨酸氨基转氨酶检测试剂盒、血清白蛋白检测试剂盒(南京建成生物工程研究所); 大鼠白介素1β酶联免疫试剂盒(W07036997)、大鼠白介素6酶联免疫试剂盒(W07036996)、大鼠肿瘤坏死因子-α酶联免疫试剂盒(U27036998) (Cusabio公司)。雷公藤药材购自福建三明, 经首都医科大学附属北京友谊医院赵奎君教授鉴定, 为卫矛科雷公藤的干燥根; 生甘草饮片购自北京友谊医院中药房, 经首都医科大学附属北京友谊医院赵奎君教授鉴定, 为豆科植物胀果甘草的干燥根。
药品制备 雷公藤提取物:称取适量雷公藤生药材, 打碎成粗颗粒状, 8倍体积60%乙醇超声提取3次, 合并滤液, 减压浓缩回收乙醇, 真空干燥得粗提物, 临用前生理盐水配制成相应浓度(按雷公藤生药量配制)。
雷公藤配伍甘草样品制备:取适量雷公藤生药材(碎成粗颗粒状)及生甘草饮片, 雷公藤:甘草= 3:1。8倍体积60%乙醇超声提取3次, 合并滤液, 减压浓缩回收乙醇, 真空干燥得粗提物, 临用前生理盐水配制成相应浓度(按雷公藤生药量配制)。
实验动物与分组 SD (Sprague Dawley)大鼠, SPF级, 180 ± 20 g, 30只, 正常饲养5天, 随机分成3组(n = 10), 空白对照组、雷公藤组(15 g·kg-1)、雷公藤配伍甘草组(15 g·kg-1) (以雷公藤生药材计), 连续给药14天, 于末次给药后1 h取血和肝脏组织。以上实验动物均由中国人民解放军军事医学科学院实验动物中心提供(动物合格证号: SCXK (京) 2011-0004), 实验动物分笼饲养于解放军第302医院实验动物中心。每天上午9:00~10:00灌胃, 空白对照组每天灌以等量生理盐水。
肝组织病理形态学检查 取大鼠肝组织1.5 cm × 1 cm × 0.5 cm, 10%甲醛固定, 常规病理切片, HE染色, 光镜下观察, 拍照。
实验动物取血及血清处理 大鼠给药2周后眼眶静脉取血, 冷冻离心(4 ℃、3 500 r·min-1, 10 min), 取上清, 全自动生化及酶标仪检测天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、丙氨酸转氨酶(alanine aminotransferase, ALT)、肌酐(creatinine, CRE)、尿素(urea, UREA)和白蛋白(albumin, ALB)。
眼眶取血后股主动脉取血, 冷冻离心(4 ℃、3 500 r·min-1, 10 min), 血清置于-80 ℃冰箱, 检测前将大鼠血清于-80 ℃冰箱中取出, 复融, 取250 μL加入到1.5 mL EP管中, 再加入甲醇溶液750 μL, 混匀, 静置, 4 ℃下冷冻离心(10 000 r·min-1, 10 min), 取上清, 并用0.22 μm微孔滤膜滤过, 备用。
LC-MS/MS-IT-TOF检测 采用Waters XBridge® C18色谱柱(100 mm × 2.1 mm, 3.5 μm)色谱柱; 柱温为40 ℃, 流速为0.3 mL·min-1, 进样量为5 μL, 样品温度为4 ℃; 液相洗脱条件:流动相A:水(1%甲酸), 流动相B:乙腈(1%甲酸)。具体洗脱程序见表 1。
| Table 1 The gradient elution condition of HPLC. A: H2O (1% HCOOH); B: CH3CN (1% HCOOH) |
质谱参数设置:电离模式: ESI±; 扫描范围: 100~1 000 m/z; 离子源电压: 4.5 kV; 雾化器流量: 1.5 L·min-1; 干燥器(N2): 100 kPa; 脱溶剂部温度: 200 ℃; Ion Accumulation Time: 30 ms; CID Energy: 50%;检测器电压1.80~2.10 kV。
实验数据处理 采用SPSS 18.0软件统计, 各项指标结果以均数±标准差(x± s)描述, 进行组间数据比较, 若符合正态分布用完全随机设计资料单因素方差分析。两样本比较, 其中方差齐性者采用LSD法检验, 方差不齐者采用Dulmet’s法检验。
将所测代谢组学数据采用Profiling solution软件进行数据转换和色谱峰识别, 再将数据导入SIMCA-P 11软件, 标准化后进行偏最小二乘法-判别(partial least squares-discriminate analysis, PLS-DA)分析。运用variable influence in the projection (VIP)方法来预测各个数据对模型的贡献值, VIP > 1说明具有明显的贡献, 有统计学意义, 为可能的潜在标志物。再采用one-way ANOVA的方法, 依据P < 0.05的原则, 排除没有显著性差异的数据。最后在Human Metabolome Database (HMDB)和Kyoto Encyclopedia of Genes and Genomes (KEEG)数据库中进行匹配。
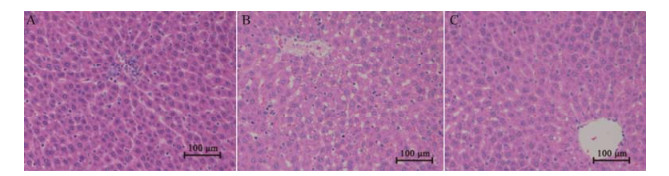
结果 1 病理组织形态学检查(HE染色)图 1显示:空白对照组大鼠肝组织着色均匀、肝索排列整齐、肝细胞形态完好。雷公藤组肝索排列紊乱, 肝细胞肿胀、浑浊, 伴有少量水肿和脂肪变性少量坏死, 结构破坏、局部区域出现炎性细胞浸润, 肝细胞出现空泡和局灶性炎性。雷公藤配伍甘草组肝组织着色较均匀、肝索排列整齐、肝细胞形态完好, 无明显肝损伤表现。
|
Figure 1 The results of HE staining of paraffin sections of liver tissues in rats. A: Con; B: TW; C: TW+RG. Con: Blank control; TW: Tripterygium wilfordii Hook. f.; RG: Radix glycyrrhiza |
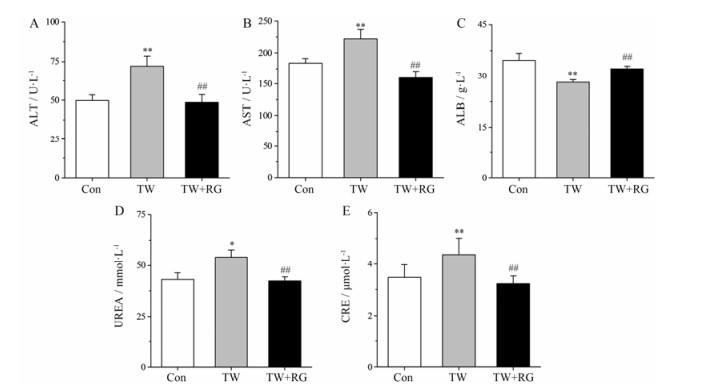
如图 2显示:雷公藤组与空白对照组比较, AST、ALT和CRE升高(P < 0.01), UREA升高(P < 0.05), ALB降低(P < 0.01);雷公藤配伍甘草组与雷公藤组比较, AST、ALT、CRE和UREA均降低(P < 0.01), ALB升高(P < 0.01)。提示雷公藤配伍甘草可显著降低其肝毒性。
|
Figure 2 The results of serum biochemical indexes in rats. A: Alanine aminotransferase (ALT); B: Aspartate aminotransferase (AST); C: Albumin (ALB); D: Urea (UREA); E: Creatinine (CRE). n = 10, x± s. *P < 0.05, **P < 0.01 vs Con; ##P < 0.01 vs TW |
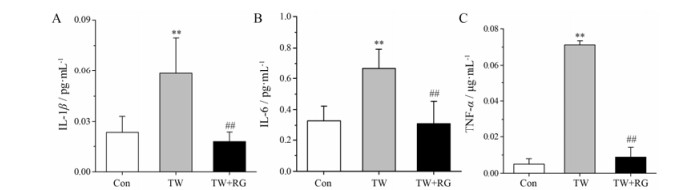
图 3显示:雷公藤组与空白对照组相比, 血清中IL-1β、IL-6和TNF-α水平显著升高(P < 0.01);雷公藤配伍甘草组与雷公藤组比较, 血清中三者水平显著降低(P < 0.01)。
|
Figure 3 The results of inflammatory factors of IL-1β, IL-6 and TNF-α in serum of rats. n = 10, x± s. **P < 0.01 vs Con; ##P < 0.01 vs TW |
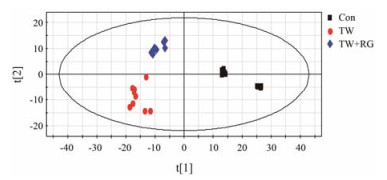
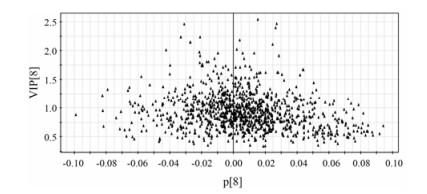
通过PLS-DA数据处理和模型拟合, 模型拟合参数R2Y为0.998, Q2为0.914, 说明该拟合模型的准确度和预测度均良好。代谢组学分析结果显示:空白对照组、雷公藤组和雷公藤配伍甘草组大鼠分别处于不同的象限区域内(图 4), 表示3组大鼠体内的小分子代谢物水平存在一定的差异性, 雷公藤大鼠由于受到雷公藤毒性的影响, 其体内的小分子代谢物水平发生了显著性的改变, 从而在图中显示出远离空白对照组大鼠的直观表现; 当雷公藤与甘草配伍后用于大鼠, 其因雷公藤毒性影响而发生显著性变化的小分子代谢物进而显示出恢复正常水平的态势, 并且整体有向着空白对照组正常大鼠区域发展的趋势。具体到微观形态(图 5), 每一个小三角形的标识都代表一种差异性变量, 正是这些差异性变量的联合作用形成了3组大鼠宏观形态的不同分布区域的布局。而且, 距离坐标中心轴越远的变量, 说明其在3组分离状态中的贡献越大, 所代表的小分子代谢物在3组大鼠体内的含量差异就越大, 即为本文中所要寻找的潜在生物标志物; 再者, 通过观察模型中拟合的VIP值排序(图 6), VIP值越大说明此变量在模型中的统计学差异就越大, 可作为潜在的变量进行后续的生物标志物鉴定工作。
|
Figure 4 The score scatter plot of serum of rats |

|
Figure 5 The loading scatter plot of serum of rats |
|
Figure 6 The VIP scatter plot of serum of rats |
通过上述步骤的变量筛选与数据库鉴定, 本研究中共鉴定出15个生物标志物, 详见表 2。其中, 包括标志物在模型中所对应的差异性变量VIP值、质荷比、保留时间、标志物种类、加合形式、误差值及在各组大鼠血清中的含量变化等信息。在所鉴定出的15个生物标志物中, 涉及到脂肪酸、甘油酯、甘油磷酸、磷脂酰乙醇胺、磷脂酰胆碱、溶血磷脂酸和亚油酸等代谢物质。而且, 通过比较相同生物标志物在不同分组大鼠体内的含量变化趋势, 发现其中7个标志物在雷公藤组和雷公藤配伍甘草组中呈现出反向的含量变化趋势, 剩余的8个标志物则呈现出同向的含量变化趋势, 但变化程度各异。由此认为, 通过雷公藤配伍甘草减毒的过程中, 大鼠体内的小分子代谢物水平也在同步地发生变化, 表现为甘草弱化了雷公藤肝毒性作用所引起的代谢物含量改变或是抵消其变化。
| Table 2 Identification biomarker of TW liver toxicity and compatibility of RG. n = 10, x± s. aTW group vs Con group; bTW + RG group vs Con group |
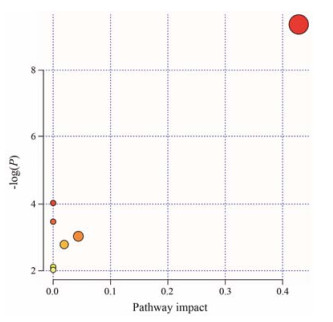
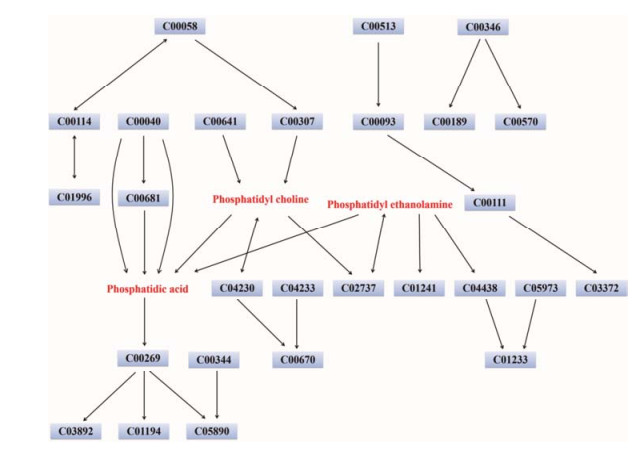
将所鉴定出的生物标志物相关信息输入至MetaboAnalyst 3.0在线通路分析数据库, 依次查看标志物在KEGG数据库中所对应的作用靶点及实验动物种属, 并选择相应的统计分析方法, 最终查看通路分析结果(图 7和表 3)。结果显示:这些生物标志物对应的生物代谢通路包括甘油磷脂代谢(图 8)、亚油酸代谢、α-亚油酸代谢、糖基磷脂酰肌醇末端生物合成、甘油酯代谢、花生四烯酸代谢和脂肪酸代谢。其中, 与标志物相关性最强的且对生物代谢作用影响最大的通路是甘油磷脂代谢, 其-log(P)值和impact值分别为9.36和0.43。此外, 对于生物代谢也具有稍弱影响的通路有糖基磷脂酰肌醇末端生物合成和甘油酯代谢, 其impact值分别为0.04和0.02。甘油磷脂代谢作为机体内含量最多的一类磷脂代谢, 不仅在生物膜构成方面发挥着重要的作用, 而且还是胆汁和膜表面的活性物质成分, 可参与细胞膜对蛋白质的识别功能和信号传导机制。甘油磷脂在体内合成的基本部位是生物体, 其中以肝脏中尤为活跃, 这也在一定程度上印证了雷公藤肝毒性的客观存在。
|
Figure 7 Metabolic pathway analysis |
|
Figure 8 KEGG target map of glycerol phospholipid metabolism |
| Table 3 Summary information of metabolic pathway analysis. n = 10, x± s |
本研究在前期研究基础上, 采用代谢组学的方法探讨雷公藤配伍甘草减毒的作用机制。从生化指标、血清炎症因子及肝组织病理切片结果看, 本研究成功复制雷公藤肝损伤的模型, 并且可看出雷公藤配伍甘草降低肝毒性的效果, 为深入进行代谢组学的研究分析提供支持。
雷公藤可引起大鼠肝脏生化指标出现异常和组织病理改变, 表明其肝毒性客观存在; 通过雷公藤与甘草进行配伍, 本文发现配伍后可降低雷公藤所引起的肝脏毒性。并且雷公藤配伍甘草减毒这一配伍应用也是来源于传统中医古方记载, 具有一定的临床经验事实依据。本文着重论述的是, 雷公藤配伍甘草减毒在宏观的药理实验结果下得到了确切的数据支持, 在微观的代谢组学分析中同样也实现了数据论证。在具体的代谢组学分析结果中, 空白对照组大鼠、雷公藤组大鼠和雷公藤配伍甘草组大鼠分布于不同的象限区域, 代表各组大鼠体内的小分子代谢物水平存在一定的差异性。而且需要注意的是, 雷公藤配伍甘草组大鼠处于空白对照组和雷公藤组大鼠的中间区域, 可以理解为, 当大鼠受到雷公藤肝毒性的影响后, 体内的小分子代谢物水平相比正常大鼠出现了含量显著性改变, 而通过雷公藤配伍甘草作用后, 这些异常变化的小分子代谢物则又表现出恢复正常水平的趋势, 即甘草发挥了雷公藤肝毒性转归作用。
为了进一步研究这些发生异常改变的小分子代谢物, 本文通过PLS-DA分析方法从中筛选最具显著性差异的变量, 通过HMDB数据库进行鉴定, 最终发现了15个潜在的生物标志物, 这些标志物中包含脂肪酸、甘油酯、甘油磷酸、磷脂酰乙醇胺、磷脂酰胆碱、溶血磷脂酸和亚油酸等代谢物质。其中, L-palmitoylcarnitine作为一种表明活性分子可改变膜流动性和表面电荷, 影响细胞中的相应酶和转运蛋白的活性[7]。MG (15:0/0:0/0:0) 和DG (18:2 (9Z, 12Z)/22:4 (7Z, 10Z, 13Z, 16Z)/0:0) 属于甘油酯, 是动物组织中的微量成分, 对于细胞膜具有一定的破坏作用, 在淋巴系统和肝脏中可实现相互转变[8]。PGP (18:1 (9Z)/18:1 (11Z))是一种甘油磷酸, 涉及细胞膜磷脂降解及重塑过程, 在线粒体膜的含量较高[9]。PEs和PCs分别为磷脂酰乙醇胺和磷脂酰胆碱, 同样涉及细胞膜磷脂降解及重塑过程, 在动物肝脏组织中可实现微粒体和线粒体之间的相互转移[10, 11]。LPA (0:0/16:0) 和LPA (0:0/18:1 (9Z))属于溶血磷脂酸, 是一种多功能脂质调控介质作用于细胞生长、流动性及变异性[12]。
针对于鉴定出来的生物标志物, 本文通过MetaboAnalyst 3.0数据库进行了通路分析, 结果发现甘油磷脂代谢在所有的代谢通路中的差异性和通路影响作用均最大, 由此认为甘油磷脂代谢可作为雷公藤肝毒性及甘草配伍减毒的关键代谢通路。如图 7所示, 甘油磷脂代谢中涉及到3个关键作用靶点, 即磷脂酸、磷脂酰胆碱和磷脂酰乙醇胺。这3类物质之间可以相关转化, 实施的主要场所是机体肝脏组织。脂质代谢通路在肝功能中发挥着关键的作用, 一旦出现紊乱就会引起各种疾病的发生。有研究[13]表明雷公藤导致的肝损伤过程能够引起脂质代谢紊乱, 包括甘油酯、酰基甘油、磷脂酰乙醇胺、磷脂酰胆碱、磷酸丝氨酸、甘油磷酸、心磷脂、神经酰胺和鞘磷脂等物质, 及相关炎性因子的变化。本文所发现的雷公藤配伍甘草减毒的关键通路为甘油磷脂代谢, 这也与上述研究在很大程度上相吻合。因此, 本文研究结果提示雷公藤肝毒性是客观存在的, 通过甘草配伍可以降低其毒性作用; 甘油磷脂代谢可能是雷公藤肝毒性发生及甘草配伍减毒的关键代谢通路, 通过调控关键作用靶点, 实现代谢通路影响。
| [1] | Bao J, Dai SM. A Chinese herb Tripterygium wilfordii Hook F in the treatment of rheumatoid arthritis: mechanism, efficacy, and safety[J]. Rheumatol Int, 2011, 31: 1123–1129. DOI:10.1007/s00296-011-1841-y |
| [2] | Jiang M, Zha Q, Zhang C, et al. Predicting and verifying outcome of Tripterygium wilfordii Hook F. based therapy in rheumatoid arthritis: from open to double-blinded randomized trial[J]. Sci Rep, 2015, 5: 9700. DOI:10.1038/srep09700 |
| [3] | Xu X, Li QJ, Xia S, et al. Tripterygium glycosides for treating late-onset rheumatoid arthritis: a systematic review and meta-analysis[J]. Altern Ther Health Med, 2016, 22: 32–39. |
| [4] | Li XX, Du FY, Liu HX, et al. Investigation of the active components in Tripterygium wilfordii leading to its acute hepatotoxicty and nephrotoxicity[J]. J Ethnopharmacol, 2015, 162: 238–243. DOI:10.1016/j.jep.2015.01.004 |
| [5] | Zhang C, Sun PP, Guo HT, et al. Safety profiles of Tripterygium wilfordii Hook F: a systematic review and meta-analysis[J]. Front Pharmacol, 2016, 7: 402. |
| [6] | Liu J, Lee J, Salazar Hernandez MA, et al. Treatment of obesity with celastrol[J]. Cell, 2015, 161: 999–1011. DOI:10.1016/j.cell.2015.05.011 |
| [7] | Wasant P, Matsumoto I, Naylor E, et al. Mitochondrial fatty acid oxidation disorders in Thai infants: a report of 3 cases[J]. J Med Assoc Thai, 2002, 85 Suppl 2: S710–S719. |
| [8] | Kolomiytseva IK, Lakhina AA, Markevich LN, et al. Fatty acids and cholesterol in the liver cell nuclei of hibernating Yakutian ground squirrels[J]. Dokl Biochem Biophys, 2016, 470: 364–367. DOI:10.1134/S160767291605015X |
| [9] | Chiu TH, Arnold B, Kim SR, et al. Phosphatidyl glycerolphosphate serves as glycerolphosphate donor in polymer synthesis[J]. Biochem Biophys Res Commun, 1985, 128: 906–912. DOI:10.1016/0006-291X(85)90132-9 |
| [10] | Konarzewska D, Juhaniewicz J, Güzeloğlu A, et al. Characterization of planar biomimetic lipid films composed of phosphatidylethanolamines and phosphatidylglycerols from Escherichia coli[J]. Biochim Biophys Acta, 2017, 1859: 475–483. DOI:10.1016/j.bbamem.2017.01.010 |
| [11] | Korytowski A, Abuillan W, Amadei F, et al. Accumulation of phosphatidylcholine on gut mucosal surface is not dominated by electrostatic interactions[J]. Biochim Biophys Acta, 2017, 1859: 959–965. DOI:10.1016/j.bbamem.2017.02.008 |
| [12] | Boruszewska D, Kowalczyk-Zieba I, Sinderewicz E, et al. The effect of lysophosphatidic acid together with interferon tau on the global transcriptomic profile in bovine endometrial cells[J]. Theriogenology, 2017, 92: 111–120. DOI:10.1016/j.theriogenology.2017.01.021 |
| [13] | Xie T, Zhou X, Wang S, et al. Development and application of a comprehensive lipidomic analysis to investigate Tripterygium wilfordii-induced liver injury[J]. Anal Bioanal Chem, 2016, 408: 4341–4355. DOI:10.1007/s00216-016-9533-9 |
 2017, Vol. 52
2017, Vol. 52