2. 解放军302医院全军中医药研究所, 北京 100039;
3. 湖南中医药大学药学院, 湖南 长沙 410208;
4. 河南中医药大学第一附属医院, 河南 郑州 450000;
5. 成都中医药大学药学院, 四川 成都 611137
2. China Military Institute of Chinese Medicine, 302 Military Hospital, Beijing 100039, China;
3. School of Pharmacy, Hunan University of Traditional Chinese Medicine, Changsha 410208, China;
4. The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, China;
5. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
随着“中草药天然无毒”的理念逐渐深入人心, 中草药愈来愈受欢迎, 促进其在全球范围内的普及应用[1-3]。然而, 近年来有关中草药肝损伤的文献[3-7]报道也不断增多。何首乌是我国临床常用中药和保健食品, 一些何首乌产品如首乌片、Shen-Min等在国外市场也有销售[8]。但是, 随着何首乌肝损伤(事件)报道不断增加[9-14], 引起国内外关注。
本课题组[15]前期通过对1 985例临床病例回顾性分析, 系统对比不同中、西药导致肝损伤的特点, 发现何首乌肝损伤与机体免疫应激状态相关, 多数患者属中医辨证属阴虚火旺、热毒内生者, 推测何首乌肝损伤可能具有免疫特异质属性。另外, 建立的免疫应激动物模型, 也从实验角度证实何首乌免疫特异质肝损伤的客观真实性[16]。“九蒸九曝”或称“九蒸九晒”为本草记载的何首乌传统炮制方法, 然而, 目前何首乌主流炮制方法是蒸制或加黑豆汁蒸制[17], “九蒸九晒”炮制品极少。一般认为, 何首乌经“九蒸九晒”炮制后, 达到的减毒效果会更佳, 但是尚缺乏理论依据, 主要是因为通过常规毒理学实验很难实现传统无毒中药的评价, 这是由于中药具有复杂多样性的特点[18]。为此, 本文在免疫应激动物模型上, 考察何首乌经“九蒸九晒”后对其免疫特异质肝毒性的减毒效果, 并结合代谢组学技术, 筛查与何首乌炮制减毒相关的潜在生物标志物及代谢通路, 本研究为药源性肝损伤新型标志物的发现及肝毒性早期诊断提供了参考, 以期为何首乌炮制减毒提供科学依据。
材料与方法动物 健康雄性SD大鼠, SPF级, 体重(200 ± 10) g, 购于军事医学科学院实验动物中心[合格证号SCXK-(军) 2012-0004]。分笼饲养于解放军第302医院实验动物中心, 自由饮水及进食。饲养环境保持安静, 通风良好, 并定期消毒, 温度(25 ± 2) ℃, 湿度50%~60%, 人工光照约12 h/12 h明暗周期。
药物与试剂 何首乌(批号: SA8201) 购于北京华邈中药工程技术开发中心, 经解放军第302医院肖小河研究员鉴定为蓼科植物何首乌(Polygonum multiflorum Thunb.)的干燥块根。制首乌为上述何首乌“九蒸九晒”制品。脂多糖(lipopolysaccharide, LPS, 每支100 mg, 批号046M4045V)、戊巴比妥钠(每瓶5 g, Cat#57-33-0) 购于Sigma公司。色谱级乙腈购于德国默克公司。色谱级甲酸和甲醇购于美国Fisher公司。去离子水经(18.2 MΩ) Millipore Milli-Q系统(美国Millipore Co.)超纯水器净化。其他所用试剂均为分析纯。
仪器 Nikon E200光学显微镜(日本尼康公司); 爱华KPJ-1A生物组织摊片烤片机(天津天利航空有限公司); 全自动生化分析HITACH17080仪(日本日立有限公司); Leica 2016石蜡切片机(上海莱卡仪器有限公司); Waters acquity超高效液相色谱仪, 二极光阵列检测器(PDA), Empower 2色谱工作站, Waters Xevo G2-XS QTOF/MS质谱仪(英国Waters公司)。
药品制备 “九蒸九晒”何首乌制品:称取适量生何首乌(PM)饮片, 加入80%黑豆汁(黑豆汁:水= 25%:55%)拌匀, 闷润8 h, 然后高压清蒸6 h, 选择光照好的晴天, 将样品置于室外1天1夜, 至干透, 此为一蒸一晒。如此反复9次, 即得“九蒸九晒”样品, 备用。
实验样品制备 称取适量生PM饮片, 加8倍量的50%乙醇冷浸提取, 共2次, 每次48 h, 合并提取液, 减压浓缩回收乙醇, 真空干燥得粗提物, 临用前用去离子水配制成相应浓度(按生药量配制)。制何首乌样品制备同何首乌。
动物分组与给药 将SD大鼠60只随机分成6组(n = 10):正常对照组、LPS (剂量为2.8 mg·kg-1)组、何首乌组(PM, 剂量为5.40 g·kg-1)、制何首乌组(RPM, 剂量为5.40 g·kg-1)、LPS+PM组和LPS+ RPM组。将大鼠称重, 记录, 禁食不禁水12 h后, 其中PM和RPM通过灌胃给予, 3 h后参考文献[16]尾静脉注射2.8 mg·kg-1 LPS, 在7 h后, 使用1%戊巴比妥钠(剂量为50 mg·kg-1)将所有大鼠麻醉, 下腔静脉取血, 离心, 并采集血浆样本和肝组织样本。
肝功能指标检测 采集大鼠血浆, 采用全自动HITACH17080生化仪测定并计算血清ALT和AST的活力。
肝脏病理学检查 取大鼠肝组织1.5 cm × 1 cm × 0.5 cm, 10%甲醛固定, 常规病理切片, HE染色, 光镜下观察。
统计学分析 数据均以x± s表示, 采用SPSS 13.0进行统计分析, 计量资料采用单因素方差分析(ANOVA), P < 0.05为有统计学意义。
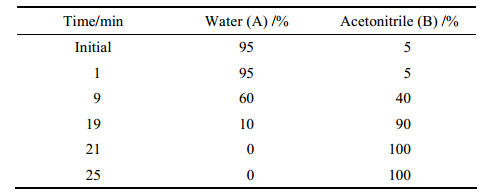
代谢组学色谱条件 色谱柱: Acquity UPLC HSS T3 C18 column (100 mm × 2.1 mm, 1.8 μm)。检测波长: 245、360、420、225和280 nm; 柱温: 30 ℃; 样品温度: 4 ℃; 流动相A:水(0.1%甲酸), B:乙腈(0.1%甲酸); 流速: 0.30 mL·min-1; 进样量: 4 μL。色谱梯度洗脱条件如表 1。
| Table 1 High performance gradient elution conditions |
代谢组学质谱条件 采用电喷雾电离(ESI)离子源, 在负离子模式下数据采集范围m/z: 50~1 200, 采集模式: ESI Continuum模式。毛细管电压2.2 kV (正离子2.5 kV), 锥孔电压40 V, 源温130 ℃, 脱溶剂气温度: 350 ℃, 锥孔气流量50 L·h-1, 脱溶剂气流量800 L·h-1, 碰撞气为氮气和氩气, 碎片碰撞能量, 低能量4 V, 高能量10~55 V, 采集频率0.2 s。质量数校正:亮氨酸脑啡肽(正离子模式下m/z 554.261 5;负离子模式下m/z 556.277 1), 质量浓度100 pg·mL-1, 流速10 mL·min-1, 采样频率每次10 s。质量轴校正:甲酸钠溶液(质量精度误差 < 5 ppm)。正离子条件同负离子。
代谢组学血清样品处理 将存放于-80 ℃冰箱中大鼠血清样品复融, 精密量取200 μL置于EP管中, 加入3倍样品量的乙腈稀释, 涡旋混匀, 再放入离心机中, 在4 ℃条件下, 以10 000 r·min-1离心10 min, 吸取上清液, 过0.22μm微孔滤膜, 备用。
代谢组学数据处理与分析 采用美国Waters公司QI工作站进行色谱峰识别、提取, 并进行分级和校正。然后将化合物的色谱峰的峰面积导入MetaboAnalyst软件进行标准化处理, 保留至少在1个实验组全部样本中都检测到的化合物用于单因素方差分析(ANOVA)及t-test分析, 筛选出具有显著性差异的化合物(P < 0.05且倍数变化 > 2)。然后将上述差异化合物导入SIMCA-P-13软件进行主成分分析(PCA)和偏最小二乘法-判别分析(OPLS-DA)。
代谢组学生物标志物鉴定及通路分析 借助GeneSpring的ID Browser功能模块, 将上述潜在的生物标志物与METLIN代谢物数据库中准确的质荷比进行比对, 质量误差为35 ppm, 筛选其中得分值高于30分的化合物鉴定结果进行通路富集分析。通路的富集分析主要是基于Kyoto Encyclopedia of Genes and Genomes (KEGG)的通路数据库(www.genome. jp/kegg/), 该过程由导入MetaboAnalyst软件实现。
结果 1 对正常和LPS模型大鼠肝功能指标的影响差异与正常对照组比较, 单独给予LPS、单独给予PM和RPM组的ALT和AST活力均没有显著性升高(P > 0.05);与LPS组比较, LPS联合RPM组的ALT和AST活力没有显著性升高(P > 0.05), 而LPS联合PM组的ALT和AST活力有显著性升高(P < 0.05), 说明何首乌经过“九蒸九晒”炮制后对大鼠的肝毒性降低。结果见图 1。

|
Figure 1 Influence of co-treatment with lipopolysaccharide (LPS) and Polygonum multiflorum (PM) or processed Polygonum multiflorum (RPM) on plasma alanine aminotransferase (ALT) (A) and aspartate aminotransferase (AST) (B) activities. LPS-treated group served as a model group. n = 10, x± s. **P < 0.05 vs normal control group; ##P < 0.05 vs LPS group |
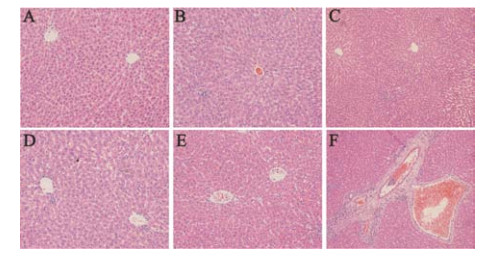
与正常对照组相比, 单独给药PM组和RPM组均无显著病理学改变; LPS组门管区有轻度的炎症细胞浸润; 与LPS组比较, LPS联合RPM组也无明显病理学改变, 而LPS联合PM组可见明显肝损伤(图 2)。
|
Figure 2 Representative microphotographs of livers isolated from rats in experiment of PM and RPM. Saline-treated (control) (A), LPS-treated (B), RPM-treated (C), PM (5.40 g·kg-1, i.g.)-treated (D), LPS/RPM group (E), LPS/PM group (F). HE staining (×200) |
借助UPLC代谢组学平台, 对正离子和负离子模式下的重要的代谢产物进行统计分析。PCA作为一种无监督的模式识别方法, 通过将分散在变量中的信息集中到主成分上来描述数据内部结构, 得到PCA得分图直观显示了不同组别下生物体代谢模式的变化, 具有相同或相似状态的样本处于相近的位置。PCA分析如图 3所示, 在正离子和负离子共同模式下, QC样本聚集在得分矩阵投影图中接近中间位置, 表明在整个分析过程中LC/MS系统是稳定的。另外, 可观察到在正负两种离子模式下, 正常对照组、LPS组、PM组、RPM组、LPS/PM组和LPS/RPM组之间可较好区分, 说明6组间的生理代谢环境发生改变。在正离子模式下79.2%样本符合模型判别(R2X = 0.792), 模型的预测能力为50.8% (Q2 = 0.508);在负离子模式下, R2X = 0.829, Q2 = 0.512, 表明在两种离子模式下模型拟合均良好。另外, 可以观察到LPS/PM组距离其他5组最远, 其他5组有少许重叠, 说明与其他5组相比, LPS模型大鼠给予何首乌造成肝损伤后, 生理代谢环境受到明显干扰, 病理状态下代谢网络出现紊乱。

|
Figure 3 Principal component analysis (PCA) score plots of different extracts of PM by UHPLC-MS in negative (A) and positive (B) electrospray ionization source (ESI) mode |
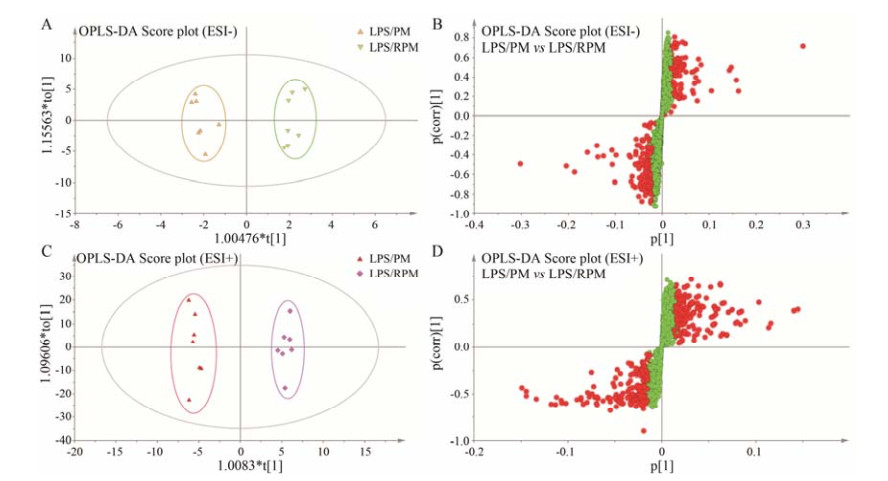
在LPS模型上, 为了进一步区分何首乌与制何首乌干扰生理代谢环境的差异, 使用有监督的模式识别方法OPLS-DA进行分析。该分析方法可筛选得到由组间差异而形成的潜在标记物, 且在显著提高分类判别能力的同时减少了干扰因素对相似性聚类分析的影响。如图 4A得分矩阵投影图所示, 在负离子模式下, LPS/PM组和LPS/RPM组可明显区分, 分别位于纵坐标两侧, 说明在LPS模型上, 何首乌与制何首乌对大鼠生理代谢环境的扰动有显著差异, 结合肝损伤表型, 何首乌导致肝损伤造成病理状态下代谢网络出现紊乱。并且R2X = 0.568, R2Y = 0.982, Q2 = 0.656, 表明该模型具有良好的预测能力。同样, 如图 4C所示, 在正离子模式下也获得如上述类似结果(R2X = 0.573, R2Y = 0.990, Q2 = 0.691)。
|
Figure 4 Orthogonal partial least squares-discriminant analysis (OPLS-DA) analysis of the data generated from the ESI-and ESI+ mode. S-score plots constructed from the supervised OPLS analysis of serum, the axes that are plotted in the S-plot from the predictive component are p1 vs p(corr)1, representing the magnitude and reliability, respectively. Metabolite ions with variable influence on the projection (VIP) value > 1 were marked with a red square. A, B: Displays the result of OPLS-DA model using the data from the LPS/PM and LPS/RPM groups in ESI-mode; C, D: Displays the result of OPLS-DA model using the data from the LPS/PM and LPS/RPM groups in ESI+ mode |
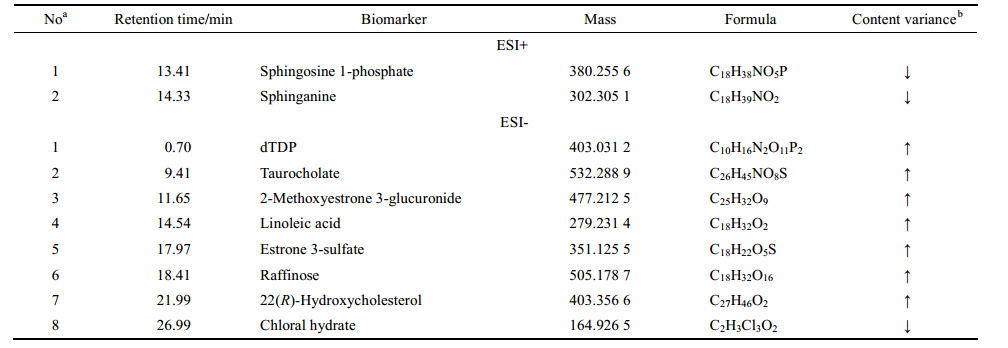
在建立OPLS-DA模型基础上, 通过S-plot分析指标筛选LPS/PM组和LPS/RPM组之间的差异性变量, 作为潜在的生物标志物。在S-plot图中, 通常在原点附近变量没有显著变化, 而分布在最高端或最低端的变量变化显著。选择VIP > 1或|p(corr)|≥0.5差异变量作为潜在候选标志物, 如图 4中红色标记, 这些差异变量可能是区分肝损伤大鼠与非肝损伤大鼠的关键代谢物。采用MetaboAnalyst软件进行单变量分析, 包括ANOVA分析及t-test分析, 选出具有显著性差异的化合物作为生物标志物(P < 0.05且倍数变化 > 2)。在正离子模式下, 共筛选出226个内源性生物标志物; 在负离子模式下, 共筛选出451个内源性生物标志物。然后将正负离子的所有标志物结合在一起, 借助ID Browser与METLIN数据库中的准确的质荷比进行比对, 鉴定出得分值高于30分的化合物作为内源性生物标志物, 共鉴定出71个。通过KEGG通路分析, 进一步筛选得到有KEGG号的39个生物标志物, 与动物实验表型匹配筛选得到10个生物标志物, 见表 2。
| Table 2 Identification and trends of change for potential biomarkers. a: Potential biomarkers identified both in positive and negative ESI mode; b: Change trends of potential biomarkers in LPS/PM compared with LPS/RPM groups. The levels of potential biomarkers were marked with (↓) down-regulated, (↑) up-regulated |
将上述筛选的有KEGG号的39个内源性生物标志物导入MetaboAnalyst软件进行富集通路分析, 筛选得到10个代谢通路, 见图 5。

|
Figure 5 Summary of pathway analysis with MetaboAnalyst 3.0. a: Sphingolipid metabolism; b: Linoleic acid metabolism; c: Steroid hormone biosynthesis; d: Galactose metabolism; e: Steroid biosynthesis; f: Metabolism of xenobiotics by cytochrome P450; g: Pyrimidine metabolism; h: Biosynthesis of unsaturated fatty acids; i: Primary bile acid biosynthesis; j: Taurine and hypotaurine metabolism |
特异质肝毒性(idiosyncratic hepatotoxicity)是世界范围内药物不被批准、撤市或退为二线用药的主要原因。中药特异质毒性及毒性应答个体差异的问题较少被关注。特异质肝毒性预测是目前研究面临的巨大挑战。近年来研究表明, 采用低剂量LPS免疫干预的动物模型与临床药物特异质肝损伤较为近似, 是模拟药物炎症特异质肝损伤的理想模型, 已成功用于曲伐沙星、苏灵大、氟烷、氯丙嗪、野百合碱、雷尼替丁、双氯芬酸和胺碘酮的特异质肝毒性的评价[19-22]。本课题组[16]前期基于该模型证实何首乌属于特异质肝损伤, 并且发现在LPS特异质模型上, 生首乌在接近临床等效剂量的情况下即可表现出肝损伤作用。本研究表明, 基于与何首乌同等剂量的条件下, 经“九蒸九晒”炮制后在该模型上没有显示肝损伤, 而何首乌可见明显的肝损伤, 说明炮制确实可以降低何首乌的毒性(图 1)。何首乌作为传统补益类中药, 在我国应用已有上千年的历史, 历代本草著作鲜有述及其安全性问题, 大多谓其“无毒”。只有在《本草汇言》中描述“生用气寒, 性敛有毒; 制熟气温, 无毒”, 说明何首乌要经过炮制方能减毒。从何首乌炮制历史沿革可以发现, 其炮制工艺逐渐由简至繁, 如从简单的修制发展到黑豆等辅料蒸制、随后“九蒸九晒”制法的出现与广泛应用, 而目前何首乌的主流炮制方法简化为“黑豆汁蒸制”, 说明古人非常重视何首乌的炮制方法[23]。本实验结果也证实了古人炮制的科学性, 那么古今炮制方法的差异是否与何首乌导致肝毒性有关, 还需要进一步研究。
代谢组学是以表型为导向的研究, 可以直接反映疾病的多样性或药物毒性的代谢轮廓和变化[24]。应用代谢组学技术有助于发现在药物肝损伤早期发生显著变化的标志性代谢物, 已成功鉴用于临床肝损伤的早期诊断[25-27]。目前的研究表明, 基于LPS模型何首乌可以通过炮制减毒, 在正常动物上, 何首乌和制首乌均未显示毒性。因此, 为了找到与特异质肝毒性相关的生物标志物, 本研究基于LPS模型将何首乌与制首乌进行比较。PCA显示各组样本间可明显区分, 且LPS/PM组距离其他组最远, 说明何首乌诱导肝损伤与其他各组明显不同。说明代谢组学可以用于表征何首乌的代谢扰动以阐明其毒性作用。标志物的发现, 为有毒药物的早期预警提供了有价值的参考。本研究共筛选了10个标志物, 分别是1-磷酸鞘氨醇(sphingosine 1-phosphate)、二氢鞘氨醇(sphinganine)、dTDP、牛磺胆酸(taurocholic acid)、棉子糖(raffinose)、水合氯醛(chloral hydrate)、亚油酸(linoleic acid)、羟化胆固醇[22(R)-hydroxycholesterol]、雌酮葡萄糖醛酸苷(2-methoxyestrone 3-glucuronide)和硫酸雌酮(estrone 3-sulfate)。1-磷酸鞘氨醇和二氢鞘氨醇主要参与鞘脂代谢; 亚油酸主要参与亚油酸代谢和不饱和脂肪酸合成; 羟化胆固醇、雌酮葡萄糖醛酸苷和硫酸雌酮主要参与甾类激素生物合成; 棉子糖主要参与半乳糖代谢; 水合氯醛主要参与细胞色素P450外源性物质代谢; dTDP主要参与嘧啶代谢; 牛磺胆酸主要参与初级胆汁酸合成牛和磺酸与亚牛磺酸代谢。
从图 5可以看出, 鞘脂代谢可能是何首乌引起肝损伤最重要的代谢通路。在鞘脂代谢中, 鞘脂是细胞膜结构的重要组成部分, 具有重要的生物学功能, 参与多种生理过程, 能够提供许多生物活性代谢物, 如神经酰胺、二氢鞘氨醇、鞘氨醇和1-磷酸鞘氨醇等, 它们作为细胞内外的媒介可以调节细胞的功能[28, 29]。神经酰胺是由鞘磷脂降解得来, 在神经酰胺酶的作用下去乙酰化生成鞘氨醇, 鞘氨醇能被鞘氨醇激酶磷酸化为1-磷酸鞘氨醇[30]。本实验中, 与LPS/ RPM组比较, LPS/PM组的二氢鞘氨醇和鞘氨醇、1-磷酸鞘氨醇的峰浓度都下降, 因此推测肝损伤可能与神经酰胺的累积有关, 神经酰胺不能进一步去乙酰化生成鞘氨醇, 导致其浓度下降, 同样的现象也发生在肝损伤再灌注模型与体内肝移植手术中[31, 32]。
总之, 如前所述何首乌导致的特异质肝损伤的生物学机制可能是炎症应激和代谢通路发生紊乱共同作用的结果。本文尽管已经筛选得到何首乌炮制减毒相关的生物标志物, 但是仍需要进一步通过实验和临床验证。另外, 何首乌导致特异质肝损伤的物质基础和生物学机制也需要进一步研究。
| [1] | Stickel F, Shouval D. Hepatotoxicity of herbal and dietary supplements: an update[J]. Arch Toxicol, 2015, 89: 851–865. DOI:10.1007/s00204-015-1471-3 |
| [2] | Fan TP, Deal G, Koo HL, et al. Future development of global regulations of Chinese herbal products[J]. J Ethnopharmacol, 2012, 140: 568–586. DOI:10.1016/j.jep.2012.02.029 |
| [3] | Frenzel C, Teschke R. Herbal hepatotoxicity: clinical characteristics and listing compilation[J]. Int J Mol Sci, 2016, 17: 588. DOI:10.3390/ijms17050588 |
| [4] | De Boer YS, Sherker AH. Herbal and dietary supplement-induced liver injury[J]. Clin Liver Dis, 2017, 21: 135–149. DOI:10.1016/j.cld.2016.08.010 |
| [5] | Teschke R, Eickhoff A. Herbal hepatotoxicity in traditional and modern medicine: actual key issues and new encouraging steps[J]. Front Pharmacol, 2015, 6: 72. |
| [6] | Teschke R, Wolff A, Frenzel C, et al. Herbal traditional Chinese medicine and its evidence base in gastrointestinal disorders[J]. World J Gastroenterol, 2015, 21: 4466–4490. |
| [7] | Navarro VJ, Khan I, Björnsson E, et al. Liver injury from herbal and dietary supplements[J]. Hepatology, 2017, 65: 363–373. DOI:10.1002/hep.28813 |
| [8] | Wang J, Ma Z, Niu M, et al. Evidence chain-based causality identification in herb-induced liver injury: exemplification of a well-known liver-restorative herb Polygonum multiflorum[J]. Front Med, 2015, 9: 457–467. DOI:10.1007/s11684-015-0417-8 |
| [9] | Dong H, Slain D, Cheng J, et al. Eighteen cases of liver injury following ingestion of Polygonum multiflorum[J]. Complement Ther Med, 2014, 22: 70–74. DOI:10.1016/j.ctim.2013.12.008 |
| [10] | Furukawa M, Kasajima S, Nakamura Y, et al. Toxic hepatitis induced by show-wu-pian, a Chinese herbal preparation[J]. Intern Med, 2010, 49: 1537–1540. DOI:10.2169/internalmedicine.49.3509 |
| [11] | Jung KA, Min HJ, Yoo SS, et al. Drug-induced liver injury: twenty five cases of acute hepatitis following ingestion of Polygonum multiflorum Thunb[J]. Gut Liver, 2011, 5: 493–499. DOI:10.5009/gnl.2011.5.4.493 |
| [12] | Laird AR, Ramchandani N, deGoma EM, et al. Acute hepatitis associated with the use of an herbal supplement(Polygonum multiflorum)mimicking iron-overload syndrome[J]. J Clin Gastroenterol, 2008, 42: 861–862. DOI:10.1097/MCG.0b013e3181492515 |
| [13] | Lei X, Chen J, Ren J, et al. Liver damage associated with Polygonum multiflorum Thunb.: a systematic review of case reports and case series[J]. Evid Based Complement Alternat Med, 2015, 2015: 459749. |
| [14] | Ma J, Zheng L, He YS, et al. Hepatotoxic assessment of Polygoni multiflori Radix extract and toxicokinetic study of stilbene glucoside and anthraquinones in rats[J]. J Ethnopharmacol, 2015, 162: 61–68. DOI:10.1016/j.jep.2014.12.045 |
| [15] | Zhu Y, Niu M, Chen J, et al. Hepatobiliary and pancreatic: comparison between Chinese herbal medicine and Western medicine-induced liver injury of 1985 patients[J]. J Gastroenterol Hepatol, 2016, 31: 1476–1482. DOI:10.1111/jgh.2016.31.issue-8 |
| [16] | Li CY, Li XF, Tu C, et al. The idiosyncratic hepatotoxicity of Polygonum multiflorum based on endotoxin model[J]. Acta Pharm Sin(药学学报), 2015, 50: 28–33. |
| [17] | The State Pharmacopoeia Commission of PR China. Pharmacopoeia of the People's Republic of China(中华人民共和国药典)[M]. Beijing: China Medical Science and Technology Press, 2015. |
| [18] | Willett KL, Roth RA, Walker L. Workshop overview: hepatotoxicity assessment for botanical dietary supplements[J]. Toxicol Sci, 2004, 79: 4–9. DOI:10.1093/toxsci/kfh075 |
| [19] | Waring JF, Liguori MJ, Luyendyk JP, et al. Microarray analysis of lipopolysaccharide potentiation of trovafloxacin-induced liver injury in rats suggests a role for proinflammatory chemokines and neutrophils[J]. J Pharmacol Exp Ther, 2006, 316: 1080–1087. |
| [20] | Shaw PJ, Ganey PE, Roth RA. Idiosyncratic drug-induced liver injury and the role of inflammatory stress with an emphasis on an animal model of trovafloxacin hepatotoxicity[J]. Toxicol Sci, 2010, 118: 7–18. DOI:10.1093/toxsci/kfq168 |
| [21] | Roth RA, Ganey PE. Animal models of idiosyncratic drug-induced liver injury-current status[J]. Crit Rev Toxicol, 2011, 41: 723–739. DOI:10.3109/10408444.2011.575765 |
| [22] | Poulsen KL, Olivero-Verbel J, Beggs KM, et al. Trovafloxacin enhances lipopolysaccharide-stimulated production of tumor necrosis factor-α by macrophages: role of the DNA damage response[J]. J Pharmacol Exp Ther, 2014, 350: 164–170. DOI:10.1124/jpet.114.214189 |
| [23] | Cui HR, Bai ZF, Song HB, et al. Investigation of potential toxic factors for fleece-flower root: from perspective of processing methods evolution[J]. China J Chin Mater Med(中国中药杂志), 2016, 41: 333–339. |
| [24] | Wang X, Zhang A, Han Y, et al. Urine metabolomics analysis for biomarker discovery and detection of jaundice syndrome in patients with liver disease[J]. Mol Cell Proteomics, 2012, 11: 370–380. DOI:10.1074/mcp.M111.016006 |
| [25] | Rofiee MS, Yusof MI, Abdul Hisam EE, et al. Isolating the metabolic pathways involved in the hepatoprotective effect of Muntingia calabura against CCl4-induced liver injury using LC/MS Q-TOF[J]. J Ethnopharmacol, 2015, 166: 109–118. DOI:10.1016/j.jep.2015.03.016 |
| [26] | Weiss RH, Kim K. Metabolomics in the study of kidney diseases[J]. Nat Rev Nephrol, 2011, 8: 22–33. |
| [27] | Xue LM, Zhang QY, Han P, et al. Hepatotoxic constituents and toxicological mechanism of Xanthium strumarium L. fruits[J]. J Ethnopharmacol, 2014, 152: 272–282. DOI:10.1016/j.jep.2013.12.024 |
| [28] | Gault CR, Obeid LM, Hannun YA. An overview of sphingolipid metabolism: from synthesis to breakdown[J]. Adv Exp Med Biol, 2010, 688: 1–23. DOI:10.1007/978-1-4419-6741-1 |
| [29] | Nojima H, Freeman CM, Gulbins E, et al. Sphingolipids in liver injury, repair and regeneration[J]. Biol Chem, 2015, 396: 633–643. |
| [30] | Wang SY, Zhang JL, Zhang D, et al. Recent advances in study of sphingolipids on liver diseases[J]. Acta Pharm Sin(药学学报), 2015, 50: 1551–1558. |
| [31] | Bradham CA, Stachlewitz RF, Gao W, et al. Reperfusion after liver transplantation in rats differentially activates the mitogen-activated protein kinases[J]. Hepatology, 1997, 25: 1128–1135. DOI:10.1002/(ISSN)1527-3350 |
| [32] | Alessenko AV, Galperin EI, Dudnik LB, et al. Role of tumor necrosis factor alpha and sphingomyelin cycle activation in the induction of apoptosis by ischemia/reperfusion of the liver[J]. Biochemistry(Mosc), 2002, 67: 1347–1355. |
 2017, Vol. 52
2017, Vol. 52