2. 解放军302医院, 全军中医药研究所, 北京 100039;
3. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193;
4. 解放军302医院, 中西医结合肝病诊疗与研究中心, 北京 100039
2. China Military Institute of Chinese Medicine, 302 Military Hospital, Beijing 100039, China;
3. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
4. Integrative Medical Center for Liver Diseases, 302 Military Hospital, Beijing 100039, China
何首乌是临床常用中药, 其炮制品具有补肝肾、乌发、降脂等功效, 为百姓广泛服用的补益类中药。然而近年来国内外有关何首乌肝损伤病例的报道逐渐增多[1-5], 这引起药监部门高度重视。前期研究发现, 何首乌在临床上引起肝损伤存在显著的个体差异[6-8], 可能存在易感因素。课题组前期研究发现, 肝脏免疫异常活化或应激态是何首乌肝损伤的重要易感因素之一, 并建立了基于内毒素诱导免疫应激的何首乌肝损伤易感性评价模型[9, 10]。然而, 代谢差异也可能是导致药物肝损伤的重要易感因素, 如对乙酰氨基酚[11]。前期实验提示何首乌中的二苯乙烯苷类化合物对大鼠肝脏呈现一定的损伤作用[12], 而反式二苯乙烯苷(trans-2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucoside, trans-SG)是该类化合物中的主要成分之一, 在何首乌药材中约占1%~7%, 且其在较高浓度时对肝细胞具有一定的毒性作用[13]。有研究报道trans-SG在体内经肝脏Ⅱ相代谢, 代谢产物为葡糖醛酸结合物[14]。Ⅰ相代谢是否影响trans-SG的代谢, 以及肝脏Ⅰ相和Ⅱ相代谢功能的差异是否影响trans-SG的潜在肝毒性, 尚未见研究报道。为此, 本文采用药物代谢酶抑制剂改变肝脏代谢能力, 考察trans-SG对易感性模型肝损伤的影响, 并在体外考察Ⅰ相和Ⅱ相代谢酶对trans-SG代谢转化的影响, 从代谢角度探讨引起何首乌肝损伤的相关因素。
材料与方法动物 雄性Sprague-Dawley (SD)大鼠, SPF级, 6~8周龄, 160~180 g, 购于军事医学科学院实验动物中心[合格证号SCXK-(军) 2012-0004]。分笼饲养, 自由饮水及进食。室温(25 ± 2) ℃, 环境安静、通风良好, 室内保持12 h照明, 12 h黑暗, 并定期用紫外灯光消毒。所有对动物的处理和操作均通过解放军第302医院伦理委员会的批准。
药物与试剂 2, 3, 5, 4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(简称二苯乙烯苷, trans-SG, C20H22O9, M.W. 406.39, HPLC纯度 > 98%)购于成都普菲德生物科技有限公司(141101;中国成都); 苄基咪唑(BI)购自Sigma公司; 酮康唑(KT)购于武汉丰竹林化工科技有限公司; 人肝微粒体、人重组UGT同工酶UGT1A1、UGT1A3、UGT1A4、UGT1A6、UGT1A7、UGT1A8、UGT1A9、UGT1A10、UGT2B4、UGT2B7、UGT2B15和UGT2B17均购于BD gentest公司; 多聚甲醛固定液等购于谷歌生物; 甲醇(色谱级)、乙腈(色谱级)均购于Merck公司; 去离子水经(18.2 MΩ) Millipore Milli-Q系统(Millipore Co., 美国)超纯水器净化, 其他试剂均为市售分析纯。
仪器 超高效液相色谱-质谱联用仪(Agilent Technologies 6550 iFunne1Q-TOF LC/MS, 美国); 酶联免疫检测仪(Synergy H1, BioTek, 美国); 微量分析天平(AL204, Mettler Toledo); 涡旋混匀器(HYQ 2121A); 爱华KPJ-1A生物组织摊片烤片机(天津天利航空有限公司); Leica 2016石蜡切片机(上海莱卡仪器有限公司); Nikon E200光学显微镜(日本Nikon公司)。
苄基咪唑联合trans-SG对LPS大鼠易感性模型的肝损伤评价 将SD大鼠随机分为7组(n = 10):对照组、LPS组(给药剂量为2.8 mg·kg-1)、苄基咪唑组(BI, 给药剂量为10 mg·kg-1)、trans-SG组(给药剂量为31 mg·kg-1)、trans-SG+LPS组、BI+LPS组和trans-SG+LPS+BI组。将大鼠称重, 记录, 苄基咪唑组、BI+LPS组和trans-SG+LPS+BI组连续4天腹腔注射苄基咪唑, 禁食不禁水12 h后, 第5天trans-SG组、trans-SG+LPS组和trans-SG+LPS+BI组灌胃给予trans-SG, 3 h后LPS组、trans-SG+LPS组、BI+LPS组和trans-SG+LPS+BI组尾静脉注射LPS, 7 h后, 使用1%戊巴比妥钠(给药剂量为50 mg·kg-1)将所有大鼠麻醉, 下腔静脉取血, 离心并采集血浆样本[7, 8]。
酮康唑联合trans-SG对LPS大鼠易感性模型的肝损伤评价 将SD大鼠随机分为7组(n = 10);对照组、LPS组(给药剂量为2.8 mg·kg-1)、trans-SG组(给药剂量为31 mg·kg-1)、酮康唑组(KT, 给药剂量为35 mg·kg-1[15])、trans-SG+LPS组、KT+LPS组和trans-SG+LPS+KT组。将大鼠称重, 记录, 酮康唑组、KT+LPS组和trans-SG+LPS+KT组连续4天腹腔注射酮康唑, 禁食不禁水12 h后, 第5天trans-SG组、trans-SG+LPS组和trans-SG+LPS+KT组灌胃给予trans-SG, 3 h后LPS组、trans-SG+LPS组、KT+LPS组和trans-SG+LPS+KT组腹腔注射LPS, 7 h后, 使用1%戊巴比妥钠(给药剂量为50 mg·kg-1)将所有大鼠麻醉, 下腔静脉取血, 离心并采集血浆样本[7, 8]。
肝功能指标检测 采集大鼠血浆, 采用试剂盒(酶标仪法)检测肝功能指标ALT、AST活力。
人肝微粒体Ⅰ相代谢孵育 将人肝微粒体与底物共同孵育, 总体积为250 μL, 孵育体系为0.1 mol·L-1磷酸盐缓冲液(pH 7.4, EDTA 1 mmol·L-1), 肝微粒体终质量浓度为0.4 mg·mL-1。底物为: trans-SG (50 μmol·L-1), 对乙酰氨基酚(50 μmol·L-1)。分为6组: trans-SG组、对乙酰氨基酚组、trans-SG +NADPH+肝微粒体组、对乙酰氨基酚+ NADPH +肝微粒体组、NADPH+肝微粒体组和trans-SG +对乙酰氨基酚+NADPH+肝微粒体组。每组分别加入适量相应的试剂, 放入水浴摇床中于37 ℃下温孵5 min后, 再加入辅助因子NADPH以启动反应, NADPH的终浓度为1 mmol·L-1。反应体系中的有机溶剂浓度≤5‰。混匀后, 于60 min取温孵液100 μL, 分别加入100 μL冰甲醇终止反应, 终止后的混合液充分涡旋。4 ℃条件下16 000 ×g离心30 min, 取上清液保存在-80 ℃冰箱, 备用。
人重组UGT同工酶Ⅱ相代谢孵育 选取体系总体积为100 μL, 含人重组UGT同Ⅰ酶亚型(UGT1A1、1A3、1A4、1A6、1A7、1A8、1A9、1A10、2B4、2B7、2B15和2B17) 中的一种(终质量浓度为0.1 g·L-1)、UDPGA (终浓度2 mmol·L-1), MgCl2 (终浓度5 mmol·L-1), Tris-HCl缓冲液(50 mmol·L-1, pH 7.4) 和trans-SG溶液(终浓度为800 μmol·L-1)。trans-SG溶液、MgCl2、Tris-HCl缓冲液(pH 7.4) 和UGT单酶加入EP管于37 ℃恒温振荡水浴箱中预孵3 min, 再加入辅因子UDPGA启动反应, 37 ℃恒温振荡水浴箱中孵育60 min后, 分别加入冰甲醇100 μL终止反应, 终止后的混合液充分涡旋。4 ℃条件下16 000 ×g离心30 min, 取上清液保存在-80 ℃冰箱, 备用。
色谱条件 色谱柱: Acquity UPLC HSS T3 C18 column (2.1 mm × 100 mm, 1.8 μm, 美国)。检测波长: 245、360、420、225和280 nm, 柱温: 30 ℃; 样品温度: 4 ℃; 流动相: A乙腈(0.1%甲酸), B水(0.1%甲酸); 流速: 0.30 mL·min-1; 进样量: 4 μL。色谱梯度洗脱条件如表 1。精密吸取上清液100 μL, 氮气吹干, 90%甲醇溶解残留物, 离心过膜后注入UPLC-ESI-MS系统分析。
| Table 1 High performance gradient elution conditions |
质谱条件 采用电喷雾电离(ESI)离子源, 在负离子模式下数据采集范围m/z: 50~1 200, 采集模式: ESI Continuum模式。毛细管电压2.2 kV (正离子2.5 kV); 锥孔电压40 V; 源温130 ℃; 脱溶剂气温度350 ℃; 锥孔气流量50 L·h-1; 脱溶剂气流量800 L·h-1; 碰撞气为氮气和氩气; 碎片碰撞能量:低能量4 V, 高能量10~55 V; 采集频率0.2 s。校正:质量数校正:亮氨酸脑啡肽(m/z 554.261 5, 负离子模式; m/z 556.277 1, 正离子模式), 质量浓度100 pg·mL-1, 流速10 mL·min-1, 采样频率每次10 s。质量轴校正:甲酸钠溶液(误差 < 5 ppm)。
统计学分析 用SPSS 20.0软件进行分析, 所有数据以均值±标准差(x± s)表示, 组间比较用one-way ANOVA检验, P < 0.05表示差异有统计学意义, P < 0.01表示差异有显著的统计学意义。
结果 1 苄基咪唑不影响trans-SG在LPS易感性模型大鼠的肝损伤风险实验结果显示, 与对照组比较, LPS组、trans-SG组、苄基咪唑(BI)组、BI+LPS组、trans-SG+LPS组和trans-SG+LPS+BI组ALT和AST均无明显变化(P > 0.05); trans-SG+LPS+BI组与trans-SG+LPS组相比, ALT和AST无明显变化(P > 0.05), 说明苄基咪唑对trans-SG的肝损伤风险无明显影响。结果见图 1。

|
Figure 1 Influence of co-treatment with lipopolysaccharide (LPS), trans-SG and benzyl imidazole (BI) on plasma alanine aminotransferase (ALT) and aspartate aminotransferase (AST) activities. LPS represents lipopolysaccharide-treated group (model group); trans-SG represents trans-SG-treated group; BI represents benzyl imidazole-treated group; BI+LPS represents co-treatment with BI and LPS; trans-SG+LPS represents co-treatment with trans-SG and LPS; trans-SG+LPS+BI represents co-treatment with trans-SG, LPS and BI. n = 10, x± s |
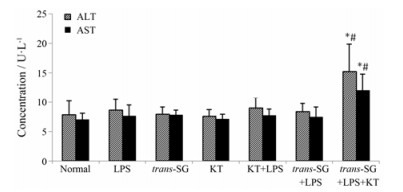
从图 2可以看出, 与对照组比较, LPS组、trans-SG组、酮康唑(KT)组、KT+LPS组、trans-SG+LPS组ALT和AST均无明显变化(P > 0.05); trans-SG + LPS+KT组与对照组比较, ALT和AST显著升高(P < 0.05); trans-SG +LPS+KT组与trans-SG +LPS组相比, ALT和AST均明显升高(P < 0.05), 说明酮康唑可增加trans-SG的肝损伤风险。
|
Figure 2 Influence of co-treatment with lipopolysaccharide (LPS), trans-SG and ketoconazole (KT) on plasma alanine aminotransferase (ALT) and aspartate aminotransferase (AST) activities. LPS represents lipopolysaccharide-treated group; trans-SG represents trans-SG-treated group; KT represents ketoconazole-treated group; KT+LPS represents co-treatment with KT and LPS; trans-SG+LPS represents co-treatment with trans-SG and LPS; trans-SG+LPS+KT represents co-treatment with trans-SG, LPS and KT. For LPS-treated groups, group served as a model group. n = 5, x± s. *P < 0.05 vs control group; #P < 0.05 vs trans-SG+LPS group |
在trans-SG与人肝微粒体共同孵育进行体外微粒体Ⅰ相代谢实验中, 未见trans-SG量减少, 没有检测到Ⅰ相代谢产物, 这提示trans-SG在体外肝微粒体环境中可能未发生Ⅰ相代谢。
在trans-SG与人重组UGT同工酶孵育体系进行Ⅱ相代谢实验中, 在UGT1A1组、UGT1A7组、UGT1A8组、UGT1A9组、UGT1A10组和UGT2B7组均检测到trans-SG的葡糖醛酸结合产物(m/z 581.151 2) (图 3), 并检测到trans-SG含量相对于对照组有所减少(图 4A)。其中, UGT1A1组检测到3个葡糖醛酸结合产物; UGT1A7组、UGT1A9组和UGT1A10组均检测到2个葡糖醛酸结合产物; UGT1A8和UGT2B7组均检测到1个葡糖醛酸结合产物, 结果见图 3。根据生成代谢物的相对丰度, 各UGT亚型所起的代谢作用比例为: UGT1A9 > UGT1A1 > UGT1A7 > UGT1A10 > UGT2B7 > UGT1A8, 结果见图 4B。提示trans-SG可通过UGT酶发生Ⅱ相代谢, 主要参与代谢的亚型为UGT1A9、UGT1A1和UGT1A7。

|
Figure 3 trans-SG metabolism in phase Ⅱ of human uridine diphosphate glucuronate transferase (UGT) isoenzymes. A: Sample of m/z 581.15 in UGT1A1 group; B: Sample of m/z 581.15 in UGT1A7 group; C: Sample of m/z 581.15 in UGT1A8 group; D: Sample of m/z 581.15 in UGT1A9 group; E: Sample of m/z 581.15 in UGT1A10 group; F: Sample of m/z 581.15 in UGT2B7 group. Peak 1, 2, 3 respectively represent different trans-SG metabolites (glucuronic acid conjugates) |

|
Figure 4 trans-SG metabolism and the glucuronic acid conjugates in phase Ⅱ of 6 human UGT isoenzymes groups. A: The relative content (%) of trans-SG in 6 human UGT isoenzymes groups after incubation vs control group; B: The abundance ratio of the glucuronic acid conjugates of trans-SG in 6 human UGT isoenzymes groups after incubation. Different colors represent different conjugates. Calculation method of relative ratio of metabolic capacity for 6 subtypes: take the minimum peak area of m/z 581.15 catalyzed by UGT 1A10 as 1, calculate the relative peak value of m/z 581.15 catalyzed by 6 subtypes comparing with the minimum peak area of m/z 581.15, then add the relative peak value of each subtypes separately |
课题组前期研究发现, 肝脏免疫异常活化或应激态是何首乌肝损伤的重要易感因素之一[6-8]。然而, 代谢因素是否也影响何首乌肝损伤的发生风险, 尚缺少评价研究。本文采用给药剂量为31 mg·kg-1来评价trans-SG特异质肝损伤情况。中国药典规定, 制何首乌临床用量不超过12 g, 其中trans-SG含量不少于0.70%, 大鼠给药剂量为31 mg·kg-1, 按体表面积折算成体重为70 kg的人的等效剂量为344 mg, 以制何首乌药材中trans-SG含量为0.70%折算, 相当于制何首乌药材49 g, 为药典规定最高剂量(12 g)的4倍。实验结果表明, 在31 mg·kg-1剂量下, 单独给trans-SG的正常动物和LPS易感模型大鼠均未引起肝损伤(P > 0.05), 提示在没有改变代谢因素情况下, 即使在LPS易感模型内, trans-SG也不会引起肝损伤。然而, 采用酮康唑抑制Ⅱ相代谢酶后, 31 mg·kg-1 trans-SG在LPS易感模型内引起肝损伤(P < 0.05), 提示抑制Ⅱ相代谢可增加trans-SG的肝损伤风险。
代谢酶抑制剂苄基咪唑的剂量可能对肝损伤评价有影响, 故预实验中参考文献剂量, 考察了苄基咪唑高、低2个剂量(20和10 mg·kg-1), 结果显示, 与正常组相比, LPS组、正常动物苄基咪唑低剂量组、正常动物苄基咪唑高剂量组、LPS+苄基咪唑10 mg·kg-1组的ALT、AST水平均没有明显差异; 而LPS+苄基咪唑20 mg·kg-1组的ALT、AST水平均显著升高(P < 0.01), 提示苄基咪唑20 mg·kg-1对LPS模型动物肝损伤指标有影响, 将可能影响后面与trans-SG联用的肝损伤考察。因此, 本文选择苄基咪唑10 mg·kg-1作为正式实验的给药剂量。酮康唑的剂量选取是参考文献[15], 并且对其进行浓度摸索, 最后锁定为35 mg·kg-1 (文献为小鼠给药剂量50 mg·kg-1, 换算成大鼠为35 mg·kg-1)。文献中提到酮康唑50和200 mg·kg-1 (换算成大鼠给药剂量分别为35和140 mg·kg-1)是安全的, 为了确定最佳给药浓度, 预实验中选取35和140 mg·kg-1两个剂量对酮康唑的给药剂量进行摸索。结果发现各组ALT水平与正常组相比没有明显差异; 但140 mg·kg-1组大鼠的AST水平与正常组相比显著升高(P < 0.01), 提示140 mg·kg-1酮康唑对大鼠肝损伤指标有一定影响。因此, 最终选择酮康唑35 mg·kg-1作为正式实验的给药剂量。
上述Ⅰ相和Ⅱ相代谢的不同影响规律, 可能与trans-SG的多羟基二苯乙烯结构特点和代谢途径有关。为此, 作者进一步考察了Ⅰ相和Ⅱ相代谢酶对trans-SG的代谢情况。体外肝微粒体Ⅰ相代谢实验结果表明, 孵育后trans-SG含量未下降, 未检测到trans-SG的代谢产物, 提示trans-SG可能不是主要通过CYP450酶代谢, 这一结果可以解释动物实验中Ⅰ相代谢酶抑制剂苄基咪唑并未影响trans-SG的肝损伤作用。采用人重组UGT同工酶孵育体系进行Ⅱ相代谢实验, 检测到多个trans-SG葡糖醛酸结合产物, 在所考察的12种UGT亚型中发现了UGT1A1等6种亚型具有Ⅱ相代谢trans-SG的能力, 这一结果可以解释动物实验中Ⅱ相代谢酶抑制剂酮康唑显著增加了trans-SG的肝损伤作用, 即酮康唑抑制Ⅱ相代谢酶导致trans-SG代谢清除减慢, 故增加了trans-SG肝损伤作用。
上述结果提示, 何首乌中主要成分trans-SG主要通过UGT介导的Ⅱ相代谢, 抑制药物Ⅱ相代谢酶可增加trans-SG潜在的肝损伤风险。进一步提示何首乌如果与具有Ⅱ相代谢酶抑制作用的药物配伍使用, 可能增加临床肝损伤发生风险; 而对于存在Ⅱ相代谢酶基因多态性差异或功能低下的患者, 可能同样存在临床肝损伤风险增高的问题。因此, 何首乌临床应用时应综合考虑代谢相关的易感因素和药物配伍禁忌。
| [1] | Ma J, Zheng L, He YS, et al. Hepatotoxic assessment of Polygoni Multiflori Radix extract and toxicokinetic study of stilbene glucoside and anthraquinones in rats[J]. J Ethno pharmacol, 2015, 162: 61–68. DOI:10.1016/j.jep.2014.12.045 |
| [2] | Lei X, Chen J, Ren J, et al. Liver damage associated with Polygonum multiflorum Thunb.: a systematic review of case reports and case series[J]. Evid Based Complement Alternat Med, 2015. DOI:10.1155/2015/459749 |
| [3] | Dong H, Slain D, Cheng J, et al. Eighteen cases of liver injury following ingestion of Polygonum multiflorum[J]. Complement Ther Med, 2014, 22: 70–74. DOI:10.1016/j.ctim.2013.12.008 |
| [4] | Banarova A, Koller T, Payer J. Toxic hepatitis induced by Polygonum multiflorum[J]. Vnitr Lek, 2012, 58: 958–962. |
| [5] | Jung KA, Min HJ, Yoo SS, et al. Drug-induced liver injury: twenty five cases of acute hepatitis following ingestion of Thunb[J]. Gut Liver, 2011, 5: 493–499. DOI:10.5009/gnl.2011.5.4.493 |
| [6] | Zhu Y, Liu SH, Wang JB, et al. Clinical analysis of drug-induced liver injury caused by Polygonum multiflorum and its preparations[J]. Chin J Integr Tradit West Med(中国中西医结合杂志), 2015, 35: 1442–1447. |
| [7] | Li CY, Li XF, Tu C, et al. The idiosyncratic hepatotoxicity of Polygonum multiflorum based on endotoxin model[J]. Acta Pharm Sin(药学学报), 2015, 50: 28–33. |
| [8] | Li XF, Li N, Tu C, et al. Comparison of crude and prepared Polygonum multiflorum-induced idiosyncratic hepatotoxicity based on lipopolysaccharide model[J]. Chin Tradit Herb Drugs(中草药), 2015, 46: 1481–1486. |
| [9] | Steven BY, Umesh MH, Bryan LC, et al. Endothelial cell injury and coagulation system activation during synergistic hepatotoxicity from monocrotaline and bacterial lipopolysac charide coexposure[J]. Toxicol Sci, 2003, 74: 203–214. DOI:10.1093/toxsci/kfg106 |
| [10] | Wang JB, Cui HR, Bai ZF, et al. Precision medicine-oriented safety assessment strategy for traditional Chinese medicines: disease-syndrome-based toxicology[J]. Acta Pharm Sin(药学学报), 2016, 51: 1681–1688. |
| [11] | Tujios S, Fontana RJ. Mechanisms of drug-induced liver injury: from bedside to bench[J]. Nat Rev Gastroenterol Hepatol, 2011, 8: 202–211. DOI:10.1038/nrgastro.2011.22 |
| [12] | Li CY, Niu M, Bai ZF, et al. Screening for main components associated with the idiosyncratic hepatotoxicity of a tonic herb Polygonum multiflorum[J]. Front Med, 2017. DOI:10.1007/s11684-017-0508-9 |
| [13] | Li N, Ma ZJ, Meng YK, et al. Research of inhibition rate and influential factors on normal human liver cell line caused by 2, 3, 5, 4'-tetrahydroxyl diphenylethylene-2-O-glucoside[J]. Chin J Pharmacovigil(中国药物警戒), 2015, 12: 385–388. |
| [14] | Sun JH, Zhang LT, Wang CY, et al. Study on the metabolite of stilbene glucoside in mice by liquid chromatography tandem-mass spectrometry[J]. Acta Pharm Sin(药学学报), 2003, 38: 968–970. |
| [15] | Ding ZF, Jia FL, Ruan M, et al. Protective effects of ketoconazole against cocaine-induced hepatotoxicity in mice[J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志), 2006, 20: 399–404. |
 2017, Vol. 52
2017, Vol. 52



