2. 中国医学科学院肿瘤医院, 北京 100021;
3. 北京输血医学研究所, 北京 100850;
4. 河北北方学院, 河北 张家口 075000
2. Cancer Hospital, Chinese Academy of Medical Sciences, Beijing 100021, China;
3. Beijing Institute of Transfusion Medicine, Beijing 100850, China;
4. Hebei North University, Zhangjiakou 075000, China
药物肝毒性是国内外多种药物撤市的主要原因, 也是导致药物研发失败的重要影响因素[1, 2]。为了更准确地评估药物的安全性, 开发新的临床前药物安全评价模型至关重要[3-5]。目前药物肝毒性评价常用的体外模型有L02细胞株和HepG2细胞株等, 主要采用2D培养的方式, 难以维持肝细胞立体结构形态和细胞间联系, 故导致肝细胞在培养过程中较少表达肝脏特有合成和代谢功能相关的酶类, 与体内肝脏真实情况相差较大; 并且由于上述细胞株均为肝实质细胞来源, 难以评价药物对胆管细胞的损伤作用。类器官(organoids)是采用3D培养方式构建的、能够模拟肝脏细胞形态与功能的体外评价模型, 近年来研究显示该模型较常规2D培养具有显著优势, 可以更准确地评价药物肝毒性[6]。
为了更好地模拟肝脏的结构和功能, 本文采用具有干性潜能的HepaRG细胞株, 由氢化可的松和二甲基亚砜(DMSO)诱导分化为肝实质细胞和胆管细胞, 通过3D培养获得在细胞构成、组织结构和特定功能等方面与肝脏更为相似的体外评价模型, 提高类器官模型评价药物肝毒性的可靠性和准确性[7-9]。此外, 将类器官模型结合高内涵成像技术, 通过特异性荧光标记抗体监测类器官中细胞及亚细胞形态与数量、细胞膜完整性、细胞凋亡相关改变、氧化应激及DNA损伤等多种靶标[10-12], 实现多通道、多靶点和高通量筛选, 且结果直观可定量, 显著提高药物肝毒性体外评价的效率和准确性。
材料与方法材料和仪器 胺碘酮(amiodarone, AMD)、环孢霉素(cyclosporin, CSP)、阿司匹林(aspirin, ASP)、牛胰岛素、氢化可的松、Trizol购自美国Sigma公司; 胰蛋白酶、胎牛血清、William’s E培养基、GlutaMAX购自美国Life Technologies公司; GravityPLUSTM悬滴板购自瑞士InSphero公司; RevertAid First Strand cDNA Synthesis Kit、Power SYBR Green Master Mix、Hoechst 33342、Calcein AM、EthD-1、MitoTracker® Red CMXRos、CellRox Green、ArrayScan High-Content Systems、7500 Real-Time PCR System、离心机、二氧化碳培养箱购自美国Thermo公司; CellTiter-GloTM 3D细胞活力检测试剂购自美国Promega公司; 引物合成于上海Invitrogen公司; SynergyTM H1全功能酶标仪购自美国BioTek公司, 超净工作台购自中国冠鹏公司。
细胞培养 HepaRG细胞由中国食品药品检定研究院馈赠。将HepaRG细胞以每平方厘米2.0×104个接种于25 cm2培养瓶中, 用含10%胎牛血清、100 u·mL-1青霉素、100 μg·mL-1链霉素、2 mmol·L-1 GlutaMAX、5 μg·mL-1牛胰岛素和50 μmol·L-1氢化可的松的William’s E培养基在37 ℃、5% CO2培养箱中培养2周后, 培养基中加入2% DMSO诱导2周。
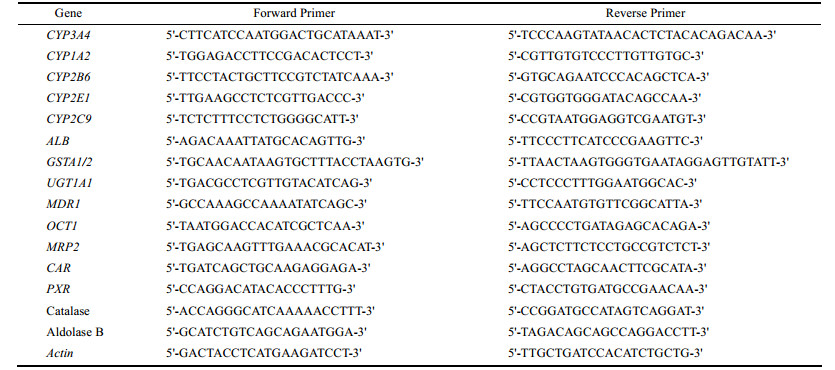
Q-PCR检测 Trizol法提取总RNA, 逆转录成cDNA, 反应条件: 25 ℃ 5 min, 42 ℃ 60 min, 70 ℃ 5 min。RT-PCR所用引物见表 1, 反应程序:预变性95 ℃ 10 min, 循环40次95 ℃ 15 s→60 ℃ 60 s, 溶解曲线75 ℃→95 ℃, 每20 s升温1 ℃。以actin为内参, 采用2-ΔΔCt法进行相对基因表达分析。
| Table 1 Primer sequences used for qPCR |
药品配制 无菌条件下配制。阳性药物AMD、CSP及阴性对照品ASP以200 μmol·L-1为最高剂量[13], 在无菌EP管内用无血清William’s E培养基依次向下倍比稀释7个浓度, 振荡混匀备用, 药物终浓度分别为100、50、25、12.5、6.25、3.13和1.562 5 μmol·L-1。阳性药物AMD的最大血药浓度(Cmax)为0.85 μmol·L-1、CSP的Cmax为0.78 μmol·L-1, 阴性对照药物ASP的Cmax为0.995 μmol·L-1。
类器官培养 将诱导完成的HepaRG细胞, 以1 000个/孔接种于上端GravityPLUSTM板, 细胞散列在悬滴液中(图 1A); 在重力的作用下, 细胞逐渐聚集, 建立细胞与细胞之间的联系, 形成稳定类器官球体(图 1B); 给予液体压力, 将类器官球体转移至GravityTRAPTM板中(图 1C), 类器官球体可在GravityTRAPTM板培养数周[14], 进行后续的药物毒性实验。

|
Figure 1 Liver organoid production and culture. A: HepaRG cells were produced in a 96-well hanging-drop culture platform (Gravity PLUSTM). B, C: After organoid formation, they were transferred into a 96-well culture and assay platform (Gravity TRAPTM). Further maintenance and compound treatments were performed in Gravity TRAPTM plates |
加样处理 取培养7天的类器官球体, 在无菌条件下, 依次将不同浓度的阳性药物和阴性对照药物加入培养板内, 设置溶媒对照组。将加样后的培养板置于37 ℃、5% CO2培养箱中培养24 h。
细胞增殖活力检测 取培养24 h的细胞, 室温平衡30 min, 每孔加入CellTiter-GloTM试剂100μL, 振荡混匀5 min, 室温孵育20~60 min。采用酶标仪读取样品荧光值, 检测ATP合成量用于评价细胞增殖活力。
类器官荧光染料标记 取培养24 h的细胞, 按各荧光染料说明书配制Hoechst 33342、Calcein AM、EthD-1、活性氧(ROS)及Mito染色液。小心吸去培养板内的液体, PBS冲洗3次, 加入配制好的染液, 每孔100 μL, 培养板置于37 ℃、5% CO2培养箱中孵育30 min。将培养板孔内液体小心吸去, PBS冲洗1次, 每孔加入PBS 100 μL, 待测。
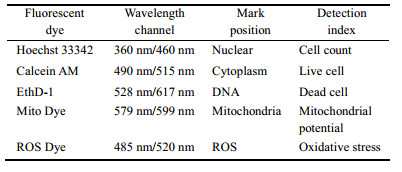
高内涵成像分析 采用高内涵活细胞成像对类器官的细胞数量、ROS和线粒体膜电位(MMP)进行定位和定量分析[13]。将荧光染料Hoechst 33342、Calcein AM、EthD-1、Mito Dye和ROS Dye标记类器官细胞; 选用细胞毒性模块, 设置不同波长通道, 采集荧光图像并对图像进行荧光强度的量化分析, 如表 2所示[10]。
| Table 2 The high-content screening assay based on HepaRG cells |
统计学方法 数据采用x± s表示, 使用SPSS 23.0软件进行统计分析, 组间比较采用单因素方差分析, P < 0.05为具有统计学显著性差异。
结果 1 HepaRG细胞的诱导分化以每平方厘米细胞数2.0×104个接种于25 cm2培养瓶中培养, 起初HepaRG细胞表现为狭长的未分化形态, 待细胞慢慢融合后, 形成肝细胞样的粒状上皮细胞和扁平的胞质透明的细胞。加入2% DMSO诱导2周后, 进一步分化为肝细胞形态和胆管样结构(图 2)。
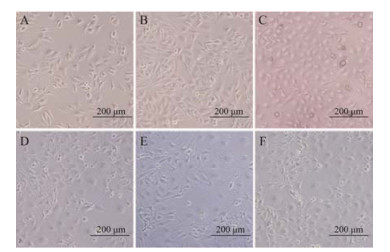
|
Figure 2 Phase-contrast micrographs of control and DMSO-treated differentiated HepaRG cells. HepaRG cells were cultured for 5 days without DMSO (A), 10 days without DMSO (B), or 15 days without DMSO (C), then exposed to 2% DMSO for 15 days (D, E, F) |
当培养的HepaRG细胞开始融合, 加入2% DMSO诱导2周, Q-PCR检测DMSO诱导前后Ⅰ相药物代谢酶(CYP450) CYP3A4、CYP1A2、CYP2B6、CYP2E1、CYP2C9, Ⅱ相代谢酶UGT1A1、GSTA1/2, 核受体因子PXR、CAR, 肝脏特异性蛋白ALB、aldolase B, 膜转运体MDR1、MRP2、OCT1、BSEP及过氧化氢酶catalase的基因表达, 发现各基因的表达均有不同程度的上调, 其中CYP2E1、CYP3A4、CYP2B6、UGT1A1、GSTA1/2和CAR的基因表达显著升高, 而CYP1A2、PXR和ALB的基因表达轻微上调, 其中Ⅰ相药物代谢酶CYP3A4基因表达水平上升最为明显, 约为诱导前培养的35倍, 说明经DMSO诱导后HepaRG细胞高表达药物代谢相关的酶类, 与体内肝脏代谢酶水平更加接近(图 3)。
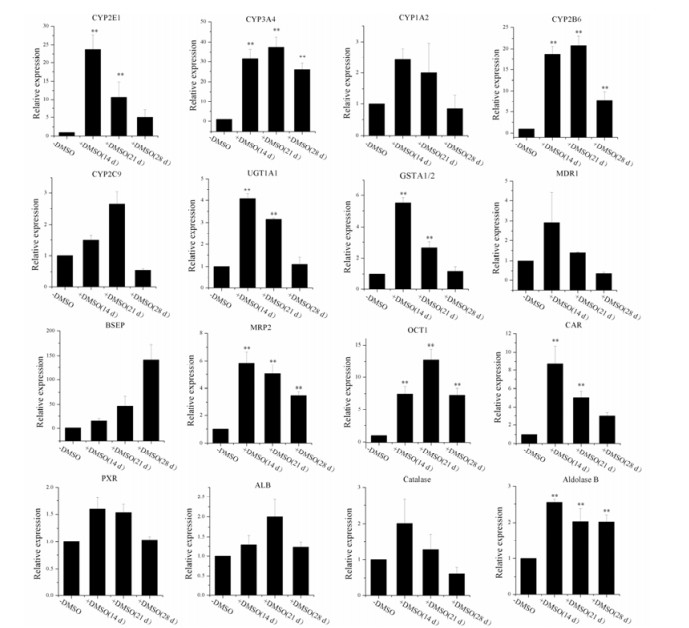
|
Figure 3 Comparative expression of drug metabolic enzymes, transporters, nuclear receptors and liver-specific protein mRNA in control and DMSO-treated differentiated HepaRG cells. n = 3, x± s. **P < 0.01 vs group |
接种于悬滴培养板的HepaRG细胞, 3天后形成稳定的类器官球体结构, 球体直径约为270 μm, 可持续培养3周以上, 且前3周球体细胞增殖较稳定, 可用于药物的评价(图 4)。
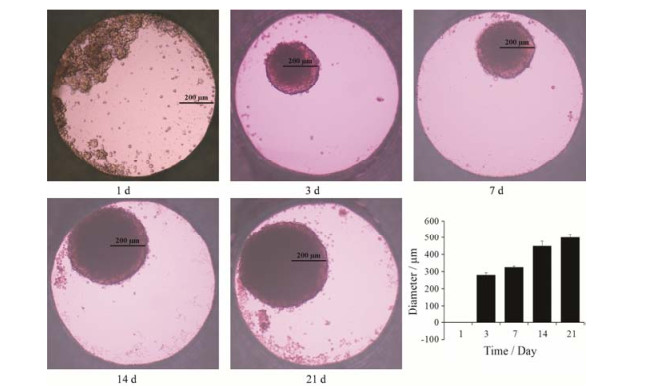
|
Figure 4 Bright field microscopy of HepaRG cell organoid |
采用CellTiter-Glo® 3D定量检测培养物中ATP含量, 进而评价类器官模型中的细胞活力, 结果表明不同浓度(200、100、50、25、12.5、6.25、3.125和1.562 5 μmol·L-1)的3种药物对HepaRG细胞孵育24 h后, 与ASP阴性对照组相比, AMD和CSP对HepaRG细胞活力有明显的抑制作用, 呈剂量依赖性, 且AMD对HepaRG细胞活力的抑制作用比CSP更显著(图 5), 提示AMD具有更强的毒性风险。
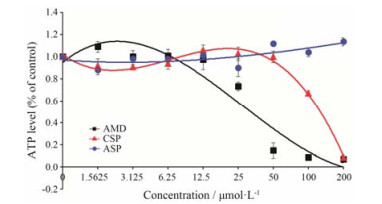
|
Figure 5 Luminescence curves of HepaRG cell organoid treated with drugs. The cell viability of HepaRG treated with drugs for the indicated concentration point respectively. AMD: Amiodarone; ASP: Aspirin; CSP: Cyclosporin |
Hoechst 33342染色结果表明, ASP阴性对照组细胞核呈现均匀的蓝色荧光, 而AMD与CSP分别作用24 h后, 随药物浓度的增加, 荧光强度出现不同程度的减弱, 细胞数量减少。Calcein AM标记的活细胞染色结果显示, 与ASP阴性对照组比较, AMD组与CSP组HepaRG细胞绿色荧光强度随着药物浓度的增强而减弱, 且相同浓度条件下, AMD组HepaRG细胞绿色荧光强度显著降低, 提示AMD组HepaRG细胞的活细胞数量少。而EthD-1标记的死细胞染色结果显示, 与ASP阴性对照组比, AMD组与CSP组HepaRG细胞红色荧光强度随着药物浓度的增强而增强, AMD组HepaRG细胞红色荧光强度显著增强, 提示AMD组HepaRG细胞的死细胞数量多, 具有更强的毒性风险(图 6)。
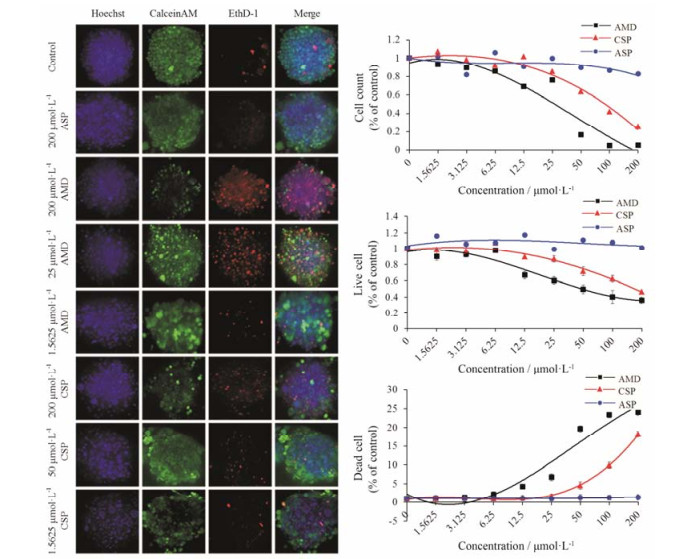
|
Figure 6 Effects of drugs on HepaRG cell organoid. The cell count was observed by Hoechst 33342, Calcein AM and EthD-1 staining |
荧光染料ROS Dye标记的ROS染色结果显示, 与阴性对照ASP组比较, AMD组和CSP组HepaRG细胞绿色荧光增强, 且呈剂量依赖性。与CSP组相比, AMD组ROS的水平显著增加(图 7), 提示AMD导致的肝细胞氧化应激损伤更严重。
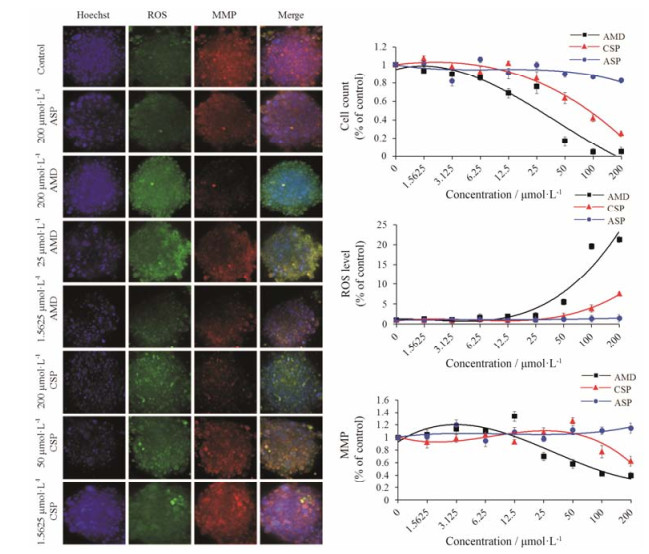
|
Figure 7 Effects of drugs on HepaRG cell organoid. Oxidative stress injury was observed by ROS Dye and Mito Dye staining |
Mito Dye标的MMP染色结果显示, 阴性对照ASP组的细胞膜电位最高, 呈现亮红色荧光, 荧光强度较强。AMD组和CSP组的细胞红色荧光逐渐减弱。随浓度的增加, 对应的红色荧光强度降低。与CSP组相比, AMD组的线粒体膜电位水平显著降低(图 7), 对肝细胞的线粒体损伤作用更严重。
讨论传统2D培养的细胞呈平面生长, 缺乏细胞与细胞、细胞与基质间的相互作用, 无法模拟肝脏组织复杂的细胞生长环境。最近由干(祖)细胞分化并通过3D培养得到的类器官模型, 可复制出已分化组织的复杂空间形态, 维持细胞的生理功能, 提高细胞的存活率, 与体内来源的组织或器官高度相似[14-16]。HepaRG细胞具有干性潜能, 可诱导分化为不同的肝组织细胞类型, 如本研究经过氢化可的松和DMSO诱导获得了向肝实质细胞和胆管细胞分化的细胞形态, 诱导后肝细胞相关的药物代谢酶、药物转运体、
核受体及肝细胞特异标志性分子白蛋白(ALB)等相关基因的表达较高, 接近于体内正常肝脏代谢水平, 对一些无毒或低毒的物质通过生物转化后反而有毒的药物的代谢发挥重要作用, 而普通2D培养的肝细胞系较少表达药物代谢相关酶基因[17], 对一定肝毒性的化合物不敏感, 在药物毒性评价中受到限制。因此, HepaRG细胞3D培养获得的类器官模型可以更好地模拟肝脏的结构和功能, 满足药物代谢与毒副作用筛选需求。此外, 由于HepaRG细胞来源于人肝祖细胞, 避免人与动物间存在的种属差异[18-23]。
高内涵成像技术是基于高效新药筛选需求发展起来的新技术, 具有结果直观且可定量分析的优势, 通过标记不同的靶标, 可以同时评价多个药物的损伤机制。本研究采用悬滴法建立HepaRG细胞肝脏类器官, 该类器官高表达正常肝细胞相关的药物代谢酶、药物转运体、核受体及肝细胞特异标志性分子(ALB)等, 并且可以稳定维持3周以上, 具有类似于在体细胞的药物代谢能力, 更好地模拟药物在肝脏中的代谢和毒性作用; 通过高内涵活细胞成像技术分析发现:类器官模型可以准确地区分肝毒性阳性对照药和阴性对照药的毒性差异, 其中ASP作为阴性对照药在实验浓度(1.562 5~200 μmo·L-1)下未检测到肝毒性作用; 而AMD和CSP作为阳性药在实验浓度(12.5~200 μmol·L-1)表现出浓度依赖的肝毒性作用, 表现在对类器官球体的总细胞数和活细胞数、MMP和细胞内ROS水平均有不同程度改变, 特别是高浓度(≥50 μmol·L-1) AMD显著抑制了类器官球体的细胞增殖、并导致大量细胞死亡, 实验结果与文献[17]报道的结果一致, 可用于药物肝毒性的高通量评价。
HepaRG细胞获得的类器官模型还具有胆管样结构, 标记胆管细胞可以检测胆管细胞损伤型药物的作用[17]。最新的研究表明, 免疫细胞在药物肝毒性发生中起到重要作用[24], 甚至一些药物的肝损伤作用主要依赖于免疫系统的参与而发生[25], 常规的细胞2D培养模型很难模拟这种特殊的损伤过程, 因此, 可以采用免疫细胞与肝细胞共培养形成多细胞类型的类器官模型, 研究具有免疫损伤作用的药物毒性作用。此外, 考虑到药物临床发生的肝毒性往往是特异质的、个体差异较大, 可以采用患者来源的体细胞, 利用本课题组前期建立的小分子化合物诱导谱系重编程技术[26], 获得具有同胚层来源的功能性肝细胞, 建立患者特异的类器官的肝毒性评价模型, 可以更好地模拟和研究特异质肝毒性的发生机制和易感因素。
| [1] | Funk C, Roth A. Current limitations and future opportunities for prediction of DILI from in vitro[J]. Arch Toxicol, 2017, 91: 131–142. DOI:10.1007/s00204-016-1874-9 |
| [2] | Li M, Dong YS, Li ZJ, et al. Progress of cell models for liver toxicity evaluation in vitro[J]. Chin New Drugs J(中国新药杂志), 2015, 24: 1954–1958. |
| [3] | Li DD, Tang XL, Tan HL, et al. 3D evaluation model for drug hepatotoxicity testing on HepG2 cells and its application in drug safety evaluation[J]. Chin J Chin Mater Med(中国中药杂志), 2016, 41: 1313–1317. |
| [4] | Chen M, Borlak J, Tong W. High lipophilicity and high daily dose of oral medications are associated with significant risk for drug-induced liver injury[J]. Hepatology, 2013, 58: 388–396. |
| [5] | Benesic A, Leitl A, Gerbes AL. Monocyte-derived hepato cyte-like cells for causality assessment of idiosyncratic drug-induced liver injury[J]. Gut, 2016, 65: 1555–1563. DOI:10.1136/gutjnl-2015-309528 |
| [6] | Lauschke VM, Hendriks DFG, Bell CC, et al. Novel 3D culture systems for studies of human liver function and as sessments of the hepatotoxicity of drugs and drug candidates[J]. Chem Res Toxicol, 2016, 29: 1936–1955. DOI:10.1021/acs.chemrestox.6b00150 |
| [7] | Tan YY, Liu Y, Liu CB, et al. The research progress of organiod culture[J]. Guang dong Med J(广东医学), 2016, 37: 2827–2828. |
| [8] | Wang J, Chen F, Liu L, et al. Engineering EMT using 3D micro-scaffold to promote hepatic functions for drug hepato toxicity evaluation[J]. Biomaterials, 2016, 91: 11–22. DOI:10.1016/j.biomaterials.2016.03.001 |
| [9] | Kostadinova R, Boess F, Applegate D, et al. A long-term three dimensional liver co-culture system for improved predic tion of clinically relevant drug-induced hepatotoxicity[J]. Toxicol Appl Pharmacol, 2013, 268: 1–16. DOI:10.1016/j.taap.2013.01.012 |
| [10] | Gao Y, Hu YC, Zuo ZP, et al. Study on the risk assessment of drug hepatoxicty by high content analysis[J]. J Pharm Res(药学研究), 2015, 12: 688–691. |
| [11] | Ramaiahgari SC, den Braver MW, Herpers B, et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies[J]. Arch Toxicol, 2014, 88: 1083–1095. |
| [12] | Chen M, Borlak J, Tong W. A model to predict severity of drug-induced liver injury in humans[J]. Hepatology, 2016, 64: 931–940. DOI:10.1002/hep.v64.3 |
| [13] | Chen M, Tung CW, Shi Q, et al. A testing strategy to predict risk for drug-induced liver injury in humans using high-content screen assays and the 'rule-of-two'model[J]. Arch Toxicol, 2014, 88: 1439–1449. DOI:10.1007/s00204-014-1276-9 |
| [14] | Messner S, Agarkova I, Moritz W, et al. Multi-cell type human liver microtissues for hepatotoxicity testing[J]. Arch Toxicol, 2013, 87: 209–213. DOI:10.1007/s00204-012-0968-2 |
| [15] | Godoy P, Hewitt NJ, Albrecht U, et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME[J]. Arch Toxicol, 2013, 87: 1315–1530. DOI:10.1007/s00204-013-1078-5 |
| [16] | Kanninen LK, Porola P, Niklander J, et al. Hepatic differen tiation of human pluripotent stem cells on human liver progenitor HepaRG-derived acellular matrix[J]. Exp Cell Res, 2016, 341: 207–217. DOI:10.1016/j.yexcr.2016.02.006 |
| [17] | Jiang L, Wang YM. Application and biology characteristics of HepaRG cells[J]. Chin Hepatol(肝脏), 2010, 15: 380–383. |
| [18] | Kim SH, Naisbitt DJ. Update on advances in research on idiosyncratic drug-induced liver injury[J]. Allergy Asthma Immunol Res, 2016, 8: 3–11. DOI:10.4168/aair.2016.8.1.3 |
| [19] | Rebelo SP, Costa R, Estrada M, et al. HepaRG microencap sulated spheroids in DMSO-free culture: novel culturing approaches for enhanced xenobiotic and biosynthetic metabolism[J]. Arch Toxicol, 2015, 89: 1347–1358. DOI:10.1007/s00204-014-1320-9 |
| [20] | Gunness P, Mueller D, Shevchenko V, et al. 3D organotypic cultures of human HepaRG cells: a tool for in vitro toxicity studies[J]. Toxicol Sci, 2013, 133: 67–78. DOI:10.1093/toxsci/kft021 |
| [21] | Josse R, Aninat C, Glaise D, et al. Long-term functional stability of human HepaRG hepatocytes and use for chronic toxicity and genotoxicity studies[J]. Drug Metab Dispos, 2008, 36: 1111–1118. DOI:10.1124/dmd.107.019901 |
| [22] | Kanebratt KP, Andersson TB. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies[J]. Drug Metab Dispos, 2008, 36: 1444–1452. DOI:10.1124/dmd.107.020016 |
| [23] | McGill MR, Yan HM, Ramachandran A, et al. HepaRG cells: a human model to study mechanisms of acetaminophen hepatotoxicity[J]. Hepatology, 2011, 53: 974–982. DOI:10.1002/hep.24132 |
| [24] | Chakraborty M, Fullerton AM, Semple K, et al. Drug-induced allergic hepatitis develops in mice when myeloid-derived suppressor cells are depleted prior to halothane treatment[J]. Hepatology, 2015, 62: 546–557. DOI:10.1002/hep.v62.2 |
| [25] | Metushi IG, Hayes MA, Uetrecht J. Treatment of PD-1-/- mice with amodiaquine and anti-CTLA4 leads to liver injury similar to idiosyncratic liver injury in patients[J]. Hepatology, 2015, 61: 1332–1342. DOI:10.1002/hep.v61.4 |
| [26] | Wang Y, Qin J, Wang S, et al. Conversion of human gastric epithelial cells to multipotent endodermal progenitors using defined small molecules[J]. Cell Stem Cell, 2016, 19: 449–461. DOI:10.1016/j.stem.2016.06.006 |
 2017, Vol. 52
2017, Vol. 52