全蝎作为传统中药已有2 000多年的应用历史, 全蝎的主要有效成分为蝎尾毒腺分泌的蝎毒素。药理学研究表明, 蝎毒素具有镇痛、抗炎、抗肿瘤、抗血栓及免疫调节等多种功效[1-5], 作为一种新型的多肽类药物, 其具有良好的研究潜力和应用前景。然而, 蝎毒素含有多种复杂的活性成分, 为了更深入地探索其药理作用, 需进一步对全蝎的有效成分进行提取分离或重组表达, 以获得成分单一的目的蛋白。
近年来, 随着蝎毒提取技术的发展, 国内外研究人员已从蝎毒中分离出数十种蝎毒素单体[6]。其中, 蝎毒活性肽BmK AngM1是从东亚钳蝎(Buthus martensii Karsch)中分离得到的一种新的长链蝎毒素[7]。目前, 对该肽的研究内容主要包括分离纯化、分子克隆、原核和真核表达及其镇痛药理活性评价等[8, 9], 对其抗炎活性研究尚未有报道。有鉴于此, 本研究对BmK AngM1进行了抗炎活性评价。
蛋白质剪接(protein splicing)是一种由蛋白质内含肽(intein)介导, 在蛋白质水平上的翻译后加工过程。此过程从翻译后的蛋白质前体中切除蛋白质内含肽, 同时两侧的蛋白质外显肽(extein)连接成新的具有生物活性的成熟蛋白质。天然的外显肽常常可以替换成外源蛋白质而不影响内含肽的剪切活性[10]。这一点是以内含肽作为融合蛋白进行蛋白质纯化的理论基础。IMPACTTM-TWIN系统正是利用了内含肽的自剪切实现了对蛋白质的纯化。本文利用这一系统建立了rBmK AngM1的纯化方法, 获得了与天然蛋白序列一致的重组蛋白, 进行了抗炎活性检测。
本研究通过软件分析, 将BmK AngM1三维结构与其他α型蝎毒素进行比对, 发现其含有两个主要的功能域:由N末端和C末端的残基共同形成的NC结构域及残基(14YECGI18)与(38WGGKY42)共同形成的核心结构域[11]。本研究根据初步的活性位点预测, 利用定点突变的方法, 获得了6个相关的突变体蛋白, 探索了BmK AngM1中3个可能的活性位点与其抗炎活性之间的关系。
材料与方法菌株和质粒 宿主菌Escherichia coli BL21 trxB (DE3);质粒pMD18-BmK AngM1;表达载体pTWIN1 (本实验室保存)。
试剂 Sap I、BamH I限制性内切酶、Dpn I、T4 DNA连接酶和Q5高保真DNA聚合酶(NEB公司); 几丁质树脂(GE Healthcare); Hepes (拜尔迪生物技术有限公司); IPTG和氨苄青霉素(美国INALCO公司); 普通Taq聚合酶、DNA Marker、PCR产物纯化试剂盒和琼脂糖凝胶DNA回收试剂盒(北京全式金生物技术有限公司); 质粒提取试剂盒(天根生化科技有限公司); 其他试剂均为国产分析纯。
仪器 3K18型低温高速离心机(Sigma公司); 超声波破碎仪(Sonics公司); Mini 2D型电泳仪(Bio-Rad公司); PCR仪(Eppendorf公司)。
BmK AngM1基因的克隆 根据目的基因的碱基序列, 利用Primer Premier 5软件设计引物, 在5'端加上Sap I酶切位点, 在3'端加上BamH I酶切位点。以质粒pMD18-BmK AngM1为模板, 以A和B为引物, 扩增得到基因BmK AngM1。PCR反应程序: 98 ℃ 30 s, (98 ℃ 10 s, 52 ℃ 30 s, 72 ℃ 2 min) ×30循环, 72 ℃ 10 min。具体引物序列见表 1。反应结束后用1%琼脂糖凝胶进行电泳检测, 并用凝胶回收试剂盒对目的基因进行回收。
| Table 1 Primer sequences |
表达质粒构建 将PCR扩增得到的基因片段BmK AngM1和质粒载体pTWIN1用Sap I和BamH I双酶切处理。回收目的片段, 用T4 DNA连接酶将BmK AngM1片段与pTWIN1进行连接, 得到的野生型重组表达质粒命名为pTWIN1-BmK AngM1。以质粒pTWIN1-BmK AngM1为模板, 根据目的突变体序列设计引物(表 1), 通过Q5高保真DNA聚合酶进行全质粒扩增。PCR反应程序: 98 ℃ 30 s, (98 ℃ 10 s, 52 ℃ 30 s, 72 ℃ 2 min) ×30循环, 72 ℃ 10 min。PCR反应结束后, 取1 μL PCR产物进行琼脂糖凝胶电泳, 验证片段大小正确后, 向装有PCR产物的离心管中加入2 μL Dpn Ⅰ, 37 ℃水浴2 h以消化模板, 随后将离心管内溶液加到Trans1-T1感受态细胞中进行转化, 将转化子进行PCR扩增鉴定后, 进一步测序确证。从测序正确的菌株中提取质粒。
重组菌的构建与筛选 将表达质粒转化E. coli BL21 trxB (DE3) 感受态细胞, 在含100 μg·mL-1氨苄青霉素(Amp)的LB平板上进行培养, 37 ℃过夜。从抗性平板上挑取转化子, 以各自引物进行PCR扩增验证。PCR条件: 94 ℃ 10 min, (94 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 4 min) × 30循环, 72 ℃ 10 min。
重组菌的诱导表达 挑取重组菌单菌落, 接种于10 mL含Amp的LB培养基中, 37 ℃、200 r·min-1培养过夜, 然后按1:100体积转入150 mL含Amp的LB培养基37 ℃扩大培养, 当OD值达到0.5时, 加入IPTG至终浓度0.5 mmol·L-1, 16 ℃、150 r·min-1诱导表达18 h, 8 000 r·min-1离心10 min, 收集菌体。超声波破碎仪破碎, 9 000 r·min-1离心30 min, 收集上清液, 取20 μL进行SDS-PAGE电泳, 银染。
rBmK AngM1蛋白的纯化 取2 mL几丁质(Chitin)树脂装柱, 用10个柱体积的缓冲液Buffer I (20 mmol·L-1 Hepes, pH 8.5) 进行柱平衡, 将0.22 μm滤膜过滤后的上清液缓慢加入Chitin柱, 流速为1 mL·min-1, 再用至少20倍柱体积的缓冲液Buffer I洗柱。取100 μL Chitin柱填料用缓冲液Buffer I吹洗两次, 离心, 去上清, 加40 μL 1% SDS吹洗, 离心, 取上清检测蛋白是否挂柱。用15 mL Buffer Ⅱ (20 mmol·L-1 Hepes, pH 7.0) 诱导内含肽的自剪切, 4 ℃静置2天。2天后, 用Buffer Ⅱ洗脱并收集目的蛋白。取100 μL Chitin柱填料用缓冲液Buffer Ⅱ吹洗两次, 离心, 去上清, 加40 μL 1% SDS吹洗, 离心, 取上清检测蛋白与内含肽是否已完全裂解。用10倍柱体积的1% SDS漂洗Chitin柱, 将其在该溶液中浸泡30 min, 再用0.5 mol·L-1 NaOH漂洗, 经过处理的Chitin柱可再次用来纯化蛋白。
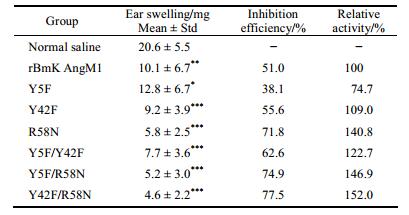
rBmK AngM1及其突变体的抗炎活性检测 昆明种小鼠, 雄性, 18~22 g, 按体重随机分为空白对照组(假手术组)、野生型组和突变体组, 每组各10只。空白组动物按体重静脉注射0.9%氯化钠溶液1 mg·kg-1; 野生型组和突变体组分别皮下注射1 mg·kg-1样品。10 min后, 小鼠左耳涂2%巴豆油液50 μL。4 h后处死, 剪下双耳, 用直径为8 mm的不锈钢铳子冲下左右耳片, 分别称重, 以左右耳片重量之差作为肿胀度, 计算对炎症的抑制率。样品组抑制率(%) = (空白组平均肿胀度-样品组平均肿胀度) /空白组平均肿胀度× 100%。
结果 1 重组表达质粒的构建以质粒pMD18-BmK AngM1为模板, 以表 1中的A和B为引物, 通过PCR扩增得到基因BmK AngM1。将BmK AngM1片段用Sap I和BamH I双酶切, 切胶回收目的片段, 将其连接到相应内切酶处理过的表达载体pTWIN1, 得到重组表达质粒pTWIN1-BmK AngM1, 测序证明读码框架准确。
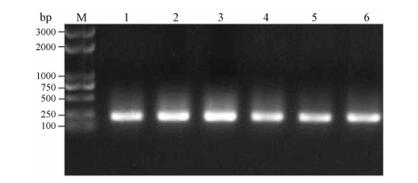
以质粒pTWIN1-BmK AngM1为模板, 以表 1中的相应引物进行全质粒扩增, 获得突变体Y5F、Y42F、R58N、Y5F/Y42F、Y5F/R58N及Y42F/R58N的基因(图 1)。以突变体质粒为模板, 通过各自引物进行PCR扩增, 电泳结果显示, 基因大小均与理论值相符(图 2)。对突变体质粒进行测序, 结果也与预期设计相符, 证明突变位点和读码框架准确。

|
Figure 1 Gene sequences of mutants |
|
Figure 2 The amplification of mutated BmK AngM1 genes by PCR. M: Marker; 1-6: Mutants of Y5F, Y42F, R58N, Y5F/ Y42F, Y5F/R58N, Y42F/R58N |
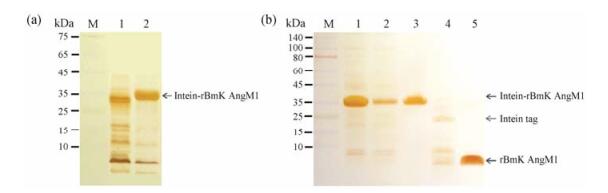
将带有BmK AngM1基因的pTWIN1质粒转入E. coli BL21 trxB (DE3), 在含有100 μg·mL-1 Amp的LB培养基中进行培养, 通过0.5 mmol·L-1 IPTG诱导表达, 从图 3a可看出, 发酵液上清在35~45 kDa之间出现一条特异的蛋白条带, 而转入空载体pTWIN1的对照转化子在相应位置没有出现条带, 证明BmK AngM1蛋白获得了表达。
|
Figure 3 (a) The analysis of intein-rBmK AngM1 expression by Tricine-SDS-PAGE. M: Marker; 1: pTWIN1/trxB; 2: pTWIN1/ Intein-rBmK AngMl/trxB. (b) The purification of rBmK AngM1 by IMPACT-TWIN system. M: Marker; 1: Cell lysate; 2: Chitin column flow-through; 3: Chitin column before washing (CBD-intein-rBmK AngM1); 4: Chitin column after washing (CBD-intein); 5: Chitin column eluent after washing with elution buffer |
取上样后Chitin柱填料经处理后检测表明, 融合蛋白(CBD-intein-rBmK AngM1) 与Chitin柱结合(图 3b-泳道3);经Buffer Ⅱ诱导内含肽自剪切后的Chitin柱填料经处理后检测表明, rBmK AngM1与内含肽裂解(图 3b-泳道4), rBmK AngM1被洗脱下来(图 3b-泳道5)。
3 rBmK AngM1及其突变体的抗炎活性检测通过巴豆油诱导小鼠耳炎模型证明, 以1 mg·kg-1剂量皮下注射给药, rBmK AngM1与突变体蛋白均有显著抑制活性(表 2)。其中单突变体Y5F和Y42F与rBmK AngM1相比, 无显著差异; 单突变体R58N及双突变体Y5F/R58N、Y42F/R58N与rBmK AngM1相比, 其活性均有显著提高。
| Table 2 Anti-inflammatory effects of rBmK AngM1 and its mutants on mice. *P < 0.05, **P < 0.01, ***P < 0.001 vs normal saline |
通过不同的表达系统表达目的蛋白时, 需要根据目的蛋白的特性来选择最适载体及宿主, 这对于蛋白表达和纯化至关重要。IMPACTTM-TWIN系统是一种新型的蛋白融合表达及纯化系统, 该系统最大的优点是表达的融合蛋白无需蛋白酶裂解即可实现目的蛋白与融合标签的精确切割, 不但可以有效降低成本, 提高效率, 还减少了蛋白酶与目的蛋白的分离纯化步骤[12]。本文利用pTWIN1载体构建重组载体以表达目的蛋白。将载体pTWIN1中含有的内含肽-几丁质结合蛋白基因与BmK AngM1基因进行融合, 经诱导表达出从N端到C端为几丁质结合蛋白-内含肽-rBmK AngM1的融合蛋白, 有利于表达可溶性目的蛋白, 并通过几丁质亲和色谱一步纯化得到目的蛋白, 减少目的蛋白在纯化过程中的损失。此外, 宿主的选择对重组蛋白的结构和功能也有重要影响。大肠杆菌表达系统能够在较短时间内获得表达产物, 且成本相对较低, 但其表达的重组蛋白常以包涵体形式存在[13]。大肠杆菌胞质中有一套硫氧还蛋白(thioredoxin)系统可以破坏二硫键的形成, 从而维持胞内还原态, 这主要是硫氧还蛋白还原酶(thioredoxin reductase, TrxB)的作用, 因此其缺乏催化二硫键形成的能力[14]。E. coli BL21 trxB (DE3) 是一种硫氧还蛋白还原酶缺陷菌株, 有利于胞质中蛋白二硫键的形成, 为具有二硫键的外源蛋白在大肠杆菌中正确折叠提供了有效的环境[15]。Cao等[16]利用pET32a载体构建了重组表达载体, 并在E. coli BL21 trxB (DE3) 宿主菌中进行表达, 发现在BL21 trxB (DE3) 中能够有效表达出具有活性的BmK AngM1。因此, 本文通过IMPACTTM-TWIN系统, 在宿主菌E. coli BL21 trxB (DE3) 中对BmK AngM1进行了重组表达, 并建立了rBmK AngM1的纯化方法, 成功表达并纯化得到了有活性的rBmK AngM1。
通过对BmK AngM1的三维结构进行分析, 发现其有四对二硫键、一个NC结构域及一个核心结构域[11]。据文献报道, 当蝎毒活性肽BmK AGP-SYPU1的5位和核心结构域中的42位酪氨酸突变成苯丙氨酸时, 其活性明显提高[17]。通过对其结构进行分析, 推断可能原因为突变的Phe5和Phe42不能与Lys41和Pro60形成氢键, 使得核心结构域的柔性更高, 从而使这些突变体具有更高的活性。但本文实验结果表明, 当5位和42位的酪氨酸突变成苯丙氨酸时, BmK AngM1的抗炎活性无显著变化。将NC结构域中的58位精氨酸突变成天冬酰胺时, 其抗炎活性显著提高, 其可能原因为精氨酸的多个带电基团和脂肪链部分影响了BmK AngM1的抗炎活性, 天冬酰胺的侧链使得BmK AngM1的结构更加稳定。由此可见, 58位残基在BmK AngM1的抗炎活性中起关键作用, 该位点可能是其发挥抗炎作用的活性位点。
| [1] | Wang CY, Tan ZY, Chen B, et al. Antihyperalgesia effect of BmK IT2, a depressant insect-selective scorpion toxin in rat by peripheral administration[J]. Brain Res Bull, 2000, 53: 335–338. DOI:10.1016/S0361-9230(00)00355-5 |
| [2] | Ye HY, Li WD, Lin ZB. The anti-inflammatory effect of scorpion venom[J]. J Gannan Med Univ (赣南医学院学报), 2001, 21: 248–251. |
| [3] | Shao JH, Cui Y, Zhao MY, et al. Purification, characterization, and bioactivity of a new analgesic-antitumor peptide from Chinese scorpion Buthus martensii Karsch[J]. Peptides, 2014, 53: 89–96. DOI:10.1016/j.peptides.2013.10.023 |
| [4] | Wang J, Qian W, Zhu Q, et al. Martentoxin, a large-conduc tance Ca2+-activated K+ channel inhibitor, attenuated TNF-α-induced nitric oxide release by human umbilical vein endothe lial cells[J]. J Biomed Res, 2013, 27: 386–393. |
| [5] | Santhosh KN, Pavana D, Thippeswamy NB. Impact of scorpion venom as an acute stressor onthe neuroendocrine-immunological network[J]. Toxicon, 2016, 122: 113–118. DOI:10.1016/j.toxicon.2016.09.021 |
| [6] | Liu KN, Nie XB, Liu J. Extraction technology of scorpion venom and its application prospect[J]. J Hebei Tradit Chin Med Pharmacol (河北中医药学报), 2016, 31: 55–58. |
| [7] | Cao ZY, Mi ZM, Cheng GF, et al. Purification and charac terization of a new peptide with analgesic effect from the scorpion Buthus martensii Karch[J]. J Peptide Res, 2004, 64: 33–41. DOI:10.1111/j.1399-3011.2004.00164.x |
| [8] | Yang JL, He HX, Zhu HX, et al. Optimization on the production of analgesic peptide from Buthus martensii Karsch in Pichia pastoris[J]. Acta Pharm Sin (药学学报), 2009, 44: 91–94. |
| [9] | Cao Z, Wang W, Xiao X, et al. High-level expression and purification of an analgesic peptide from Buthus martensii Karsch[J]. Protein Peptide Lett, 2007, 14: 247–251. DOI:10.2174/092986607780090883 |
| [10] | Eryilmaz E, Shah NH, Muir TW, et al. Structural and dynamical features of inteins and implications on protein splicing[J]. J Biol Chem, 2014, 289: 14506–14511. DOI:10.1074/jbc.R113.540302 |
| [11] | Cui Y, Song YB, Ma L, et al. Site-directed mutagenesis of the toxin from the Chinese scorpion Buthus martensii Karsch (BmKAS): insight into sites related to analgesic activity[J]. Arch Pharm Res, 2010, 33: 1633–1639. DOI:10.1007/s12272-010-1012-9 |
| [12] | Wang H, Meng X, Xu J, et al. Production, purification, and characterization of the cecropin from Plutella xylostella, pxCECA1, using an intein-induced self-cleavable system in Escherichia coli[J]. Appl Microbiol Biotechnol, 2012, 94: 1031–1039. DOI:10.1007/s00253-011-3863-5 |
| [13] | Sulitan A, Ji SJ, Zhu YX. Prokaryotic expression and transgenic analysis of a scorpion toxin AaHIT1 gene[J]. Chin J Biochem Mol Biol (中国生物化学与分子生物学报), 2003, 19: 182–185. |
| [14] | Derman AI, Prinz WA, Belin D, et al. Mutations that allow disulfide bond formation in the cytoplasm of Escherichia coli[J]. Science, 1993, 262: 1744–1748. DOI:10.1126/science.8259521 |
| [15] | Lei RY, Qiao YH, Yan JD, et al. Soluble expression of recombinant human BMP6 in Escherichia coli and its purification and bioassay in vitro[J]. Chin J Biotechnol (生物工程学报), 2008, 24: 452–459. DOI:10.1016/S1872-2075(08)60025-4 |
| [16] | Cao ZY. Studies on Buthusmartensii Toxins: Purification, Identification, Characterization and Gene Expression (东亚钳蝎蝎毒多肽的分离纯化、结构鉴定、活性测定及基因表达研究) [D]. Beijing: Chinese Academy of Medical Sciences and Peking Union Medical College, 2004. |
| [17] | Deng L, Zhang HX, Wang Y, et al. Site-directed mutagenesis of BmK AGP-SYPU1: the role of two conserved Tyr (Tyr5 and Tyr42) in analgesic activity[J]. Protein J, 2014, 33: 157–164. DOI:10.1007/s10930-014-9547-0 |
 2017, Vol. 52
2017, Vol. 52