2. 道地药材国家重点实验室培育基地, 中国中医科学院中药资源中心, 北京 100700;
3. 中国中药公司, 北京 100195;
4. 中国医学科学院药用植物研究所云南分院, 云南 景洪 666100
2. State Key Laboratory of Dao-di Herbs Breeding Base, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. Chinese Traditional Medicine Company of China, Beijing 100195, China;
4. Yunnan Branch of Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Jinghong 666100, China
石斛类药材作为名贵中药, 药用历史悠久、来源广泛, 掺伪现象极为突出。其中霍山石斛、铁皮石斛和齿瓣石斛因形态结构的相似性, 常相互混伪, 特别是经过炮制加工成枫斗或干条后, 形态特征已破坏, 霍山石斛的“龙头凤尾”、铁皮石斛叶鞘紫斑等特征不显著, 难以从性状上进行区分。市场易见用茎细的铁皮石斛或齿瓣石斛加工品掺杂于霍山石斛枫斗, 或用齿瓣石斛加工品掺杂于铁皮石斛枫斗或干条。虽然目前已有多种石斛的定性鉴别方法, 如基于化学特征的薄层鉴别法等[1]以及基于分子特征的位点特异性PCR法[2-4]等、PCR-RFLP[5]、序列测定[6]或DNA条形码技术[7-9]等, 但只能检测是否存在特定物种的石斛, 未能解决掺伪问题。为进一步完善质量控制体系, 需建立一种能同时鉴别多种石斛的方法, 以解决掺伪检测困难的问题。
多重PCR是一种能同时扩增和检测多个目的片段的方法, 能够通过一次PCR鉴别多个物种以及是否存在相应物种的相互掺伪。该法多应用于医学[10]、遗传学[11, 12]与食品检测领域, 如对肉类[13]、鱼类[14]的掺伪检测。近年来, 多重PCR也用于鉴别近缘中药材, 如对三七、人参、西洋参[15-17], 鱼腥草与百部还魂[18], 以及多基源药材海龙[19]的分子鉴别等, 在中药鉴别尤其是掺伪检测中具有广阔的前景。本文旨在建立一种能同时鉴别三种石斛真伪及掺杂的多重位点特异性PCR方法, 强化霍山石斛、铁皮石斛、齿瓣石斛等名贵石斛的质量控制体系。
材料与方法材料 本实验所用材料为野外采集或购自药材基地, 经硅胶干燥保存于中国中医科学院资源中心。实验材料包括12个不同种源的霍山石斛原植物52批, 霍山石斛干条19批, 及霍山枫斗13批; 铁皮石斛原植物95批、枫斗3批、干条5批; 齿瓣石斛原植物22批(表 1), 及石斛属其他物种68种(表 2), 分别由中国科学院植物研究所金效华副研究员、安徽中医药大学俞年军教授、中国医学科学院药用植物研究所云南分院李戈研究员鉴定。
| Table 1 Sample information of the materials for multiplex allele-specific PCR |
| Table 2 Closely related Dendrobium species and the GenBank sequence of ITS and trnL-trnF used in this paper. Accession numbers were collected from GenBank, based on literatures of Jin XH et al[9, 20] |
试剂 r Taq DNA聚合酶、Ex Taq DNA聚合酶、DL2000 DNA Marker购自Takara公司; FastTaq DNA聚合酶、2× EasyTaq PCR SuperMix购自TransGen公司。
仪器 微量分光光度计(Nanodrop 2000, Thermo Scientific公司); PCR仪: Veriti PCR仪(Applied Biosystems), GeneAmp PCR System 9700 (Applied Biosystems), TC-512 (TECHNE Co. Limited)。
鉴别标记获得与引物设计 以Jin等[9, 20]对亚洲大陆石斛属184个物种ITS、matK、rbcL、trnH-psbA序列分析为基础, 利用BioEdit软件对GenBank数据库中石斛属所有物种的ITS、matK、rbcL、trnH-psbA、trnL-trnF、trnK序列进行同源对齐, 校对后分析铁皮石斛、霍山石斛、齿瓣石斛的特异性SNP位点, 利用Primer Primier 5.0软件分别设计其特异性鉴别引物, 使用Oligo 6软件分析引物间聚合情况, 以避免可能产生的发夹结构、引物二聚体或错误引发, 并着重考虑多重PCR反应对退火温度一致性的要求。设计的霍山石斛、铁皮石斛及齿瓣石斛的特异性鉴别引物序列见表 3, 由生工生物工程(上海)有限公司合成。
| Table 3 Primer pairs sequence, Tm and the length of amplified products for multiplex allele-specific PCR used in this study |
DNA提取 取干燥的石斛样品0.5 g, 使用球磨粉碎机粉碎至能过五号筛。取枫斗粉末50 mg或干燥的原植物粉末20 mg, 使用不同DNA提取方法(CTAB法[21]、两步CTAB法[22]、不同预处理(10% PEG 6000、10%甘油及5%甘油[23, 24])后再经改良CTAB法提取总DNA, 使用微量分光光度计测定DNA浓度, 并记录其A260/A280及A260/A230值, 寻找适合的DNA提取方法提取总DNA, 调整浓度至30 ng·µL-1, 用于PCR扩增或于-20 ℃下保存。
多重PCR扩增及电泳 霍山石斛、铁皮石斛、齿瓣石斛的多重特异性PCR鉴别反应在200 μL的PCR管中进行, 总反应体系25 µL: 10× PCR Buffer 2.5 µL, dNTPs混合液(10 mmol·L-1) 1 µL, 霍山石斛上下游引物各(10 µmol·L-1) 0.4 µL, 铁皮石斛上下游引物各(10 µmol·L-1) 0.1 µL, 齿瓣石斛上下游引物各(10 µmol·L-1) 0.2 µL, r Taq酶(5 U·µL-1) 0.3 µL, DNA模板(10~50 ng) 1 µL, 其余加灭菌水19.8 µL, 将反应液振荡混匀, 瞬时离心。将反应混合体系置PCR仪上。其扩增程序为: 95 ℃预变性5 min; 95 ℃变性10 s, 61 ℃退火20 s, 72 ℃延伸20 s, 共35个循环; 最后72 ℃延伸3 min。待PCR扩增反应结束后, 向反应体系加6 µL 6×loading buffer, 混匀, 取混合产物8 µL点样于1.5%的琼脂糖凝胶上, 于200 V电压的条件下电泳8~10 min, 经EB显色, 最后于凝胶成像仪观察记录结果。
条件优化 在确定单对引物对相应石斛药材的特异性PCR条件后, 对可能影响多重PCR鉴别准确性和稳定性的主要条件进行考察, 包括退火温度(58 ℃、59 ℃、60 ℃、61 ℃)、循环数(31、33、35、37)、DNA聚合酶种类(rTaq、Ex Taq、Fast Taq、Easy Taq Mix)、PCR仪种类(Veriti、9700、TC-512) 和三种石斛鉴别引物的比例(齿瓣石斛上下游引物各0.2 µL、铁皮石斛引物各0.1 µL)等。
检测限及掺伪检出限 随机选取霍山石斛、铁皮石斛、齿瓣石斛DNA样品各2个, 使用微量分光光度计测定总DNA浓度, 调整浓度获得DNA浓度为30、6、1.2和0.24 ng·µL-1的系列样品, 使用经优化的反应体系和PCR程序进行多重特异性PCR, 以测定对3种石斛的检测限。
另取霍山石斛、铁皮石斛、齿瓣石斛样品粉末各0.5 g, 取齿瓣石斛粉末, 以1%、2%、5%、10%、20%、50%、100%的比例与余下两种石斛粉末充分混匀, 使用上述方法提取DNA并进行PCR扩增, 以检测所建立的多重特异性PCR方法对铁皮石斛、霍山石斛中掺杂齿瓣石斛的检出限; 使用对应的方式, 分别检测铁皮石斛和霍山石斛的检出限。
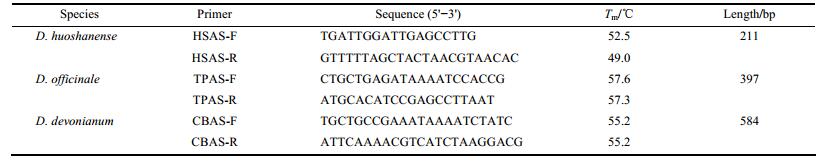
结果与分析 1 引物设计对石斛属不同物种ITS、matK、rbcL、trnH-psbA、trnL-trnF、trnK序列的分析结果表明, 石斛属ITS序列上存在铁皮石斛和齿瓣石斛的特异性SNP位点, 齿瓣石斛ITS序列第58位和59位为T和C, 其他石斛为C和T, 齿瓣石斛ITS序列第599位为C, 其他石斛为A或G; 铁皮石斛序列第68位和第453位分别为G和A, 其他石斛为C和G。trnL-trnF序列上存在霍山石斛特异性SNP位点, 序列第191位霍山石斛为A, 其他石斛均为G, 依据这些位点设计分别设计3种石斛的特异性PCR引物, 并使其长度具有区别, 预期经PCR扩增后, 霍山石斛、铁皮石斛和齿瓣石斛分别获得211、397和584 bp大小的条带。引物设计见图 1。
|
Figure 1 The design of specific primers for the three species |
石斛类材料, 尤其是枫斗和干条多糖含量高, 经炮制处理后DNA降解严重。使用改良CTAB法、两步CTAB法或不同预处理(10% PEG 6000、10%甘油及5%甘油)后再经由改良CTAB法提取石斛DNA, 结果表明, 两步CTAB法提取的DNA浓度和A260/A230均优于其他方法, DNA呈水状, 不黏稠(表 4)。使用特异性引物进行PCR, 仅两步CTAB法提取的DNA能在所有测试的样本中扩出相应条带。
| Table 4 DNA exacted result by using different isolation or pre-treated methods (n = 10). a: Fengdou samples; b: Dried plant samples |
我国石斛属有74种和2变种, 为考察霍山、铁皮、齿瓣石斛鉴别引物的特异性, 随机选取霍山石斛、铁皮石斛、齿瓣石斛各4个, 及其他66种石斛属物种进行特异性扩增, 结果在退火温度分别为60~61 ℃时, 齿瓣石斛(图 2A)、铁皮石斛(图 2B)、霍山石斛(图 2C)均出现特异性条带。

|
Figure 2 Simplex allele-specific PCR for the identification of the three species. M: DL2000 Marker; a1-a4: D. devonianum; b1-b4: D. officinale; c1-c4: D. huoshanense; 1-3: D. chrysotoxum; 4, 5: D. nobile; 6, 7: D. aphyllum; 8: D. thyrsiflorum; 9: D. chrysanthum; 10: D. williamsonii; 11-13: D. strongylanthum; 14, 15: D. crystallinum; 16: D. brymerianum; 17: D. heterocarpum; N: No template control (ddH2O as template) |
取霍山石斛、铁皮石斛、齿瓣石斛DNA, 在PCR反应中同时加入3种石斛的特异性引物进行多重位点特异性PCR反应, 当多重PCR的退火温度为61 ℃时, 霍山石斛、铁皮石斛和齿瓣石斛分别出现211、397和584 bp大小的条带。在此基础上, 为明确PCR体系和PCR程序对多重位点特异性PCR的影响, 对退火温度、循环数、DNA聚合酶种类、PCR仪种类以及石斛鉴别引物的比例进行考察。
4.1 最适退火温度的确定退火温度直接影响PCR鉴别的准确性, 当退火温度分别为58 ℃和59 ℃时, 齿瓣石斛出现了211 bp (霍山石斛鉴别条带)和397 bp (铁皮石斛鉴别条带)的假阳性条带, 霍山石斛出现397 bp的假阳性条带, 而退火温度60 ℃和61 ℃时, 3种石斛均无假阳性和非特异性条带出现, 确定退火温度为61 ℃。
4.2 最适循环数的确定当循环数为31~37循环时均无非特异性扩增和假阳性条带出现, 但35和37循环条带较亮, 由于原植物、干条和枫斗中所含DNA的质量不同, 降解程度和提取难度不一, 可以根据材料的来源确定循环次数, 对新鲜样品或原植物, 可用33个循环进行检测, 对枫斗或干条, 需适当提高循环数至35或37。
4.3 Taq DNA聚合酶对鉴别结果的影响不同Taq酶因其聚合酶活性和3'-5'外切酶活性不同可能导致假阴性或假阳性结果。分别使用rTaq、Ex Taq、Fast Taq和Easy Taq Mix进行多重特异性PCR, 结果表明, 使用Ex Taq DNA聚合酶和Fast Taq DNA聚合酶时齿瓣石斛出现了211 bp和397 bp的假阳性条带, 霍山石斛出现397 bp的假阳性条带, 而使用无3'-5'外切酶活性的r Taq或Easy Taq Mix时无假阳性条带出现, 故选择r Taq DNA聚合酶进行后续实验。
4.4 PCR仪对鉴别结果的影响使用4种不同品牌型号的PCR仪进行多重特异性PCR鉴别, 结果使用不同的PCR仪时, 霍山石斛、铁皮石斛和齿瓣石斛分别出现211、397和584 bp大小的条带, 虽不同仪器的条带亮度有差异, 但并不影响扩增结果。
4.5 最适引物量的确定PCR引物用量及引物间的相互比例对多重特异性PCR结果有重要影响。根据预实验结果, 以齿瓣石斛上下游引物各0.2 µL、铁皮石斛引物各0.1 µL为基础, 分别考察霍山石斛引物用量为0.2、0.3、0.4、0.5 µL时对石斛多重特异性鉴别结果的影响, 结果发现, 0.4及0.5 µL条带亮度最大, 且无假阳性条带出现, 确定霍山石斛上下游引物量为0.4 µL; 在此基础上考察铁皮石斛用量分别为0.05、0.1、0.15、0.2 µL的影响, 结果0.1 µL引物时铁皮石斛电泳条带亮度大且无假阳性条带出现。在此基础上同法考察齿瓣石斛用量为0.15、0.2、0.25、0.3 µL, 结果0.2 µL引物时条带亮度大, 最终确定引物量配比为齿瓣:铁皮:霍山= 0.2 µL:0.1 µL:0.4 µL。
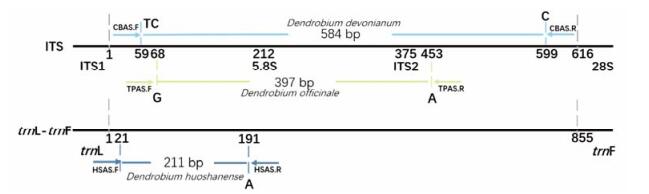
5 多重位点特异性PCR法的检测限及掺杂检出限使用建立的石斛多重位点特异性鉴别方法, 对不同浓度的霍山石斛、铁皮石斛、齿瓣石斛进行PCR反应以测定对3种石斛的检测限。结果PCR体系中齿瓣石斛和霍山石斛在1.2 ng以上时能出现特异性鉴别条带, 而铁皮石斛DNA模板浓度低于0.24 ng时仍能见到清晰的特异性鉴别条带, 可推定所建立的石斛多重位点特异性PCR鉴别方法对齿瓣石斛和霍山石斛的检测下限为1.2 ng, 对铁皮石斛的检测下限低于0.24 ng如图 3。

|
Figure 3 The limit of detection of the three species by multiplex allele-specific PCR. M: DL2000 Marker; 1, 2: D. devonianum; 3, 4: D. officinale; 5, 6: D. huoshanense |
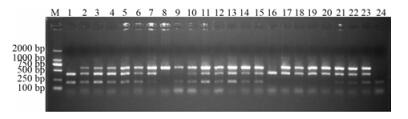
以不同比例混合霍山石斛、铁皮石斛和齿瓣石斛, 提取其DNA并进行多重位点特异性PCR反应以检测建立的方法对掺伪的检出效果。结果表明样品中混入1%以上的齿瓣石斛、1%以上的铁皮石斛或5%以上的霍山石斛时即可检出, 其对铁皮石斛、齿瓣石斛和霍山石斛的检出限分别为1%、1%和5%。如图 4。
|
Figure 4 The detection limit of one mixed with other two species by multiplex allele-specific PCR. 1-8 for the different proportion of D. devonianum of 0, 1%, 2%, 5%, 10%, 20%, 50%, 100%, respectively; 9-16 for the different proportion of D. officinale of 0, 1%, 2%, 5%, 10%, 20%, 50%, 100%, respectively; 17-24 for the different proportion of D. huoshanense of 0, 1%, 2%, 5%, 10%, 20%, 50%, 100%, respectively |
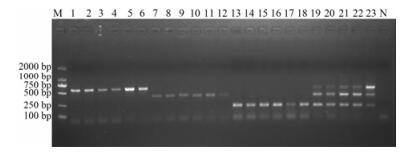
为防止出现假阳性, 随机选取霍山石斛、铁皮石斛、齿瓣石斛及其他68种石斛属物种各1个, 使用建立的多重位点特异性PCR进行扩增, 结果除霍山石斛、铁皮石斛、齿瓣石斛各自出现特异性条带外, 其他石斛均无扩增, 表明建立的方法具有特异性。在此基础上, 对来自于云南、安徽的22批齿瓣石斛, 来自于安徽、云南、浙江的103批铁皮石斛样品和来源于安徽霍山不同产地的52批霍山石斛原植物、19批霍山干条和13批霍山石斛枫斗样品进行多重位点特异性PCR扩增, 结果霍山石斛原植物、干条均扩增获得211 bp的特异性条带, 枫斗10批获得211 bp的特异性条带, 铁皮石斛均获得397 bp的特异性条带, 齿瓣石斛获得584 bp的特异性条带, 无假阳性和假阴性结果出现, 见图 5。
|
Figure 5 The applicability of multiple allele-specific PCR for identification of the three species. M: DL2000 Marker; 1-6: D. devonianum; 7-12: D. officinale; 13-18: D. huoshanense; 19-23: the mixture of the three species; N: No template control (ddH2O as template) |
DNA提取一直是石斛类药材分子鉴定的难点, 特别是干条及枫斗类药材, 受高温影响其DNA降解严重[25]。并且石斛类药材多糖含量较高, 提取的总DNA质量低下, 严重影响PCR扩增, 需预先除去部分多糖。本研究比较了不同DNA提取方法对石斛类提取效果, 结果发现仅两步CTAB法能有效提取石斛枫斗和干条总DNA。与其他植物相比, CTAB法提取的石斛类材料总DNA的A260/A230值显著偏低(0.59 ± 0.28), 表明可能存在严重的多糖、多酚残留。虽然经甘油或PEG 6000前处理后, CTAB提取效果有所提高, 但对枫斗类样品提高效果不明显, DNA浓度低(表 4)。而两步CTAB法显著提高了DNA得率和A260/A230值, 推测是预处理时的沉淀步骤有利于水溶性多糖的溶出与总DNA的沉淀[22]。
本研究建立的多重PCR法鉴别铁皮石斛、齿瓣石斛和霍山石斛时, 对霍山石斛中掺杂铁皮石斛或齿瓣石斛检出限较高, 而对其他两种石斛中掺杂霍山石斛检出限较低, 可能与铁皮石斛糖分含量高, DNA提取更为困难有关。由于常见情况为霍山石斛中掺杂铁皮石斛或齿瓣石斛, 及铁皮石斛中掺杂齿瓣石斛, 对此二种情况, 本研究建立的多重特异性PCR方法检出率均可达到1%, 能有效的控制石斛掺伪现象。近缘中药尤其是多基原中药往往形态相似, 化学成分不明确, 性状质量标准不具有足够的物种特异性, 通过多重PCR法能一次检测多个基原, 从而控制药材掺伪问题, 进一步为质量控制提供了新思路。除本文涉及的三种名贵石斛外, 目前市场上常见枫斗类药材还包括细茎石斛、金钗石斛、兜唇石斛、流苏石斛、晶鞘石斛等10余种。由于多重PCR的共显性特点, 在后期的研究中, 可通过设计相应的物种特异性引物, 建立更高重数的多重位点特异性PCR, 达到一次PCR即可鉴别市场上主流枫斗类药材基源及掺伪的目的。
致谢: 中国科学院植物研究所金效华副研究员对本研究中样品采集和标本鉴定提供了帮助!| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. 2015 ed. Part 1. Beijing: China Medical Science Press, 2015: 92-93. |
| [2] | Ding G, Zhang D, Feng Z, et al. SNP, ARMS and SSH authentication of medicinal Dendrobium officinale Kimura et Migo and application for identification of Fengdou drugs[J]. Biol Pharm Bull, 2008, 31: 553–557. DOI:10.1248/bpb.31.553 |
| [3] | Liu SQ, Li XJ, Yu QB, et al. Allele-specific diagnostic PCR authentication of Dendrobium huoshanense and its allied species of Dendrobium Sw.[J]. Chin Tradit Herb Drugs (中草药), 2006, 1: 111–115. |
| [4] | Ding X, Xu L, Wang Z, et al. Allele-specific diagnostic PCR authentication of D. devonianum from other Dendrobium species[J]. Acta Pharm Sin (药学学报), 2001, 37: 897–901. |
| [5] | Zhang T, Xu LS, Wang ZT, et al. Molecular identification of medicinal plants: Dendrobium chrysanthum, Dendrobium fimbriatum and their morphologically allied species by PCR-RFLP analyses[J]. Acta Pharm Sin (药学学报), 2005, 40: 728–733. |
| [6] | Liu J, He T, Chun Z. Analysis and authentication of chloroplast matK gene sequences of Herba Dendrobii[J]. Acta Pharm Sin (药学学报), 2009, 44: 1051–1055. |
| [7] | Shao SG, Han L, Ma YH, et al. Analysis and authentication of cpDNA psbA-trnH regions of Dendrobium species of fengdous[J]. Acta Pharm Sin (药学学报), 2009, 44: 1173–1178. |
| [8] | Geng LX, Zheng R, Ren J, et al. Application of new type combined fragments: nrDNA ITS+ nad 1-intron 2 for identification of Dendrobium species of Fengdous[J]. Acta Pharm Sin (药学学报), 2015, 50: 1060–1067. |
| [9] | Xu S, Li D, Li J, et al. Evaluation of the DNA barcodes in Dendrobium (Orchidaceae) from mainland Asia[J]. PLoS One, 2015, 10: e0115168. DOI:10.1371/journal.pone.0115168 |
| [10] | Vallone PM, Just RS. A multiplex allele-specific primer extension assay for forensically informative SNPs distributed throughout the mitochondrial genome[J]. Int J Legal Med, 2004, 118: 147–157. DOI:10.1007/s00414-004-0428-5 |
| [11] | Li DY, Xue DJ, Li JF, et al. Simultaneous identification of Ty-3, I-2 and Mi gene by multiplex PCR and its application on tomato[J]. J Northeast Agric Univ (东北农业科学), 2016, 41: 39–43. |
| [12] | Chen MJ, Liu Y, Tu ZM, et al. Rapid confirmation of the transgenic wheat lines by multiplex polymerase chain reaction (MPCR)[J]. J Huazhong Univ Sci Tech (华中科技大学学报), 2004, 32: 105–107. |
| [13] | Ali ME, Razzak MA, Hamid SBA, et al. Multiplex PCR assay for the detection of five meat species forbidden in Islamic foods[J]. Food Chem, 2015, 177: 214–224. DOI:10.1016/j.foodchem.2014.12.098 |
| [14] | Catanese G, Manchado M, Fernández-Trujillo A, et al. A multiplex-PCR assay for the authentication of mackerels of the genus Scomber in processed fish products[J]. Food Chem, 2010, 122: 319–326. DOI:10.1016/j.foodchem.2010.02.036 |
| [15] | Liu L, Xiao BY, Luo HM, et al. Identification of Panax ginseng, Panax quinquefolium and Panax notoginseng by multiplex PCR assay[J]. Chin J Pharm Anal (药物分析杂志), 2016, 36: 668–677. |
| [16] | Cui GH, Tang XJ, Huang LQ. Application of multiplex allele-specific PCR for authentication of Panax ginseng and P. quinquefolius[J]. China J Chin Mater Med (中国中药杂志), 2006, 31: 1940–1943. |
| [17] | Jiang C, Luo YQ, Yuan Y. Identification of Panax ginseng, Panax notoginseng and Panax quinquefolius admixture by multiplex allele-specific polymerase chain reaction[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 1319–1324. |
| [18] | Wei YC, Yuan Y, Chen JX, et al. Rapid PCR identification of Houttuynia cordata and Gymnotheca chinensis[J]. Chin Tradit Herb Drugs (中草药), 2016, 12: 2163–2166. |
| [19] | Gao LH, Yin Y, Li J, et al. Identification of traditional Chinese medicinal pipefish and exclusion of common adulterants by multiplex PCR based on 12S sequences of specific alleles[J]. Mitochondrial DNA Part A, 2017. DOI:10.1080/24701394.2016.1278538 |
| [20] | Xiang XG, Schuiteman A, Li DZ, et al. Molecular systematics of Dendrobium (Orchidaceae, Dendrobieae) from mainland Asia based on plastid and nuclear sequences[J]. Mol Phylogenet Evol, 2013, 69: 950–960. DOI:10.1016/j.ympev.2013.06.009 |
| [21] | Chen KS, Li F, Xu CJ, et al. An efficient macro-method of genomic DNA isolation from Actindia chinensis leaves[J]. Hereditas (遗传), 2004, 26: 529–531. |
| [22] | Dong XM, Jiang C, Zha LP, et al. Study on identification of Dendrobium officinale and related species by bidirectional PCR amplification of mismatched and specific alleles[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 896–901. |
| [23] | Li JL, Wang S, Yu J, et al. A modified CTAB protocol for plant DNA extraction[J]. Chin Bull Bot (植物学报), 2013, 48: 72–78. DOI:10.3724/SP.J.1259.2013.00072 |
| [24] | Chen LY, Song MS, Zha HG, et al. A modified protocol for plant genome DNA extraction[J]. Plant Divers Resour (植物分类与资源学报), 2014, 36: 375–380. |
| [25] | Sze SCW, Zhang KYB, Shaw PC, et al. A DNA microarray for differentiation of the Chinese medicinal herb Dendrobium officinale (Fengdou Shihu) by its 5 S ribosomal DNA intergenic spacer region[J]. Biotechnol Appl Biochem, 2008, 49: 149–154. DOI:10.1042/BA20070059 |
 2017, Vol. 52
2017, Vol. 52