柔性脂质体是一类在磷脂双分子层膜中包埋如乙醇、1, 2-丙二醇、Tween-80和胆酸盐等柔软剂而降低磷脂膜的刚性并增加膜的流动性和变形性的新型脂质体[1]。它们可以通过磷脂膜的变形、与机体细胞的融合或扰乱机体生物膜的致密有序结构等多途径而促进水溶性药物包括蛋白多肽类大分子进入皮肤与黏膜。因此, 柔性脂质体已成为一种极具潜力的皮肤和黏膜给药的微粒型给药载体[2, 3]。研究发现, 以1, 2-丙二醇为柔软剂的柔性脂质体比其他类型的变形脂质体具有更高的载药量、稳定性和良好的促进药物吸收性能[4], 包埋1, 2-丙二醇的柔性脂质体在皮肤给药与黏膜给药领域显示了广阔的应用前景[5, 6]。但是, 液体状态下包封于脂质体内水相中水溶性药物的泄漏, 已经成为脂质体作为给药载体广泛应用的重大技术瓶颈之一。目前, 解决水溶性药物泄漏的主要措施有将液态脂质体通过冷冻干燥制成固态或进行脂质体磷脂膜修饰, 以克服药物的泄漏问题[7, 8]。但是, 脂质体冻干粉目前多用于注射给药或肺部吸入给药, 在外用制剂领域以冻干粉形式应用较少, 且制备工艺复杂与存储条件苛刻也阻碍了脂质体冻干粉的进一步广泛应用; 而磷脂膜修饰也存在一些不可忽视的问题, 如用聚乙二醇修饰后脂质体微粒存在重复注射给药可使血液清除加速并妨碍靶细胞对脂质体微粒摄取等弊端[9, 10]。挥发油是一类流动性与脂溶性良好的中药活性部位, 也可用作溶剂。本文基于“相似相溶原理”, 将中药挥发油包埋于以1, 2-丙二醇为柔软剂的柔性脂质体脂质双分子层内, 以期通过增加双分子层内的疏水性而降低水溶性药物通过脂质层的泄漏。目前, 尚未见将中药挥发油包埋于脂质体脂质双分子层以减少柔性脂质体内水相中药物泄漏的类似研究报道。盐酸巴马汀(palmatine chloride, PC)是一种水溶性良好的具有广谱抗菌作用的生物碱类单体植物药, PC不易透过生物膜进行吸收, 将其制成纳米柔性脂质体能够提高PC透皮、透阴道黏膜的吸收[11, 12]。因此, 本文以PC为模型药物, 研究了中药挥发油包埋于柔性脂质体的磷脂膜后对脂质体微粒的药物泄漏、刺激性及其他药剂学性能的影响。
材料与方法试剂与药品 盐酸巴马汀(纯度≥98%, 批号XC20140514) 购自西安小草植物科技有限责任公司; 盐酸巴马汀标准品(中国食品药品检定研究院, 纯度≥98%, 批号: 110732-201108);艾叶油、桉叶油、茉莉油、丁香油和连翘油(吉安博锐香料油有限公司); 大豆磷脂(上海太伟药业有限公司); 胆固醇(天津博迪化工股份有限公司); 1, 2-丙二醇(厦门星鲨制药有限公司); 硫酸鱼精蛋白(Sigma公司); 其他试剂均为分析纯, 水为双蒸水。14-kD透析袋(上海新睿生物科技有限公司)。
猪阴道组织(西安市屠宰场); SPF级昆明种小鼠(18~20 g, 中国食品药品检定研究院, SCXK (京) 2009-0017);雌性日本大耳白兔(2.0~2.5 kg, 北京金牧阳实验动物养殖有限责任公司, SCXK (京) 2015-0005)。
主要仪器 ZEN-3600光子相关光谱仪(英国马尔文公司); JEM-2000EX透射电镜(日本电子株式会社); HIC-10ASP高效液相色谱仪(SPD-10A检测器, 日本岛津公司)。水平双室扩散池(容积为5.0 mL, 有效扩散面积为1.54 cm2, 上海玉研科学仪器有限公司)。
盐酸巴马汀的测定 采用高效液相色谱法(HPLC)测定PC浓度。色谱柱为C18柱, 流动相为0.4%磷酸-乙腈(80:20), 检测波长345 nm, 流速1.0 mL·min-1, 进样量20 μL。取PC标准品, 精密称定后用双蒸水配制成质量浓度为0.84、2.79、8.37、13.95和25.11 μg·mL-1标准液, 取各标准液20 μL, 注入HPLC中测定峰面积(A), 以PC的A为纵坐标、浓度(C)为横坐标, 进行线性回归, 得到标准曲线为A = 94.501C -49.623 (r = 0.999 5), 线性范围0.84~25.11 μg·mL-1。
脂质体的制备
盐酸巴马汀纳米柔性脂质体(PFL) 称取处方量卵磷脂与胆固醇置于干燥洁净的茄形瓶内, 加入无水乙醇10 mL后振摇溶解, 并于50 ℃、-0.05 MPa条件下旋转蒸干乙醇, 至瓶壁上形成均匀的脂质膜。将丙二醇加入双蒸水中混匀, 得水相; 将0.25% PC加入1/3量水相中溶解并于50 ℃预热, 再滴加到茄形瓶内, 并在氮气氛围下与脂质膜水合60 min后移至洁净的锥形瓶内, 于20 000 r·min-1条件下匀质5 min, 通过0.22 μm微孔滤膜循环过滤2次, 之后将余量水相加入其中, 轻轻振摇混匀, 即得本品, 4 ℃保存, 备用。
包埋挥发油的PFL 将挥发油、卵磷脂与胆固醇置于茄形瓶内, 用10 mL无水乙醇振摇至溶解, 其余操作同上, 分别得到包埋了艾叶油PFL (FA-PFL)、桉叶油PFL (FE-PFL)、茉莉油PFL (AJ-PFL)、丁香油PFL (SA-PFL)和连翘油PFL (FF-PFL), 4 ℃保存, 备用。
盐酸巴马汀水溶液(PS) 将盐酸巴马汀0.25 g与丙二醇20 g, 加入双蒸水79.75 g后搅拌至药物溶解充分并混合均匀, 即得, 4 ℃保存, 备用。
脂质体体外药物泄漏行为 分别取PFL与包埋5种不同挥发油的PFL各样品2.5 mL置于14-kD透析袋, 悬置于盛有50 mL生理盐水的具塞三角瓶; 密闭, 于37 ℃水浴恒温振荡, 分别于0、5、24、72、96和120 h取接收液1.0 mL, 同时补加新鲜生理盐水1.0 mL, 将样品在3 000 r·min-1离心10 min, 吸取上清液20 μL, 注入HPLC测定, 根据标准曲线计算PC含量; 计算各时间点的药物累积泄漏百分率(Ft), 以Ft为纵坐标、时间(t)为横坐标作PC泄漏曲线, 根据泄漏曲线筛选能有效降低PFL药物泄漏的最佳挥发油及其用量水平, 并制备3批最佳挥发油及其用量水平的PFL用于药剂学性能的研究。
脂质体的药剂学性质
包封率测定 分别取PFL与包埋最佳挥发油的PFL各0.75 mL置于2 mL离心管, 加入10 mg·mL-1鱼精蛋白溶液0.75 mL, 振摇混匀, 静置3 min后离心(9 500×g) 15 min, 弃掉上清液, 沉淀物用10% Triton X-100甲醇溶液2 mL消解至澄明, 取20 μL, 采用HPLC测定PC含量。包封率按照如下公式计算:包封率(%) = (WE / WT) × 100%, 其中WE为被脂质体包封的药量, WT为实际加入的总药量。
粒径与zeta电位 取PFL与包埋最佳挥发油的PFL稀释液样品适量, 注入光子相关光谱仪测定脂质体微粒的粒径与zeta电位。
结构观察 将PFL与包埋最佳挥发油的PFL稀释液样品适量滴于铜载网上, 晾干后用磷钨酸(1.5%, w/w)负染色, 再晾干, 用透射电镜(TEM)进行形态结构观察。
变形性考察 根据文献[13]报道的方法, 取PFL与包埋最佳挥发油的PFL样品各5 mL, 在0.8 MPa下通过0.22 µm微孔滤膜的过滤速率, 与5mL水在相同条件下过滤速率的比值为变形性。按照以下公式计算:变形性= VL / VW × 100%, VL为5 mL脂质体的过滤速率, VW为5 mL水的过滤速率, 过滤速率等于供试样品的体积除以过滤的时间。
安全性考察 采用家兔评价药物的黏膜安全性[14]。将雌性日本大耳白兔随机分为PFL组、包埋最佳挥发油的PFL组和空白对照组共3组, 每组6只。前两组动物每天阴道给药(按照人体临床用药量折算为4.5 mg·kg-1·d-1), 对照组不作任何处理, 连续给药7天后处死动物, 进行大体解剖, 摘取阴道, 进行病理组织学检查。
体外透皮透黏膜给药
体外透皮给药 小鼠脱颈处死后剥离腹部皮肤, 剪净毛发并去掉皮下脂肪组织, 用生理盐水冲洗干净后将其置于水平双室扩散池中, 角质层面向供给池、真皮层面向接收池; 扩散池置于磁力搅拌器上, 以恒速搅拌接收液并保持温度(32 ± 0.5) ℃。供给池中分别加入PFL、包埋最佳挥发油的PFL与PS各5 mL, 接收池中加入生理盐水5 mL作为接收液。每隔1 h取接收液0.3 mL, 并补加等量的新鲜接收液, 共取6个样品, 样品经0.45 μm滤膜过滤后取20 μL注入HPLC测定PC含量, 实验重复3次。按如下公式计算药物的累积透过量(ΔM): ΔM = ∑CV/Ae, 其中V为接收液的体积(mL), C为接收液中PC质量浓度(μg·mL-1), Ae为扩散池的有效扩散面积(cm2)。
体外透黏膜给药 将新鲜的猪阴道组织剪开后, 剔除黏膜层下结缔脂肪组织, 并用生理盐水冲洗至干净, 剪切成2.0 cm × 2.0 cm的小块; 置于水平双室扩散池中, 内黏膜层面向供给池、外组织层面向接收池; 其余操作与药物透过黏膜的累积渗透量(ΔM)的计算方法同上。
统计学分析 实验结果数据采用方差分析与t-检验进行统计学分析, P < 0.05为差异有统计学意义。
结果 1 挥发油对PFL药物泄漏的影响将艾叶油、桉叶油、茉莉油、丁香油与连翘油包埋于PFL的脂质双分子层内, 对于PFL内水相中药物PC泄漏的影响如图 1所示。由图可知, 上述5种挥发油均能降低水溶性PC从PFL内水相中泄漏, 表明通过增加脂质体脂质双分子层内疏水性能减少内水相中药物的泄漏。PFL包埋了桉叶油、茉莉油与丁香油后对药物泄漏的抑制程度相似, 三者之间无显著性差异(P > 0.05), 但三者的抑制PC泄漏程度均低于包埋了艾叶油与连翘油后PFL的抑制泄漏程度, 表明不同的挥发油可能由于组成成分不同而具有不同的改变脂质双分子层内疏水性的作用。在120 h时, PFL中药物的泄漏分别是FA-PFL与FF-PFL的2.34与1.62倍(P < 0.05), 而且在整个实验过程中FA-PFL中药物泄露最少, 因此, 表明本文所选的5种挥发油中艾叶油具有良好的抑制PC从PFL内水相中泄漏的作用。

|
Figure 1 Effects of different volatile oils on the leakage of palmatine chloride (PC) from PFL. n = 3, x± s. PFL: PC loaded flexible nano-liposomes; FA-PFL: Folium Artemisiae Argyi oil encapsulated in the PFL; FE-PFL: Folium Eucalypti oil encapsu lated in the PFL; AJ-PFL: Arabian Jasmine oil encapsulated in the PFL; SA-PFL: Syzygium Aromaticum oil encapsulated in the PFL; FF-PFL: Fructus Forsythiae oil encapsulated in the PFL |
艾叶油与脂质质量比为1:6和1:9时, 抑制PC从PFL内水相中的泄漏作用显著高于PFL (P < 0.05), 且在1:6时达到最佳的泄漏抑制作用; 当艾叶油与脂质质量比为1:3时, 艾叶油反而促进了PFL中PC的泄漏, 其原因可能是高浓度的艾叶油破坏了脂质体的脂质双分子层磷脂膜的稳定性和完整性, 从而造成内水相中药物的泄漏增加, 如图 2所示。结果表明, 艾叶油抑制PFL内水相中PC泄漏的作用不会随着艾叶油的浓度增大而无限增大, 当艾叶油与脂质质量比为1:6时抑制药物泄漏作用最大, 从而也提高了PFL的稳定性。

|
Figure 2 Effects of different Folium Artemisiae Argyi oil and lipid mass ratio (FA-PFL-1 = 1:3; FA-PFL-2 = 1:6; FA-PFL-3 = 1:9) on the leakage of PC from PFL. n = 3, x± s |
PFL对PC的包封率为(76 ± 2.47) % (n = 5), 包埋艾叶油后PFL对PC的包封率为(79 ± 1.65) % (n = 5), 尽管其包封率有所提高, 但二者之间无显著性差异(P > 0.05), 表明PFL在其脂质双分子层内包埋艾叶油后对内水相中PC的包封率无显著影响。
2.2 脂质体的粒径和表面电位PFL的粒径为182 ± 19 nm (n = 5), 表面zeta电位为-45 ± 3.43 mV (n = 5);包埋艾叶油后PFL的粒径为190 ± 25 nm (n = 5), 表面zeta电位为-49 ± 2.85 mV (n = 5);尽管PFL包埋艾叶油后其粒径和zeta电位稍有增加, 但二者之间无显著性差异(P > 0.05)。结果表明, 艾叶油包埋于PFL脂质双分子层内对其粒径和电位不产生显著影响, 且电位的增加意味着微粒间静电斥力增加而利于稳定性提高。当微粒表面zeta电位的绝对值大于30 mV时, 有利于制剂稳定性的提高, 粒径保持均匀[15]。
2.3 脂质体的结构由TEM观察可知, 包埋艾叶油前后PFL均为具有层状囊泡结构的圆形或椭圆形(图 3), 表明艾叶油包埋在PFL脂质双分子层内的脂溶性空间对其整体的层状结构没有影响, 这也从粒径和zeta电位的研究结果得到进一步印证。

|
Figure 3 The TEM images of PC loaded flexible liposomes. A: PFL; B: FA-PFL |
PFL的变形性为(78 ± 6.34) % (n = 5), PFL包埋艾叶油后的变形性稍有增加(80 ±5.72) % (n = 5), 其原因可能是艾叶油被包埋于PFL脂质双分子层后扰乱了磷脂膜的有序结构或进一步降低其相变温度, 从而使膜的变形性增加, 但二者之间无显著性差异(P > 0.05), 表明艾叶油包埋于PFL脂质双分子层后对磷脂膜的变形性无显著性影响。
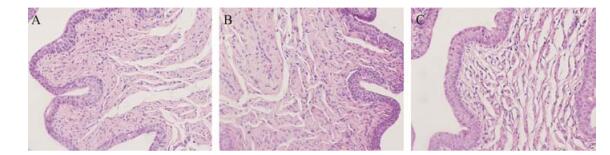
2.5 脂质体的安全性由图 4可知, 给药组与对照组病理切片均显示动物阴道组织各层结构清晰, 黏膜层细胞排列规整, 前庭部为鳞状上皮细胞, 阴道黏膜部为柱状上皮, 未见坏死脱落, 可见散在淋巴细胞及少量中性粒细胞分布其间, 固有层血管分布丰富, 未见水肿渗出, 肌层细胞排列规整, 无炎性细胞浸润。结果表明, PFL与包埋艾叶油后的PFL对黏膜均无刺激性。
|
Figure 4 The histological sections of the treated rabbit vaginal tissue. A: Control group; B: PFL; C: FA-PFL |
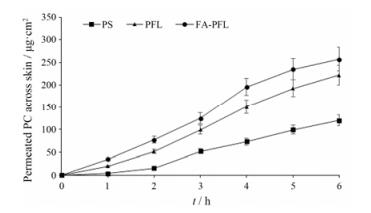
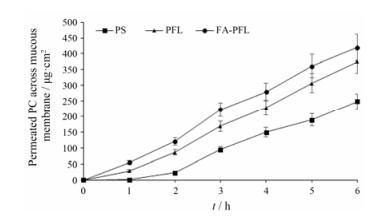
由图 5和图 6可知, 在透皮与透黏膜实验中, PS始终具有最低的药物累积渗透曲线, 表明尽管PC是一个水溶性的小分子药物, 但其仍不易通过皮肤和黏膜进行吸收, 也表明柔性脂质体具有促进水溶性PC通过皮肤和黏膜吸收的能力。包埋艾叶油后的PFL (艾叶油:脂质= 1:6) 促进PC透皮与透黏膜的累积透过量在整个实验中始终高于PFL和PS, 在6.0 h时, 包埋艾叶油后的PFL促进PC透皮与透黏膜给药的累积透过量分别是PFL透皮与透黏膜给药的累积透过量的1.16倍和1.12倍, 是PS的2.14倍和1.69倍, 表明包埋艾叶油后能进一步增强PFL促进PC透过皮肤和黏膜吸收的能力, 也表明在促进药物透皮与透黏膜吸收方面艾叶油与PFL之间存在一定的协同作用。
|
Figure 5 The cumulative permeable amount of PC across skin from different formulations. n = 3, x± s. PS: PC aqueous solution |
|
Figure 6 The cumulative permeable amount of PC across mucous membrane from formulations. n = 3, x± s |
柔性脂质体微粒给药系统属于热力学与动力学不稳定的体系, 加之包封于脂质囊泡内水相中药物的泄漏, 限制了脂质体微粒以液体状态作为给药载体的产业化应用。因此, 药物泄漏已成为脂质体领域亟待解决的重大共性技术问题之一。本文基于“相似相溶原理”, 通过将流动性与脂溶性良好的中药挥发油包埋于脂质囊泡的脂质双分子层以增加双分子层内环境的疏水性, 从而降低内水相中药物的泄漏。研究结果显示, 艾叶油、桉叶油、茉莉油、丁香油与连翘油均能不同程度地抑制PFL中水溶性药物的泄漏, 但艾叶油抑制药物泄漏的能力显著大于桉叶油、茉莉油、丁香油和连翘油, 表明不同挥发油可能由于油的组成成分存在差异而具有不同理化性质如脂溶性/疏水性与流动性, 从而赋予脂质体脂质双分子层内环境不同的疏水性(非极性), 进而对内水相中水溶性药物具有不同的抑制扩散的屏障作用。但是, 艾叶油抑制药物泄漏的能力并不是随着油用量的增加而无限增大, 当艾叶油与脂质质量比为1:6时, 对药物泄漏的抑制作用最大; 而质量比为1:3时, 艾叶油反而促进了药物的泄漏, 其原因可能是高浓度的艾叶油破坏了脂质体脂质双分子层磷脂膜的稳定性和完整性, 使磷脂膜的屏障作用降低。
艾叶油包埋于PFL脂质双分子层后, PFL的包封率、粒径和电位的绝对值与磷脂膜的变形性均稍有增加, 但无显著性差异(P > 0.05), 这种变化的原因可能是艾叶油包埋于PFL后增加了脂质双分子层的厚度及其内环境的疏水性等相关理化性质, 从而减少了内水相中药物的泄漏, 并在一定程度上提高了其稳定性; 但TEM显示艾叶油并未改变PFL的层状囊泡结构与外观形态特点, 也不会对白兔的阴道黏膜产生刺激。体外透皮透黏膜给药实验发现包埋艾叶油后能进一步增强PFL促进其内水相中药物透皮透黏膜的吸收, 其原因可能是艾叶油本身是一种优良的促进药物透皮透黏膜吸收的吸收促进剂[16], 包埋于PFL后, 与柔性脂质体的促进药物透皮透黏膜吸收[1-3]之间可能产生了一定的协同作用。基于上述结果, 推测艾叶油可能作为一种新的柔软剂用于柔性脂质体的制备, 但还需进一步深入研究。综上所述, 本文为液体状态纳米柔性脂质体作为给药系统的研究和产业化应用提供了一种新方法和新思路, 具有一定的科学意义和广阔的应用前景。
| [1] | Manconi M, Mura S, Sinico C, et al. Development and characterization of liposomes containing glycols as carriers for diclofenac[J]. Colloids Surf A Physicochem Eng Asp, 2009, 342: 53–58. DOI:10.1016/j.colsurfa.2009.04.006 |
| [2] | Subongkot T, Wonglertnirant N, Songprakhon P, et al. Visualization of ultradeformable liposomes penetration pathways and their skin interaction by confocal laser scanning microscopy[J]. Int J Pharm, 2013, 441: 151–161. DOI:10.1016/j.ijpharm.2012.12.003 |
| [3] | Li C, Deng L, Zhang Y, et al. Silica-coated ethosome as a novel oral delivery system for enhanced oral bioavailability of curcumin[J]. Acta Pharm Sin (药学学报), 2012, 47: 1541–1547. |
| [4] | Elsayed MMA, Abdallah OY, Naggar VF, et al. Lipid vesicles for skin delivery of drugs: reviewing three decades of research[J]. Int J Pharm, 2007, 332: 1–16. DOI:10.1016/j.ijpharm.2006.12.005 |
| [5] | Li WZ, Zhao N, Zhou YQ, et al. Post-expansile hydrogel foam aerosol of PG-liposomes: a novel delivery system for vaginal drug delivery applications[J]. Eur J Pharm Sci, 2012, 47: 162–169. DOI:10.1016/j.ejps.2012.06.001 |
| [6] | Pavelić Ž, Škalko-basnet N, Filipović-grčić J, et al. Devel opment and in vitro evaluation of a liposomal vaginal delivery system for acyclovir[J]. J Control Release, 2005, 106: 34–43. DOI:10.1016/j.jconrel.2005.03.032 |
| [7] | Hu YZ, Li M, Zhang TT, et al. Preparation of liposomal artesunate dry powder inhalers and the effect on the acute lung injury of rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 1906–1912. |
| [8] | Zhang WJ, Yang DX, Feng LL, et al. Modification by wheat germ agglutinin delays the ocular elimination of liposome[J]. Acta Pharm Sin (药学学报), 2014, 49: 543–549. |
| [9] | Xu Y, Shi L, Deng YH. Effect of polyethylene glycol-lipid derivatives on the stability of grafted liposomes[J]. Acta Pharm Sin (药学学报), 2011, 46: 1178–1186. |
| [10] | Zhang D, Xu H, Hu MN, et al. "PEG dilemma" for liposomes and its solving approaches[J]. Acta Pharm Sin (药学学报), 2015, 50: 252–260. |
| [11] | Li WZ, Hao XL, Zhao N, et al. Propylene glycol-embodying deformable liposomes as a novel drug delivery carrier for vaginal fibrauretine delivery applications[J]. J Control Release, 2016, 226: 107–114. DOI:10.1016/j.jconrel.2016.02.024 |
| [12] | Li WZ, Han WX, Zhao N, et al. Studies on the preparation and transdermal drug delivery of hydrogel patches of palmatine loaded flexible nano-liposomes[J]. Chin J Vet Drug (中国兽药杂志), 2016, 50: 46–50. |
| [13] | Mahor S, Rawat A, Dubey PK, et al. Cationic transfersomes based topical genetic vaccine against hepatitis B[J]. Int J Pharm, 2007, 340: 13–19. DOI:10.1016/j.ijpharm.2007.03.006 |
| [14] | Fichorova RN, Mendonca K, Yamamoto HS, et al. A quanti tative multiplex nuclease protection assay reveals immuno toxicity gene expression profiles in the rabbit model for vaginal drug safety evaluation[J]. Toxicol Appl Pharm, 2015, 285: 198–206. DOI:10.1016/j.taap.2015.02.017 |
| [15] | Wang HJ, Liu MF, Du S. Optimization of madecassoside liposomes using response surface methodology and evaluation of its stability[J]. Int J Pharm, 2014, 473: 280–285. DOI:10.1016/j.ijpharm.2014.07.010 |
| [16] | Zhao Q, Li WZ, Cheng YC, et al. Studies on the transdermal delivery of palmatine by several volatile oils as penetration enhancers[J]. Appl Chem Ind (应用化工), 2016, 45: 186–189. |
 2017, Vol. 52
2017, Vol. 52


