2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
肿瘤是严重威胁人类健康的一大类疾病, 居各类疾病死亡率的第二位, 针对肿瘤药物递药系统方面的研发已经成为目前医药领域的热点。常见的纳米载体递药系统包括脂质体、聚合物纳米粒及囊泡等, 具有增加难溶性药物的溶解度、减少药物对正常组织的损伤并提高药物抗肿瘤作用等功效[1]。然而传统的纳米制剂, 如普通的脂质体, 由于其在体液中的理化性质不稳定, 注射后在到达肿瘤部位前, 聚集、沉积、破裂等原因产生一定的药物泄露[2-5], 而进入肿瘤组织后药物释放也较慢, 导致肿瘤组织内药物浓度较低, 生物利用度不高, 对正常组织及器官造成严重损伤的同时, 也限制了临床治疗效果[6]。因此, 需要新型的药物传递系统以提高药物抗肿瘤疗效。
磷酸钙(calcium phosphate, CAP)是一种天然的生物材料, 具有良好的生物安全性和可降解性。CAP类物质可与多种药物和生物活性物质结合, 且不会使结合的药物失去活性, 因此可用作药物载体。已有文献[7]报道将CAP类物质作为抗生素、蛋白质、生长因子及抗癌药物的载体。磷酸钙纳米粒(calcium phosphate nanoparticles, CAPNs)作为载体材料, 具有生物相容性好、比表面积大、无不良反应、不像脂质体易被巨噬细胞摄取及具有较好载药性能等一系列优点。最重要的是CAP对酸敏感[8], 在肿瘤酸性环境下可以快速释药, 使肿瘤部位的药物浓度有所提高, 进而增强抗肿瘤作用, 但CAP在一定程度上也存在到达肿瘤组织前的药物泄露问题。此外, 尽管磷酸钙具有较好的生物相容性, 但是作为无机材料, 其细胞摄取水平不高, 降低了药物疗效。因此, 在CAP上包裹一层脂质膜, 可减少制剂到达肿瘤前的药物泄露, 提高细胞摄取, 延长体内循环时间。
本研究设计了一种将磷酸钙与脂质体相结合的核/壳纳米粒(LCAPNs)药物递送系统, 以抗肿瘤药物紫杉醇(paclitaxel, PTX)为模型药物, 制备了包载PTX的脂质-磷酸钙核/壳纳米粒(PTX-LCAPNs)。一方面, 脂质膜可以有效保护包载的药物, 减少制剂到达肿瘤前的泄露; 另一方面, 磷酸钙纳米粒的酸溶解性使得药物实现在胞内的迅速释放, 发挥药效。此外, 该载体有利于增加细胞摄取, 提高药物在细胞内的蓄积, 进一步提高药效。在构建载体的基础上, 本研究对LCAPNs进行了表征, 并评价了其细胞摄取、胞内溶解特性及体外抗肿瘤活性。
材料与方法材料与试剂 PTX原料药(含量 > 99%, 大连美仑生物技术有限公司); 泊洛沙姆188 (Poloxamer 188, Pluronic F68)、聚氧乙烯蓖麻油(Cremophor EL)、泊洛沙姆407 (Poloxamer 407, Pluronic F127) (德国BASF公司); 卵磷脂E80 (德国Lipoid公司); 海藻酸钠(青岛晶岩生物科技开发有限公司); 胎牛血清(美国Hyclone公司); DMEM培养基(美国Gibico公司); 异硫氰酸罗丹明B (Rhodamine B isothiocyanate, RITC, 阿拉丁化学试剂有限公司); 胆固醇、(3-氨丙基)三乙氧基硅烷(3-aminopropyltriethoxysilane, APTES) (国药集团化学试剂有限公司); 超纯水(MiliQ); Fluo-3-乙酰氧基甲基酯(Fluo-3-acetoxymethyl ester, Fluo-3 AM), Hoechst 33342 (上海翊圣生物科技有限公司); MTT、DAPI (碧云天生物技术公司); 其他试剂均为色谱纯。
主要仪器 Agilent 1200高效液相色谱仪(美国Agilent公司); Zetasizer Nano ZS粒度仪(英国Malvern公司); JEM-2100F型透射电镜(日本JEOL公司); CO2培养箱Binder 150L (德国Binder公司); FV1000型激光共聚焦显微镜(日本Olympus公司); BD FACS Calibur型流式细胞仪(美国Becton Dickinson公司); Synergy H1全功能酶标仪(美国BioTek公司); 旋转蒸发仪、加热磁力搅拌器、恒温摇床IKA KS 3000i (德国IKA公司); Allegra 64R高速冷冻离心机(美国Beckman Coulter公司); 红外光谱仪(IS5·FT-IR, 美国Thermo公司)。
细胞模型 人肝癌Huh-7细胞株(中国科学院上海药物研究所)培养于含10%胎牛血清DMEM培养液中, 在37 ℃、5% CO2孵箱中孵育, 每1~2天更换一次培养液。
HPLC色谱条件 色谱柱Agilent Zorbax SB-C18 (150 mm × 4.6 mm, 5 µm), 流动相为水-乙腈(45:55), 流速1.0 mL·min-1, 柱温30 ℃, 检测波长227 nm, 进样量50 µL。
CAPNs的制备 精密称取泊洛沙姆188 (F68) 1.4 g于70 mL去离子水中, 40 ℃加热搅拌, 待溶液澄清后, 加入海藻酸钠溶液(2 mg·mL-1) 10 mL, 搅拌1 h后, 依次加入25 mol·L-1 Ca(NO3)2·4H2O 15 mL和25 mol·L-1 Na2HPO4 10 mL, 并用氨水调pH为10, 继续搅拌24 h, 离心收集沉淀, 以水和乙醇交替清洗, 再离心收集沉淀, 4 ℃保存[9]。
载PTX载体的制备
PTX-CAPNs的制备 取CAPNs 10 mg分散于1 mL水中, 将PTX 4 mg和十八胺4 mg加热溶于10%无水乙醇和90%聚氧乙烯蓖麻油中配制成40 g·L-1的油溶液, 并将PTX油溶液加入到CAPNs水溶液中, 避光搅拌24 h, 离心收集沉淀, 以pH 7.4磷酸盐缓冲液(phosphate buffer solution, PBS)清洗, 即得PTX-CAPNs, 4 ℃保存。
PTX-LCAPNs的制备 称取E80 15 mg、胆固醇1.5 mg于圆底烧瓶中, 氯仿适量溶解, 40 ℃旋转蒸发除去有机溶剂, 形成均匀脂质膜。以PTX-CAPNs的PBS溶液(其中CAPNs质量浓度为2.5 g·L-1) 1 mL于45 ℃水化30 min, 以1%功率探头超声2 min。离心除去空白脂质体和游离PTX, 即得PTX-LCAPNs, 4 ℃保存。
PTX-LPs的制备 在相同实验条件下, 称取E80 15 mg、胆固醇1.5 mg和PTX 0.3 mg于圆底烧瓶中形成均匀脂质膜。以1 mL PBS溶液水化, 即得包载紫杉醇的脂质体(liposomes loaded with PTX, PTX-LPs), 4 ℃保存。
荧光标记载体的制备 精密称取RITC 1 mg, 加入无水乙醇1 mL溶解, 再加入APTES 10 µL, 室温搅拌过夜[10], 即得RITC-APTES。取CAPNs 10 mg分散于2 mL水中, 加入RITC-APTES 100 µL, 于40 ℃下搅拌24 h, 离心收集沉淀, 并用水清洗, 即得RITC标记的磷酸钙纳米粒(RITC labeled CAPNs, RITC-CAPNs)。参考“PTX-LCAPNs的制备”, 在相同实验条件下, 以RITC-CAPNs的pH 7.4 PBS溶液水化磷脂膜, 即得到荧光染料RITC标记的脂质-磷酸钙核/壳纳米粒(RITC labeled LCAPNs, RITC-LCAPNs)。参考“PTX-LPs的制备”, 称取E80 15 mg和胆固醇1.5 mg于圆底烧瓶中, 氯仿适量溶解, 并加入RITC-APTES 25 µL, 40 ℃旋转蒸发除去有机溶剂, 形成均匀脂质膜。以pH 7.4 PBS溶液1 mL于45 ℃水化30 min, 1%功率探头超声2 min, 并将纳米粒溶液过G50凝胶柱, 即得荧光染料RITC标记的纳米脂质体(RITC labeled LPs, RITC-LPs)。
粒径和zeta电位 取CAPNs及LCAPNs适量, 用水稀释, 采用Zetasizer Nano ZS粒度电位测定仪测定载体的粒径、粒径分布和zeta电位。
透射电镜(TEM) 用水分别稀释CAPNs、LCAPNs至0.2 g·L-1, 各取适量滴加在铜网上, 用2%磷钨酸负染[11], 置于透视电镜下观察纳米粒的形态。
红外光谱(IR) 以KBr为介质, 用Thermofisher·Nicolet·IS5·红外光谱仪(IS5·FT-IR)对CAPNs进行红外光谱的表征。
载体稳定性 通过纳米粒粒径变化考察载体稳定性。取LPs、CAPNs及LCAPNs适量, 用水稀释, 分别于1、2、7和15天测定载体的粒径。
载药量的测定 精密量取PTX-CAPNs或PTX-LCAPNs 1.0 mL, 加入甲醇2 mL, 超声30 min, 离心并收集上清液, 沉淀物中加入甲醇2 mL, 重复操作3次, 合并上清液, 以流动相定容至10 mL, HPLC测定PTX含量, 采用以下公式计算纳米载体的载药量(drug loading capacity, DLC):
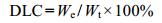
|
其中, We:纳米载体中包载的PTX含量(mg); Wt:包载PTX的纳米载体的总重量(mg)。
体外释放度研究 精密吸取PTX-CAPNs、PTX-LCAPNs及PTX-LPs各0.2 mL, 分别加入pH 7.4或5.0的PBS (含0.2% Tween 80) 等渗溶液7.8 mL为释放介质, 于37 ℃, 100 r·min-1振荡, 1、2、4、8、12、24和48 h取样, 并用超滤管(截留分子量5 000 Da)离心, 取上清用甲醇稀释5倍, 采取HPLC法测定PTX浓度, 计算累积释药量[12]。
细胞摄取实验 将Huh-7细胞接种于12孔板的玻璃盖玻片上, 培养24 h, 分别以RITC-LPs、RITC-CAPNs和RITC-LCAPNs于37 ℃、5% CO2孵育体系下孵育细胞4 h, 弃去孵育液, 以PBS 7.4洗涤; 加入4%多聚甲醛室温固定细胞15 min, 除去固定液, 以PBS 7.4洗涤; 加入5 µg·mL-1 DAPI室温孵育10 min, 除去染色液, 以PBS 7.4洗涤, 取出盖玻片, 以90%甘油封片, 置于共聚焦显微镜下观察[13]。
流式细胞仪检测 将Huh-7细胞以1×105个/孔接种于12孔板中, 培养24 h后, 分别以RITC-LPs、RITC-CAPNs和RITC-LCAPNs于37 ℃、5% CO2孵育体系下孵育细胞4 h, 弃去孵育液, 以PBS 7.4洗涤, 胰酶消化, 最终将细胞悬于0.5 mL PBS 7.4中, 以流式细胞仪检测荧光强度[13]。
磷酸钙胞内钙离子释放 将2 mmol·L-1 Fluo-3-乙酰氧基甲基酯溶液与20% F127溶液等体积混匀, 用Hank’s平衡盐溶液稀释1 000倍, 得到新鲜配制的Fluo-3 AM工作液。将Huh-7细胞以1×105个/孔接种于激光共聚焦培养皿中, 培养24 h后, 加入Hoechst 33342染液200 µL, 室温孵育20 min后, 移去染液, 用PBS清洗2~3次, 加入新鲜配制的Fluo-3 AM工作液200 µL, 于37 ℃、5% CO2条件下孵育1 h, 弃去孵育液, 用PBS清洗2~3次后, 加入空白DMEM培养基, 置于共聚焦显微镜下观察; 再加入CAPNs或LCAPNs 200 µL, 于488 nm激发波长处观察[8]。
细胞内PTX浓度测定 将Huh-7细胞接种于12孔板上, 培养24 h, 分别以游离PTX、PTX-LPs、PTX-CAPNs和PTX-LCAPNs (其中PTX质量浓度为0.25 µg·mL-1)孵育液代替培养液, 孵育0.5、1和2 h, 弃去孵育液, 以PBS (pH 7.4) 洗涤, 除去残留药物。胰酶消化细胞, 以细胞裂解液200 µL孵育后, 加入甲醇300 µL[14], 超声并离心后, 取上清液采用HPLC法测定PTX浓度, 计算胞内药物蓄积浓度。
体外抗肿瘤活性检测 以MTT法[15]检测制剂的体外抗肿瘤活性。将Huh-7细胞以1×104个/孔接种于96孔板中, 培养24 h。以完全培养基稀释游离PTX、PTX-LPs、PTX-CAPNs和PTX-LCAPNs, 使PTX的梯度质量浓度为0.25、1.25和2.5 µg·mL-1, 在对应孔中分别加入含不同药物浓度的制剂100 µL, 每组设4个复孔, 处理细胞24 h。结束后, 每孔加入新鲜配制的MTT溶液(5.0 g·L-1) 10 µL, 孵育4 h; 弃去上清液, 每孔加入DMSO 150 µL并置于37 ℃摇床中振荡15 min以溶解紫色结晶产物, 于490 nm处检测吸收度值。
空白载体的安全性评价 以MTT法考察空白载体的安全性。LPs、CAPNs和LCAPNs空白纳米粒浓度与“体外抗肿瘤活性检测”项下的高浓度制剂的浓度一致, 以此孵育Huh-7细胞, 同时参考“体外抗肿瘤活性检测”, 在相同条件下实验, 以研究空白载体对抑制肿瘤细胞增殖的影响。
数据处理 实验所有数据以x± s表示, 如果数据符合正态分布, 统计方法采用双侧t检验; 3组及以上数据采用方差分析, P < 0.05为显著性差异, P < 0.01为极显著性差异。
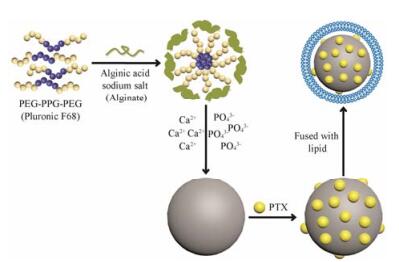
结果 1 纳米载体的制备与表征PTX-LCAPNs的制备过程见图 1。在CAPNs的制备过程中, 改变Ca(NO3)2·4H2O和Na2HPO4的投料量, 选择合适的量进行实验。Zetasizer Nano ZS粒度电位测定仪于25 ℃测定, 结果见表 1。可见CAPNs和LCAPNs的粒径均小于150 nm, 粒度分布窄。
|
Figure 1 Schematic illustration of the synthesis of PTX-loaded lipid bilayer-coated calcium phosphate core-shell nanoparticles (PTX-LCAPNs). The calcium phosphate nanoparticles (CAPNs) as the core of the drug delivery system was synthesized by stirring pluronic F68 and alginate followed by adding Ca2+ and PO43- in hot water. After CAPNs loading PTX, lipid bilayer composed of E80 was then fused to PTX-loaded cores through film-hydration method. PTX: Paclitaxel |
| Table 1 The characterization of CAPNs and LCAPNs in deionized water. PI: Polydispersity index. n = 3, x± s |
Zeta电位是微粒表面荷电性质与大小的标志, 往往决定着微粒的物理稳定性、体内分布及药物动力学。测定结果显示, CAPNs的zeta电位值为负值, 与Seong等[9]的研究结果一致。本研究采用注射级蛋黄卵磷脂E80包被CAPNs, E80显电中性。结果显示, LCAPNs的表面电位为-6 mV左右, 证实脂质膜对磷酸钙纳米粒的包覆, 表明本研究成功制备了LCAPNs。
透射电镜结果(图 2A)显示, CAPNs近球形, 粒径100 nm左右。图 2B显示, LCAPNs具有明显的核/壳结构, 其颗粒大小与粒度测定结果一致。

|
Figure 2 Transmission electron micrographs (TEM) of CAPNs (A) and LCAPNs (B) |
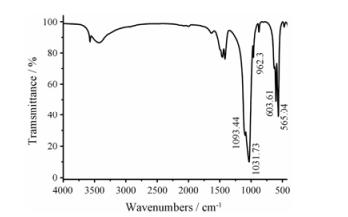
经IS5·FT-IR红外光谱检测, 结果如图 3所示, 并参照文献[9]分析可知1 093.44、1 031.73、962.30、603.61和565.04 cm-1处的峰是PO43-的特征峰。结果表明, 制备的纳米粒中含有PO43-离子。
|
Figure 3 FT-IR spectra of CAPNs |
通过粒径变化考察纳米粒的稳定性, 结果见表 2。CAPNs在15天内粒径增长了20 nm左右, 而LCAPNs的粒径没有变化, 表明包裹磷脂膜可以提高CAPNs的稳定性。普通制剂LPs粒径稍有变化, 15天内增长了5 nm左右, 但是没有显著性差异。
| Table 2 The diameter of LPs, CAPNs and LCAPNs in 1, 2, 7, 15 days. LPs: Liposomes. n = 3, x± s |
以HPLC法测定, PTX-CAPNs的载药量为(11.58 ± 0.57) % (n = 3); PTX-LCAPNs的载药量为(1.69 ± 0.09) % (n = 3)。
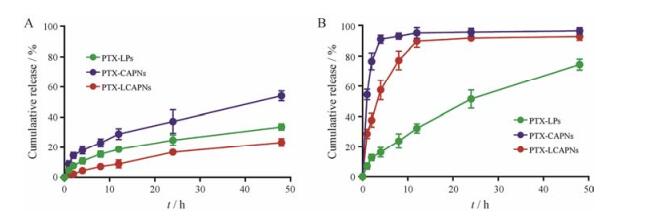
2 体外释放的研究以超滤离心法研究CAPNs和LCAPNs的体外释放行为, 结果表明载体具有pH敏感释药特性。在生理环境(pH 7.4) 下, PTX-CAPNs释放较慢, 48 h仅释放了50%左右; 而PTX-LCAPNs的累积释放量明显低于PTX-CAPNs, 48 h时仅释放了20%左右, 将PTX-CAPNs的释放量降低了30%左右, 表明脂质包载后进一步减少了载体中药物的释放, 一定程度上减少了PTX-CAPNs到达肿瘤组织前的药物泄露(图 4A); 在pH 5.0条件下, PTX-CAPNs和PTX-LCAPNs的释放速率均较快, 12 h时释放量超过90%, 而PTX-LPs组的释放速率远低于PTX-CAPNs和PTX-LCAPNs。结果表明, 与普通的脂质体相比, PTX-CAPNs和PTX-LCAPNs具有快速释药的效果(图 4B)。
|
Figure 4 The release profiles of PTX-LPs, PTX-CAPNs and PTX-LCAPNs in vitro. The release of PTX in simulated body fluid pH 7.4 (A) and pH 5.0 (B) acid fluid at 37 ℃ for 48 h. n = 3, x± s |
有研究表明[13, 14], 在酸性条件(pH 5.0) 下, 脂质膜不稳定。与正常生理环境相比, PTX-LPs在酸性条件下释放较快。结果表明, 在正常生理条件(pH 7.4) 下, LCAPNs结构较稳定, 载体可以有效地将药物递送至肿瘤组织及细胞中, 包裹的磷脂膜可以减少CAPNs的药物泄露对正常组织和细胞造成的损伤, 降低不良反应, 增加药效; 载体在模拟肿瘤胞内环境中(pH 5.0) 表现出一定的突释性, 快速释药, 提高肿瘤细胞内的药物浓度。
3 荧光载体的细胞摄取研究RITC-CAPNs、RITC-LPs和RITC-LCAPNs处理组的孵育时间为4 h, 细胞摄取结果如图 5所示。激光共聚焦实验结果显示, 3组荧光载体在胞内的荧光强度有明显差异, LCAPNs组荧光最强, 强度顺序为RITC-LCAPNs组 > RITC-LPs组 > RITC-CAPNs组(图 5A)。流式细胞仪检测结果如图 5B、C所示, LCAPNs组的胞内RITC荧光强度55.77 ± 1.32高于CAPNs组14.33 ± 1.23和LPs组30.33 ± 1.37, 且3个处理组的胞内荧光强度有显著性差异。由激光共聚焦及流式细胞仪结果可看出, LCAPNs组的胞内荧光强度比CAPNs高, 表明脂质包载后纳米粒的摄取水平显著提高; 另外, LCAPNs组的摄取比LPs组多, 可能是由于磷酸钙核的原因, LCAPNs的硬度比LPs大, 使LCAPNs摄取较多[16, 17]。以上实验结果表明, LCAPNs和CAPNs均可以在短时间内被细胞摄取, 但LCAPNs显著增加了其在细胞中的摄取量。激光共聚焦实验及流式细胞仪检测结果均表明脂质膜可显著提高载体的细胞摄取量。

|
Figure 5 Confocal micrographs (A, scale bar: 20 µm), flow cytometry charts (B) and intracellular fluorescence intensity assay (C) of Huh-7 cells incubated with RITC-CAPNs, RITC-LPs, RITC-LCAPNs for 4 h. The nuclei were stained with DAPI (blue). n = 3, x± s. **P < 0.01 vs CAPNs, LPs |
磷酸钙是一种酸溶性的沉淀物, 在酸性条件下可以快速溶解并释放钙离子。在酸性肿瘤环境中, 质子可以渗透到LCAPNs磷脂膜内进而溶解CAPNs。本研究采用Fluo-3 AM检测细胞内钙离子的情况。Fluo-3 AM是一种细胞膜可渗透钙离子荧光探针, 常用来检测细胞内钙离子浓度。Fluo-3 AM穿透细胞膜进入细胞后被细胞内的酯酶剪切形成Fluo-3, Fluo-3游离配体几乎是非荧光性的, 当与细胞内钙离子结合后可以产生较强的荧光。先用Fluo-3 AM孵育细胞, 再加入CAPNs或LCAPNs, 在激发波长488 nm, 发射波长525 nm条件下成像, 结果见图 6。在加入制剂孵育10 min左右即可观察到绿色荧光, 随着时间延长, 在孵育1 h后, 荧光明显增强。表明CAPNs进入细胞后会迅速溶解。而LCAPNs组无论是在10 min还是1 h, 其绿色荧光均比CAPNs组强, 表明该组Huh-7细胞内钙离子含量较高, 主要是因为其细胞摄取比CAPNs组好。这些结果均表明, CAPNs在肿瘤环境中可以迅速溶解, 达到快速释药的效果, 并与细胞摄取实验中RITC-LCAPNs摄取水平较高的结果一致。

|
Figure 6 The intracellular calcium release profile of CAPNs and LCAPNs. The fluorescence images of Fluo-3 labeled Huh-7 cells after the addition of CAPNs or LCAPNs with 10 min or 1 h. The nuclei were stained with Hoechst 33342 (blue). Scale bar: 20 µm |
游离PTX、PTX-LPs、PTX-CAPNs和PTX-LCAPNs溶液分别处理细胞0.5、1和2 h后, 细胞内PTX的浓度见图 7。处理30 min后, Huh-7细胞对4种制剂均有一定的摄取, 但PTX-LCAPNs体现出显著的摄取优势; 2 h时, 游离PTX、PTX-LPs、PTX-CAPNs和PTX-LCAPNs的胞内PTX的浓度分别为25.38 ± 1.61、49.14 ± 0.76、43.12 ± 1.52及73.14 ± 1.80 ng/106 cells; 与游离PTX、PTX-LPs和PTX-CAPNs相比, PTX-LCAPNs胞内PTX的浓度显著提高(P < 0.01);以上结果表明, 各处理组的细胞摄取均呈现出一定的时间依赖性; 同样条件下PTX-LCAPNs的细胞摄取显著高于PTX-LPs和PTX-CAPNs, 胞内PTX浓度明显增大, 从而提高抗肿瘤效果。

|
Figure 7 Intracellular accumulation of PTX in Huh-7 cells treating with free PTX, PTX-LPs, PTX-CAPNs and PTX-LCAPNs for differential time. Huh-7 cells were incubated with free PTX, PTX-LPs, PTX-CAPNs and PTX-LCAPNs with PTX 0.25 µg·mL-1 for 0.5, 1 and 2 h. n = 3, x± s. **P < 0.01 vs PTX, PTX-LPs, PTX-CAPNS |
通过MTT法测定含药载体对Huh-7细胞的杀伤能力, 如图 8A所示。结果表明, 游离PTX、PTX-CAPNs、PTX-LPs和PTX-LCAPNs对Huh-7细胞均有抑制其增殖的作用, 且抑制作用均具有剂量依赖性。由图 8A可见, PTX质量浓度为2.5 µg·mL-1, 孵育24 h后, 游离PTX组未对Huh-7细胞增殖产生显著的抑制作用, 细胞存活率仍达80%以上。与游离PTX组相比, PTX-LPs、PTX-CAPNs和PTX-LCAPNs组的抑制细胞增殖作用有明显差异, 具有较强的抗肿瘤效果。其中, PTX-LCAPNs组与另外两组相比, 对细胞增殖的抑制作用更大, 且有显著性差异(P < 0.01)。在3组载体制剂中, PTX-LCAPNs的抗肿瘤活性最强。

|
Figure 8 Cytotoxicity of free PTX, PTX-LPs, PTX-CAPNs, PTX-LCAPNs against Huh-7 cells during 24 h with the concentration of PTX at 0.25, 1.25, 2.5 µg·mL-1 (A). And cytotoxicity of LPs, CAPNs, LCAPNs against Huh-7 cells during 24 h with the highest concentration of blank nanoparticles used in the antitumor activity in vitro (B). n = 4, x± s. **P < 0.01 vs PTX-LCAPNs group |
以SPSS对数据进行拟合, 计算2组载体PTX-CAPNs、PTX-LCAPNs作用细胞24 h的IC50值分别为2.52和0.54 µg·mL-1, 可知PTX-LCAPNs对细胞的杀伤力是PTX-CAPNs的4.7倍, 表明PTX-LCAPNs具有更高的抗肿瘤活性。
通过MTT法测定空白载体对Huh-7细胞的细胞毒性。结果如图 8B所示, 3种空白载体没有对Huh-7细胞增殖产生显著的抑制作用, 细胞存活率仍达90%以上, 且各载体组之间没有显著性差异。结果表明, 空白载体的细胞毒性较低, 安全性较高。PTX-LPs、PTX-CAPNs和PTX-LCAPNs的体外抗肿瘤活性结果与载体本身的毒性无关。
讨论脂质-磷酸钙核/壳纳米粒融合了磷酸钙快速释药的特性及脂质体良好的生物相容性的优势, 克服了二者的不足, 从而达到增加紫杉醇的载药量和细胞摄取量, 减少药物的泄露, 增加药物在肿瘤部位的浓度及蓄积的目的。
研究发现, CAPNs纳米载体在酸性(pH 5.0) 条件下可以快速溶解, 药物迅速释放。但CAPNs的细胞摄取量少, 入胞后即使能快速释药, 其胞内药物含量也较低。而LCAPNs中以脂质双分子层为CAPNs的药物泄露增加了一道屏障, 降低了CAPNs包载的紫杉醇在正常生理条件下(pH 7.4 PBS)的释放。同时脂质双分子层由于磷酸钙的支撑, 提高了其物理稳定性及细胞摄取水平。在酸性环境中, 脂质双层膜遭到破坏, 磷酸钙溶解, 继而药物快速释放, 从而达到减少药物胞外泄露, 胞内药物快速释放的目的。因此, LCAPNs具有更好地抑制肿瘤细胞增殖的效果。
Huh-7细胞对LCAPNs的摄取量大于CAPNs, 推测原因是LCAPNs表面包被的脂质双分子层与细胞膜有极大的相似性, 使得载体对细胞膜的亲和性增加。此外, LCAPNs的细胞摄取量高于LPs, 可能是因为LCAPNs包载了CAPNs, 提高了其硬度, 使得载体更易被细胞摄取。
PTX-LCAPNs对Huh-7细胞增殖的抑制作用在一定范围内呈现浓度依赖性。同样条件下, PTX-LCAPNs比PTX、PTX-LPs和PTX-CAPNs具有更高的细胞增殖抑制率, 可以推测LCAPNs通过增加细胞的摄取量以提高胞内药物的浓度, 从而增加细胞增殖抑制率。而PTX-LPs组的胞内PTX的浓度比PTX-CAPNs组高, 却显示较低的细胞增殖抑制率, 推测原因是在酸性条件下PTX-CAPNs的释药速率比PTX-LPs快, 从而产生较高的胞内游离药物浓度。通过MTT法对空白载体进行了安全性评价, 结果表明空白载体的细胞毒性较低, 排除了空白载体的细胞毒性对PTX-LCAPNs的抗肿瘤活性实验结果的影响。
本研究表明, 脂质-磷酸钙核/壳纳米粒作为抗肿瘤药物紫杉醇的智能药物传递系统具有一定的应用前景。然而, 目前对该载体的研究尚处于初步研究阶段, 有待进一步地考察载体的体内抗肿瘤活性, 此外肿瘤组织靶向性也值得研究与摸索。
| [1] | Ashley CE, Carnes EC, Epler KE, et al. Delivery of small interfering RNA by peptide-targeted mesoporous silica nanoparticle-supported lipid bilayers[J]. ACS Nano, 2012, 6: 2174–2188. DOI:10.1021/nn204102q |
| [2] | Ye GF, Gupta A, DeLuca R, et al. Bilayer disruption and liposome restructuring by a homologus series of small Arg-rich synthetic peptides[J]. Colloids Surf B Biointerfaces, 2010, 76: 76–81. DOI:10.1016/j.colsurfb.2009.10.016 |
| [3] | Marianecci C, Di Marzio L, Rinaldi F, et al. Niosomes from 80s to present: the state of the art[J]. Adv Colloid Interf Sci, 2014, 205: 187–206. DOI:10.1016/j.cis.2013.11.018 |
| [4] | Yarosh DB. Liposomes in investigative dermatology[J]. Photodermatol Photoimmunol Photomed, 2001, 17: 203–212. DOI:10.1034/j.1600-0781.2001.170501.x |
| [5] | Huang ZY, Sun YQ, Hu HY, et al. Techniques and methods evaluation on pharmaceutical stability of liposomes[J]. Acta Pharm Sin (药学学报), 2016, 51: 356–361. |
| [6] | Estanqueiro M, Amaral MH, Lobo JMS, et al. Evolution of liposomal carriers intended to anticancer drug delivery: an overview[J]. Int J Curr Pharm Res, 2014, 6: 3–10. |
| [7] | Ginebra MP, Traykova T, Planell JA. Calcium phosphate cements: competitive drug carriers for the musculoskeletal system?[J]. Biomaterials, 2006, 27: 2171–2177. DOI:10.1016/j.biomaterials.2005.11.023 |
| [8] | Li J, Chen YC, Tseng YC, et al. Biodegradable calcium phosphate nanoparticle with lipid coating for systemic siRNA delivery[J]. J Control Release, 2010, 142: 416–421. DOI:10.1016/j.jconrel.2009.11.008 |
| [9] | Seong DY, Kim YJ. Enhanced photodynamic therapy efficacy of methylene blue-loaded calcium phosphate nanopar ticles[J]. J Photoch Photobio B, 2015, 146: 34–43. DOI:10.1016/j.jphotobiol.2015.02.022 |
| [10] | Luo T, Huang P, Gao G, et al. Mesoporous silica-coated gold nanorods with embedded indocyanine green for dual mode X-ray CT and NIR fluorescence imaging[J]. Opt Express, 2011, 19: 17030–17039. DOI:10.1364/OE.19.017030 |
| [11] | Liu JW, Jiang XM, Ashley C, et al. Electrostatically medi ated liposome fusion and lipid exchange with a nanoparticle-supported bilayer for control of surface charge, drug contain ment, and delivery[J]. J Am Chem Soc, 2009, 131: 7567–7569. DOI:10.1021/ja902039y |
| [12] | Lomis N, Westfall S, Farahdel L, et al. Human serum albumin nanoparticles for use in cancer drug delivery: process optimization and in vitro characterization[J]. Nanomaterials, 2016, 6: 116–132. DOI:10.3390/nano6060116 |
| [13] | Li FF, Zhang XX, Guo SY, et al. Preliminary study on pH-sensitive lipid bilayer-coated mesoporous silica nanoparticles as a novel drug carrier for antitumor drug[J]. Acta Pharm Sin (药学学报), 2013, 48: 291–297. |
| [14] | Chen X, Zhang XX, Li FF, et al. Antitumor efficacy of irinotecan-loaded galactosyl modified lipid bilayer-coated mesoporous silica nanoparticles against hepatocellular carci noma cells[J]. Acta Pharm Sin (药学学报), 2014, 49: 718–725. |
| [15] | Zhou YM, Wu XP, Zeng Li, et al. In vitro anti-tumor effect of methotrexate modified by peptide[J]. Acta Pharm Sin (药学学报), 2012, 47: 452–458. |
| [16] | Zhang L, Feng Q, Wang JL, et al. Microfluidic synthesis of hybrid nanoparticles with controlled lipid layers: understanding flexibility-regulated cell-nanoparticle interaction[J]. ACS Nano, 2015, 9: 9912–9921. DOI:10.1021/acsnano.5b05792 |
| [17] | Sun JS, Zhang L, Wang JL, et al. Tunable rigidity of (poly meric core)-(lipid shell) nanoparticles for regulated cellular uptake[J]. Adv Mater, 2015, 27: 1402–1407. DOI:10.1002/adma.201404788 |
 2017, Vol. 52
2017, Vol. 52




