2. 北京市理化分析测试中心, 北京 100089
2. Beijing Centre for Physical and Chemical Analysis, Beijing 100089, China
甘草(Radix Glycyrrhiza)为豆科多年生草本植物, 作为药用甘草有乌拉尔甘草(Glycyrrhiza uralensis)、胀果甘草(Glycyrrhiza Inflate)及光果甘草(Glycyrrhiza glabra)的根及根茎。甘草性平、味甘, 具有补脾益气、清热解毒、祛痰止咳、缓急止痛等功效, 被广泛应用于医药及食品工业的调味剂和赋形剂[1]。
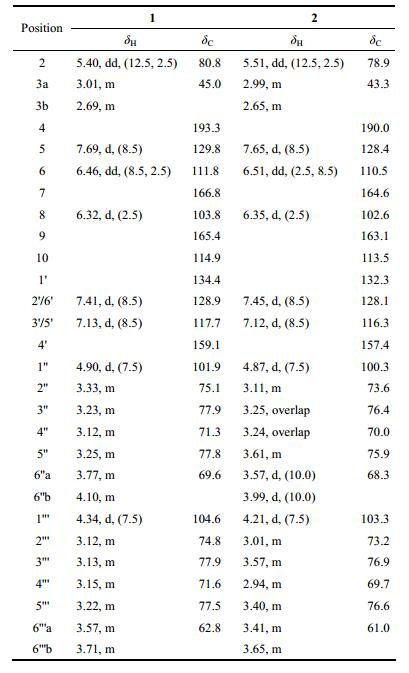
乌拉尔甘草是甘草属植物中分布最广、产量最多的药用甘草, 主要分布于吉林、辽宁、内蒙古、新疆、青海等地[2]。现代药理学研究[3-5]表明甘草具有抗氧化、抗炎、抗病毒、免疫抑制、抗菌、抗肿瘤、保肝、降糖等活性。目前已从甘草中得到黄酮类[6]、三萜皂苷类[7]、香豆素类[8]、多糖[9]等多种化学成分。通过文献[10-12]调研发现, 甘草中黄酮类化合物是其主要的活性物质基础之一。为了进一步揭示乌拉尔甘草的药效物质基础, 本实验通过对乌拉尔甘草的80%乙醇提取物进行系统分离和结构鉴定, 得到2个二氢黄酮类化合物(图 1), 均为新化合物。
|
Figure 1 Structures of compounds 1 and 2 |
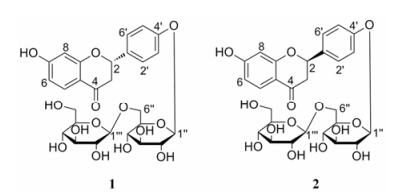
化合物1 淡黄色无定形粉末, UV (MeOH) λmax (log ε): 275.4 (2.44)、312.4 (2.34) nm, IR显示该化合物结构中含有羟基(3 366 cm-1)、共轭酮羰基(1 663 cm-1)、苯环(1 607、1 512、1 465 cm-1); HR-ESI-MS m/z 603.167 7 [M+Na]+ (Calcd. 603.168 4), 提示化合物1的分子式为C27H32O14。1H NMR (500 MHz, CD3OD)数据(表 1)显示1组AA´BB´偶合系统的苯环质子信号δH 7.41 (2H, d, J = 8.5 Hz, H-2´/6´)和7.13 (2H, d, J = 8.5 Hz, H-3´/5´), 以及1组ABX自旋偶合系统的苯环质子信号δH 7.69 (1H, d, J = 8.5 Hz, H-5)、6.46 (1H, dd, J = 8.5, 2.5 Hz, H-6) 和6.32 (1H, d, J = 2.5 Hz, H-8)。进一步结合1H NMR谱中高场区的氢信号δH 5.40 (1H, dd, J = 12.5, 2.5 Hz, H-2)、3.01 (1H, m, H-3a)和2.69 (1H, m, H-3b), 提示该化合物可能为一个二氢黄酮类化合物。经查阅文献[13, 14], 可确定化合物1的苷元为甘草素(liquiritigenin)。在13C NMR (125 MHz, CD3OD)谱中共显示了27个碳信号, 除了15个二氢黄酮碳信号外, 还包括2分子葡萄糖的12个碳信号。1H NMR谱中δH 4.90 (1H, d, J = 7.5 Hz)及δH 4.34 (1H, d, J = 7.5 Hz)分别是两分子β-葡萄糖单元的端基质子信号H-1"和H-1"´。参照文献[15], 利用酸水解的方法获得单体葡萄糖, 结合GC分析, 确定两分子葡萄糖的构型均为D型。在HMBC谱中(图 2), H-1"´ (δH4.34) 与C-6" (δC 69.6)、C-2"´ (δC 74.8)、C-3"´ (δC 77.9) 相关, 说明两分子葡萄糖是1→6连接; H-1" (δH4.90) 与C-4´ (δC 159.1)、C-3" (δC 77.9) 相关, 说明糖链连接在C-4´位。
| Table 1 1H NMR (500 MHz, δ in ppm, J in Hz) and 13C NMR (125 MHz) data for compounds 1 (CD3OD) and 2 (DMSO-d6) |
|
Figure 2 Key HMBC of compound 1 |
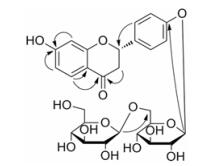
CD光谱显示(图 3), 化合物1在301.5 nm出现负Cotton效应, 在329.5 nm出现正Cotton效应, 可确定C-2的绝对构型为S[16]。
|
Figure 3 CD spectrum of 1 |
综上所述, 化合物1的结构被确定为(2S)-甘草素-4´-O-β-D-葡萄糖-(1→6)-O-β-D-葡萄糖苷。
化合物2 淡黄色无定形粉末, HR-ESI-MS m/z 603.166 1 [M+Na]+ (Calcd. 603.168 4), 提示化合物2分子式为C27H32O14。化合物2的1H NMR (500 MHz, DMSO-d6)和13C NMR (125 MHz, DMSO-d6)数据均与化合物1相似。不同之处在于, 化合物2的CD光谱(图 4)显示出与化合物1相反的Cotton效应, 即在292.0 nm出现正Cotton效应, 在317.5 nm出现负Cotton效应。因此, 化合物2的C-2位构型为R。
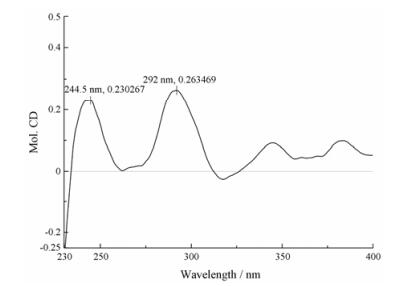
|
Figure 4 CD spectrum of 2 |
根据以上推断, 化合物2的结构被鉴定为(2R)-甘草素-4´-O-β-D-葡萄糖-(1→6)-O-β-D-葡萄糖苷。
实验部分JASCO V-650型紫外分光光度仪; Nicolet 5700型红外光谱仪(美国热电公司); JASCO P-2000型旋光仪; Bruker-500 MHz核磁共振仪; Agilent 6520 HPLC-Q-TOF质谱仪; JASCO J-815型圆二色谱仪; Agilent 1200型高效液相色谱仪, 包括四元高压梯度泵、自动脱气机、二极管阵列检测器、自动进样器、柱温箱; Shimadzu LC-6AD制备型高效液相色谱仪; HP-20大孔吸附树脂(日本三菱化学株式会社); Sephadex LH-20 (GE公司); Rp-C18 (50 µm, YMC, 日本东京); 分析纯试剂, 北京化工厂生产; 色谱纯试剂, Fischer公司、天津科密欧公司。
甘草药材于2013年11月购于内蒙古乌拉尔, 由中国医学科学院、北京协和医学院药物研究所马林教授鉴定为乌拉尔甘草(Glycyrrhiza uralensis)的根及根茎, 标本储存在中国医学科学院、北京协和医学院药物研究所标本室, 标本号为ID-S-2813。
1 提取分离乌拉尔甘草100 kg, 80%乙醇回流提取(3×2 h), 得总浸膏35 kg。将浸膏分散于水中, 搅拌, 静止, 除去沉淀。所得水溶性部位(10 kg)经大孔吸附树脂柱色谱分离, 以水-乙醇梯度洗脱, 共得到5个部分, 分别为Fr.1 (H2O)、Fr.2 (15% EtOH-H2O)、Fr.3 (30% EtOH-H2O)、Fr.4 (50% EtOH-H2O)和Fr.5 (95% EtOH-H2O)。Fr.3 (260 g)经中压反相柱色谱, 用水-甲醇进行梯度洗脱(100:0~0:100), 共得到40个部分(Fr.3-1~Fr.3-40), 其中Fr.3-28 (60 mg)再经Sephadex LH-20柱色谱和制备型高效液相分离(流动相: 25% MeOH-H2O; 流速: 5 mL·min-1), 得到化合物1 (32 mg, Rt = 114 min)与化合物2 (16 mg, Rt = 124 min)。
2 结构鉴定化合物1 淡黄色无定形粉末; UV (MeOH) λmax(log ε): 275.4 (2.44)、312.4 (2.34) nm; [α]20 D-48.2 (c 0.067, MeOH); IR (KBr) νmax: 3 366、1 663、1 607、1 512、1 465 cm-1; CD (MeOH) λmax (∆ε): 301.5 (-2.73)、329.5 (1.44) nm; HR-ESI-MS m/z 603.167 7 [M+Na]+ (C27H32O14)。1H NMR (500 MHz, CD3OD)和13C NMR (125 MHz, CD3OD)数据见表 1。
化合物2 淡黄色无定形粉末; UV (MeOH) λmax (log ε): 276.2 (2.50)、313.6 (2.30) nm; [α]20 D-45.2 (c 0.067, MeOH); IR (KBr) νmax: 3 391、1 739、1 608、1 510 cm-1; CD (MeOH) λmax (∆ε): 292.0 (0.26)、317.5 (-0.03) nm; HR-ESI-MS m/z 603.166 1 [M+Na]+ (Calcd. 603.168 4), 确定分子式为C27H32O14。1H NMR (500 MHz, DMSO-d6)和13C NMR (125 MHz, DMSO-d6)数据见表 1。
| [1] | Kitagawa I, Sakagami M, Hashiuchi F, et al. Apioglycyr rhizin and araboglycyrrhizin, two new sweet oleanene-type triterpene oligoglycosides from the root of Glycyrrhiza inflata[J]. Chem Pharm Bull, 1989, 37: 551–553. DOI:10.1248/cpb.37.551 |
| [2] | Wang Q, Miao WJ, Ye M, et al. Chemical constituent from Glycyrrhiza uralensis[J]. China Tradit Herb Drugs (中草药), 2012, 43: 1886–1890. |
| [3] | He J, Chen L, Heber D, et al. Antibacterial compounds from Glycyrrhiza uralensis[J]. J Nat Prod, 2006, 69: 121–124. DOI:10.1021/np058069d |
| [4] | Gao XY, Wang WQ, Li WD, et al. Review of pharmacological effects of Glycyrrhiza Radix and its bioactive compounds[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 2695–2700. |
| [5] | Li SP, Li W, Wang YH, et al. Prenylflavonoids from Glycyr rhiza uralensis and their protein tyrosine phosphatase-1B inhibitory activities[J]. Bioorg Med Chem Lett, 2010, 20: 5398–5401. DOI:10.1016/j.bmcl.2010.07.110 |
| [6] | Saitoh T, Kinoshita T, Shibata S. Flavonols from licorice root[J]. Chem Pharm Bull, 1976, 24: 1242–1245. DOI:10.1248/cpb.24.1242 |
| [7] | Kitagawa I, Zhou JL, Sakagami M, et al. Licorice-saponins A3, B2, C2, D3 and E2, five new oleanene-type triterpene oligoglycosides from Chinese Glycyrrhiza Radix[J]. Chem Pharm Bull, 1988, 36: 3710–3713. DOI:10.1248/cpb.36.3710 |
| [8] | Wang CL, Zhang RY, Han YS, et al. Chemical studies of coumarins from Glycyrrhiza uralensis Fisch[J]. Acta Pharm Sin (药学学报), 1991, 26: 147–151. |
| [9] | Zhang QY, Ye M. Chemical analysis of the Chinese herbal medicine Gan-Cao (licorice)[J]. J Chromatogr A, 2009, 1216: 1954–1969. DOI:10.1016/j.chroma.2008.07.072 |
| [10] | Ji S, Li ZW, Song W, et al. Bioactive constituents of Glycyrrhiza uralensis (licorice): discovery of the effective components of a traditional herbal medicine[J]. J Nat Prod, 2016, 79: 281–292. DOI:10.1021/acs.jnatprod.5b00877 |
| [11] | Ye RG, Fan YH, Ma CM. Identification and enrichment of α-glucosidase-inhibiting dihydrostilbene and flavonoids from Glycyrrhiza uralensis leaves[J]. J Agric Food Chem, 2017, 65: 510–515. DOI:10.1021/acs.jafc.6b04155 |
| [12] | Asl MN, Hosseinzadeh H. Review of pharmacological effects of Glycyhiza sp. and its bioactive compounds[J]. Phytother Res, 2008, 22: 709–724. DOI:10.1002/(ISSN)1099-1573 |
| [13] | Zhang HJ, Liu Y, Zhang RY. Chemical studies of flavonoid compounds from Glycyrrhiza uralensis Fisch[J]. Acta Pharm Sin (药学学报), 1994, 29: 471–474. |
| [14] | Yahara S, Nishioka I. Flavonoid glucosides from licorice[J]. Phytochemistry, 1984, 23: 2108–2109. DOI:10.1016/S0031-9422(00)84998-5 |
| [15] | Agrawal PK. NMR spectroscopy in the structural elucidation of oligosaccharides and glycosides[J]. Phytochemistry, 1992, 31: 3307–3330. DOI:10.1016/0031-9422(92)83678-R |
| [16] | Gaffield WJ. Circular dichroism, optical rotator dispersion and absolute configuration of flavanones, 3-hydroxyflavanones and their glycosides[J]. Tetrahedron, 1970, 26: 4093–4108. DOI:10.1016/S0040-4020(01)93050-9 |
 2017, Vol. 52
2017, Vol. 52