2. 福建中医药大学中西医结合研究院, 福建 福州 350108;
3. 加拿大不列颠哥伦比亚大学, 温哥华 V6T1Z3;
4. 上海市疾病预防控制中心化学品毒性检定所, 上海 200336
2. Academy of Integrative Medicine, Fujian University of Traditional Chinese Medicine, Fuzhou 350108, China;
3. The University of British Columbia, Vancouver V6T1Z3, Canada;
4. Institute of Chemical Toxicity and Safety Assessment, Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China
组织蛋白酶K (CTSK)是溶骨活性最强的一种半胱氨酸蛋白酶, 选择性高表达于破骨细胞中, 降解Ⅰ型骨胶原、骨桥接素和骨连接素等生理底物, 是骨吸收过程中一个关键酶[1]。人体CTSK基因表达的变异会导致致密性成骨不全症、骨质疏松和骨脆性的增加等症状[2]。CTSK基因缺失小鼠骨髓培养的离体破骨细胞不能形成骨吸收陷窝, 不能有效降解Ⅰ型胶原[3]。因此, CTSK抑制剂是抗骨质疏松药物研发的热点之一。目前临床前和临床研究以CTSK活性位点为靶点, 尚无成功上市药物。研究结果显示, 作用于活性位点(active site)的CTSK抑制剂, 不仅抑制骨胶原降解活性, 同时抑制CTSK酶的其他正常蛋白水解生物活性, 导致非骨骼组织的纤维化等不良反应。不列颠哥伦比亚大学Bromme教授基于生物化学和结构分析的研究发现组织蛋白酶K与黏多糖(glycosaminoglycans, GAGs)可形成一种复合物, 如硫酸软骨素(chondroitin 4-sulfate, C4-S或CSA), 只有CTSK二配体与一个CSA分子形成复合物才具有胶原酶作用, 降解骨胶原[4, 5]。因此, 具有抑制CTSK与GAGs形成复合物的作用, 而不影响CTSK活性位点的生理活性, 称为非活性位点(exosite)抑制剂[6]。寻找这种新型的非活性位点抑制剂将是未来开发临床治疗骨质疏松药物的重要方向。
墨旱莲, 收录于2015版《中国药典》, 来源于植物鳢肠Ecliptaprostrata L.的干燥地上部分, 具滋补肝肾、凉血止血的功效, 主治肝肾阴虚、牙齿松动、须发早白、眩晕耳鸣、腰膝酸软、阴虚血热吐血、衄血和尿血症等[7]。化学成分主要为三萜皂苷类、噻吩类、香草醚类及黄酮类等[8]。现代药理研究表明, 墨旱莲具有显著的抗骨质疏松活性, 其根和叶的乙醇提取物、总挥发油和总皂苷均显著促进UMR106成骨细胞的增殖和碱性磷酸酶的活性[8-10]。墨旱莲有效成分刺囊酸和蟛蜞菊内酯均显示能有效抑制破骨细胞骨吸收活性[11, 12]。因此, 本研究拟从墨旱莲活性成分寻找抑制CTSK活性的抑制剂, 以期筛选得到理想的抗骨质疏松的非活性位点抑制剂。
材料与方法 材料与试剂墨旱莲药材购自上海华宇药业有限公司, 经中国人民解放军第二军医大学秦路平教授鉴定为菊科植物鳢肠Ecliptaprostrata L.的干燥地上部分。重组CTSK的毕赤酵母表达菌株GS115-pPIC9K, 由不列颠哥伦比亚大学Dieter Bromme实验室提供; 固体酵母浸出粉/胰蛋白胨/右旋葡萄糖培养基(yeast extract peptone dextrose medium, YPD)、缓冲复合甘油培养基(buffered glycerol complex medium, BMGY)和缓冲复合甲醇培养基(buffered methanol complex medium, BMMY)均购自Invitrogen公司; Benzyloxycarbonyl-Phe-Arg-7-amido-4-methylcoumarin (Z-FR-MCA)购自日本WAKO公司; Ⅰ型胶原购自美国Affymetrix公司; E-64 (L-3-carboxy-trans-2-3-epoxypropionyl-leucylamido-(4guanidino)-butane)、CSA和胃蛋白酶购自Sigma公司; n-Butyl琼脂糖柱和SP琼脂糖柱购自美国GE Healthcare公司; 微孔过滤滤膜离心管购自Amico Millipore公司。
仪器与设备荧光分光光度计(LB50, Perkin-Elmer公司); GeneSnap凝胶成像系统(MD, Syngene Inc. Frederick公司); J21-M型高速离心机(美国Beckman公司); 蛋白电泳仪(Bio-Rad公司); 微孔板酶标仪(美国Molecular Devices公司); Beckman Du 530分光光度计(德国Beckman公司)。
墨旱莲提取物制备称取两份墨旱莲药材, 每份100 g, 分别用10倍量的95%乙醇回流提取, 每次2 h, 提取3次, 合并滤液。一份得到醇提物11.0 g; 另一份分别用正丁醇、石油醚、乙酸乙酯和二氯甲烷依次萃取, 将各部位药液分别浓缩至干浸膏, 醇提石油醚部位1.6 g、乙酸乙酯部位2.2 g、正丁醇部位3.6 g和二氯甲烷部位2.1 g。分别用DMSO配成质量浓度为40 mg·mL−1的供试溶液; 墨旱莲皂苷(Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅸ)和刺囊酸是墨旱莲正丁醇部位经凝胶柱层析分离得到(结构式见图 1), DMSO溶解, 制备成10 μmol·mL−1的供试液。

|
Figure 1 Compounds isolated from butanol extract of Herba Ecliptae |
取出重组毕赤酵母菌, 在超净台中将菌株20 μL接种于5 mL YPD培养基, 37 ℃培养1天。将YPD培养菌液体5 mL, 加入BMGY培养液50 mL, 200 r·min−1摇床28 ℃培养1~2天, 用Beckman Du 530分光光度计至吸光度(OD)值为6。菌液于1 000 r·min−1离心10 min, 收集全部菌体, 分别重新悬浮于2×500 mL BMGY培养基, 培养24 h后, 重新悬浮于2×200 mL BMMY培养基, 于摇床28 ℃、200 r·min−1进行诱导表达2~3天, 每天加入100%甲醇1 mL诱导发酵, 培养液合并, 4 ℃下6 000 r·min−1离心10 min, 取上清液, 浓缩至40 mL, 存放于−80 ℃冰箱。纯化过程如下:取发酵液20 mL, 加入0.6 mg·mL−1胃蛋白酶激活CTSK, 用20%乙酸溶液调节pH至4.0, 于37 ℃孵育, 利用Z-FR-MCA底物实时检测酶活性。取发酵液5 μL置于100 mmol·L−1醋酸钠缓冲液中(pH 5.5, 含2.5 mmol·L−1 DTT和2.5 mmol·L−1 EDTA), 加入底物1 mmol·L−1 Z-FR-MCA溶液5 μL开始反应, 检测1 min荧光信号slope, 直到CTSK活性最强, 将发酵液置于冰上, 待进一步纯化。胃蛋白酶活化后的发酵液, 加入硫酸铵使最终达到2 mol·L−1, 于4 ℃、6 000 r·min−1离心10 min, 上清液上样过N端正丁基琼脂糖凝胶柱, 采用硫酸铵梯度洗脱(100%、70%、50%和0%), CTSK酶被洗脱下来, 用Z-FR-MCA实时观察酶活性, 洗脱收集合并活性强的部位, 用Millipore 10KD微孔过滤滤膜在6 000 r·min−1离心10 min, 收集上清液。再经SP-琼脂糖凝胶柱, 采用氯化钠梯度洗脱(0%、30%、50%和100%), 收集活性集中组分合并, 用Millipore 10KD微孔过滤滤膜在6 000 r·min−1离心10 min, 收集上清液, 得到浓缩酶液1.5 mL, 保存于−80 ℃冰箱, 备用。
组织蛋白酶K纯度采用凝胶电泳方法验证CTSK蛋白纯度。取纯化CTSK 1 µL加入100 mmol·L−1醋酸钠缓冲液(pH 5.5, 含2.5 mmol·L−1 DTT和2.5 mmol·L−1 EDTA) 15 µL, 再分别取16 µL胃蛋白酶活化前后的菌液、经正丁基柱和SP柱纯化后, 分别加入5×SDS上样缓冲液5 µL, 95 ℃加热5 min后, 上样, 10% SDS-PAGE凝胶电泳分离, 胶体用卡马斯亮蓝染色20 min, 用乙酸−甲醇(4:1) 脱色。灰度用GeneSnap软件进行定量分析。
组织蛋白酶K浓度酶浓度测定采用活性位点滴定法。取浓缩后CTSK酶溶液5 µL, 分别加入5 µL不同浓度的抑制剂E-64 (0、2、5、8、10、15和20 μmol·L−1)溶液于100 mmol·L−1醋酸钠缓冲液(pH 5.5, 含2.5 mmol·L−1 DTT和2.5 mmol·L−1 EDTA) 40 µL中孵育30 min后, 从中取溶液5 μL, 于990 μL醋酸钠缓冲液中, 加入1 mmol·L−1 Z-FR-MCA底物溶液5 μL反应30 s后, 在微孔板酶标仪(美国Molecular Devices公司)测定1 min内的荧光slope值(发散光波长460 nm, 吸收光波长355 nm)。计算公式:酶活(U) = slope/测定样品量(μL) ×总溶液容量(μL), 1 U = 4.68×10−6 mg。
组织蛋白酶K动力学Michaelis-Menten常数(Km)采用非线性回归分析, 总反应液为200 μL, 用100 mmol·L−1醋酸钠缓冲液(pH 5.5, 含2.5 mmol·L−1 DTT和2.5 mmol·L−1 EDTA)稀释配制成终浓度为2 nmol·L−1 CTSK, 加入5 μL不同终浓度(0.5、2.5、5、10、15、20、25、30和40 μmol·L−1) Z-FR-MCA底物孵育30 s, 测定1 min内的荧光slope值, 方法同上。
组织蛋白酶K稳定性总反应液为200 μL, 用100 mmol·L−1醋酸钠缓冲液中(pH 5.5, 含2.5 mmol·L−1 DTT和2.5 mmol·L−1 EDTA)稀释配制终浓度2 nmol·L−1 CTSK, 存放在不同温度(22 ℃、28 ℃和37 ℃)下孵育, 分别在0、0.5、1、2、3和4 h, 加入1 mmol·L−1 Z-FR-MCA底物5 μL孵育30 s, 测定1 min内的荧光slope值, 方法同上。
胶原降解活性总反应液为50 μL, 可溶性Ⅰ型胶原溶解在100 mmol·L−1醋酸钠缓冲液(pH 5.5, 含2.5 mmol·L−1 DTT和2.5 mmol·L−1 EDTA), 最终质量浓度为0.6 mg·mL−1, 分别加入抑制剂:最终质量浓度为400 μg·mL−1墨旱莲石油醚部位、乙酸乙酯部位、正丁醇部位和二氯甲烷部位; 100 μmol·L−1墨旱莲皂苷(Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅸ)和刺囊酸, 依次将CTSK (最终浓度400 nmol·L−1)和CSA (最终浓度200 nmol·L−1)加入含有Ⅰ型胶原蛋白的反应液中, 使总反应液容量达50 μL。混匀, 28 ℃孵育4 h, 取出后加入5 μL 100 μmol·L−1 E64终止反应。采用10% SDS-PAGE凝胶电泳分离, 卡马斯亮蓝染色20 min, 用乙酸乙酯−甲醇(4:1) 脱色。Ⅰ型胶原的α1条带的灰度用GeneSnap软件进行定量分析。实验重复3次, 每次重复3组胶。
Z-FR-MCA活性墨旱莲石油醚部位、乙酸乙酯部位、正丁醇部位和二氯甲烷部位分别用100 mmol·L−1醋酸钠缓冲液(pH 5.5, 含2.5 mmol·L−1 DTT, 和2.5 mmol·L−1 EDTA)稀释至质量浓度为25 μg·mL−1; 墨旱莲皂苷(Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅸ)和刺囊酸稀释至25 μmol·mL−1, 于比色皿中, 最终反应容量为1 mL。加入终浓度为5 nmol·L−1的CTSK孵育5 min, 再加入底物1 mmol·L−1 Z-FR-MCA溶液5 μL, 孵育30 s, 测定1 min内的荧光slope值(发射光波长460 nm, 吸收光波长355 nm)。实验设阴性对照组(无抑制剂), 阳性对照组(E64, 活性位点抑制剂)。计算公式:抑制率(%) = 100 − (1 − Vi/V0)。其中Vi和V0分别表示存在和不存在抑制剂时荧光信号。
统计学分析所有实验重复3次, 实验所得数据均采用SPSS18.0软件进行单因素方差(one-way ANOVA)分析, 所测数据以x± s表示。
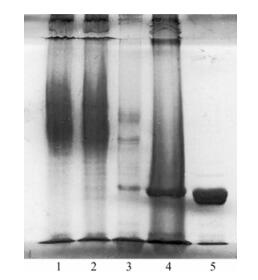
结果 1 组织蛋白酶K纯度和浓度检测对制备CTSK不同阶段留样进行凝胶电泳分析(图 2), 5号为纯化浓缩后的CTSK, 为单一深黑色条带, 其灰度值为99.9%, 达到纯化标准, 作为定性位置。胃蛋白酶活化前, 在同一纬度并无条带出现; 活化后, 在同一位置出现暗灰色的条带。经N端正丁基琼脂糖柱后, 出现明显的CTSK条带, 但仍然有较多其他蛋白条带, 灰度值显示纯度只能达到50%。经SP柱纯化后, 只有一条显著的CTSK条带, 无明显的其他条带, 纯度达到99%。因此经两步柱分离后, 可得到纯CTSK。
|
Figure 2 SDS-PAGE analysis on identification and purification of cathepsin K (CTSK). Run 10% polyacrylamide gel with CTSK solutions 10 μL in different purification process. 1: Fermentation broth before activation by pepsin; 2: Fermentation broth before activation by pepsin; 3: After n-butyl agarose column purification; 4: After SP agarose column purification; 5: After ultrafiltration using Millipore centrifugal filter unit with MW 10 000 cut-off |
对最终浓缩制备的CTSK稀释10倍进行浓度测定, E64和底物Z-FR-MCA (1:1) 竞争性与CTSK酶结合, 采用E64的浓度来反向滴定测定酶浓度。图 3A结果显示, 当E64浓度为20 μmol·mL−1时, 可完全抑制酶与底物结合, 随E64浓度的升高, CTSK与Z-FR-MCA结合反应的荧光信号降低。线性方程y = −0.209 5 x + 4.014 5, R = 0.996, 得到CTSK浓度为19.16 μmol·mL−1。不加E64的slope值为4.014 5 dA·min−1, 经计算, 酶活为12.04×106 U, 约等于56.4 mg。

|
Figure 3 Plots for the determination of CTSK concentration with different E64 concentrations (A) and plot for Km and Kcat according to Michaelis-Menten kinetics (B). Determine the fluorescence units (FU) per min ('slope') for enzyme incubated with inhibitor E64 concentrations (0, 2, 5, 8, 10, 15, 20 μmol·L−1) at a constant Z-FR-MCA substrate concentration (1 mmol·L−1) and for Z-FR-MCA substrate concentrations (0.5, 2.5, 5, 10, 15, 20, 25, 30, 40 μmol·L−1) at a constant 5 nmol·L−1 enzyme concentration, which measured at Ex 355 nm and Em 460 nm. Z-FR-MCA: Benzyloxycarbonyl-Phe-Arg-7-amido-4-methylcoumarin |
对制备的CTSK进行酶动力参数考察, Km、Kcat和Kcat/Km采用Michaelis-Menten方程公式计算, 不同底物浓度测得的数据(图 3B), 随时间的延长, 荧光slope逐渐升高, 反应25 min后, 数值趋于平稳, 反应终止。非线性回归分析结果显示Km为8.77 ± 1.70 μmol·L−1, Kcat为9.99 ± 1.10 s−1, Kcat/Km为1.14 ± 0.90 (106 s−1 mol−1·L)。
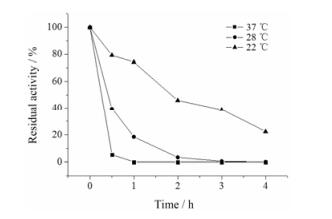
研究考察了22 ℃ (室温)、28 ℃和37 ℃的稳定性。在室温、pH 5.5环境下, 经4 h孵育, 还剩20% CTSK活性。在28 ℃和37 ℃条件下, 30 min孵育后CTSK剩余酶活降低至39.5%和5.3%;在1 h后, 28 ℃时孵育剩下19.5%活性, 37 ℃时孵育无剩余活性(图 4)。
|
Figure 4 Stability of CTSK under different temperatures was tested against the substrate Z-FR-MCA (1 mmol·L−1). Samples were tested at 22 ℃ (room temperature), 28 ℃, and 37 ℃ at the time points of 0.5, 1, 2, 3, and 4 h. The residual activities were plotted against time |
墨旱莲不同提取部位(正丁醇、石油醚、乙酸乙酯和二氯甲烷)抑制CTSK引起胶原降解活性筛选结果显示, 墨旱莲正丁醇, 石油醚和乙酸乙酯部位在400 μg·mL−1显示较强的抑制作用, 分别为78.3%、95.6%和68.9%;二氯甲烷部位对胶原降解无抑制作用。对不同部位提取物进行Z-FR-MCA底物结合实验结果显示, 墨旱莲石油醚、二氯甲烷和乙酸乙酯部位抑制作用明显, 超过50%, 可能其中的CTSK抑制剂主要作用于活性位点; 墨旱莲正丁醇部位对CTSK与底物结合抑制作用为25.9%。石油醚部位胶原降解活性显著高于正丁醇部位, 石油醚、二氯甲烷和乙酸乙酯部位的Z-FR-MCA活性显著高于正丁醇部位(表 1)。
| Table 1 Inhibition effect of different fractions of Herba Ecliptae on collagenase activity and Z-FR-MCA substrate activity of CTSK. *P < 0.05, ***P < 0.001 vs n-butanol |
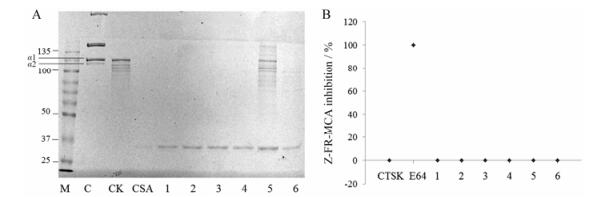
从正丁醇部位分离得到的主要是皂苷类化合物, 有墨旱莲皂苷(Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅸ)和刺囊酸等化合物(图 1)。通过考察这些活性成分抑制CTSK胶原降解活性和抑制Z-FR-MCA活性。结果显示墨旱莲皂苷Ⅸ胶原α1条带灰度值为CK灰度值70.3% (图 5A), 墨旱莲皂苷(Ⅰ、Ⅱ、Ⅴ、Ⅶ)和刺囊酸显示无抑制作用; 6个化合物对Z-FR-MCA均不显示抑制活性(图 5B)。
|
Figure 5 Inhibition effect of compounds form butanol extract of Herba Ecliptae on collagenase activity (A) and Z-FR-MCA substrate activity (B) of CTSK. 1: Eclalbasaponin Ⅰ; 2: Eclalbasaponin Ⅱ; 3: Eclalbasaponin Ⅴ; 4: Eclalbasaponin Ⅶ; 5: Eclalbasaponin Ⅸ; 6: Echinocystic acid |
CTSK抑制剂可特异性地抑制破骨细胞胶原降解酶的活性, 而不影响细胞活力, 可以避免成骨细胞和破骨细胞双向调节的失衡。临床前和临床研究数据表明CTSK抑制剂对骨吸收的抑制作用可以达到80%, 而不降低骨形成的生物指标[13, 14]。然而, 临床试验表明, 基于这种新型的防治骨质疏松策略的4种CTSK抑制剂中至少2种的临床试验结果失败, 其原因与导致非骨骼组织的纤维化有关[15]。默克公司odanacatib虽然成功通过了Ⅲ期临床试验, 但增加了房颤和中风风险而放弃。除了骨骼系统预期的表型外, CTSK缺陷鼠还表现出肺气道损伤[16], 使肺和皮肤易于发生纤维化[15, 17], 甲状腺球蛋白加工(thyroglobulin processing)改变[18, 19], TGF-1β转换, 甚至学习记忆缺陷[20], 表明活性位点抑制剂可能引起诸多不良反应, 为开发新型的抗骨质疏松药物提出了挑战。Bromme教授提出非活性位点的概念, 寻找这种选择性的、不抑制非胶原基质降解的CTSK抑制剂将避免目前活性位点抑制剂的安全性问题。中草药含有丰富的活性物质, 有些化合物经反复验证可治疗包括骨骼疾病在内的多种病症, 但大多数化合物的药理学靶标尚不清楚。因此, 长期临床治疗骨骼疾病的中草药是理想的候选药物库。墨旱莲与女贞子组方二至丸被临床医家常用于治疗更年期骨质疏松, 疗效确切, 能明显改善更年期骨质疏松征症状, 增强骨密度[21]。本研究期望发现墨旱莲中具有抗骨质疏松活性的CTSK非活性位点抑制剂。
CTSK是通过在毕赤酵母菌发酵、制备和纯化得到的, 最终20 mL浓缩菌液获得CTSK约56.2 mg。采用Z-FR-MCA底物活性测试, 全程监控制备、纯化过程, 以期获得最大的酶活量。纯化过程经两步柱纯化, 采用梯度洗脱, 最大地保留了酶量, 同时达到了纯化要求。对CTSK进行了酶动力参数和酶稳定性研究, 酶动力参数Km = 8.77 ± 1.70 μmol·L−1, Kcat = 9.99 ± 1.10 s−1, Kcat/Km = 1.14 ± 0.90 (106 s−1·mol−1·L), 与文献[5]报道大致相同, 确保制备得到的酶是CTSK。稳定性实验表明, 在22 ℃条件下, 4 h后仍有约20%剩余活性; 28 ℃条件下缓慢失活, 3 h基本失活; 37 ℃条件下1 h内基本失活。因此本研究选择28 ℃下孵育4 h用于胶原降解实验。
CTSK选择性地大量表达于破骨细胞, 其生理作用底物正是在有机骨基质中含量达95%的Ⅰ型胶原, 非活性位点和活性位点抑制剂均能抑制Ⅰ型胶原的α1和α2条带降解。Z-FR-MCA是CTSK人工合成底物, 作用于CTSK活性位点, 具有荧光发光基团MCA, 发射波长460 nm, 激发波长355 nm。CTSK将裂解底物端FR-MCA结合, 释放游离的MCA基团, 通过检测MCA产生的荧光信号来检测CTSK的活性; 抑制胶原降解活性考察是否为CTSK抑制剂; Z-FR-MCA实验判断抑制剂作用于活性位点还是非活性位点。
通过对治疗骨质疏松常用药物墨旱莲的有效部位筛选, 发现墨旱莲正丁醇部位表现较强的胶原降解活性, 且抑制Z-FR-MCA与CTSK结合不明显, 是比较理想的非活性位点有效部位。墨旱莲石油醚和乙酸乙酯部位虽然具有较强的抑制胶原降解活性, 但其抑制Z-FR-MCA活性同样很强, 超过60%以上, 极有可能是活性位点抑制剂。虽然不排除可能存在非活性位点抑制剂, 但筛选发现墨旱莲正丁醇部位分离活性化合物更有可能得到非活性位点抑制剂。墨旱莲正丁醇部位主要分离得到皂苷类成分, 墨旱莲皂苷(Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅸ)和刺囊酸均为五环三萜类化合物(图 1), 但仅墨旱莲皂苷Ⅸ表现出明显的抑制胶原降解活性, 可能与糖环上磺酸根基团和苷元上羟基基团密切相关。本研究对墨旱莲各部位及正丁醇部位皂苷类成分进行了筛选, 发现CTSK非活性位点抑制剂是潜在存在的, 未来计划从墨旱莲正丁醇部位中分离更多的有效成分进行筛选。
| [1] | Lecaille F, Kaleta J, Brömme D. Human and parasitic papain-like cysteine proteases: their role in physiology and pathology and recent developments in inhibitor design[J]. Chem Rev, 2002, 102: 4459–4488. DOI:10.1021/cr0101656 |
| [2] | Fratzl-Zelman N, Valenta A, Roschger P, et al. Decreased bone turnover and deterioration of bone structure in two cases of pycnodysostosis[J]. J Clin Endocrinol Metab, 2004, 89: 1538–1547. DOI:10.1210/jc.2003-031055 |
| [3] | Duque G, Troen BR. Understanding the mechanisms of senile osteoporosis: new facts for a major geriatric syndrome[J]. J Am Geriatr Soc, 2008, 56: 935–941. DOI:10.1111/jgs.2008.56.issue-5 |
| [4] | Li Z, Hou WS, Escalante-Torres CR, et al. Collagenase activity of cathepsin K depends on complex formation with chondroitin sulfate[J]. J Biol Chem, 2002, 277: 28669–28676. DOI:10.1074/jbc.M204004200 |
| [5] | Aguda AH, Panwar P, Du X, et al. Structural basis of collagen fiber degradation by cathepsin K[J]. Proc Natl Acad Sci U S A, 2014, 111: 17474–17479. DOI:10.1073/pnas.1414126111 |
| [6] | Panwar P, Se K, Guido RV, et al. A novel approach to inhibit bone resorption: exosite inhibitors against cathepsin K[J]. Br J Pharmacol, 2016, 173: 396–410. DOI:10.1111/bph.13383 |
| [7] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Part Ⅰ. Beijing: China Medical Science Press, 2015, 374-375. |
| [8] | Lee MK, Ha NR, Yang H, et al. Stimulatory Constituents of Eclipta prostrata on mouse osteoblast differentiation[J]. Phytother Res, 2009, 23: 129–131. DOI:10.1002/ptr.v23:1 |
| [9] | Lin XH, Wu YB, Lin S, et al. Effects of volatile components and ethanolic extract from Eclipta prostrata on proliferation and differentiation of primary osteoblasts[J]. Molecules, 2010, 15: 241–250. DOI:10.3390/molecules15010241 |
| [10] | Huang YX, Yi J, Wu JG, et al. Comparative study on antiosteoporosis activity and chemical composition from different parts of Eclipta prostrata L[J]. Nat Prod Res Dev (天然产物研究与开发), 2014, 26: 1229–1232. |
| [11] | Liu YQ, Zhan LB, Liu T, et al. Inhibitory effect of Ecliptae herba extract and its component wedelolactone on pre-osteoclastic proliferation and differentiation[J]. J Ethnopharmacol, 2014, 157: 206–211. DOI:10.1016/j.jep.2014.09.033 |
| [12] | Deng YT, Kang WB, Zhao JN, et al. Osteoprotective effect of echinocystic acid, a triterpone component from Eclipta prostrata, in ovariectomy-induced osteoporotic rats[J]. PLoS One, 2015, 10: e0136572. DOI:10.1371/journal.pone.0136572 |
| [13] | Costa AG, Cusano NE, Silva BC, et al. Cathepsin K: its skeletal actions and role as a therapeutic target in osteoporosis[J]. Nat Rev Rheumatol, 2011, 7: 447–456. DOI:10.1038/nrrheum.2011.77 |
| [14] | Eisman JA, Bone HG, Hosking DJ, et al. Odanacatib in the treatment of postmenopausal women with low bone mineral density: three-year continued therapy and resolution of effect[J]. J Bone Miner Res, 2011, 26: 242–251. DOI:10.1002/jbmr.212 |
| [15] | Rünger TM, Adami S, Benhamou CL, et al. Morphea-like skin reactions in patients treated with the cathepsin K inhibitor balicatib[J]. J Am Acad Dermatol, 2012, 66: 89–96. DOI:10.1016/j.jaad.2010.11.033 |
| [16] | Zhang D, Leung N, Weber E, et al. The effect of cathepsin K deficiency on airway development and TGF-β1 degradation[J]. Respir Res, 2011, 12: 72. DOI:10.1186/1465-9921-12-72 |
| [17] | Bühling F, Röcken C, Brasch F, et al. Pivotal role of cathepsin K in lung fibrosis[J]. Am J Pathol, 2004, 164: 2203–2216. DOI:10.1016/S0002-9440(10)63777-7 |
| [18] | Tepel C, Bromme D, Herzog V, et al. Cathepsin K in thyroid epithelial cells: sequence, localization and possible function in extracellular proteolysis of thyroglobulin[J]. J Cell Sci, 2000, 113: 4487–4498. |
| [19] | Friedrichs B, Tepel C, Reinheckel T, et al. Thyroid functions of mouse cathepsins B, K, and L[J]. J Clin Invest, 2003, 111: 1733–1745. DOI:10.1172/JCI15990 |
| [20] | Dauth S, Sîrbulescu RF, Jordans S, et al. Cathepsin K deficiency in mice induces structural and metabolic changes in the central nervous system that are associated with learning and memory deficits[J]. BMC Neurosci, 2011, 12: 74. DOI:10.1186/1471-2202-12-74 |
| [21] | Yu QY. Clinical observation of Er-Zhi-Wan in treating climacteric osteoporosis[J]. Strait Pharm J (海峡药学), 2009, 21: 169–170. |
 2017, Vol. 52
2017, Vol. 52



