2. 中国医学科学院、北京协和医学院药物研究所, 北京 100050;
3. 中国医学科学院、北京协和医学院医药生物技术研究所, 北京 100050
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
3. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
肝细胞性肝癌(human hepatocellular carcinoma, HCC)是原发性肝癌最常见的形式, 为世界第五大癌症, 位于癌症相关死亡率的第三位[1]。目前我国肝癌发病人数占全球肝癌患者的50%以上, 已经成为严重威胁我国人民健康和生命的一大杀手[2]。抗肝癌治疗一直处于一种治疗技术有限、有效药物很少的困难境地, 因此寻找高效低毒的抗肝癌药物是科研工作者努力的目标[3]。
自20世纪50年代初以来, 许多传统化疗药物包括5-氟尿嘧啶(5-FU)、多柔比星(ADM)/表柔比星(EADM)、顺铂、丝裂霉素C (mitomycin C, MMC)和依托泊苷已被陆续应用于治疗HCC[4]。近年来, 一系列新一代化疗药物如奥沙利铂、吉西他滨和卡培他滨等被广泛应用[4]。但是, 肝癌的化疗进展不大, 单药治疗有效率通常低于20%, 且毒副作用大, 可重复性差[4]。与其他实体瘤相比, 晚期HCC患者的生存时间相对较短, 从而限制了使用单个药物进行连续治疗的可能性; 此外, 考虑到大多数单药治疗的反应率低和HCC肿瘤异质性高相关, 联合化疗也许可潜在地改善临床效果[5]。联合化疗是指联合使用两种或更多种治疗药物治疗癌症。与单一疗法相比, 抗癌药物的合用有可能增强疗效, 因为联合化疗可以特征性地针对关键作用途径从而产生协同或加和效应; 此外, 这种方法可潜在地降低耐药性, 并产生治疗性的抗癌益处, 如降低肿瘤生长和转移潜力, 阻断细胞的细胞周期, 减少癌症干细胞群体和诱导细胞凋亡等[6]。所以合理的联合化疗可达到既增效又减毒, 或减毒而不减效, 或增效而不增毒的目的, 肝癌的联合化疗一直受到临床医生的重视。
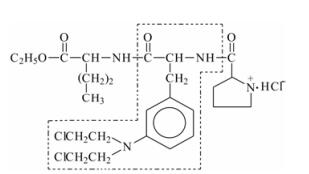
L-脯氨酸-间-双(2-氯乙基)胺基-L-苯丙氨酰基-L-正缬氨酸乙酯盐酸盐(MF13) 是一个新颖的含三肽的氮芥类化合物(结构式见图 1), 本研究组以往的研究数据表明MF13在体外对多种不同来源的人肝癌细胞系均有较强的抗增殖活性; 在裸鼠皮下异种移植人肝癌实验中, 结果表明与对照组相比, MF13对Bel-7402和HepG2实体瘤有显著的肿瘤生长抑制作用, 并且呈剂量依赖性; 此外, MF13的抗肝癌活性优于等摩尔当量的前体化合物间-溶肉瘤素(m-SL) (瘤体积比P < 0.01)[7]。MF13单药给药的研究结果表明, MF13可能有较好的抗肝癌潜能。本课题研究MF13与其他抗肿瘤药物联合化疗的体内外抗肝癌作用, 并与单药给药的疗效作比较, 进一步评估MF13作为抗肝癌化合物的应用前景。为了研究MF13与其他药物联合应用的效果, 在动物体内研究中, 采用了同为氮芥类烷化剂的环磷酰胺(cyclophosphamide, CTX)和抗生素类烷化剂MMC, 还选用了G2/M期特异性药物——植物来源抗肿瘤药长春新碱(vincris tine, VCR); 在体外实验中没有考证联合应用CTX的作用, 是因为CTX为前药, 进行体外实验需加肝微粒体功能氧化酶, 这样就增加了实验影响因素。体内外的实验结果一致表明, 无论是单药给药, 还是联合化疗, MF13是一个有潜在应用前景的抗肝癌化合物。
|
Figure 1 Chemical structure of MF13 |
药物及主要生化试剂 MF13、m-SL由蒋建东研究组[7-9]合成, 纯度大于90.0%。将MF13和m-SL溶于N, N-二甲基乙酰胺(DMF): 1, 2-丙二醇(1:2), 配成10 mg·mL-1母液, 体外实验时再用培养基稀释成所需浓度, 动物实验则临用前再用生理盐水稀释成所需浓度。注射用MMC购于山西泰盛制药有限公司, 溶于pH 8.0碱液中; 注射用CTX, 上海新亚药业有限公司产品; 注射用硫酸VCR, 由北京医科大学实验药厂提供。进行动物实验时, 所有药液临用前再用生理盐水稀释成所需浓度。RPMI 1640培养基、胰酶/EDTA购自GIBCO公司; 无DNA酶的RNA酶(RNase)、碘化丙啶(PI)、噻唑蓝(MTT)、十二烷基硫酸钠(SDS)均购自Sigma公司; DMF、乙醇与其他试剂为国产试剂(北京化工厂)。
细胞系 人肝癌细胞系Bel-7402购自中国科学院上海细胞研究所, 用含10%小牛血清的RPMI 1640培养基(每毫升培养基含有150单位青霉素和150单位链霉素), 在含5% CO2的37 ℃培养箱培养。用胰酶/EDTA消化细胞传代, 并按细胞的生长规律定期传代, 实验所用的细胞均处于对数生长期。在动物实验中, 人肝癌细胞Bel-7402皮下注射裸鼠体内, 以实体瘤形式传代。
实验动物及饲养条件 5~6周龄的BALB/c裸鼠, 动物许可证: SCXK (京) 2004-0011, 雌性, 体重为17 ± 2 g, 由中国医学科学院实验动物研究所提供。每个无菌隔离罩中放入8~10只裸鼠, 置层流柜中饲养观察1周, 确认其健康后开始动物实验。裸鼠的饲养条件为:用钴60照射的鼠颗粒饲料和高压灭菌的自来水饲养裸鼠, 高压消毒的垫料每周更换2次, 饲养室温度在24~26 ℃, 湿度为50%~60%。
流式细胞术检测MF13联合化疗对细胞周期的影响 收集溶剂对照细胞和按不同设定孵育时间、经不同配伍方式药物处理后的细胞(贴壁及未贴壁的), 冰冷PBS洗2次, 加入预冷的70%乙醇于4 ℃固定至少12 h, 离心去除乙醇, PBS洗2次, 250 μg·mL-1 RNA酶37 ℃消化30 min, 加入PI使其终质量浓度为50 μg·mL-1, 4 ℃避光染色30 min, 过300目尼龙网, 经流式细胞仪(Coulter EPICS-XL型, 美国Coulter公司)检测各组细胞的周期变化。
MF13联合化疗对HCC细胞的生长抑制作用——MTT比色法[10] 将Bel-7402细胞接种于2块96孔培养板上, 接种的活细胞数为每孔1x104个。一块培养板分别加入两倍浓度梯度的VCR (0.42×10-5~6.72×10-5 µmol·L-1)、MF13 (0.14~4.42 µmol·L-1)和MF13+VCR (联合给药组每孔的浓度通过正交法确定), 同样方法, 另一块分别加入MMC (0.24~3.74 µmol·L-1)、MF13和MF13+MMC。各孔的总体积为250 µL, 每个浓度重复2孔, 溶剂对照孔内加入等体积含等量溶剂的培养基, 置CO2孵箱于37 ℃培养72 h。然后弃去药液, 加入无血清培养液配制的MTT工作液(0.2 mg·mL-1) 200 µL, 置CO2孵箱于37 ℃继续培养4 h后, 倒掉MTT工作液, 每孔加入50% DMF-20% SDS脱色液200 µL, 置37 ℃恒温摇床反应2 h后, 在酶标仪上测定波长为570 nm时各孔的光密度吸收值(OD)。每组实验重复3次, 每次实验均设定溶剂对照孔和细胞对照孔各3孔, 结果以细胞生长抑制率(%)和两药相互作用指数表示。细胞生长抑制率(%)通过公式(OD溶剂对照组 -OD加药组) / OD溶剂对照组x 100%计算。两药相互作用指数(coefficient of drug interaction, CDI)的计算公式为: CDI = AB / (A×B), 在MTT法中, AB为两药联合使用组与对照组在570 nm处吸光度的比值, A、B为各药单独使用组与对照组在570 nm处吸光度的比值; 在动物实验中, AB为两药联合使用组与对照组瘤体积的比值, A、B为各药单独使用组与对照组瘤体积的比值。CDI < 1、= 1或 > 1分别表示这些药物组合的作用是协同、加和或拮抗的, CDI < 0.7表明该药物具有显著的协同作用[11-13]。
MF13联合化疗对裸鼠皮下异种移植人肝癌Bel-7402的治疗作用 无菌条件下, 剥取体内接种传代人肝癌Bel-7402细胞30天的荷瘤裸鼠皮下瘤块于消毒平皿中, 小心剔除粘连组织或血块后, 在无血清的RPMI-1640培养基中, 选取肿瘤细胞活力强的瘤块外层剪成2~8 mm3大小的均匀瘤块, 用套管针将瘤块接种于裸鼠右侧背部皮下, 1块/只。肿瘤接种第7天, 将48只裸鼠随机分为8组, 分别为溶剂对照组(7只)、50 mg·kg-1 CTX治疗组(5只)、2 mg·kg-1 MMC治疗组(5只)、0.3 mg·kg-1 VCR治疗组(5只)、2 mg·kg-1 MF13治疗组(5只)、2 mg·kg-1 MF13 + 50 mg·kg-1 CTX治疗组(7只)、2 mg·kg-1 MF13 + 2 mg·kg-1 MMC治疗组(7只)及2 mg·kg-1 MF13 + 0.3 mg·kg-1 VCR治疗组(7只)。待各组荷瘤裸鼠的平均瘤体积为100 mm3左右时, 开始腹腔注射(intraperitoneal injection, ip)给药, 首剂剂量按组别所示(所有2 mg·kg-1 MF13治疗组首剂为4 mg·kg-1, 联合化疗组两药同时给药), 以后继续每周给药1次, 共5次。接种肿瘤第35天, 因溶剂对照组裸鼠的平均瘤体积超过2 000 mm3而结束实验[14], 颈椎脱臼法处死动物, 剥取瘤块称重并计算抑瘤率(%)。用下列公式计算肿瘤体积:瘤体积=瘤长径×瘤宽径2 × 0.52[15], 根据瘤体积绘制各组肿瘤生长曲线, 并计算抑瘤率(%)。对各组瘤体积和瘤重组间差异显著性进行F和t检验。
统计学方法 数据在SPSS软件中进行计算和统计, 经正态分布和方差齐性检验(F检验)后, 进行两两比较的两个独立样本的t检验。
结果 1 MF13与其他抗肿瘤药联合使用时对细胞周期的影响 1.1 MMC单独使用时主要将细胞阻断在S期以前的研究数据显示, MF13连续处理Bel-7402细胞, 作用6 h后S期细胞数量已有所增加; 作用12 h后S期细胞所占比例超过50%;作用24 h后S期细胞所占比率达到76.2%, 同时G0/G1期和G2/M期细胞也分别减少至10%左右[7]。在本研究中,流式细胞仪检测结果显示Bel-7402细胞未经药物处理时, 细胞周期各时相的细胞呈典型性分布, 即G0/G1期细胞占55.4%, S期细胞占34.2%, G2/M期细胞占10.4%; 1.87 µmol·L-1MMC连续处理Bel-7402细胞, 6 h后S期细胞数量已有所增加, 12 h后S期细胞所占比例超过60%, 24 h后S期细胞所占比率达到87.9%, 具体结果见图 2。由此可见, MMC单剂给药时主要将细胞阻断在S期。由于MMC或MF13单独[7]给药时的细胞阻断作用都在24 h达到最大值, 因此本研究选用24 h这一时间点来考查不同剂量的MF13与MMC联合给药对细胞周期的影响。
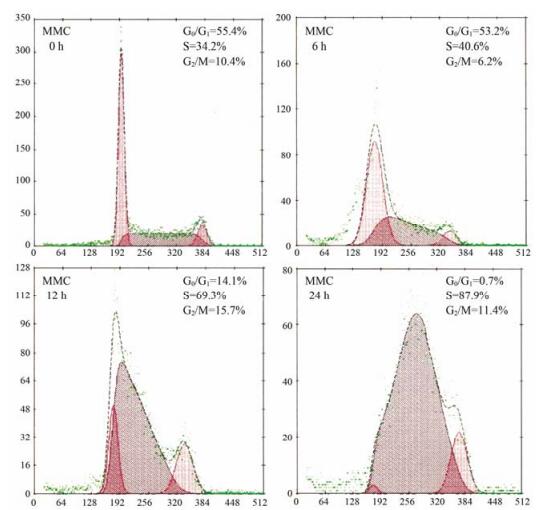
|
Figure 2 Blockade of cell cycle in Bel-7402 cells treated with mitomycin C (MMC). Cell cycle analysis was done by flow cytometry at 0, 6, 12 and 24 h after MMC treatment (1.87 µmol·L-1). The major blockade was found in the S-phase |
流式细胞仪检测结果显示, 3.36×10-5 µmol·L-1VCR单独连续处理Bel-7402细胞, 6 h后G2/M期细胞数量已增加到31.8%, 12 h后G2/M期细胞所占比例为60.2%, 24 h后G2/M期细胞所占比率达到76.0%, 具体结果见图 3, 由此可见, VCR主要将细胞阻断在G2/M期。MMC和VCR对细胞周期的影响不同, 这正是本研究选用这两个药物用以考查不同细胞周期作用时相的药物与MF13联用的效果的原因。虽然VCR单独给药时的细胞阻断作用也在24 h达到最大值, 但由于VCR连续作用24 h将有超过10%的凋亡细胞出现(数据未列出), 为了使对细胞周期时相分布的分析数据更准确, 选用12 h这一时间点考查不同剂量的MF13与VCR联合用药对细胞周期的影响。

|
Figure 3 Blockade of cell cycle in Bel-7402 cells treated with vincristine (VCR). Cell cycle analysis was done by flow cytometry at 0, 6, 12 and 24 h after VCR treatment (3.36×10-5 µmol·L-1). The major blockade was found in the G2/M-phase |
因考虑到若采用较高的剂量, 单独用药组S期细胞或G2/M所占比率便已达到很高的值, 则不易观察到联合用药组对周期阻断作用增强的现象, 所以本实验选用了较小剂量。流式细胞仪检测结果显示, 2.21 µmol·L-1 MF13作用24 h后S期细胞所占比率为48.3%, 0.94 µmol·L-1 MMC作用后S期细胞所占比率为38.4%, 2.21 µmol·L-1 MF13 + 0.94 µmol·L-1 MMC作用后S期细胞所占比率为60.5%, 具体结果见图 4。由此可见, MF13与MMC联合给药组对S期的阻断作用要强于单独给药组。
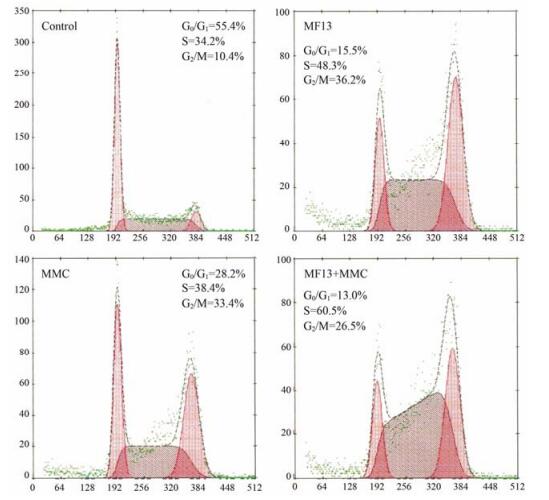
|
Figure 4 Blockade of cell cycle in Bel-7402 cells treated with MF13 or MMC alone, or MF13 in a combination with MMC. MF13 was at 2.21 µmol·L-1 and MMC at 0.94 µmol·L-1. Cell cycle analysis was done by flow cytometry at 24 h after treatment. As compared to the treatment with MF13 or MMC alone, S-phase blockade increased in combination chemotherapy |
流式细胞仪检测结果显示2.21 µmol·L-1 MF13作用12 h后S期和G2/M期细胞所占比率分别为44.5%和13.4%, 1.68×10-5 µmol·L-1 VCR作用12 h后S期和G2/M期细胞所占比率分别为37.0%和57.8%, 2.21 µmol·L-1 MF13 + 1.68×10-5 µmol·L-1 VCR作用后, S期细胞所占比率为43.2%, G2/M期细胞所占比率为52.6%, 说明联合用药组中的MF13和VCR各自阻断肿瘤细胞, 分别进入它们作用的敏感时相S期和G2/M期, 具体结果见图 5。

|
Figure 5 Blockade of cell cycle in Bel-7402 cells treated with MF13 or VCR alone, or MF13 in a combination with VCR. MF13 was at 2.21 µmol·L-1 and VCR at 1.68×10-5µmol·L-1. Cell cycle analysis was done by flow cytometry at 12 h after treatment. The major blockade was found in the S-phase by MF13 or in the G2/M-phase by VCR. Double blockade of S-phase and G2/M-phase was found when cells were treated with combination chemotherapy |
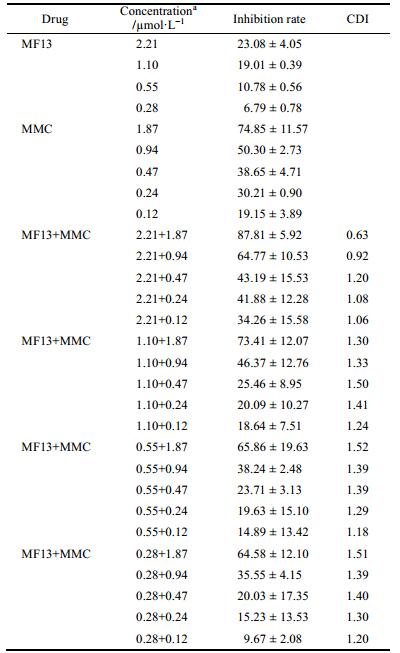
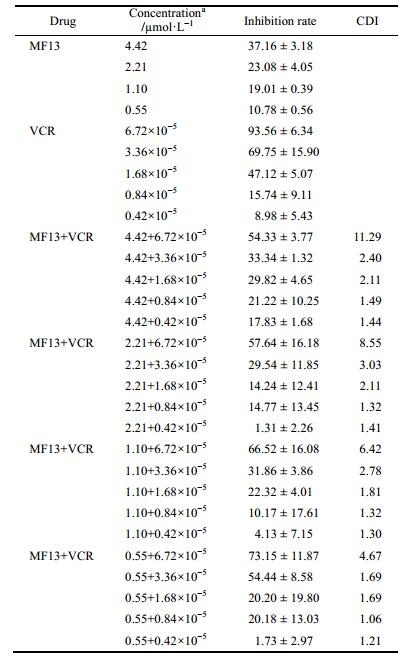
在联合化疗的体内外实验中, 本研究选用其他抗肿瘤药物与MF13同时给药的治疗方案。以两药相互作用指数CDI衡量两药是否有协同作用, 认为当CDI < 1时, 两药有协同作用, 当CDI < 0.7时, 协同作用非常显著[11-13]。MF13、MMC、VCR单独使用及MF13分别与MMC、VCR联合应用时对Bel-7402细胞系的抗增殖活性检测结果如表 1和2所示。由表 1数据可见2.21 µmol·L-1 MF13与1.87 µmol·L-1或0.94 µmol·L-1 MMC联合应用时有协同作用, 且2.21 µmol·L-1 MF13与1.87 µmol·L-1 MMC联用时协同作用显著, 而MF13与MMC在其他浓度联用时无协同作用。由表 2数据可见, MF13与VCR联用时无协同作用。
| Table 1 Cytotoxicity of MF13 combined with MMC on Bel-7402 cells. After seeding, cells were treated with MF13 in a combination with MMC. After 72 h, cell viability was detected by MTT assay. Data are the mean ± SD from at least three independent observations. aµg·mL-1 concentration of MMC can be calculated by multiplying 334.3. CDI, coefficient of drug interaction |
| Table 2 Cytotoxicity of MF13 combined with VCR on Bel-7402 cells. After seeding, cells were treated with MF13 in a combi nation with VCR. After 72 h, cell viability was detected by MTT assay. Data are the mean ± SD from at least three inde pendent observations. aµg·mL-1 concentration of VCR can be calculated by multiplying 923.04 |
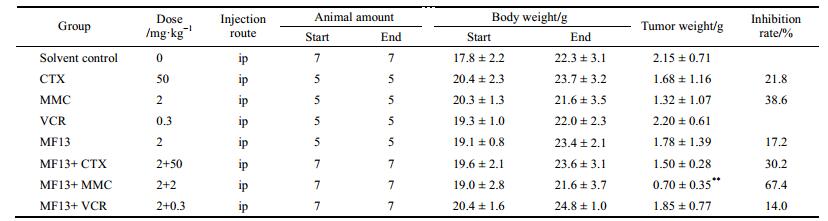
在裸鼠接种瘤块第35天, 溶剂对照组平均瘤体积为2 041 mm3时, 2 mg·kg-1 MF13治疗组、50 mg·kg-1 CTX治疗组、2 mg·kg-1 MMC治疗组和0.3 mg·kg-1 VCR治疗组的瘤体积分别为1 855.78、1 797.19、1 293.63和1 998.38 mm3, 对肿瘤生长的抑制率分别为9.1%、12.3%、38.7%和2.3%, 与对照组的瘤体积比较, 各治疗组均无显著的差异性(P > 0.05); 2 mg·kg-1 MF13 + 50 mg·kg-1 CTX治疗组的瘤体积为1 128.59 mm3, 对肿瘤生长的抑制率为47.3%, 与对照组比较有显著的差异性(P < 0.05); 2 mg·kg-1 MF13 + 2 mg·kg-1 MMC治疗组的瘤体积为766.15 mm3, 对肿瘤生长的抑制率为65.8%, 与对照组比较有非常显著的差异性(P < 0.01), 2 mg·kg-1 MF13 + 0.3 mg·kg-1 VCR治疗组的瘤体积为1 844.50 mm3, 对肿瘤生长的抑制率为9.9%, 与对照组比较没有显著的差异性(P > 0.05)。实验过程中各组动物的瘤体积变化见图 6 (因为VCR两治疗组与对照组比较没有统计学意义, 所以图中未显示VCR两治疗组的数据)。可见MF13联合用药组的治疗效果要优于单独用药组, 2 mg·kg-1 MF13与2 mg·kg-1 MMC (CDI为0.65) 或50 mg·kg-1 CTX联合使用时协同作用显著(CDI为0.69), 而与0.3 mg·kg-1 VCR联合使用时无协同作用(CDI = 1.02)。动物的体重和瘤重等数据见表 3。本研究所用的VCR的剂量(0.3 mg·kg-1, ip)已接近其毒性剂量[16], 却未能显示很好的疗效可能与用药间隔时间长有关(VCR多数采用每天或每3天给药的方式)。
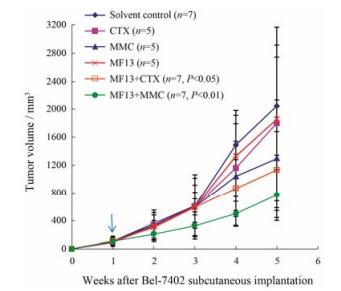
|
Figure 6 Growth inhibition of Bel-7402 tumor by MF13 and its combination with other anti-cancer drugs in nude mice. Tumor tissue (4 mm3) was subcutaneously implanted on the right backs of the nude mice. Severn days later, the mice with visible tumor mass at the average volume of 100 mm3, were randomly distrib uted into cages with 5 or 7 mice per group. Treatments (MF13 was initiated with 4 mg·kg-1, ip; VCR 0.3 mg·kg-1, ip; MMC 2 mg·kg-1, ip; CTX 50 mg·kg-1, ip) were started on day 7, and continued with other 4 ip injections at 7-day intervals at the same dose, with exception of MF13 which was continued at 2 mg·kg-1. The tumor volume was measured every week and the experiments were terminated when the average tumor size of the solvent control group was over 2 000 mm3. Each point represents the mean of the tumor volume and the SD error bars. Statistics was done between treatment groups and the solvent group |
| Table 3 Therapeutic efficacy of MF13 combined with other anticancer drugs in Bel-7402 human hepatoma bearing nude mice |
大多数转移性癌症的5年生存率仍然相当低, 开发新的抗癌药物既价格昂贵又非常耗时[6]。因此, 以提高疗效和减轻经济负担为目标的方法被认为是一种可行的新策略, 其中的方法之一就是联合用药[6]。由于联合用药时, 使用的药物之一已被FDA批准, 这样使得治疗的总体成本降低, 弥补“医疗不足”的缺陷[6]。
氮芥类烷化剂是临床上使用的一类重要的抗肿瘤药物。早期的氮芥类烷化剂选择性差、治疗指数低, 并有潜在的致癌危险, 因此在应用上有所限制。由于肿瘤细胞进行蛋白质合成时需要大量的氨基酸, 以氨基酸或小分子肽做载体可提高药物对肿瘤细胞的靶向性, 又由于小分子肽易合成, 便于确定对靶器官或肿瘤细胞的靶向作用, 因此研究以肽为载体的抗肿瘤药物是一种可行的方案[17, 18]。蒋建东研究组曾设计了各种不同三肽载体, 在上述理论基础上, 还主要考虑了以下几个可能性[8, 9]: ① 所选连接肽通过蛋白间的相互作用, 可克服多药耐药性, 从而增加肿瘤细胞对药物的敏感性; ② 所选连接肽能靶向关键的生物大分子(如癌基因和酶等), 可提高药物治疗的针对性; ③ 所选连接肽可与DNA分子的小沟结合, 进一步增强药物与DNA的结合能力, 增加药物的细胞毒作用。在大量以不同三肽为载体的m-SL新衍生物中, MF13是一个具有高抗癌活性的化合物。以往的研究表明, MF13分子中的三肽能将药物很好地靶向肿瘤组织, 用正缬氨酸代替缬氨酸, 使药物的疏水性增加, 可降低体内的酶对药物的降解作用, 从而使MF13具有毒性小和化学稳定等优势[8]。
MF13单药给药在体外对所测定的7株不同来源的人肝癌细胞系均有较强的抗增殖活性, IC50值在0.32~2.32 µmol·L-1之间, IC90值在3.84~29.20 µmol·L-1之间[7-9]。MF13可引起肝癌细胞选择性凋亡[7-9], MF13通过磷酸化pRb蛋白将肝癌细胞阻断在S期; MF13虽未诱导Bcl-2发生磷酸化, 也未影响Bcl-2的蛋白表达量, 但MF13使Bax的蛋白表达量上调, Bcl-2/Bax的比例下降, 使细胞趋向凋亡[7-9]。此外, 研究表明MF13既能活化上游的caspase-8和caspase-9, 又能活化下游的caspase-3, 使DFF45由45 kDa的完整分子降解为31 kDa的片段。说明MF13诱导的凋亡信号传导通路启动了caspase-3途径[7-9]。
MF13在动物体内也同样显示了较强的抗肝癌作用, 并且疗效与剂量呈正相关[7-9]。10 mg·kg-1 MF13 (17.67 µmol·L-1·kg-1)对BALB/c裸鼠异种移植人肝癌Bel-7402和HepG2实体瘤的抑瘤率分别为83% (P < 0.01) 和94% (P < 0.001), MF13对肝癌治疗效果优于MMC (2 mg·kg-1 = 5.98 µmol·L-1·kg-1)及前体化合物m-SL (MF13 5 mg·kg-1 = m-SL 2.7 mg·kg-1 = 8.8 µmol·L-1·kg-1), 而与CTX (100 mg·kg-1 = 383 µmol·L-1·kg-1)相当[7-9]。体内作用机制的研究结果显示, MF13不仅能抑制肝癌细胞生长, 而且通过诱导细胞凋亡而发挥抗肝癌作用, 与体外实验结果一致。以前的MF13单药给药的研究结果提示MF13是一个有潜在应用前景的抗肝癌化合物, 而它与其他药物联合使用时的疗效如何有待进一步深入研究。
将细胞周期作用时相不同、作用机制不同或药物毒性不相互重叠的药物合理的联合使用时, 有可能达到既增效又减毒, 或减毒而不减效, 或增效而不增毒的目的。为了研究MF13与其他药物联合应用的效果, 本研究选用的药物有同为氮芥类烷化剂的CTX、抗生素类烷化剂MMC、植物来源的G2/M期特异性抗肿瘤药VCR。在体外细胞实验中没有考证CTX单药给药或联合给药的作用, 是CTX本身不具备细胞毒活性, 进入体内后先在肝脏中经肝微粒体功能氧化酶转化成醛磷酰胺。而醛酰胺不稳定, 在肿瘤细胞内分解成酰胺氮芥及丙烯醛, 酰胺氮芥对肿瘤细胞有细胞毒作用。但在动物体内实验中, 考查了CTX的抗肝癌作用。由于联合化疗时, 不仅药物的剂量和给药方法会影响疗效, 而且药物的给药顺序和给药方案也会产生重要的影响, 因此在本研究的联合化疗中, 统一采用两药同时给药的方式进行深入研究。
烷化剂通常被认为是周期非特异性药物, 因多核苷酸最易受到烷化, 所以烷化剂对处于G1期后期及S期的细胞的作用最为明显, 并能影响S期向G2期过渡[19]。流式细胞仪检测结果显示, MF13或MMC单药给药时将细胞主要阻断在G1/S期, 二者联用时对S期的阻断作用进一步增强, 可能是这种烷化作用的一种体现, 两药联用时使DNA损伤的强度增强, 发挥对S期细胞的集中抑制。体内外肿瘤抑制实验结果一致显示, MF13与MMC或CTX (因为CTX是前药, 所以没有进行体外实验)联合使用时有协同的抗肝癌疗效, 提示了对S期有阻断作用的药物与MF13联用时可能均有协同作用。流式细胞仪检测结果还表明, MF13与VCR联用对细胞周期双阻断, 体内外实验结果一致表明MF13与VCR联用时没有协同作用。与之相似, S期敏感药物5-氟尿嘧啶[20]或顺铂[21]与G2/M期抑制剂紫杉醇联用时疗效降低, 而且疗效降低与5-氟尿嘧啶或顺铂可抑制紫杉醇所诱导的G2/M期阻滞和细胞凋亡有关。虽然同时给药MF13与VCR联合化疗不产生协同作用, 但不排除序贯给药时联合化疗疗效可能增加的可能性。若选用12~24 h之间的某一时间点, 在此之前先给VCR, 此后再给MF13, 那么在VCR有效浓度降低时, 大量的未被杀伤的堆积在G2/M期细胞几乎可同步化地进入S期而被MF13杀伤。类似实验显示先给长春碱, 16 h后再给阿糖胞苷, 可出现明显的增效效果; 而同时给药则疗效降低; 先给长春碱6、8和24 h后再给阿糖胞苷, 增效的程度也都不及16 h后再给药[22]。这些研究结果均说明了联合化疗时, 给药顺序是一个重要的考虑内容。
值得一提的是, 来源于中国肝癌患者的Bel-7402细胞, 对临床化疗一线药物多柔比星具有先天耐药性[20, 23], 然而体内外研究一致显示, 它对MF13有较强的敏感性, 并且MF13与MMC或CTX联合使用时, 对Bel-7402实体瘤的疗效增加, 预示了MF13有联合用药的临床应用价值。本研究结果表明, 无论单药给药还是联合化疗, MF13都显示了潜在的抗肝癌应用前景, 其联合化疗的作用机制正进行深入研究。
| [1] | Faloppi L, Scartozzi M, Maccaroni E, et al. Evolving strategies for the treatment of hepatocellular carcinoma: from clinical-guided to molecularly-tailored therapeutic options[J]. Cancer Treat Rev, 2011, 37: 169–177. DOI:10.1016/j.ctrv.2010.08.001 |
| [2] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI:10.3322/caac.21338 |
| [3] | Hu QY, Jiang JD. New molecular targets for human hepato cellular carcinoma treatment and related drugs[J]. Chin Pharmacol Bull (中国药理学通报), 2005, 21: 2–6. |
| [4] | Liu L, Zheng YH, Han L, et al. Efficacy and safety of the oxaliplatin-based chemotherapy in the treatment of advanced primary hepatocellular carcinoma: a meta-analysis of prospec tive studies[J]. Medicine (Baltimore), 2016, 95: e4993. DOI:10.1097/MD.0000000000004993 |
| [5] | Chan SL, Yeo W. Development of systemic therapy for hepatocellular carcinoma at 2013: updates and insights[J]. World J Gastroenterol, 2014, 20: 3135–3145. DOI:10.3748/wjg.v20.i12.3135 |
| [6] | Mokhtari RB, Homayouni TS, Baluch N, et al. Combination therapy in combating cancer[J]. Oncotarget, 2017. DOI:10.18632/oncotarget.16723 |
| [7] | Hu QY, Li JN, Song DQ, et al. Inhibition of human hepato cellular carcinoma by L-proline-m-bis (2-chloroethyl) amino-L-phenylalanyl-L-norvaline ethyl ester hydrochloride (MF13) in vitro and in vivo[J]. Int J Oncol, 2004, 25: 1289–1296. |
| [8] | Jiang JD, Zhang H, Li JN, et al. High anticancer efficacy of L-proline-m-bis (2-chloroethyl) amino-L-phenylalanyl-L-norvaline ethyl ester hydrochloride (MF13) in vivo[J]. Anticancer Res, 2001, 21: 1681–1689. |
| [9] | Roboz J, Jiang J, Holland JF, et al. Selective tumor apoptosis by MF13, L-prolyl-L-m-[bis(chloroethyl)amino]-phenylalanyl-L-norvaline ethyl ester, a new sarcolysin containing tripeptide[J]. Cancer Res, 1997, 57: 4795–4802. |
| [10] | Rubinstein LV, Shoemaker RH, Paull KD, et al. Comparison of in vitro anticancer-drug-screening data generated with a tetrazolium assay versus a protein assay against a diverse panel of human tumor cell lines[J]. J Natl Cancer Inst, 1990, 82: 1113–1118. DOI:10.1093/jnci/82.13.1113 |
| [11] | Guo J, Reidenberg MM. Inhibition of 11beta-hydroxysteroid dehydrogenase by bioflavonoids and their interaction with furosemide and gossypol[J]. J Lab Clin Med, 1998, 132: 32–38. DOI:10.1016/S0022-2143(98)90022-1 |
| [12] | Hao JQ, Li Q, Xu SP, et al. Effect of lumiracoxib on prolif eration and apoptosis of human nonsmall cell lung cancer cells in vitro[J]. Chin Med J (Engl), 2008, 121: 602–607. |
| [13] | Zhao Y, Gao JL, Ji JW, et al. Cytotoxicity enhancement in MDA-MB-231 cells by the combination treatment of tetrahy dropalmatine and berberine derived from Corydalis yanhusuo W[J]. J Intercult Ethnopharmacol, 2014, 3: 68–72. DOI:10.5455/jice. |
| [14] | Dolan ME, Fleig MJ, Feuerstein BG, et al. Effect of 1, 19-bis(ethylamino)-5, 10, 15-triazanonadecane on human tumor xenografts[J]. Cancer Res, 1994, 54: 4698–4702. |
| [15] | Yagi MJ, Bekesi JG. Evaluation of p-F-Phe-m-bis-(2-chloroethyl)amino-L-Phe-Met-ethoxy HCl against transplantable and spontaneous murine neoplasia[J]. Cancer Chemother Pharmacol, 1990, 26: 215–220. DOI:10.1007/BF02897202 |
| [16] | Ogawa T, Mimura Y, Isowa K, et al. An antimicrotubule agent, TZT-1027, does not induce neuropathologic alterations which are detected after administration of vincristine or pacli taxel in animal models[J]. Toxicol Lett, 2001, 121: 97–106. DOI:10.1016/S0378-4274(01)00327-7 |
| [17] | Barinaga M. Peptide-guided cancer drugs show promise in mice[J]. Science, 1998, 279: 323–324. DOI:10.1126/science.279.5349.323 |
| [18] | Unger C. Current concepts of treatment in medical oncology: new anticancer drugs[J]. J Cancer Res Clin Oncol, 1996, 122: 189–198. DOI:10.1007/BF01209645 |
| [19] | Judson PL, Watson JM, Gehrig PA, et al. Cisplatin inhibits paclitaxel-induced apoptosis in cisplatin-resistant ovarian cancer cell lines: possible explanation for failure of combination therapy[J]. Cancer Res, 1999, 59: 2425–2432. |
| [20] | Huang M, Liu G. The study of innate drug resistance of human hepatocellular carcinoma Bel-7402 cell line[J]. Cancer Lett, 1999, 135: 97–105. |
| [21] | Smyth MJ, Krasovskis E, Sutton VR, et al. The drug efflux protein, P-glycoprotein, additionally protects drug-resistant tumor cells from multiple forms of caspase-dependent apoptosis[J]. Proc Natl Acad Sci U S A, 1998, 95: 7024–7029. DOI:10.1073/pnas.95.12.7024 |
| [22] | Zhang Xunmu. Pharmacology and Clinical Application of Antitumor Drugs (抗肿瘤药物的药理与临床应用)[M]. Zhengzhou: Henan Medical University Press, 1999: 36-40. |
| [23] | Cheng RM, Zhu DH, Ye XZ, et al. Establishment and some biological characteristics of human hepatocellular cell line Bel-7402[J]. Acta Biol Exp Sin (实验生物学报), 1978, 11: 37–45. |
 2017, Vol. 52
2017, Vol. 52