2. 江苏省产业技术研究院医药生物技术研究所, 江苏 南京 210023
2. Institute of Pharmaceutical Biotechnology, Jiangsu Industrial Technology Research Institute, Nanjing 210023, China
膜联蛋白(annexins)是一类钙依赖的磷脂结合蛋白超家族, 在结构上具有高度同源性, 由保守C-端中心结构域和承担独特功能的N-端结构域构成, 中心结构域延伸为C-末端结构, 由4组(annexin A6为8组)、每组约70个氨基酸残基组成的重复序列构成。膜联蛋白存在于大多数真核生物物种中, 是能够钙依赖性结合磷脂的胞质蛋白, 以钙依赖的方式结合带负电荷的磷脂几乎是所有膜联蛋白的共同特点[1-3]。它们的保守性和丰度表明其在体内具有重要的功能。
在不同的物种中已经发现了超过100种膜联蛋白。脊椎动物的12个膜联蛋白被归为膜联蛋白A家族, 并从annexin A1到annexin A13分别命名(简称A1~A13, A12未赋名)。除脊椎动物外的其他膜联蛋白被分为B家族(无脊椎动物)、C家族(真菌和一些单细胞真核生物群)、D家族(植物)和E家族(原生生物)。人annexin家族包括12个成员, 其中annexin A5 (以下称A5) 是annexin家族中分布最广、功能最特殊的蛋白, 参与很多生理活动, 在细胞凋亡和抗凝血等方面有重要的应用前景。科学家们已经证明标记或修饰后的A5可通过不同的成像技术进行凋亡显像而被广泛用于细胞凋亡检测, 如应用于化疗或同种异体移植监测[4-15]。A5与活化血小板的亲和活性使之有可能在全身造影术中用于血栓定位, 甚至开发成能溶解可见及不可见血栓的靶向溶栓药。A5功能异常造成的显著病理变化正引起越来越多的重视, 基于A5的一批新药已处于从实验室到临床Ⅱ期的各研发阶段[16]。
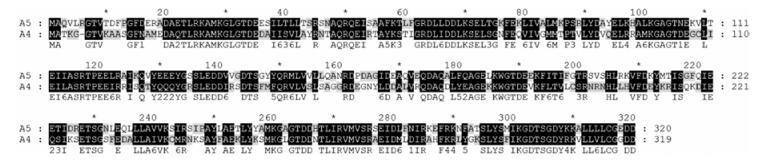
依据NCBI中提供的annexin家族成员的蛋白质序列, 利用Clustal X2软件对A5与annexin其他家族成员进行多重序列比对[17] (图 1), 发现annexin A4 (以下称A4) 与A5的同源性最高, 其氨基酸长度和构成与A5相似性很高(图 2)。因此与A5相比, A4很可能同样具有良好的应用开发前景。A4, 也称为脂皮质素Ⅳ、内毒素Ⅰ或碳水化合物结合蛋白P33/P41, 同样是膜联蛋白家族的重要成员之一。相较A5, A4的功能研究较少。A4拥有4个annexin重复序列, 这些重复序列位于1个高度对称、平滑对立的凹凸面阵列中, 每个重复序列中都包含了1个特异的钙离子结合位点和5个α-螺旋结构。人类A4含有319个氨基酸残基, 分子质量为35.9 kDa[18]。作为一类钙结合蛋白, A4理论上应当同样具有结合磷脂酸的能力, 可参与细胞外分泌和凝血等过程。A4在许多组织中表达, 特别是在肺、肠、胃和肾的分泌上皮细胞质中[19]。Ca2+浓度升高后, A4易位至质膜或核膜。A4在体外结合钙离子后, 可在脂质层上聚集, 这个特性对其功能至关重要。

|
Figure 1 Multiple alignment of amino acid sequences of annexins family |
|
Figure 2 Alignment of amino acid sequences of annexin A4 and annexin A5 |
膜联蛋白的功能直接取决于它们结合磷脂的能力[20]。而目前关于A4大部分研究集中在检测其在真核细胞内过表达对细胞的影响[21, 22]或Ca2+结合位点对蛋白功能的影响[23, 24]等, A4与PS的真实结合强度尚不清楚。为了研究A4与细胞膜上PS的结合及其相关的生物学功能, 本文构建了annexin A4-EGFP (以下简称A4-EGFP)融合蛋白表达载体, 且为了便于其后续纯化, 在融合蛋白的C-末端加入了His-tag。本研究选用并比较了不同纯化方法, 最终获得了大量的高纯度A4蛋白。并以A4与细胞膜上PS的结合能力即以凋亡检测功能为对象, 运用流式细胞仪对A4与凋亡细胞的结合情况进行了结合动力学常数分析, 为后续研究奠定了基础。
材料与方法实验材料 含有EGFP-His-tag基因的改造型质粒pET28a-EH[25]、annexin-A5-EGFP-His和EGFP-His重组蛋白(以下称A5-EGFP和EGFP), 均保存于本实验室。Top10、BL21等菌株保存于本实验室中。Jurkat淋巴瘤细胞和A549细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所, 依托泊苷购自江苏凯基生物技术股份有限公司, 保存于本实验室。
A4 cDNA序列的扩增与克隆构建 由于A4基因上游50 bp处含有Nco I酶切位点, 因此需利用引物对其进行同义突变。根据A4的mRNA序列(XM_011532805.1) 及突变位点设计3条引物(表 1)。引物P2引入同义点突变(下划线处), 引物P3删除终止密码子。
| Table 1 Primers of A4 PCR |
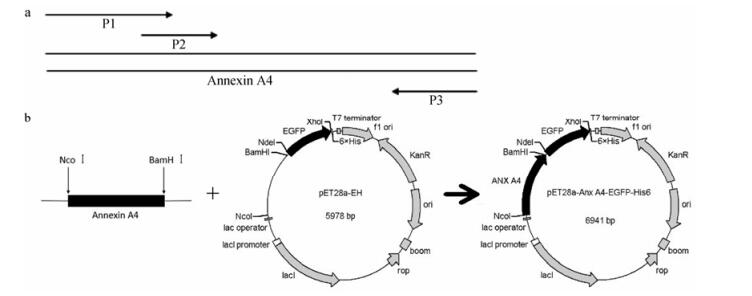
对正常培养的A549细胞进行收集, 使用总RNA提取试剂盒提取细胞的总mRNA, 后用逆转录试剂盒进行逆转录, 最终得到A549 cDNA。利用Pyrobest DNA Polymerase (Takara)进行PCR扩增, 首先通过引物A4-P2与A4-P3从cDNA中扩增出A4的非全长片段A, 然后以片段A为模板, 通过引物A4-P1与A4-P3扩增出全长的A4片段(图 3a)。
|
Figure 3 PCR amplification of A4 cDNA and construction of the expression plasmid. a: PCR amplification of A4 cDNA; b: Construction of the pET28a-A4-EGFP expression plasmid. The plasmid pET28a-EH was constructed by insertion of EGFP and (GS)4 linker encoding sequence into pET28a. The expression plasmid pET28a-A4-EGFP was constructed by insertion of A4 encoding sequence between Nco I and BamH I sites of pET28a-EH |
将全长的A4片段与pET28a-EH质粒经Nco I与BamH I双酶切并纯化后进行连接, A4的C-末端与EGFP的N-末端通过Linker蛋白连接, 设计出表达质粒pET28a-A4-EGFP (图 3b)。重组表达质粒转化Top10感受态菌株, 涂布卡那抗性平板筛选阳性克隆, 菌落PCR鉴定后, 送至南京金斯瑞生物科技有限公司进行测序。
重组A4-EGFP蛋白的表达分析 pET28a质粒和pET28a-A4-EGFP质粒分别转化BL21 (DE3) 感受态细胞, 分别挑取单克隆接种到3 mL LB液体培养基中(包含50 μg·mL-1卡那霉素), 220 r·min-1、37 ℃振荡培养过夜后, 将含有pET28a质粒和pET28a-A4-EGFP质粒的过夜菌按1:50的比例转接到3 mL LB液体培养基中。37 ℃振荡培养至OD600值约为0.6时, 加入异丙基-β-D-硫代半乳糖甘诱导剂(isopropyl-β-D-thiogalactoside, IPTG)至终浓度为1 mmol·L-1, 20 ℃诱导培养5 h。12 000 r·min-1离心1 min, 收集菌体至1.5 mL EP管中。然后, 分别用Hepes-NaCl缓冲液(10 mmol·L-1 Hepes, 140 mmol·L-1 NaCl, pH 7.4) 1 mL洗涤菌体, 再用Hepes-NaCl缓冲液800 μL重悬菌体, 对菌体重悬液进行超声(超声3 s/间隔8 s, 共5 min), 超声结束后, 对pET28a-A4-EGFP质粒的BL21 (DE3) 菌体重悬液12 000 r·min-1离心5 min, 将上清转移到1.5 mL EP管中, 沉淀用Hepes-NaCl缓冲液800 μL重悬保存, 对上述样品进行SDS-PAGE分析。
亲和层析纯化A4-EGFP 将5 mL含有pET28a-A4-EGFP质粒的过夜活化菌转接至500 mL LB液体培养基(含50 μg·mL-1卡那霉素)中, 220 r·min-1、37 ℃振荡培养3.5 h, OD600值达到0.6后, 加入IPTG至终浓度为1 mmol·L-1, 20 ℃诱导培养12 h。收集菌液, 6 000 r·min-1离心15 min, 收集菌体。用Hepes-NaCl缓冲液30 mL重悬菌体, 超声破碎仪超声(超声3 s/间隔8 s, 共1 h)。超声后的菌液4 ℃、12 000 r·min-1离心30 min, 收集上清。
使用NTA-Ni亲和层析进行蛋白纯化, 镍柱使用前先用含20 mmol·L-1咪唑的Hepes-NaCl缓冲液进行平衡。上述样品中补加咪唑至终浓度10 mmol·L-1, 0.22 μm滤膜抽滤过后上样。用含有50 mmol·L-1咪唑的Hepes-NaCl缓冲液清洗未能结合在镍柱的杂蛋白, 含250 mmol·L-1咪唑的Hepes-NaCl缓冲液洗脱目的蛋白, 收集最大吸收峰处的洗脱液。
使用离子交换层析(DEAE柱和SP柱)进一步纯化A4-EGFP。DEAE柱使用前先用10 mmol·L-1 Tris-HCl缓冲液进行平衡。上述上清使用0.22 μm滤膜抽滤过后, 过DEAE柱。用含有50 mmol·L-1 NaCl的Tris-HCl缓冲液洗脱未能结合在DEAE柱的杂蛋白, 含250 mmol·L-1 NaCl的Tris-HCl缓冲液洗脱目的蛋白, 收集最大吸收峰处的洗脱液。将洗脱液稀释5倍后, 加入CaCl2至终浓度3 mmol·L-1, 0.22 μm滤膜抽滤过后, 过SP柱。SP柱使用前先用Buffer B (10 mmol·L-1 Tris-HCl, 20 mmol·L-1 CaCl2)平衡, 直至有游离Ca2+流出。用含有50 mmol·L-1 NaCl、15 mmol·L-1 CaCl2的Tris-HCl缓冲液洗脱未能结合在SP柱的杂蛋白, 含250 mmol·L-1 NaCl的Tris-HCl缓冲液洗脱目的蛋白, 收集最大吸收峰处的洗脱液。用Sephadex G-50作为填料制作分子筛层析柱, 将缓冲液置换为Hepes-NaCl缓冲液。BCA试剂盒测定蛋白浓度, 10% SDS-PAGE检测蛋白纯度。
膜吸附纯化A4-EGFP 将5 mL含有pET28a-A4-EGFP质粒的过夜活化菌转接至500 mL LB液体培养基(含50 μg·mL-1卡那霉素)中, 220 r·min-1、37 ℃振荡培养3.5 h, OD600值约为0.6, 加入IPTG至终浓度为1 mmol·L-1, 20 ℃诱导培养12 h。收集菌液, 6 000 r·min-1离心15 min, 收集菌体。用10 mmol·L-1Tris-HCl缓冲液(pH 8.5) 30 mL重悬菌体, 加入CaCl2至终浓度20 mmol·L-1, 超声破碎仪超声(超声3 s/间隔8 s, 共1 h)。超声后的菌液4 ℃, 12 000 r·min-1离心30 min, 收集沉淀。沉淀用Buffer A (10 mmol·L-1 Tris-HCl, 20 mmol·L-1 EDTA) 20 mL重悬, 将溶液在磁力搅拌器上4 ℃搅拌释放30 min, 12 000 r·min-1离心30 min, 收集上清。
使用离子交换层析(DEAE柱和SP柱)进行蛋白纯化, 方法同上。用Sephadex G-50作为填料制作分子筛层析柱, 将缓冲液置换为Hepes-NaCl缓冲液。BCA试剂盒测定蛋白浓度, 10% SDS-PAGE检测蛋白纯度。
A4-EGFP的凋亡检测 Jurkat淋巴瘤细胞用含10%胎牛血清的RPMI-1640培养液, 37 ℃、5% CO2条件下培养, 每1×106细胞用1 mL终浓度25 μmol·L-1依托泊苷的培液诱导14 h后, 1 000 r·min-1离心5 min, 收集细胞。每5×105细胞用400 μL Binding Buffer (10 mmol·L-1 Hepes, 140 mmol·L-1 NaCl, 2.5 mmol·L-1 CaCl2, pH 7.4) 洗涤2次, 400 μL Binding Buffer重悬。加入A4-EGFP, 使蛋白终浓度分别为2、10、50、100、500和1 000 nmol·L-1, 室温下避光孵育30 min。加入PI (50 μg·mL-1) 10 μL, 室温下避光孵育5 min。经PBS缓冲液洗涤2次后, 流式细胞仪检测细胞的荧光强度。含同等浓度梯度的A5-EGFP和EGFP荧光蛋白的细胞作为对照。每组实验重复3次。
数据处理 采用GraphPad 6软件进行分析, 实验数据以x±s表示。
结果 1 表达载体的构建根据NCBI中人源A4的cDNA序列设计引物, 以A549的cDNA为模板, 通过PCR扩增出了963 bp的A4全长序列, 经过NcoⅠ和BamHⅠ双酶切连接插入载体pET28a-EH的NcoⅠ和BamHⅠ位点之间, 构建了C-末端带有His-tag的A4-EGFP融合蛋白表达质粒(图 3)。菌落PCR鉴定及测序验证重组质粒中A4-EGFP的序列正确后, 转化大肠杆菌表达菌株BL21 (DE3)。
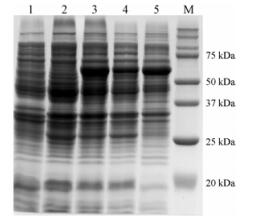
2 A4-EGFP的纯化将构建成功的重组质粒pET28a-A4-EGFP转化BL21 (DE3) 后经IPTG诱导, 通过SDS-PAGE分析发现在65 kDa左右有目的蛋白表达, 与融合蛋白的理论分子质量一致, 目的蛋白表达量占菌体总蛋白的40%, 占可溶性蛋白比例达45%, 而空载质粒与未诱导的重组质粒在相应的分子质量未出现明显蛋白质条带(图 4)。
|
Figure 4 SDS-PAGE analysis of A4-EGFP expression. Lane 1: Total crude protein of bacteria containing pET28a vector, IPTG induction; Lane 2: Total crude protein of bacteria containing pET28a-A4-EGFP, no induction; Lane 3: Total crude protein of bacteria containing pET28a-A4-EGFP, IPTG induction; Lane 4: Supernatant of lysate of bacteria containing pET28a-A4-EGFP, IPTG induction; Lane 5: Pellet of lysate of bacteria containing pET28a-A4-EGFP, IPTG induction; M: Protein markers |
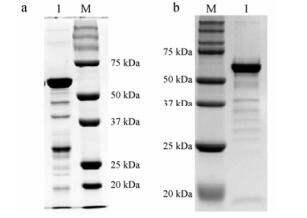
A4-EGFP融合蛋白成功表达后, 为了便于蛋白质纯化, 首先借助于其C-末端的His-tag, 选用Ni亲和层析纯化A4-EGFP, 再经两步离子交换层析纯化后, 最终纯化产率为47.1 mg·L-1, 纯度为80% (图 5a)。鉴于亲和层析成本较高、目的蛋白损失较多且纯度不理想, 本研究又依据膜联蛋白可钙依赖性结合磷脂膜的特性, 设计了另一种纯化方法, 借助细菌细胞膜为吸附介质, 使A4-EGFP特异性吸附于细胞膜上, 同样再经两步离子交换层析纯化目的蛋白(图 5b), 最终纯度达90%, 产率为75.2 mg·L-1。与Ni亲和层析纯化相比, 膜吸附纯化法成功提高了A4-EGFP的纯度与得率。
|
Figure 5 Analysis of recombinant A4-EGFP purified by different methods. a: SDS-PAGE analysis of recombinant A4-EGFP purified by Ni affinity chromatography; b: SDS-PAGE analysis of recombinant A4-EGFP purified by membrane adsorption purification |
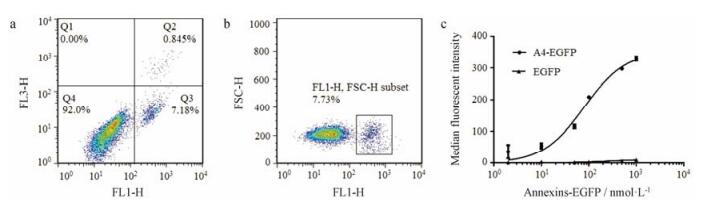
将纯化得到的A4-EGFP利用流式细胞术观察其与凋亡细胞的结合情况。设置不同的浓度梯度, 对细胞进行分群, 圈选A4-EGFP标记的早期凋亡细胞群(图 6a, b)。对A4-EGFP标记的早期凋亡细胞表面的平均荧光强度进行分析, 发现与EGFP对照组相比, A4-EGFP融合蛋白标记的细胞平均荧光强度有明显的增加, 且平均荧光强度随着A4-EGFP浓度的增加而增加, 说明纯化得到的A4-EGFP可与细胞膜上PS发生特异结合, 能够有效标记凋亡细胞(图 6c)。
|
Figure 6 Evaluation of apoptotic detection ability of A4-EGFP by flow cytometry. a: Diagrammatic dot-plot of apoptotic cells labeled with A4-EGFP; b: Diagrammatic dot-plot of flow cytometric measurement of apoptotic cells; c: Analysis of median fluorescence intensity of A4-EGFP binding to apoptotic cells |
同时设置了同等浓度梯度的A5-EGFP进行流式检测, 并对A4-EGFP和A5-EGFP与细胞膜上PS亲和力加以定量分析。最终得出A4-EGFP与PS的亲和力为79.58 ± 11.68 nmol·L-1, 同样得到A5-EGFP与PS的亲和力为33.45 ± 2.15 nmol·L-1。虽然A4-EGFP与PS的亲和力稍低于A5-EGFP, 但同属纳摩尔级, 且属于同一个数量级, 说明A4-EGFP同样可用于凋亡检测。
讨论研究发现PS与许多疾病相关, 如高密度脂蛋白(high-density lipoprotein, HDL)中的PS与动脉粥样硬化心血管疾病紧密相关, 对HDL的多种功能有重要影响[26], 且PS暴露可促进败血症中的促凝活性[27], 因此膜联蛋白依赖于其结合PS的功能, 具有良好的药物开发前景。A4是膜联蛋白家族的重要成员之一, 含有4个膜联蛋白重复结构域, 每个结构域上有一个钙结合位点, 使A4可以钙依赖的方式与磷脂相互作用。A4在体内的广泛分布及其高度保守性证明它在体内具有重要的生理功能。由于膜联蛋白的功能与其结合磷脂双层的能力紧密相关, 而针对A4结合PS的体外研究还较少, 并且目前已有的A4大多是从动物组织中分离提纯, 这种方法可得到纯度较高的蛋白, 但得率很低, 且方法比较繁琐, 阻碍了A4的结构与功能研究。因此, 获得大量高纯度的A4是开展A4功能研究的基础。
为了评价A4与细胞膜上PS的结合能力, 本研究构建了A4-EGFP融合蛋白表达质粒, 在融合蛋白的C-末端加入His-tag以便后期纯化。经过IPTG诱导, 成功实现了A4-EGFP在大肠杆菌中的高水平表达, 表达总量占菌体蛋白的40%左右, 并且可溶性表达比例较高。在A4-EGFP成功表达后, 选用不同的纯化方法, 对A4-EGFP的纯化进行了探讨。首先依据A4-EGFP融合蛋白C-末端的His-tag, 选用Ni亲和层析进行A4-EGFP的纯化, 得到了纯度为80%的蛋白。后续又充分结合A4可在Ca2+存在条件下与磷脂膜可逆结合的特性, 选用膜吸附的纯化方法, 借助细菌细胞膜为吸附介质, 使蛋白吸附在质膜上, 提高目的蛋白的纯度至90%, 实现了高纯度A4-EGFP的分离纯化。利用纯化得到的A4-EGFP进行凋亡检测, 结果显示A4-EGFP可以有效标记早期凋亡细胞, 证明所纯化的A4-EGFP具有与PS结合的生物活性和功能, 且其与PS的亲和力达79.58 ± 11.68 nmol·L-1, 与A5-EGFP和PS的亲和力同属一个数量级, 表明其可有效进行细胞凋亡检测。
本文成功实现了A4-EGFP在原核体系中的可溶性高效表达, 提供了大量的高纯度A4-EGFP蛋白, 研究了其与凋亡细胞表面PS结合的性能, 为进一步研究A4的功能与潜在应用奠定了基础。
| [1] | Gerke V, Creutz CE, Moss SE. Annexins: linking Ca2+ signalling to membrane dynamics[J]. Nat Rev Mol Cell Biol, 2005, 6: 449–461. |
| [2] | Monastyrskaya K, Babiychuk EB, Draeger A. The annexins: spatial and temporal coordination of signaling events during cellular stress[J]. Cell Mol Life Sci, 2009, 66: 2623–2642. DOI:10.1007/s00018-009-0027-1 |
| [3] | Rescher U, Gerke V. Annexins--unique membrane binding proteins with diverse functions[J]. J Cell Sci, 2004, 117: 2631–2639. DOI:10.1242/jcs.01245 |
| [4] | Kietselaer BL, Reutelingsperger CP, Heidendal GA, et al. Noninvasive detection of plaque instability with use of radio labeled annexin A5 in patients with carotid-artery atheroscle rosis[J]. N Engl J Med, 2004, 350: 1472–1473. |
| [5] | Kartachova M, Haas RL, Olmos RA, et al. In vivo imaging of apoptosis by 99mTc-Annexin V scintigraphy: visual analysis in relation to treatment response[J]. Radiother Oncol, 2004, 72: 333–339. DOI:10.1016/j.radonc.2004.07.008 |
| [6] | Kratz H, Haeckel A, Michel R, et al. Straightforward thiol-mediated protein labelling with DTPA: synthesis of a highly active 111In-annexin A5-DTPA tracer[J]. EJNMMI Res, 2012, 2: 17. DOI:10.1186/2191-219X-2-17 |
| [7] | Yagle KJ, Eary JF, Tait JF, et al. Evaluation of 18F-annexin V as a PET imaging agent in an animal model of apoptosis[J]. J Nucl Med, 2005, 46: 658–666. |
| [8] | Dumont EA, Hofstra L, van Heerde WL, et al. Cardiomyocyte death induced by myocardial ischemia and reperfusion -meas urement with recombinant human annexin-V in a mouse model[J]. Circulation, 2000, 102: 1564–1568. DOI:10.1161/01.CIR.102.13.1564 |
| [9] | Schellenberger EA, Bogdanov A Jr, Petrovsky A, et al. Optical imaging of apoptosis as a biomarker of tumor response to chemotherapy[J]. Neoplasia, 2003, 5: 187–192. DOI:10.1016/S1476-5586(03)80050-7 |
| [10] | Petrovsky A, Schellenberger E, Josephson L, et al. Near-infrared fluorescent imaging of tumor apoptosis[J]. Cancer Res, 2003, 63: 1936–1942. |
| [11] | Prinzen L, Miserus RJ, Dirksen A, et al. Optical and magnetic resonance imaging of cell death and platelet activation using annexin A5-functionalized quantum dots[J]. Nano Lett, 2007, 7: 93–100. DOI:10.1021/nl062226r |
| [12] | van Tilborg GA, Vucic E, Strijkers GJ, et al. Annexin A5-functionalized bimodal nanoparticles for MRI and fluorescence imaging of atherosclerotic plaques[J]. Bioconjug Chem, 2010, 21: 1794–1803. DOI:10.1021/bc100091q |
| [13] | Sosnovik DE, Schellenberger EA, Nahrendorf M, et al. Magnetic resonance imaging of cardiomyocyte apoptosis with a novel magneto-optical nanoparticle[J]. Magn Reson Med, 2005, 54: 718–724. DOI:10.1002/(ISSN)1522-2594 |
| [14] | Schellenberger EA, Sosnovik D, Weissleder R, et al. Magneto/optical annexin V, a multimodal protein[J]. Bioconjug Chem, 2004, 15: 1062–1067. DOI:10.1021/bc049905i |
| [15] | Schellenberger EA, Bogdanov A Jr, Högemann D, et al. Annexin V-CLIO: a nanoparticle for detecting apoptosis by MRI[J]. Mol Imaging, 2002, 1: 102–107. DOI:10.1162/153535002320162769 |
| [16] | Gerke V, Moss SE. Annexins: from structure to function[J]. Physiol Rev, 2002, 82: 331–371. DOI:10.1152/physrev.00030.2001 |
| [17] | Tu D, Ma X, Zhao H, et al. Cloning and expression of SgCYP450-4 from Siraitia grosvenorii[J]. Acta Pharm Sin B, 2016, 6: 614–622. DOI:10.1016/j.apsb.2016.06.009 |
| [18] | Mussunoor S, Murray GI. The role of annexins in tumour development and progression[J]. J Pathol, 2008, 216: 131–140. DOI:10.1002/path.v216:2 |
| [19] | Kaetzel MA, Chan HC, Dubinsky WP, et al. A role for annexin Ⅳ in epithelial cell function[J]. J Biol Chem, 1994, 269: 5297–5302. |
| [20] | Benz J, Hofmann A. Annexins: from structure to function[J]. Biol Chem, 1997, 378: 177–183. |
| [21] | Choi CH, Sung CO, Kim HJ, et al. Overexpression of annexin A4 is associated with chemoresistance in papillary serous ade nocarcinoma of the ovary[J]. Hum Pathol, 2013, 44: 1017–1023. DOI:10.1016/j.humpath.2012.08.024 |
| [22] | Chen W, Chen L, Cai Z, et al. Overexpression of annexin A4 indicates poor prognosis and promotes tumor metastasis of hepatocellular carcinoma[J]. Tumor Biol, 2016, 37: 9343–9355. DOI:10.1007/s13277-016-4823-6 |
| [23] | Arii Y, Butsusihta K, Fukuoka SI. Role of calcium-binding sites in calcium-dependent membrane association of annexin A4[J]. Biosci Biotechnol Biochem, 2015, 79: 978–985. DOI:10.1080/09168451.2014.1003131 |
| [24] | Morimoto A, Serada S, Enomoto T, et al. Annexin A4 induces platinum resistance in a chloride-and calcium-dependent manner[J]. Oncotarget, 2014, 5: 7776–7787. DOI:10.18632/oncotarget |
| [25] | Wang J, He L, Chen D, et al. Quantitative analysis of annexin V-membrane interaction by flow cytometry[J]. Eur Biophys J, 2015, 44: 325–336. DOI:10.1007/s00249-015-1026-9 |
| [26] | Darabi M, Kontush A. Can phosphatidylserine enhance atheroprotective activities of high-density lipoprotein?[J]. Biochimie, 2016, 120: 81–86. DOI:10.1016/j.biochi.2015.06.022 |
| [27] | Zhang Y, Meng H, Ma R, et al. Circulating micropaticles, blood cells, and endothelium induce procoagulant activity in sepsis through phosphatidylserine exposure[J]. Shock, 2016, 45: 299–307. DOI:10.1097/SHK.0000000000000509 |
 2017, Vol. 52
2017, Vol. 52



