2. 青海大学 生态环境工程学院, 青海 西宁 810016;
3. 青海大学 三江源生态与高原农牧业国家重点实验室, 青海 西宁 810016
2. College of Ecological and Environment Engineering, Qinghai University, Xining 810016, China;
3. State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining 810016, China
辐射是指以波或粒子的形式向周围空间或物质发射并在其中传播的能量, 分为电离辐射和非电离辐射。电离辐射是指能量强、频率高且波长短的射线, 包括α粒子、β粒子、γ-射线、X-射线、铀、铯、中子等。非电离辐射主要是指紫外线、红外线、微波、激光一类的低能量辐射[1]。
辐射主要来自医用射线、工业用射线、核工业废物、大气核武器残留物等, 其存在的广泛性使得人们对辐射的机体损伤效应及其机制引起关注。电离辐射使机体DNA突变及合成受阻, 造成脂质、DNA和蛋白质损伤, 引起组织细胞死亡, 显著影响机体的消化系统、免疫系统、呼吸系统、神经系统、内分泌系统和物质代谢等, 从而导致机体脏器功能、代谢和结构发生改变, 形成一系列局部和全身的不良反应[2, 3]。电离辐射对机体组织器官产生的作用非常广泛, 不同组织细胞对射线的敏感性不同, 电离辐射对各器官的损伤程度也不一样。
辐射研究主要集中在辐射损伤、辐射防治和药物开发等方面, 20世纪80年代以来辐射对药物体内代谢的影响引起一定关注, 辐射条件下机体产生一系列生理性变化, 部分为病理性变化, 这些变化影响药物在体内的吸收、分布、代谢和排泄, 导致药物代谢动力学特征发生改变[4, 5]。核能与核技术已经被广泛应用到工业、农业以及医疗卫生等各个领域, 人类受到辐射的机会明显增多。随着肿瘤患者的增加和放射治疗的常规应用, 放疗后辐射引发的药物代谢的变化对临床给药方案和手术策略的变更有重大意义。
本文综述了辐射尤其是电离辐射对药物代谢的影响, 阐述了辐射条件下药物代谢酶和转运体表达及药物动力学特征的变化, 并探讨了其在科研及临床上的重要意义, 旨在为临床合理用药提供参考依据。
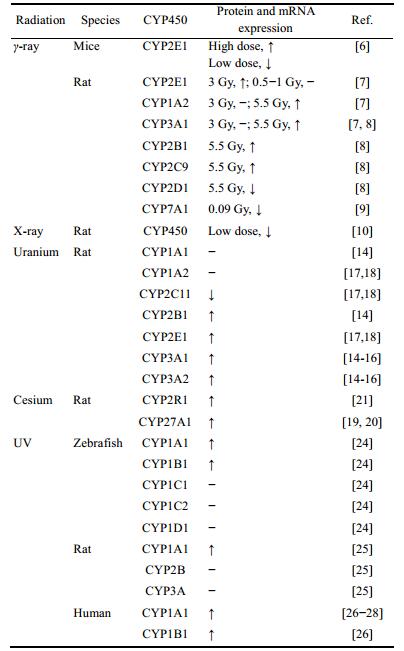
1 辐射对CYP450酶的影响 1.1 电离辐射和CYP450酶 1.1.1 γ-射线Maksymchuk等[6]发现γ-射线显著影响小鼠CYP2E1的表达, 且影响程度与γ-射线的剂量和强度有关。γ-射线低剂量连续慢性辐射和低、高剂量急性辐射时, CYP2E1的蛋白和mRNA表达均显著降低, 但高剂量γ-射线连续慢性辐射时, CYP2E1的蛋白水平升高而mRNA表达降低。大鼠研究表明, 0.5~1 Gy低剂量γ-射线连续辐射不影响CYP2E1的表达, 但3 Gy大剂量连续慢性辐射时, CYP2E1的蛋白和mRNA表达分别较对照组增加3.6倍和2.5倍[7]。
Chung等[7]探讨了γ-射线对CYP1A2和CYP3A的影响, 发现大剂量(3 Gy)连续辐射24 h后, 大鼠CYP1A2和CYP3A的蛋白和mRNA表达无明显变化。Yi等[8]研究了γ-射线对大鼠CYP450酶的调节作用, 发现5.5 Gy的γ-射线照射后, 辐射对CYP2B1和CYP3A4有显著的诱导作用; 对CYP1A2和CYP2C9有诱导作用, 但无显著性差异; 对CYP2D1有抑制作用, 但无显著性差异。Western blot和qPCR研究结果显示, 辐射使CYP1A2、CYP2B1和CYP3A1的蛋白和mRNA表达均显著增加, CYP2D1的mRNA表达显著降低。辐射对CYP2D1的蛋白表达有抑制趋势, 但无显著性差异。
γ-射线对内源性物质代谢酶也有一定影响, Mo[9]发现γ-射线显著降低大鼠胆固醇7-羟化酶CYP7A1的mRNA表达, 且随累积剂量的增大, 表达下调程度增加。低剂量率(0.09 Gy·h-1) γ-射线连续照射14、28和45天后, CYP7A1的mRNA表达分别是对照组的0.396、0.228和0.140倍。
γ-射线对药物代谢酶的调节与辐射剂量紧密相关, 除个别酶如CYP2D1外, 低剂量不影响或抑制CYP450酶的活性和表达, 如CYP2E1和CYP7A1, 高剂量诱导CYP450酶的活性和表达, 如CYP1A2、CYP2B1和CYP3A4等。
1.1.2 X-射线X-射线影响药物代谢酶的研究较γ-射线少。Marchenko等[10]探讨了辐射对大鼠肝脏解毒能力的影响, 发现与对照组比较, 低剂量X-射线辐射使大鼠CYP450和谷胱甘肽S转移酶(glutathione S-transferase, GST)的表达降低。
1.1.3 铀辐射铀辐射对药物代谢酶CYP450有显著影响[11-13]。Souidi等[14]研究发现, 大鼠连续9个月服用铀污染的水后, 与对照组比较, CYP3A1的mRNA表达在肝、脑和肾组织中分别增加300%、200%和900%; CYP3A2的mRNA表达在肝和肺组织中分别增加了200%和300%。肾组织中CYP2B1的表达增加了2倍, CYP1A1在各组织中的mRNA表达没有显著性变化。研究结果同时表明, 核受体PXR的mRNA表达在肝、脑和肾组织中分别增加150%、200%和200%, 推测铀辐射通过影响PXR的表达发挥对药物代谢酶CYP450的转录调节作用。Guéguen等[15]和Ahn等[16]进一步证实了铀辐射对CYP3A的诱导作用。
Lee等[17]和Chung等[18]研究了铀辐射对CYP1A2、CYP2C11和CYP2E1的影响, 结果显示大鼠CYP1A2的蛋白和mRNA表达没有显著变化, CYP2C11的蛋白和mRNA表达分别降低20%和25%, CYP2E1的蛋白和mRNA表达分别增加2~4倍和3倍。
综上, 铀辐射不影响CYP1A1和CYP1A2的表达, 抑制CYP2C11表达, 诱导CYP2B1、CYP2E1、CYP3A1和CYP3A2的表达。
1.1.4 铯辐射铯污染地区的流行病学调查显示, 机体肝功能和血脂异常改变, 甲状腺和心血管疾病显著增加。Souidi等[19]探讨了慢性铯辐射对大鼠胆固醇代谢的影响, 结果发现长期低剂量铯辐射导致血脂紊乱, 且胆固醇合成关键酶CYP27A1的活性显著增加34%。Racine等[20]进一步证实了慢性铯辐射对CYP27A1活性的诱导作用。慢性铯辐射条件下的维生素D3代谢研究显示, 成年大鼠肝脏中维生素D 25羟化酶(CYP2R1) 的表达增加40%, 25-羟维生素D-1α羟化酶(CYP27B1) 的表达增加35%[21]。铯辐射对CYP2R1和CYP27B1的影响与机体年龄有关, 21日龄大鼠慢性铯辐射后两种酶的表达分别降低26%和39%[22]。
铯辐射研究主要集中在胆固醇、维生素等合成代谢的关键酶方面。铯辐射影响药物代谢酶的研究文献报道较少, Obolenskaya等[23]研究发现铯辐射使人体GST的活性和表达均降低。
以上研究结果显示, 低剂量电离辐射抑制或不影响CYP450酶的表达, 而较高剂量电离辐射诱导大部分CYP450酶的表达, 除CYP2C11和CYP2D1外, 高剂量电离辐射使主要药物代谢酶CYP1A2、CYP2B1、CYP2C9、CYP2E1、CYP3A1的表达均升高, 且各种放射源间的研究结果较为一致, 见表 1[6-10, 14-21, 24-28]。
| Table 1 Effect of the radiation on CYP450. ↑: Increase; ↓: Decrease; −: No effect |
CYP2D1可能为特殊的一种酶, 高剂量辐射使大部分药物代谢酶CYP450的表达升高, 但CYP2D1的表达降低。作者曾综述了高原低氧对药物代谢的影响, 结果是高原低氧条件下, 大部分药物代谢酶CYP450的表达降低, 但CYP2D1的表达升高[29]。
1.2 非电离辐射和CYP450酶非电离辐射主要有紫外线(ultraviolet, UV)、红外线、微波、激光等, 其中阳光中的紫外线最为常见。UV有UVA和UVB两种, UVA波长较长, 有较强的穿透力, 可破坏皮肤内部的微细结构。UVB波长较UVA短, 具有中等穿透力, 可使皮肤短时间内晒红、晒伤。
Behrendt等[24]研究了UV辐射对斑马鱼CYP1系列酶的调节作用, 结果显示26.8 kJ·m-2的UVA和UVB照射8 h后, 斑马鱼的CYP1A1和CYP1B1的mRNA表达显著升高, 但CYP1C1、CYP1C2和CYP1D1的mRNA表达均无显著变化。大鼠研究表明, UVB照射1、2和4周后, CYP1A1的活性升高, 而UVB和UVA照射均不影响CYP3A和CYP2B的活性和表达[25]。Katiyar等[26]评价了UV对人体皮肤细胞CYP450的诱导作用, 发现UVB照射48 h后, CYP1A1和CYP1B1的蛋白和mRNA表达明显升高, 导致多环芳香烃类化合物和其他环境污染物的生物活性增强, 从而使机体更容易患有过敏性或接触性皮炎。Wei等[27]也发现UV照射诱导CYP1A1的蛋白和mRNA表达。人肝癌细胞HepG2的研究表明, 3 h的UVB照射抑制CYP1A1的mRNA表达, 但UVB照射9 h后, CYP1A1的mRNA表达显著升高[28]。
非电离辐射对CYP450酶的影响主要集中在紫外线辐射和CYP1A1和CYP1B1, 较为一致的结果是紫外辐射诱导CYP1A1和CYP1B1的表达, 不影响CYP1C、CYP1D、CYP3A和CYP2B的表达, 且种属间的研究结果一致, 见表 1。
2 辐射对药物转运体的影响转运体是存在于体内组织器官上一种功能性蛋白, 参与药物在体内的吸收、分布、排泄等过程, 主要有摄取型转运体和外排型转运体。摄取型转运体有寡肽转运蛋白(peptide transporter, PEPT)、有机阴离子转运蛋白(organic anion transporter, OAT)、有机阴离子转运肽(organic anion transporting polypeptide, OATP)和有机阳离子转运蛋白(organic cation trans porter, OCT)等, 外排型转运体有多药耐药蛋白(multidrug resistant protein, MDR)、多药耐药相关蛋白(multidrug resistance-associated protein, MRP)和乳腺癌耐药蛋白(breast cancer resistance protein, BCRP)等[30, 31]。转运体的表达会受到多种不同因素的影响, 导致转运体在不同状态下介导的药物出现较大的效应差异, 直接影响临床治疗效果[32]。研究发现, 辐射使药物转运体P-gp和MDR的表达增加[33, 34]。Wendy等[35]证实人肿瘤细胞系接受辐射后, BCRP的表达增加。
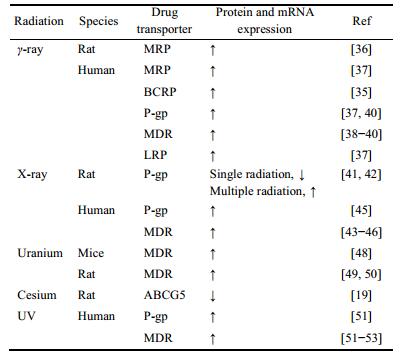
2.1 电离辐射和药物转运体 2.1.1 γ-射线Christiansen等[36]研究了γ-射线对MRP的调节作用, 大鼠肝组织接受2.4 Gy·min-1的γ-射线辐射后, MRP的蛋白和mRNA表达上调。离体大鼠肝细胞研究也表明, 8 Gy的γ-射线辐射后, MRP的蛋白和mRNA表达同样上调。
Bottke等[37]发现γ-射线辐射人肿瘤细胞系可以诱导其功能性相关的多药耐药基因及蛋白表达, 连续辐射(每周5次, 每次1.8 Gy, 共27 Gy)后, 乳腺癌和结肠癌细胞中P-gp、MRP和肺耐药相关蛋白(lung resistance related protein, LRP)的mRNA表达升高, 细胞对顺铂、多柔比星和苯达莫司汀等药物的耐药性显著提高。另外, Bartkowiak等[38]也在人结肠癌细胞中发现, 连续性γ-射线辐射(27 Gy, 1.8 Gy·d-1)诱导MDR表达。Zhang等[39]研究表明, 不同剂量多次辐射通过低氧诱导因子1α (hypoxia inducible factor-1α, HIF1α)调控人食管癌细胞中的MDR1基因, 7 Gy (每次0.5 Gy, 共14次) γ射线辐射使MDR1和HIF1α的mRNA表达分别降低54%和32%, 但大剂量28 Gy (每次2 Gy, 共14次) γ-射线辐射后, MDR1和HIF1α的mRNA表达分别升高65%和27%, 提示临床化疗时应结合放疗剂量调整药物剂量。
人肝癌细胞(HepG2) 研究表明, 2 Gy 10天或10 Gy 2天的γ射线辐射后, HepG2中MDR1和P-gp的表达显著增加, 细胞内多柔比星累积减少, 耐药性增强[40]。
γ-射线是临床放疗常见的放射源, 其对药物转运体MDR、P-gp和MRP的诱导作用对于化疗药物的合理应用具有重要意义。
2.1.2 X-射线Bart等[41]将大鼠右半球大脑进行单次(15 Gy、25 Gy)和多次(5 Gy·d-1, 连续4天)照射后, 分别测定了10、15、20和25天的P-gp表达及底物环孢素A的吸收情况, 发现单次辐射后15天和多次辐射后10天的P-gp表达降低, 环孢素A吸收增加, 但单次和多次辐射25天的P-gp表达均升高, 提示X-射线辐射可使P-gp表达临时性降低。Mima等[42]研究也证实25 Gy的X-射线辐射后的第5天P-gp表达降低60%。
Li等[43]评价了X-射线辐射对结肠癌细胞中MDR1的mRNA表达的影响, 结果显示2 Gy的辐射诱导MDR1表达。人喉癌细胞研究表明, 4 Gy的X-射线辐射8 h和16 h后, MDR表达增加, 24 h后恢复至正常水平[44]。Ji等[45]研究了辐射条件下人鼻咽癌细胞中药物转运体的表达情况, 发现10、20、50 Gy的X-射线均能使MDR1和P-gp表达显著升高。人胶质瘤细胞接受X-射线辐射后, MDR1表达升高, 为胶质瘤细胞多药耐药性提供了可能的机制[46]。
2.1.3 铀辐射贫化铀是铀富集过程中产生的副产品, 放射性比活度低, 主要发射α粒子, 其危害主要来自化学毒性和放射性毒性两个方面[47]。贫化铀对药物转运体的影响文献有一定报道, Lestaevel等[48]证实小鼠连续服用含20 mg·L-1贫化铀的水8个月后, 大脑皮层中MDR1的mRNA表达升高52%。
大鼠连续服用含贫化铀(1 mg·d-1)的水9个月后, 大脑中MDR1的mRNA表达升高34%[49], 连续服用含40 mg·L-1贫化铀的水9个月后, 肝组织中MDR1的mRNA表达升高125%[50]。
2.1.4 铯辐射Souidi等[19]测定了慢性铯污染引起的生物效应, 大鼠连续服用含6 500 Bq·L-1铯的水3个月后, 肝组织中三磷酸腺苷结合转运蛋白G超家族成员5 (ATP binding cassette subfamily G member 5, ABCG5) 的mRNA表达降低了42%。
2.2 非电离辐射和药物转运体非电离辐射对药物转运体的影响文献报道较少。人皮肤癌细胞接受16 J·m-2的UV辐射48 h后, MDR1和P-gp表达增加[51]。Uchiumi等[52]和Ohga等[53]也证实UV辐射可诱导MDR1的mRNA表达。
辐射对药物转运体的影响主要集中在MDR和P-gp, 较高剂量辐射使两种转运体的表达均升高, 小鼠、大鼠和人体等种属间以及γ-射线、X-射线、铀、铯和UV等辐射源间的研究结果完全一致, 见表 2。
| Table 2 Effect of the radiation on drug transporters. ↑: Increase; ↓: Decrease |
辐射对药物代谢的影响主要集中在CYP450酶和药物转运体, 近年来辐射对药物动力学特征的影响陆续有文献报道。辐射影响药物的代谢动力学特征, 通过相关研究可以有效掌握药物在体内治疗间隔和效果的变化, 为剂量调整和合理用药提供依据。不同药物的代谢途径和代谢机制存在差异, 但是由于辐射条件下大部分CYP450酶的表达增加, 活性升高, 机体肝脏的代谢能力提高, 多数药物的生物转化加快。Hsieh等[54]利用医用直线加速器探讨了局部盆腔辐射对大鼠5-氟尿嘧啶药物动力学特征的影响, 结果发现2 Gy的γ-射线辐射使其药-时曲线下面积(area under the curve, AUC)和平均驻留时间(mean residence time, MRT)分别下降22%和32%, 清除率(clearance, CL)升高28%, 半衰期(half-life time, t1/2)和峰浓度(peak concentration, Cmax)无显著性变化。另外, 辐射显著增加5-氟尿嘧啶在淋巴系统的分布, 与对照组比较, 其淋巴AUC增大1.5倍。大鼠整个盆腔辐射研究发现, 0.5 Gy和2 Gy的γ-射线辐射使5-氟尿嘧啶的AUC分别降低18%和21%, MRT分别减少15%和32%, CL分别升高21%和28%, t1/2和Cmax无显著性变化[55]。
顺铂的研究表明, 大鼠盆腔接收0.5 Gy和2 Gy的γ-射线辐射24 h后, 血浆AUC分别升高80%和87%, t1/2分别延长77%和68%, MRT分别延长101%和89%, Cmax升高36%和32%, 而CL分别降低45%和47%。辐射减少顺铂在胆汁中的吸收, 与对照组比较, 两种剂量的γ-射线辐射使其胆汁AUC均下降13%[56]。头部和颈部接收0.5 Gy和2 Gy的γ-射线辐射24 h后, 5-氟尿嘧啶的药物动力学参数变化与上述文献[54, 55]报道一致, 血浆AUC分别降低15%和16%, MRT分别下降19%和22%, CL分别升高18%和27%, t1/2和Cmax无显著性变化。但顺铂的药物动力学参数变化完全相反, 血浆AUC分别降低33%和29%, CL分别升高70%和50%, Cmax分别降低36%和33%, MRT和t1/2无显著性变化[57]。
Hsieh等[58]也研究了腹腔辐射对大鼠5-氟尿嘧啶药物动力学特征的影响, 结果发现0.5 Gy和2 Gy的γ-射线辐射分别使其血浆AUC降低21%和32%, MRT分别下降14%和31%, CL分别升高36%和51%; 0.5 Gy的γ-射线辐射条件下, t1/2和Cmax无显著性变化, 但2 Gy的γ-射线辐射使t1/2减少17%, Cmax无显著性变化。
不同部位γ-射线辐射均加快5-氟尿嘧啶的体内代谢, 主要表现AUC和MRT降低, CL升高, 但相同剂量、不同部位辐射使顺铂的动力学参数变化出现相反结果, 其机制值得进一步去探讨。
辐射对药物代谢动力学的影响主要集中临床γ-射线辐射和一些抗肿瘤药物, 近年来, 其他药物的研究也有文献报道。Song[59]利用医用直线加速器研究了γ-射线辐射对抗辐射药物18β-甘草酸代谢动力学特征的影响, 发现3 Gy的γ-射线辐射小鼠24 h后, AUC和Cmax分别降低75%和54%, 活性代谢物18β-甘草次酸的AUC和Cmax分别降低了70%和66%, 提示γ-射线辐射加快甘草酸的体内代谢。
辐射诱导大部分CYP450酶的表达, 加快药物在体内的代谢, 说明辐射导致代谢酶表达的改变与药物代谢动力学特征的变化一致, 提示在辐射条件下特别是临床化疗和放疗同时进行时, 应适当增加放疗药物的给药剂量。
4 存在问题及展望近年来, 随着科学的进步, 核能和核技术已经广泛应用于医疗、能源、军事、食品加工等国防和国民生活的方方面面, 与人们的日常生活息息相关。辐射在造福人类的同时, 对人们的健康也带来了不同程度的损害。目前, 可能受到辐射损伤的人群主要有接受放疗的癌症病人、从事与放射相关的工作人员和生活在高原地区的人们等。关注这些人群的个体化用药, 逐渐成为医学和药学科研人员研究的重点。在辐射条件下, 研究药物代谢酶和转运体的特点及相关机制, 以及如何对受辐射人群进行合理有效的用药将是未来研究的热点。
辐射对药物代谢的影响是放射医学和药物代谢研究的一个新方向, 目前主要集中在CYP450酶系、MDR和抗肿瘤药物, 有关辐射对其他药物代谢酶如2相代谢酶、其他转运体和药物的影响尚未见文献报道。辐射影响药物代谢的研究虽在CYP450酶及其相关药物方面取得一定的研究成果, 但目前仍处于探索阶段, 存在很大的研究空间, 今后应从以下几方面进行深入研究。
药物代谢研究的目的之一是指导临床合理用药, 目前辐射对药物代谢动力学的影响集中在γ-射线和大鼠, 而动物与人体的药物代谢存在一定差异, 应重视人体药物动力学试验, 分别探讨各类辐射的影响及机制。
高原环境具有低氧、低压、强辐射、寒冷、干燥等特征, 研究已证实高原低氧显著影响药物的体内代谢[29]。人类高原活动日益频繁, 平原机体急进高原后受到急性紫外线辐射, 另外, 全球有3 800万人生活在高原地区, 长期受到辐射。在高原特殊环境中, 除低氧的影响外, 应重视辐射对药物代谢的影响, 以对急进高原和久居高原人群进行合理有效的用药。
5-氟尿嘧啶、顺铂等是常用的抗肿瘤药物, 前期研究较多, 今后除加强这类药物的人体验证试验外, 应重视抗辐射药物和其他药物在临床医源性辐射条件下的代谢动力学研究, 为临床合理用药提供更多的参考依据。
药物代谢酶和转运体方面, 目前主要集中在CYP450酶系和MDR的蛋白和mRNA表达研究。近年来发现, 翻译后水平的修饰作用可能对代谢酶的活性有重要的影响, 从而导致出现某些CYP450亚型的蛋白和mRNA表达的水平上升而相应的活性下降的现象[60], 故除CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4等主要CYP450同工酶和MDR的表达外, 应开展酶活性和转运体功能的相关研究。另外, 应扩大研究范围, 重视对其他CYP450同工酶及UGT、UST、NAT2等2相代谢酶和MRP、BCRP及OAT等摄取型转运体的研究。
辐射影响药物代谢酶和药物转运体的分子机制还不明确, 很少有相关文献报道, 应综合病理学、细胞生物学以及分子生物学, 在细胞信号传导和基因调控水平上深入探讨辐射影响药物代谢的机制。
| [1] | Grigor'ev IuG. Ionizing and non-ionizing radiation (com parative risk estimations)[J]. Radiats Biol Radioecol, 2012, 52: 215–218. |
| [2] | Bui E, Joseph B, Rhee P, et al. Contemporary management of radiation exposure and injury[J]. J Trauma Acute Care Surg, 2014, 77: 495–500. DOI:10.1097/TA.0000000000000297 |
| [3] | von Neubeck C, Geniza MJ, Kauer PM, et al. The effect of low dose ionizing radiation on homeostasis and functional integrity in an organotypic human skin model[J]. Mutat Res, 2015, 775: 10–18. DOI:10.1016/j.mrfmmm.2015.03.003 |
| [4] | Rendic S, Guengerich FP. Summary of information on the effects of ionizing and non-ionizing radiation on cytochrome P450 and other drug metabolizing enzymes and transporters[J]. Curr Drug Metab, 2012, 13: 787–814. DOI:10.2174/138920012800840356 |
| [5] | Rendic S, Guengerich FP. Update information on drug metabolism systems-2009, part Ⅱ: summary of information on the effects of diseases and environmental factors on human cytochrome P450 (CYP) enzymes and transporters[J]. Curr Drug Metab, 2010, 11: 4–84. DOI:10.2174/138920010791110917 |
| [6] | Maksymchuk OV, Bobyk VI, Sydoryk LL, et al. Influence of long-term combined gamma-radiation and ethanol on cytochrome P450 2E1 expression in the mice liver[J]. Ukr Biokhim Zh, 2008, 80: 105–111. |
| [7] | Chung HC, Kim SH, Lee MG, et al. Mitochondrial dysfunc tion by γ-irradiation accompanies the induction of cytochrome P450 2E1 (CYP2E1) in rat liver[J]. Toxicology, 2001, 161: 79–91. DOI:10.1016/S0300-483X(01)00332-8 |
| [8] | Yi JF, Wu B, Liu CL, et al. Effect of ginsenoside total saponinon on regulation of P450 of livers of rats after γ-ray irradiation[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4037–4043. |
| [9] | Mo LF. Study on the Effect of Low Dose Rate 60Co γ/neutron Irradiation on the Rats (低剂量率60Co γ/中子辐射的生物效应研究) [D]. Shanghai: The Second Military Medical University, 2012. |
| [10] | Marchenko MM, Kopyl'chuk GP, Ketsa OV. Effect of low doses of X-ray irradiation on the liver detoxication system in rats with transplanted Guerin's carcinoma[J]. Biomed Khim, 2010, 56: 266–273. DOI:10.18097/pbmc20105602266 |
| [11] | Pasanen M, Lang S, Kojo A, et al. Effects of simulated nuclear fuel particles on the histopathology and CYP enzymes in the rat lung and liver[J]. Environ Res, 1995, 70: 126–133. DOI:10.1006/enrs.1995.1057 |
| [12] | Bucci B, Misiti S, Cannizzaro A, et al. Fractionated ionizing radiation exposure induces apoptosis through caspase-3 activa tion and reactive oxygen species generation[J]. Anticancer Res, 2006, 26: 4549–4557. |
| [13] | Choi YH, Lee YS, Kim TK, et al. Faster clearance of mirodenafil in rats with acute renal failure induced by uranyl nitrate: contribution of increased protein expression of hepatic CYP3A1 and intestinal CYP1A1 and 3A1/2[J]. J Pharm Pharmacol, 2009, 61: 1325–1332. DOI:10.1211/jpp.61.10.0008 |
| [14] | Souidi M, Gueguen Y, Linard C, et al. In vivo effects of chronic contamination with depleted uranium on CYP3A and associated nuclear receptors PXR and CAR in the rat[J]. Toxicology, 2005, 214: 113–122. DOI:10.1016/j.tox.2005.06.006 |
| [15] | Guéguen Y, Souidi M, Baudelin C, et al. Short-term hepatic effects of depleted uranium on xenobiotic and bile acid metabolizing cytochrome P450 enzymes in the rat[J]. Arch Toxicol, 2006, 80: 187–195. DOI:10.1007/s00204-005-0027-3 |
| [16] | Ahn CY, Kim EJ, Lee I, et al. Effects of glucose on the pharmacokinetics of intravenous chlorzoxazone in rats with acute renal failure induced by uranyl nitrate[J]. J Pharm Sci, 2003, 92: 1604–1613. DOI:10.1002/jps.10426 |
| [17] | Lee MG, Lee JH, Oh JM. Pharmacokinetic changes of drugs in rat model of acute renal failure induced by uranyl nitrate: correlation between drug metabolism and hepatic microsomal cytochrome P450 isozymes[J]. Curr Clin Pharmacol, 2006, 1: 193–205. DOI:10.2174/157488406776872569 |
| [18] | Chung W, Kim EJ, Lee I, et al. Effects of recombinant human growth hormone on the pharmacokinetics of intrave nous chlorzoxazone in rats with acute renal failure induced by uranyl nitrate[J]. Life Sci, 2003, 73: 253–263. DOI:10.1016/S0024-3205(03)00268-6 |
| [19] | Souidi M, Tissandie E, Grandcolas L, et al. Chronic contamination with 137Ce in rat: effect on liver cholesterol metabolism[J]. Int J Toxicol, 2006, 25: 493–497. DOI:10.1080/10915810600961317 |
| [20] | Racine R, Grandcolas L, Blanchardon E, et al. Hepatic cholesterol metabolism following a chronic ingestion of cesium-137 starting at fetal stage in rats[J]. J Radiat Res, 2010, 51: 37–45. DOI:10.1269/jrr.09064 |
| [21] | Tissandie E, Guéguen Y, Lobaccaro JM, et al. Chronic contamination with 137Cesium affects vitamin D3 metabolism in rats[J]. Toxicology, 2006, 225: 75–80. DOI:10.1016/j.tox.2006.05.006 |
| [22] | Tissandie E, Guéguen Y, Lobaccaro JM, et al. Vitamin D metabolism impairment in the rat's offspring following maternal exposure to 137Cesium[J]. Arch Toxicol, 2009, 83: 357–362. DOI:10.1007/s00204-008-0351-5 |
| [23] | Obolenskaya MY, Teplyuk NM, Divi RL, et al. Human placental glutathione S-transferase activity and polycyclic aromatic hydrocarbon DNA adducts as biomarkers for environmental oxidative stress in placentas from pregnant women living in radioactivity-and chemically-polluted regions[J]. Toxicol Lett, 2010, 196: 80–86. DOI:10.1016/j.toxlet.2010.03.1115 |
| [24] | Behrendt L, Jonsson ME, Goldstone JV, et al. Induction of cytochrome P450 1 genes and stress response genes in devel oping zebrafish exposed to ultraviolet radiation[J]. Aquat Toxicol, 2010, 98: 74–82. DOI:10.1016/j.aquatox.2010.01.008 |
| [25] | Goerz G, Barnstorf W, Winnekendonk G, et al. Influence of UVA and UVB irradiation on hepatic and cutaneous P450 isoenzymes[J]. Arch Dermatol Res, 1996, 289: 46–51. DOI:10.1007/s004030050151 |
| [26] | Katiyar SK, Matsui MS, Mukhtar H. Ultraviolet-B exposure of human skin induces cytochromes P450 1A1 and 1B1[J]. J Invest Dermatol, 2000, 114: 328–333. DOI:10.1046/j.1523-1747.2000.00876.x |
| [27] | Wei YD, Rannug U, Rannug A. UV-induced CYP1A1 gene expression in human cells is mediated by tryptophan[J]. Chem Biol Interact, 1999, 118: 127–140. DOI:10.1016/S0009-2797(98)00118-5 |
| [28] | Luecke S, Wincent E, Backlund M, et al. Cytochrome P450 1A1 gene regulation by UVB involves crosstalk between the aryl hydrocarbon receptor and nuclear factor kappaB[J]. Chem Biol Interact, 2010, 184: 466–473. DOI:10.1016/j.cbi.2010.01.038 |
| [29] | Zhang JL, Li XY. A review of drug metabolism under hypoxia environment at high altitude[J]. Acta Pharm Sin (药学学报), 2015, 50: 1073–1079. |
| [30] | Feng Y, Liu KX. Research advances in organic anion transporter[J]. Acta Pharm Sin (药学学报), 2016, 51: 1054–1059. |
| [31] | Liu Q, Liu KX. Advances in the study of enzymes and transporters-mediated pharmacokinetic mechanism for herb-drug interaction[J]. Acta Pharm Sin (药学学报), 2015, 50: 406–412. |
| [32] | Zakeri-Milani P, Valizadeh H. Intestinal transporters: enhanced absorption through P-glycoprotein-related drug interactions[J]. Expert Opin Drug Metab Toxicol, 2014, 10: 859–871. DOI:10.1517/17425255.2014.905543 |
| [33] | Robbes I, Voiseux C, Fievet B, et al. Effect of ionizing radiation on the transcription levels of cell stress marker genes in the pacific oyster Crassostrea gigas[J]. Radiat Res, 2011, 176: 38–48. DOI:10.1667/RR2525.1 |
| [34] | Westover D, Li F. New trends for overcoming ABCG2/BCRP-mediated resistance to cancer therapies[J]. J Exp Clin Cancer Res, 2015, 34: 159–168. DOI:10.1186/s13046-015-0275-x |
| [35] | Wendy JI, Lisa MC, Erica BL, et al. ABC transporter activity linked to radiation resistance and molecular subtype in pediatric medulloblastoma[J]. Exp Hematol Oncol, 2013, 2: 26–43. DOI:10.1186/2162-3619-2-26 |
| [36] | Christiansen H, Batusic D, Saile B, et al. Identification of genes responsive to gamma radiation in rat hepatocytes and rat liver by cDNA array gene expression analysis[J]. Radiat Res, 2006, 165: 318–325. DOI:10.1667/RR3503.1 |
| [37] | Bottke D, Koychev D, Busse A, et al. Fractionated irradia tion can induce functionally relevant multidrug resistance gene and protein expression in human tumor cell lines[J]. Radiat Res, 2008, 170: 41–48. DOI:10.1667/RR0986.1 |
| [38] | Bartkowiak D, Stempfhuber M, Wiegel T, et al. Radiation-and chemoinduced multidrug resistance in colon carcinoma cells[J]. Strahlenther Onkol, 2009, 185: 815–820. DOI:10.1007/s00066-009-1993-9 |
| [39] | Zhang GJ, Gao R, Wang JS, et al. Various doses of frac tioned irradiation modulates multidrug resistance 1 expression differently through hypoxia-inducible factor 1 in esophageal cancer cells[J]. Dis Esophagus, 2011, 24: 481–488. DOI:10.1111/des.2011.24.issue-7 |
| [40] | Tsang TY, Tsang SW, Lai KP, et al. Facilitation of drug resistance development by γ irradiation in human cancer cells[J]. Oncol Rep, 2009, 22: 921–926. |
| [41] | Bart J, Nagengast WB, Coppes RP, et al. Irradiation of rat brain reduces P-glycoprotein expression and function[J]. Br J Cancer, 2007, 97: 322–326. DOI:10.1038/sj.bjc.6603864 |
| [42] | Mima T, Toyonaga S, Mori K, et al. Early decrease of P-glycoprotein in the endothelium of the rat brain capillaries after moderate dose of irradiation[J]. Neurol Res, 1999, 21: 209–215. DOI:10.1080/01616412.1999.11740920 |
| [43] | Li XF, Ma L, Lu J, et al. Effect of ionizing radiation on transcription of colorectal cancer MDR1 gene of HCT-8 cells[J]. Asian Pac J Trop Med, 2013, 6: 407–409. DOI:10.1016/S1995-7645(13)60048-6 |
| [44] | Korystov YN, Shaposhnikova VV, Korystova AF, et al. Modification of multidrug resistance of tumor cells by ionizing radiation[J]. Cancer Chemother Pharmacol, 2008, 61: 15–21. |
| [45] | Ji XN, Quan XL, Sui XM, et al. Effect of fractionated irradiation on the expression of multidrug resistance genes in the CNE1 human nasopharyngeal carcinoma cell line[J]. Mol Med Rep, 2013, 7: 187–194. |
| [46] | Trog D, Moenkemann H, Haertel N, et al. Expression of ABC-1 transporter is elevated in human glioma cells under irradiation and temozolomide treatment[J]. Amino Acids, 2005, 28: 213–219. DOI:10.1007/s00726-005-0171-3 |
| [47] | Legendre A, Elie C, Ramambason C, et al. Endocrine effects of lifelong exposure to low-dose depleted uranium on testicular functions in adult rat[J]. Toxicology, 2016, 368. |
| [48] | Lestaevel P, Bensoussan H, Racine R, et al. Transcriptomic effects of depleted uranium on acetylcholine and cholesterol metabolisms in Alzheimer's disease model[J]. C R Biol, 2011, 334: 85–90. DOI:10.1016/j.crvi.2010.12.004 |
| [49] | Racine R, Gueguen Y, Gourmelon P, et al. Modifications of the expression of genes involved in cerebral cholesterol metabolism in the rat following chronic ingestion of depleted uranium[J]. J Mol Neurosci, 2009, 38: 159–165. DOI:10.1007/s12031-008-9145-8 |
| [50] | Racine R, Grandcolas L, Grison S, et al. Cholesterol 7α-hydroxylase (CYP7A1) activity is modified after chronic ingestion of depleted uranium in the rat[J]. J Steroid Biochem Mol Biol, 2010, 120: 60–66. DOI:10.1016/j.jsbmb.2010.03.066 |
| [51] | Hu Z, Jin S, Scotto KW. Transcriptional activation of the MDR1 gene by UV irradiation. Role of NF-Y and Sp1[J]. J Biol Chem, 2000, 275: 2979–2985. DOI:10.1074/jbc.275.4.2979 |
| [52] | Uchiumi T, Kohno K, Tanimura H, et al. Enhanced expres sion of the human multidrug resistance 1 gene in response to UV light irradiation[J]. Cell Growth Differ, 1993, 4: 147–157. |
| [53] | Ohga T, Uchiumi T, Makino Y, et al. Direct involvement of the Y-box binding protein YB-1 in genotoxic stress-induced activation of the human multidrug resistance 1 gene[J]. J Biol Chem, 1998, 273: 5997–6000. DOI:10.1074/jbc.273.11.5997 |
| [54] | Hsieh CH, Hou ML, Wang LY, et al. Local pelvic irradiation modulates pharmacokinetics of 5-fluorouracil in the plasma but not in the lymphatic system[J]. BMC Cancer, 2015, 15: 316–324. DOI:10.1186/s12885-015-1344-4 |
| [55] | Hsieh CH, Liu CY, Hsieh YJ, et al. Matrix metallopro teinase-8 mediates the unfavorable systemic impact of local irradiation on pharmacokinetics of anti-cancer drug 5-fluorouracil[J]. PLoS One, 2011, 6: e21000. DOI:10.1371/journal.pone.0021000 |
| [56] | Tsai TH, Chen YJ, Hou ML, et al. Pelvic irradiation modulates the pharmacokinetics of cisplatin in the plasma and lymphatic system[J]. Am J Transl Res, 2015, 7: 375–384. |
| [57] | Hsieh CH, Hou ML, Chiang MH, et al. Head and neck irradiation modulates pharmacokinetics of 5-fluorouracil and cisplatin[J]. J Transl Med, 2013, 11: 231–241. DOI:10.1186/1479-5876-11-231 |
| [58] | Hsieh CH, Hsieh YJ, Liu CY, et al. Abdominal irradiation modulates 5-fluorouracil pharmacokinetics[J]. J Transl Med, 2010, 8: 29–37. DOI:10.1186/1479-5876-8-29 |
| [59] | Song XY. Study on the Mechanism of Radiation Protection of 18-beta-Glycyrrhizic Acid (18-β-甘草酸的辐射防护作用机制研究) [D]. Xining: Qinghai University, 2016. |
| [60] | Li YH, Bi HC, Huang M. Effects of posttranslational modi fication on the activity of cytochrome P450: current progress[J]. Acta Pharm Sin (药学学报), 2011, 46: 487–492. |
 2017, Vol. 52
2017, Vol. 52