2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
2015年我国新增癌症患者约429万, 癌症发病形势严峻。其中, 乳腺癌位居女性癌症发病率之首, 约占所有女性癌症的15%[1, 2]。肿瘤耐药现象的发生是导致乳腺癌临床治疗失败的主要原因之一。导致肿瘤细胞耐药的机制主要包括药物摄取减少与外排增加、DNA损伤修复机制改变、细胞解毒系统活性升高、凋亡途径失活及药物作用靶点的改变等[3, 4]。联合多种治疗手段, 从不同作用机制出发逆转肿瘤耐药是目前的研究热点之一, 主要包括化疗、靶向治疗、基因治疗、光动力学治疗和光热力学治疗等[5-10]。借助于纳米技术, 能够将不同药理活性的药物包载到同一药物输送系统中, 实现多种治疗手段的融合, 更好地发挥协同效应[11]。其中, 光敏感纳米药物共输送系统有着独特的优势[12], 首先, 光是一种非侵入无创或微创的外源性刺激, 患者顺应性较好, 并且在一定程度上避免了内源响应性药物输送系统在肿瘤患者中应用时的个体差异; 其次, 能够在时间、空间和强度上对激光进行精确控制, 减少不良反应的发生。据报道, 脂质体在经过直径约1 cm的肿瘤时, 其经过肿瘤组织内部血管的最短滞留时间仅为50~100 s[13, 14], 因此, 设计制备快速光响应的药物输送系统尤为必要。此外, 光疗过程中激光的强度会随着穿透组织深度的增加而锐减[15], 进而削弱了药物对较深部位肿瘤组织的治疗效果。改善低功率、短时间光疗的效果也是亟待解决的科学问题之一。
本文以二氢卟吩e6三甲酯(Ce6tM)为光敏剂, 盐酸多柔比星(DOX)作为化疗药物, 大豆磷脂(soybean phospholipid, SPC)脂质体为载体, 构建了一个制备过程简单、可以光敏感快速释放化疗药物的药物输送系统, 为解决光疗过程中遇到的困难, 更好地逆转乳腺癌耐药提供了一定的研究基础。在该药物输送系统中, 亲脂性的Ce6tM嵌入在脂质体的磷脂双分子层中, 亲水性药物DOX则位于脂质体的内水相中。在激光照射过程中, Ce6tM发生光动力学反应, 产生1O2, 1O2直接作用于磷脂双分子层, 氧化破坏SPC, 增强脂质体磷脂双分子层的通透性, 快速释放药物, 在局部达到一个较高的药物浓度, 增加DOX在肿瘤细胞中的蓄积和细胞毒性。在光照后, 由于脂质体膜的氧化破坏是不可逆的, 滞留在肿瘤微环境或肿瘤细胞内的脂质体仍然可以继续较快地释放药物, 即使在低功率、短时间的光照后, 该释放行为依然存在。这有助于增加肿瘤细胞对化疗药物的敏感性, 改善低功率、短时间光照的治疗效果。此外, 光动力学可以从不同的机制出发杀死肿瘤细胞, 在治疗效果上与化疗药物DOX形成互补, 更好地逆转乳腺癌耐药。
材料与方法材料与试剂 DOX、氨苄霉素和硫酸链霉素(大连美仑生物技术有限公司); Ce6tM (和光纯药工业株式会社); S100型大豆磷脂酰胆碱(SPC, 德国Lipoid公司); 胆固醇、DSPE-PEG2000 (上海艾韦特医药科技有限公司); ProElut PLS SPE固相萃取小柱(30 mg, 1 mL, 上海迪柯马分析技术有限公司); 脂质氧化检测试剂盒、Hoechst 33342、活性氧检测试剂盒和增强型ATP检测试剂盒(上海碧云天生物技术有限公司); 单线态氧绿色探针(singlet oxygen sensor green, SOSG)、1640干粉培养基、0.25%胰蛋白酶消化液和胎牛血清(美国Life Technology公司); 细胞毒性检测试剂盒(Cell Counting Kit-8, CCK8, 上海翊圣生物科技有限公司); 其他试剂均为分析纯。
仪器 脂质体挤出器(LiposoFast LF1, Avestin, Canada); 红外激光器(MRL-FN-671, 长春新产业光电技术有限公司); 酶标仪(Enspire, PerkinElmer, USA); 快速冷冻制样机(Vitrobot, FEI, USA); 场发射冷冻透射电镜(TF20, FEI, USA); 粒度和zeta电位分析仪(Zetasizer Nano ZS90, Malvern, UK); 红外热成像仪(AI50-15-M, 明和电子企业有限公司); 倒置荧光显微镜(TH4-200, Olympus, Japan); 流式细胞仪(FACS Calibur, Becton Dickinsion, USA); 组织匀浆仪(Precellys 24, Bertin technology, France)。
细胞 人乳腺癌细胞株MCF7购自中国科学院上海细胞库; 人乳腺癌耐阿霉素细胞株MCF7/ADR购自上海博谷生物科技有限公司。二者均采用含有10%胎牛血清的完全1640培养基培养, 其中MCF7/ ADR细胞培养基中加入化疗药物DOX维持细胞的耐药性, 终质量浓度为1 μg·mL-1。
动物 BALB/c-nu裸鼠(18~20 g, 雌性, 合格证号: 2013001822795) 购自中国科学院上海实验动物中心, 置于25 ℃、12 h光-暗交替的环境下饲养, 动物可自由饮水及取食。所有实验动物的相关操作均按照中国科学院上海药物研究所实验动物管理和使用委员会的相关要求进行。荷MCF7/ADR肿瘤的裸鼠动物模型的建立方法:取BALB/c-nu裸鼠, 于右侧腋窝第三对乳腺脂肪垫皮下接种MCF7/ADR细胞, 每只裸鼠接种1×107个细胞。
CDL的制备 采用薄膜水化-硫酸铵主动载药法制备共输送Ce6tM与DOX的脂质体CDL。称取SPC、胆固醇、DSPE-PEG2000和Ce6tM (质量比70:17.5:10:3), 溶解于甲醇/二氯甲烷混合溶剂(体积比9:1), 45 ℃旋转蒸发成膜, 200 mmol·L-1硫酸铵溶液水化得到初乳。置于挤出器中, 过50 nm聚碳酸酯膜15次, 去离子水透析。加入15%质量比的DOX, 45 ℃水浴孵育10 min, 过葡聚糖凝胶Sephadex G-50柱, 除去未被包载的DOX, 得到CDL。空白脂质体(blank liposomes, SBL)、单载DOX的脂质体(liposomes loaded with DOX, SDL)、单载Ce6tM的脂质体(liposomes loaded with Ce6tM, SCL)和SDL与SCL的物理混合物(SDL+SCL mixture)的制备方法与CDL类似, 不同之处在于处方中不加DOX或Ce6tM。
CDL的处方筛选 采用上述方法, 分别改变Ce6tM的比例(质量比0%、0.25%、0.5%、1%和3%), 胆固醇与SPC的比例(质量比1:2、1:4、1:8和0), 制备不同处方的CDL。以37 ℃水浴处理6 h和2 W·cm-2 671 nm激光照射1 min后DOX的释放情况作为考察条件, 筛选最优处方。检测最优处方CDL中DOX的包封率。
DOX释放检测 用PBS (pH 7.4) 将CDL或SDL中DOX稀释至400 μg·mL-1, 经过不同处理后(37 ℃, 671 nm激光光照或水浴孵育), 利用固相萃取小柱检测DOX的释放百分比。
粒径与zeta电位 用马尔文粒度测定仪检测CDL在室温PBS (pH 7.4) 中的粒径和zeta电位。
冷冻透射电镜(cryo-transmission electron microscopy, Cryo-TEM) 将CDL脂质总质量浓度稀释至10 mg·mL-1, 采用FEI Vitrobot快速冷冻机制样, 上样量3 μL, 吸附力度为-1, 吸附时间为4.5 s。圆孔碳支持膜铜网事先经过10 s亲水化处理。Tecnai TF20 200 kV透射电镜拍摄观察CDL形态。
光热效应考察 取DOX质量浓度为400 μg·mL-1 CDL、SDL或80 μg·mL-1 SCL置于37 ℃水浴中, 671 nm激光照射, 红外热成像仪实时监测溶液温度变化。
1O2的检测 将CDL或SCL中Ce6tM稀释至95 ng·mL-1, 加入SOSG甲醇溶液, 使其终浓度为10 μmol·L-1。37 ℃水浴, 不同功率671 nm激光照射不同时间, 酶标仪检测溶液的荧光强度值(Ex/Em = 504/525 nm)。另考察CDL在30 mmol·L-1 NaN3中的1O2产生情况。
磷脂氧化产物丙二醛(malondialdehyde, MDA)的检测 采用脂质氧化检测试剂盒考察脂质体光照后产物中MDA的产生情况。由于试剂盒的荧光检测条件与DOX较为接近, 因此没有设置含DOX各脂质体处方的实验组。将SCL中Ce6tM稀释至80 μg·mL-1, 37 ℃水浴中, 不同功率671 nm激光照射不同时间。按照试剂盒说明书处理后, 酶标仪检测荧光强度值(Ex/Em = 535/553 nm), 计算MDA浓度。
DOX细胞内蓄积 定量检测DOX细胞内蓄积的方法:将MCF7/ADR细胞以8×104个/孔接种到24孔培养板中, 37 ℃、5% CO2培养箱中培养24 h。分别加入游离DOX、SDL、CDL和SDL+SCL混合物, DOX终质量浓度为5 μg·mL-1, Ce6tM终质量浓度为1 μg·mL-1, 避光孵育1、2、4、8和12 h。光照组12 h后于37 ℃, 2 W·cm-2, 671 nm激光光照2 min, 光照后尽快用流式细胞仪FL-2通道检测各组细胞中DOX的平均荧光强度值。采用类似方法另考察低功率、短时间下671 nm激光光照(0.25 W·cm-2, 15 s)对CDL中DOX胞内蓄积的影响, 不同之处在于激光的功率、光照时间及孵育时间(12 h和18 h)。定性观察DOX细胞内蓄积的方法如下, 按照前面所述制备好不同时间点的细胞样品, 每孔加入6 mg·mL-1 Hoechst 33342染料1 μL, 37 ℃孵育10 min, 标记细胞核。0.4%台盼蓝的PBS淬灭细胞表面吸附的荧光药物, 冷PBS洗涤2次, 荧光显微镜定性观察细胞内DOX的蓄积分布情况(FL1和FL4通道)。
细胞毒性 将MCF7、MCF7/ADR细胞分别以4×103个/孔接种到96孔培养板中, 培养24 h。加入不同浓度的游离DOX、SDL、SCL、CDL和SDL+SCL混合物(DOX与Ce6tM质量比为5:1), 另设空白对照组。37 ℃避光培养12 h后, 光照组在37 ℃下671 nm (2 W·cm-2, 2 min)激光照射, 继续避光孵育36 h。采用CCK8法检测各脂质体对MCF7和MCF7/ADR细胞的细胞毒性。将浓度的对数值与细胞存活率用GraphPad Prism软件拟合, 计算各制剂的IC50值。另采用类似方法考察低功率、短时间671 nm激光光照(0.25 W·cm-2, 15 s)下CDL、SCL和SDL对MCF7/ ADR细胞细胞毒性的影响。
细胞内1O2检测 利用活性氧检测试剂盒检测CDL等在细胞内1O2的产生。将MCF7/ADR细胞以8×104个/孔接种到24孔培养板中, 培养24 h后, 分别加入游离DOX、SDL、SCL、CDL和SDL+SCL混合物, DOX终质量浓度为5 μg·mL-1, Ce6tM终质量浓度为1 μg·mL-1, 另设空白对照组。避光孵育12 h后移去含有药物的培养基, PBS洗涤两次, 加入10 μmol·L-1 2, 7-二氯荧光素二乙酸酯工作液0.5 mL, 37 ℃避光孵育30 min, 装载探针。将光照组细胞用671 nm激光(2 W·cm-2, 2 min)照射。冷PBS洗涤2次, 消化, 离心收集细胞, 流式细胞仪FL-1通道检测。
细胞内ATP水平检测 将MCF7/ADR细胞以1.5×105个/孔接种到12孔培养板中, 培养24 h后, 加入游离DOX、SDL、SCL、CDL和SDL+SCL混合物(DOX终质量浓度为5 μg·mL-1, Ce6tM终质量浓度为1 μg·mL-1), 设空白对照组, 避光孵育12 h, 将光照组细胞用671 nm激光(2 W·cm-2, 2 min)照射, 继续避光孵育12 h。根据ATP检测试剂盒使用说明书制备样品, 检测各实验组细胞内ATP水平。
细胞周期 将MCF7/ADR细胞以1.5×105个/孔接种到12孔培养板中, 培养24 h后, 加入游离DOX、SDL、SCL、CDL和SDL+SCL混合物(DOX终质量浓度为5 μg·mL-1, Ce6tM终质量浓度为1 μg·mL-1), 设空白对照组, 避光孵育12 h, 将光照组细胞用671 nm激光(2 W·cm-2, 2 min)照射, 继续避光孵育12 h。消化离心收集细胞, 冷PBS洗涤2次。用冷PBS 0.3 mL重悬细胞, 边涡旋边缓慢加入无水乙醇0.7 mL, 4 ℃固定过夜。离心收集细胞, PBS洗涤2次, 向细胞悬液中加入10 mg·mL-1 RNase A 2 μL及2 mg·mL-1碘化丙啶5 μL, 37 ℃避光孵育30 min, 流式细胞仪FL-2A通道检测MCF7/ADR细胞的细胞周期分布情况。
DOX体内分布 取荷MCF7/ADR肿瘤的BALB/ c-nu裸鼠42只, 随机分为7组(游离DOX组、SDL组、SDL光照组、CDL组、CDL光照组、SDL+SCL混合物组和SDL+SCL混合物光照组), 每组每个时间点3只。经尾静脉给予DOX剂量为5 mg·kg-1的制剂。其中光照组在给药4 h后, 对肿瘤给予671 nm激光照射(2 min 2 W·cm-2)。给药后4和24 h处死裸鼠, 取心、肝、脾、肺、肾和肿瘤组织称重, 置于组织匀浆管中, 按2 mL·g-1比例加入DMSO, 匀浆后离心取上清液, 酶标仪检测各个组织中DOX浓度(Ex/Em = 485/590 nm)。
药效学评价 取荷MCF7/ADR肿瘤的BALB/ c-nu裸鼠40只, 随机分为8组, 每组5只。设生理盐水组、游离DOX组、SCL组、SDL组、CDL组、SCL光照组、CDL光照组和SDL+SCL混合物光照组。经尾静脉给药, 给药剂量为DOX 5 mg·kg-1, Ce6tM 1 mg·kg-1。每4天给药1次, 共给药3次。光照组在给药4 h后对肿瘤给予671 nm激光照射(2 min, 2 W·cm-2)。给药期间, 每2天用游标卡尺测量肿瘤的最大直径(Lmajor axis)和最小直径(Lminor axis), 计算肿瘤体积(V), 公式如下:
| $ {V_{{\rm{Tumor}}}} = \frac{{{L_{{\rm{Major}}\;{\rm{axis}}}} \times {L_{{\rm{Minor}}\;{\rm{axis}}}}^2}}{2} $ |
然后分别与各组裸鼠第1天的肿瘤体积值相比, 计算相对肿瘤生长速率。实验结束后, 用戊巴比妥钠将各组裸鼠麻醉, 并拍照。CO2窒息法将裸鼠处死, 小心完整地取出裸鼠体内肿瘤组织, 清洗后拍照称重。按照如下公式计算肿瘤抑制率(tumor inhibiting rate, TIR):
| $ {\rm{TIR}} = \left( {1 - \frac{{{W_{{\rm{test}}}}}}{{{W_{{\rm{saline}}}}}}} \right) \times 100{\text{% }} $ |
其中, Wsaline表示生理盐水组裸鼠肿瘤的平均重量, Wtest表示各制剂组裸鼠肿瘤的平均重量。
CDL的初步生物安全性评价 取正常BALB/ c-nu裸鼠6只, 按照药效学评价中生理盐水组、游离DOX组、SCL组、SDL组、CDL组和CDL光照组的方案给药, 在第14天时, 经CO2窒息法处死, 小心取出心、肝、脾、肺和肾组织, 置于4%多聚甲醛中固定, 乙醇-二甲苯脱水, 石蜡包埋, 切片。之后用二甲苯彻底脱蜡。用梯度的乙醇水溶液(100%、95%、75%、0%)和PBS (pH 7.4) 复水化。苏木精和伊红(hematoxylin and eosin, H & E)染色, 显微镜下观察拍照。
统计学方法 实验数据均以均值±标准差(x± s)表示。采用GraphPad Prism 7.0软件进行方差齐性检验, 两组样本之间比较采用t检验, 多组间采用单因素方差分析。显著性结果以*P < 0.05、**P < 0.01和***P < 0.001表示。
结果与讨论 1 CDL处方的筛选与表征37 ℃孵育6 h后不同处方脂质体中DOX释放结果见图 1A。Ce6tM载药量在0.25%~3%时对DOX的释放速度影响不大。SPC与胆固醇的比例影响较大, 当二者比例为1:8时, 6 h内释放DOX速度明显加快, 表明一定范围内胆固醇比例的提高有利于脂质体稳定。从图 1B结果可以看出, Ce6tM载药量的增加、胆固醇比例的降低有助于加快脂质体中DOX在光照条件下的释放。此外还发现, 如果Ce6tM的质量比继续提高至5%, 此时磷脂膜的刚性增强, 挤出法制备工艺难度增加, 同时得到的CDL稳定性大大降低, 室温放置36 h后会有Ce6tM析出(数据未列出)。为了兼顾CDL在37 ℃条件下的稳定性和光敏感释药特性, 选择Ce6tM载药量3%, 胆固醇与大豆磷脂质量比1:4为最终的制剂处方。
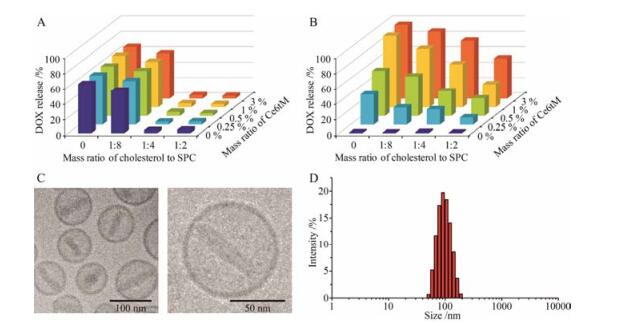
|
Figure 1 Formulation screening of liposomes loaded with chlorin e6 trimethyl ester (Ce6tM) and doxorubicin hydrochloride (DOX) (CDL). Percentages of DOX release from different CDL formulations after treatment with 6 h, 37 ℃ water incubation (A) or 1 min, 2 W·cm-2, 671 nm laser irradiation (B); C: Cryo-transmission electron microscopy (Cryo-TEM) images of CDL; D: Particle size distribu tion of CDL measured by dynamic light scattering. SPC: Soybean phospholipid |
经检测, 最佳处方的CDL中DOX的包封率为(99.7 ± 1.5) %。利用冷冻透射电镜观察到CDL呈圆球形, 较均一, 粒径在90 nm左右(图 1C)。因为DOX为亲水性药物, 位于脂质体内水腔, 在冰冻状态下形成结晶而呈棒状。采用动态光散射的方法检测到CDL在PBS (pH 7.4) 中粒径为90.7 ± 1.1 nm, 多分散指数为0.130 ± 0.019, 与透射电镜结果一致(图 1D)。Zeta电位呈近中性, 为-1.5 ± 0.6 mV。CDL表面的中性电荷, 有助于其躲避网状内皮系统的识别, 延长其体内循环时间, 增强抗肿瘤效果。
2 DOX的光敏感释放CDL在不同功率671 nm激光照射过程中DOX的累积释放情况如图 2A所示。CDL中DOX的释放速度与激光功率呈正相关。在未光照条件下, 4 min内CDL中DOX几乎无释放。当激光功率提高4 W·cm-2时, DOX在1 min内释放达到了(94.1 ± 1.8) %。然而相同条件下, SDL组DOX几乎没有释放, 与未光照CDL组没有显著性差异, 表明Ce6tM赋予了CDL光敏感释药特性。
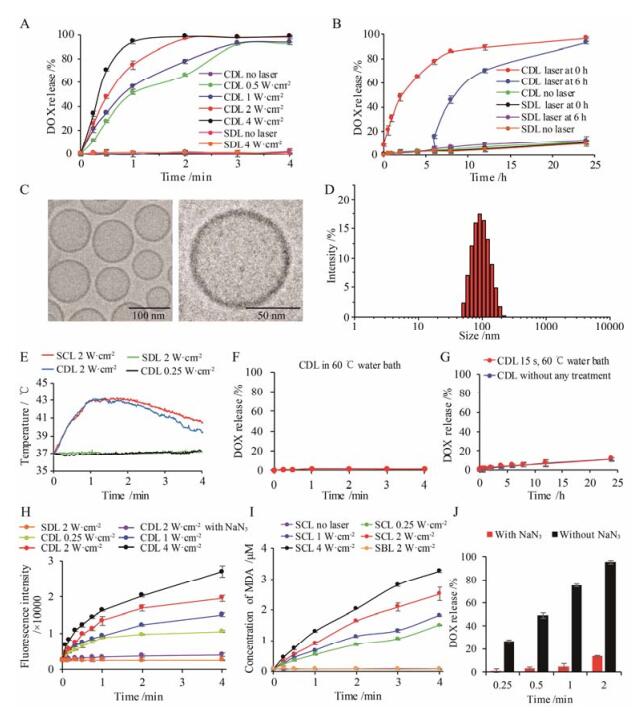
|
Figure 2 Photo-sensitive DOX release behaviors in vitro of CDL and its mechanism. A: Cumulative release of DOX from CDL or liposomes loaded with DOX (SDL) in PBS (pH 7.4) under 671 nm laser irradiation with different power; B: Cumulative release of DOX from CDL or SDL after 15 s, 0.25 W·cm-2, 671 nm laser irradiation in 37 ℃, PBS (pH 7.4); C, D: Cryo-TEM images and particle size distribution of CDL after 4 min, 2 W·cm-2, 671 nm laser irradiation; E: Temperature change curves of CDL, SCL or SDL under 671 nm laser irradiation with different power; F: Cumulative release of DOX from CDL in 60 ℃ water bath; G: Cumulative release of DOX from CDL in 37 ℃ PBS (pH 7.4) after 15 s, 60 ℃ water incubation treatment; H: Generation of 1O2 by CDL or SDL under 671 nm laser irradiation; I: Detection of oxidation products malondialdehyde (MDA) from liposomes loaded with Ce6tM (SCL) after 671 nm laser irradiation; J: Effects of 1O2 quencher NaN3 on DOX release rate from CDL under 671 nm laser irradiation (2 W·cm-2). n = 3, x± s |
短时间、较低功率光照后CDL中DOX释放结果见图 2B。CDL在经过671 nm激光(15 s, 0.25 W·cm-2)光照后, DOX突释8%左右, 之后虽然不再有激光照射, 但是该组CDL中DOX的释放速度明显快于未光照CDL组。在24 h, 该组DOX释放接近完全[(97.0 ± 1.0) %], 而未光照CDL组仅释放了11.1%。调整激光光照的时间点至6 h, 观察到类似的现象。然而同样条件的激光照射对SDL组中DOX的释放速度均没有影响, 表明短时间、低功率的光照可能导致了CDL磷脂双分子层通透性不可逆的改变, 加速了光照后CDL中DOX药物的释放。
3 光敏感释药机制为了考察CDL光敏感释药机制, 首先利用冷冻透射电镜观察了CDL经过2 W·cm-2、671 nm激光照射4 min后的形态, 见图 2C。CDL在光照后仍然呈圆球形, 较为均一, 粒径在90 nm左右。未观察到脂质体膜明显破损。内水腔中DOX消失, 这与释放实验结果一致。粒度测定结果显示, 光照后CDL在PBS (pH 7.4) 中粒径为91.3 ± 2.3 nm (图 2D), 多分散指数(PDI)为0.123 ± 0.020。Zeta电位为-1.5 ± 0.2 mV, 仍然呈近中性。以上结果表明, 光照后CDL中DOX释放, 其形态与粒径大小并未发生明显变化。
升温曲线结果显示, CDL在2 W·cm-2、671 nm光照过程中温度均略有升高(图 2E), 0.25 W·cm-2功率条件下, 温度几乎不变。在60 ℃水浴孵育4 min, CDL中DOX几乎没有释放(图 2F)。CDL中DOX在60 ℃水浴处理15 s后, CDL中DOX的释放并没有加快, 与未经过任何处理的CDL组没有显著性差异(图 2G)。以上结果表明, 温度不是导致CDL光敏感快速释放药物的主要因素。
采用SOSG检测CDL在不同功率激光照射过程中1O2产生情况, 见图 2H。CDL在671 nm的激光照射过程中, 溶液荧光强度增加, 表明有1O2产生, 并且其产生速度与激光的功率呈正相关。当溶液中含30 mmol·L-1 1O2淬灭剂NaN3时, 荧光信号明显减弱, 1O2被淬灭。相同DOX浓度的SDL在激光照射过程中, 未见1O2产生。脂质类化合物在经过氧化后会逐渐分解成为一系列复杂的化合物, 其中包括MDA。采用脂质氧化检测试剂盒检测了SCL在光照后大豆磷脂氧化产物的生成情况(图 2I)。在671 nm激光照射过程中, SCL中有MDA产生, 并且与1O2的产生情况相似, 单位时间产生MDA的量与激光功率呈正相关。在相同条件下, SBL组未见MDA产生。当CDL溶液中含NaN3时, 光照条件下DOX的释药速度明显放缓(图 2J)。结果表明, 1O2的产生对CDL中DOX的光敏感释放起主导作用, 即光照条件下, CDL中Ce6tM激发产生1O2, 1O2作用于磷脂双分子层, 增加其通透性, 加快药物的释放。
4 DOX细胞内蓄积671 nm激光(2 W·cm-2, 2 min)照射前后, MCF7/ADR细胞内DOX的蓄积情况见图 3。定量检测结果显示, MCF7/ADR细胞的耐药性, 游离DOX在MCF7/ADR细胞中的蓄积量很低。与游离DOX比较, MCF7/ADR细胞对脂质体制剂SDL、CDL和SCL+SDL混合物中DOX的摄取明显增加, 在12 h时其荧光强度值分别是游离DOX的4.70、4.76和4.65倍(P < 0.001)。经过671 nm激光照射(2 W·cm-2, 2 min)后, 不含光敏剂的游离DOX组和SDL组细胞内DOX的蓄积未发生明显变化。CDL和SDL+SCL混合物组, 在光照后细胞内DOX的平均荧光强度值均有明显升高, 与光照前比较, 分别升高了1.55和1.25倍(P < 0.001), 并且CDL组明显强于SDL+SCL混合物组, 由荧光显微镜定性结果可知, 在第12 h时, 光照前所有的实验组中DOX主要分布在细胞质中。光照后, 游离DOX和SDL组细胞内DOX荧光强度未见明显变化, CDL与SDL+SCL混合物组明显增强, 并且CDL组DOX荧光强度更强, 这与之前定量检测的结果基本一致。并且在光照后, CDL组MCF7/ADR细胞核内的DOX分布明显增多。
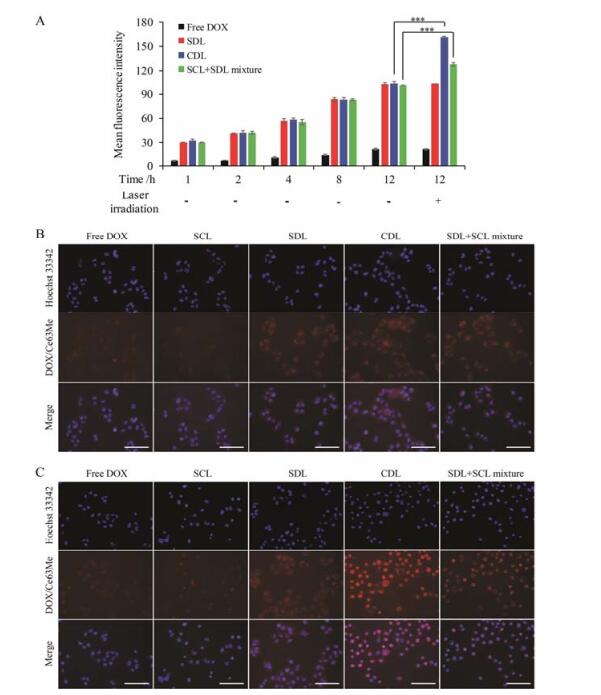
|
Figure 3 DOX accumulation in MCF7/ADR cells after 671 nm laser irradiation (2 W·cm-2, 2 min). A: Quantitative analysis of DOX accumulation in MCF7/ADR cells after treatment with Free DOX, SDL, CDL, or SDL+SCL mixture for 1, 2, 4, 8, 12 h with or without 671 nm laser irradiation (2 W·cm-2, 2 min). Laser irradiation was executed at 12 h before detection; B, C: Fluorescence images of DOX or Ce6tM in MCF7/ADR cells after incubation with Free DOX, SCL, SDL, CDL, or SDL+SCL mixture for 12 h before or after 671 nm laser irradiation (2 W·cm-2, 2 min). Laser irradiation was executed at 12 h. Scale bars represented a distance of 200 μm. n = 3, x± s. ***P < 0.001 |
671 nm激光(0.25 W·cm-2, 15 s)照射前后, CDL组MCF7/ADR细胞内DOX的蓄积情况见图 4。结果显示, 在12 h, CDL在经过671 nm激光光照后, 细胞中DOX的平均荧光强度值未见明显升高, 可能与激光强度明显减弱有关。继续避光孵育6 h后, 与未光照组比较, 光照后CDL组细胞内DOX蓄积水平明显提高(1.24倍, P < 0.001)。荧光显微镜图片与流式细胞仪定量结果一致, 并且可以观察到, CDL光照组在18 h时DOX细胞核内蓄积明显增加。这可能与CDL低功率、短时间光照的光敏感释药行为有关。
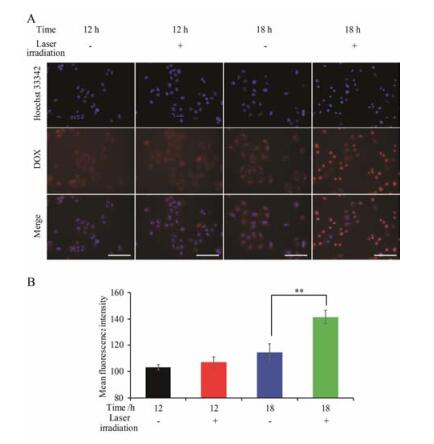
|
Figure 4 DOX accumulation in MCF7/ADR cells after 671 nm laser irradiation (0.25 W·cm-2, 15 s). A: Fluorescence images of DOX in MCF7/ADR cells after incubation with CDL for 12 h or 18 h with or without 671 nm laser irradiation (0.25 W·cm-2, 15 s). Laser irradiation was executed at 12 h. Scale bars represented a distance of 200 μm. B: Quantitative analysis of DOX accumulation in MCF7/ADR cells after incubation with CDL for 12 h or 18 h with or without 671 nm laser irradiation (0.25 W·cm-2, 15 s). Laser irradiation was executed at 12 h. n = 3, x± s. **P < 0.01 |
采用CCK8法检测671 nm激光(2 W·cm-2, 2 min)照射后CDL对MCF7和MCF7/ADR细胞的细胞毒性, 见图 5A。IC50值见表 1。因为与敏感的MCF7细胞比较, MCF7/ADR细胞中一些耐药相关蛋白过表达(如P糖蛋白等), 游离DOX对细胞的毒性很小。DOX的脂质体制剂SDL、CDL和SDL+SCL混合物组对MCF7/ADR细胞的细胞毒性比游离DOX略有增加, 这可能与脂质体制剂有利于增加DOX在耐药细胞中的蓄积有关。SCL未光照组在Ce6tM质量浓度为0~16 μg·mL-1内对MCF7/ADR和MCF7细胞均无明显毒性, 光照后SCL的细胞毒性明显增强。对于MCF7和MCF7/ADR细胞, 当Ce6tM浓度为8 μg·mL-1时, 未光照SCL组细胞存活率分别为(95.8 ± 1.0) %和(95.3 ± 1.7) %, 而光照SCL组细胞的存活率仅为(5.2 ± 0.6) %和(20.7 ± 4.6) %。这与Ce6tM在671 nm激光照射过程中产生1O2有关。不含光敏剂Ce6tM的实验组(游离DOX和SDL组)的细胞毒性在光照前后未见明显变化, 表明671 nm光照对DOX的细胞毒性没有显著影响。含光敏剂Ce6tM的实验组(CDL和SDL+SCL混合物组)在激光照射后细胞毒性均显著增强, 并且这种效果在耐药的MCF7/ADR细胞上更加明显。光照后CDL和SDL+SCL混合物组对MCF7/ADR细胞的IC50值比光照前分别降低了601.90和27.95倍, 表明光照组CDL能够有效增强MCF7/ADR细胞对DOX的敏感性。
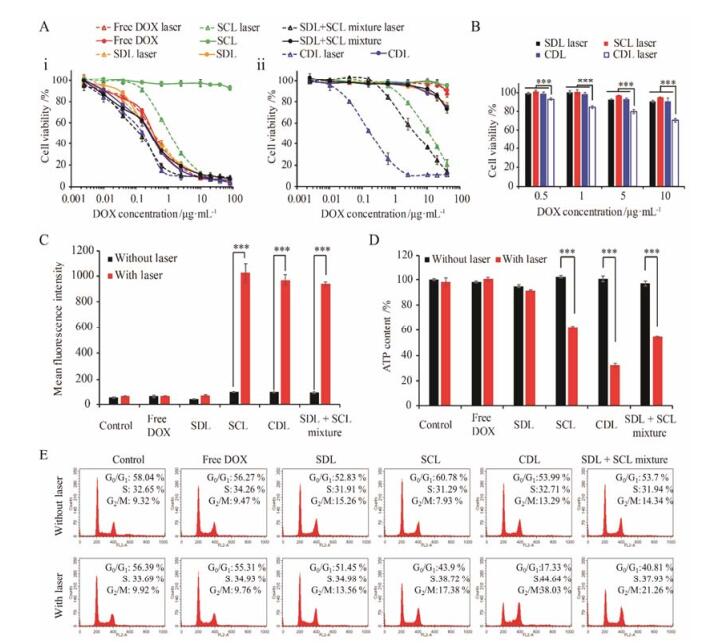
|
Figure 5 A: Cell viabilities of MCF7 (i) and MCF7/ADR (ii) cells after treatment with free DOX, SDL, SCL, CDL or SDL+SCL mixture for 48 h at different concentrations. In addition to the special note, the experimental condition of laser group was 2 min, 2 W·cm-2, 671 nm and the laser irradiation was executed at 12 h. The mass ratio of DOX to Ce6tM was 5:1; B: Cell viabilities of MCF7/ADR cells after treatment with SDL, SCL and CDL for 48 h at different concentrations with or without laser irradiation (671 nm, 0.25 W·cm-2, 15 s); C: Determination of 1O2 in MCF7/ADR cells after incubation with free DOX, SDL, SCL, CDL or SDL+SCL mixture for 12 h with or without laser irradiation; D: ATP levels in MCF7/ADR cells after incubation with free DOX, SDL, SCL, CDL, and SDL+SCL mixture for 24 h; E: Flow cytometry analysis for cell cycle changes of MCF7/ADR cells induced by free DOX, SCL, SDL, CDL or SDL+SCL mixture for 24 h. n = 3, x± s. ***P < 0.001 |
| Table 1 IC50 values and 95% confidence intervals (CIs) of DOX in MCF7 and MCF7/ADR cells after treatment with free DOX, SDL, CDL or SDL+SCL mixture for 48 h with or without laser irradiation. 671 nm laser irradiation (2 min, 2 W·cm-2) was executed at 12 h |
进一步考察了短时间、低功率(0.25 W·cm-2, 15 s)光照对不同制剂中DOX在MCF7/ADR细胞中的细胞毒性, 见图 5B。由于激光功率低、光照时间短, 光照后SCL组没有表现出明显的细胞毒性。未光照CDL组和光照SDL组细胞毒性也不明显。CDL光照组细胞毒性明显增加。这可能与低功率、短时间光照条件下CDL中DOX的释药特性有关。
6 细胞内1O2的产生利用2, 7-二氯荧光素二乙酸酯作为探针检测CDL在细胞中产生1O2的情况, 见图 5C。不含光敏剂Ce6tM的实验组(空白对照组、游离DOX和SDL组)细胞内荧光强度值在光照前后无明显变化。SCL、CDL和SDL+SCL混合物组细胞内的荧光强度值在光照后明显增加, 分别为光照前的10.45、9.91和9.96倍(P < 0.001), 表明在光照后SCL、CDL和SDL+SCL混合物组MCF7/ADR细胞内1O2水平迅速显著升高。
7 细胞内ATP水平MCF7/ADR细胞具有较强的药物外排能力, 其中一部分原因是它的细胞膜表面P糖蛋白过表达。P糖蛋白是ABC蛋白家族中的一员, 它发挥作用时需要ATP提供能量。降低MCF7/ADR细胞内ATP的水平对逆转耐药有重要意义。光照前后CDL对MCF7/ ADR细胞内ATP水平的影响, 见图 5D。MCF7/ADR细胞在游离DOX、SDL、SCL、CDL和SDL+SCL混合物孵育24 h后, 细胞内ATP水平均未发生明显变化。光照后, 空白对照组和SDL组细胞内的ATP水平也没有发生变化。SCL、CDL和SDL+SCL混合物组细胞内ATP水平在光照后明显降低, 分别为光照前的0.37、0.32和0.36倍(P < 0.001)。这可能与光敏剂在光照过程中产生的1O2的破坏作用以及细胞活力的降低有关。
8 细胞周期经过不同制剂处理后, 各组MCF7/ADR细胞的周期分布情况见图 5E。未光照的游离DOX组和SCL组细胞的周期分布和空白对照组接近。未光照的DOX脂质体制剂组(SDL、CDL和SDL+SCL混合物组)的细胞比空白对照组G0/G1期的分布略有减少, G2/M期略有增加。游离DOX和SDL组的细胞在经过光照处理后细胞周期与光照前未发生明显改变。SCL、CDL和SDL+SCL混合物光照组细胞周期发生显著变化, 主要表现为G0/G1期的分布明显降低, G2/M期分布明显增加。其中CDL光照组细胞的细胞周期分布变化最大, G0/G1期、S期和G2/M期分别从空白对照组的56.39%、33.69%和9.92%变化为17.33%、44.64%和38.03%, 细胞周期被明显阻滞。
9 DOX体内分布DOX在荷MCF7/ADR肿瘤裸鼠体内各组织的分布情况见图 6。考虑到细胞水平与动物水平的不同, 动物给药后光照治疗时间的选择在此主要依据预实验中DOX肿瘤组织内分布峰值时间而确定(4 h, 结果未列出)。结果显示, 给药4 h后, 未光照的SDL、CDL和SDL+SCL混合物组中DOX在各组织脏器中的分布基本一致, 并且所有脂质体制剂组在心脏组织中DOX分布明显少于游离DOX组, 这与脂质体的包载有关。脂质体表面有PEG层覆盖, 呈近中性, 该PEG层能够减缓药物在体内的清除速率, 延长脂质体的血液循环时间, 并且脂质体的粒径在90 nm左右, 能够利用EPR被动靶向效应, 增加DOX在肿瘤组织中的蓄积。SDL组光照后在肿瘤部位的分布未见明显变化, 这可能与671 nm光照(2 W·cm-2, 2 min)对SDL中DOX释放行为及在MCF7/ADR细胞中的蓄积均没有显著影响有关。CDL组明显增多, 增加了1.93倍。给药24 h后, 脂质体制剂组在肿瘤部位的蓄积明显多于游离DOX组。光照CDL组的DOX在肿瘤部位依然保持着较高的蓄积。

|
Figure 6 Quantitative analysis of in vivo biodistribution of DOX in MCF7/ADR tumor-bearing mice at 4 h and 24 h after intravenous administration of free DOX, SDL, CDL and SDL+SCL mixture. 671 nm laser irradiation (2 W·cm-2, 2 min) was executed at 4 h after administration. The dose of doxorubicin was 5 mg·kg-1. n = 3, x± s. **P < 0.01, ***P < 0.001 |
经过不同制剂给药后, 各组荷MCF7/ADR乳腺癌裸鼠肿瘤体积变化情况见图 7。结果显示, 生理盐水组荷瘤裸鼠的肿瘤体积增加非常迅速, 在14天内, 肿瘤平均体积比第1次给药时增加了34.11倍。由于SCL在未光照时细胞毒性较低, SCL组的肿瘤体积变化曲线与生理盐水组相似, 14天后增加了31.09倍。DOX的脂质体制剂SDL和CDL组抑制肿瘤的效果优于游离DOX组。CDL组和SDL组抑瘤效果近似, 这也再次说明了Ce6tM分子在未光照条件下几乎没有抗肿瘤活性。SCL光照组光照后, TIR达到(53.2 ± 15.9) %, 说明光照过程中SCL产生的1O2能够有效地杀死肿瘤细胞。游离DOX组、SDL组、CDL组、SCL光照组、SDL+SCL混合物光照组和CDL组均显示了不同程度的抑制肿瘤生长的效果, 它们对应的TIR分别为(36.8 ± 16.4) %、(61.8 ± 3.0) %、(61.4 ± 10.2) %、(53.2 ± 15.9) %、(76.1 ± 11.6) %和(94.7 ± 6.2) %。CDL光照组抑瘤效果最为显著, 14天后肿瘤体积仅增加了1.22倍。这可能与DOX化疗、Ce6tM光动力学治疗及DOX光敏感快速释放特性3种因素在增强抗肿瘤活性上有一定的协同效应有关。

|
Figure 7 Inhibitory effect of CDL on tumor growth. A: The variation profiles of tumor volumes. The red arrows indicated the time points for drug administrations; B: Tumor weights at the end of the experiment; C: Picture of tumors on day 14 after first drug admini stration and representative photos of tumor-bearing mice at the end of the experiment. n = 5, x± s. *P < 0.05, **P < 0.01 |
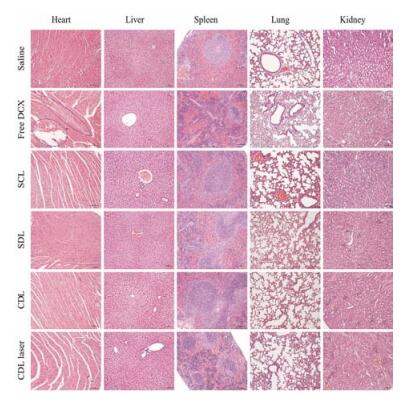
给药后, BALB/c-nu裸鼠各脏器的HE染色切片结果见图 8。据文献报道, DOX在高剂量多次给药后, 会引起严重的系统毒性, 包括心脏毒性和肾毒性等[16]。在实验中观察到类似的现象, 在给药14天后, 游离DOX组的心脏组织HE切片明显异常。CDL和CDL光照组没有引起裸鼠的心、肝、脾、肺和肾组织的炎症反应或病理损伤, 表明光敏剂Ce6tM具有较高的生物安全性, 并且光照是一种局部治疗手段, 对于未光照的组织器官, Ce6tM没有明显细胞毒性, 此外, CDL有助于减少DOX在心脏组织中的分布, 减轻DOX的毒副作用。
|
Figure 8 Histopathological analysis of tissue sections stained with HE after treatments with saline, free DOX, SCL, SDL, CDL and CDL laser. The blue circle indicated the injured myocardium tissue area. The scale bars represented a distance of 100 μm |
本文首先采用薄膜水化-硫酸铵主动载药法制备了具有光敏感特性的Ce6tM与DOX的共输送脂质体CDL。以37 ℃条件下脂质体中DOX包载稳定性及光敏感释药速度为指标, 确定了最佳处方, 即Ce6tM载药量3%, 胆固醇与SPC质量比为1:4。CDL具有良好的光刺激响应性, 可以在671 nm激光照射过程中快速释放内水腔中包载的化疗药物DOX。同时, CDL在短时间、低功率的激光照射后, 与未光照组相比, DOX释放速度明显加快。对CDL光敏感释药现象的机制进一步探索发现, Ce6tM在光照下光动力学反应对脂质体中DOX的释放起主导作用。光动力学过程中产生的1O2作用于脂质体膜, 不可逆地破坏了其化学结构, 增加了脂质体磷脂双分子层的通透性。从体外耐DOX的MCF7/ADR乳腺癌细胞模型实验结果可以看出, CDL同时具有的光动力学治疗、化疗和光敏感释药功能在一定程度上能够更好地逆转乳腺癌的耐药。初步的机制研究结果表明, 这可能与肿瘤细胞内DOX的蓄积增加、ATP水平降低及细胞周期的阻滞有关。荷MCF7/ADR乳腺癌细胞BALB/c-nu裸鼠动物模型的动物实验结果表明, CDL光照组肿瘤组织中DOX的蓄积显著增加, 并且显示出良好抗肿瘤生长的效果, TIR达到(94.7 ± 6.2) %。此外, CDL制备过程简单, 对纳米药物产业化具有一定的指导意义。
| [1] | Chen WQ. Cancer statistics: updated cancer burden in China[J]. Chin J Cancer Res, 2015, 27: 1. |
| [2] | Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI:10.3322/caac.21338 |
| [3] | Yin Q, Shen JN, Zhang ZW, et al. Reversal of multidrug resistance by stimuli-responsive drug delivery systems for therapy of tumor[J]. Adv Drug Deliv Rev, 2013, 65: 1699–1715. DOI:10.1016/j.addr.2013.04.011 |
| [4] | He QY. Tumor heterogeneity and drug resistance of targeted antitumor agents[J]. Acta Pharm Sin (药学学报), 2016, 51: 197–201. |
| [5] | Swain SM, Baselga J, Kim SB, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer[J]. N Engl J Med, 2015, 372: 724–734. DOI:10.1056/NEJMoa1413513 |
| [6] | Lucena SR, Salazar N, Gracia-Cazaña T, et al. Combined treatments with photodynamic therapy for non-melanoma skin cancer[J]. Int J Mol Sci, 2015, 16: 25912–25933. DOI:10.3390/ijms161025912 |
| [7] | Tang S, Yin Q, Zhang ZW, et al. Co-delivery of doxorubicin and RNA using pH-sensitive poly (β-amino ester) nanoparti-cles for reversal of multidrug resistance of breast cancer[J]. Biomaterials, 2014, 35: 6047–6059. DOI:10.1016/j.biomaterials.2014.04.025 |
| [8] | Wang TT, Wang DG, Yu HJ, et al. Intracellularly acid-switchable multifunctional micelles for combinational photo/chemotherapy of the drug-resistant tumor[J]. ACS Nano, 2016, 10: 3496–3508. DOI:10.1021/acsnano.5b07706 |
| [9] | Park SJ, Park W, Na K. Tumor intracellular-environment responsive materials shielded nano-complexes for highly efficient light-triggered gene delivery without cargo gene damage[J]. Adv Funct Mater, 2015, 25: 3472–3482. DOI:10.1002/adfm.v25.23 |
| [10] | Hu YP, Zhou HY, Shen S. Preparation of doxorubicin-loaded Fe3O4-TiO2 nanoparticles and evaluation of chemo-photody-namic therapy in vivo[J]. Acta Pharm Sin (药学学报), 2016, 51: 1340–1344. |
| [11] | Gao GY, Chen ML, Li MY, et al. Current status and prospect of translational medicine in nanotechnology[J]. Acta Pharm Sin (药学学报), 2015, 50: 919–924. |
| [12] | Lucky SS, Soo KC, Zhang Y. Nanoparticles in photodynamic therapy[J]. Chem Rev, 2015, 115: 1990–2042. DOI:10.1021/cr5004198 |
| [13] | Manzoor AA, Lindner LH, Landon CD, et al. Overcoming limitations in nanoparticle drug delivery: triggered, intravas-cular release to improve drug penetration into tumors[J]. Cancer Res, 2012, 72: 5566–5575. DOI:10.1158/0008-5472.CAN-12-1683 |
| [14] | Kong G, Anyarambhatla G, Petros WP, et al. Efficacy of liposomes and hyperthermia in a human tumor xenograft model: importance of triggered drug release[J]. Cancer Res, 2000, 60: 6950–6957. |
| [15] | Frangioni JV. In vivo near-infrared fluorescence imaging[J]. Curr Opin Chem Biol, 2003, 7: 626–634. DOI:10.1016/j.cbpa.2003.08.007 |
| [16] | Saad SY, Najjar TA, Al-Rikabi AC. The preventive role of deferoxamine against acute doxorubicin-induced cardiac, renal and hepatic toxicity in rats[J]. Pharmacol Res, 2001, 43: 211–218. DOI:10.1006/phrs.2000.0769 |
 2017, Vol. 52
2017, Vol. 52


