2. 军事医学科学院毒物药物研究所, 北京 100850
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China
阿奇霉素是一种临床用途广泛的大环内脂类抗生素, 尤其在治疗小儿支气管炎等方面疗效显著[1, 2], 开发其儿童用口服制剂具有广阔的市场前景和较大的临床应用价值。由于婴幼儿患者对药品的顺应性较差, 口服给药时只能选择易于吞咽的液体制剂, 而这种高度分散的剂型使掩蔽药物苦味的难度大为增加, 给阿奇霉素儿童用口服制剂的设计带来了极大的挑战, 甚至决定制剂研究的成败。目前成功上市的阿奇霉素儿童用制剂仅有辉瑞公司的干混悬剂, 该产品利用阿奇霉素在碱性条件下溶解度极低的特性, 加入碱化剂降低药物在口腔唾液中的溶出, 从而达到掩蔽苦味的目的。目前基于其他原理对阿奇霉素进行掩味的技术与方法尚未取得较大突破。
脂质纳米反胶束是指类脂在油相中自发形成的亲水头基在内、疏水链在外的纳米尺度的缔合结构。将纳米脂质反胶束技术应用于儿童用口服制剂领域, 既能通过油相对亲油的纳米反胶束的阻隔作用, 降低制剂通过口腔时药物在唾液中的释放, 又能通过刺激脂酶、胆盐的分泌及增加淋巴转运的方式促进药物的吸收, 达到掩蔽苦味和提高口服生物利用度的双重作用[3-6]。
本研究以磷脂为膜材, 采用脂质纳米反胶束技术制备阿奇霉素纳米反胶束油溶液, 再以二氧化硅为吸附剂固化得到阿奇霉素干乳(DE), 并对其进行物理表征及体内外评价。
材料与方法试药 阿奇霉素(四川江川制药有限公司); 中链脂肪酸甘油酯(MCT, 铁岭北亚药用油有限公司); 天然及合成磷脂(E80, 德国Lipoid公司); 二氧化硅(Syloid 244FP, 美国Grace Davison公司); 番茄红素(德国BASF公司); 月桂酸聚乙二醇甘油酯(Gelucire 44/14, 法国嘉法狮公司); 三氯蔗糖(山东三和维信生物科技有限公司); 樱桃香精(意大利Kerry公司); MCG 611P (VIVAPUR, 德国JRS Pharma公司); 色谱乙腈(美国Fisher Chemical公司)。
主要仪器 Zetasizer Nano ZS90 (Malvern, 英国马尔文仪器公司); 扫描电子显微镜(SEM)、透射电子显微镜(TEM) (日本Hitachi公司); X-射线衍射仪(D8-Advance, 德国布鲁克公司); 光学显微镜(X41-32RPL, 奥林巴斯公司); Shimadzu高效液相色谱仪(双泵LC-20A、SIL-20AC自动样器、CTO-20AC柱温箱、SPD-M20A检测器, 日本岛津株式会社)。
阿奇霉素脂质纳米反胶束的制备 取混合磷脂4.8 g置于烧杯中, 通入氮气保护, 60 ℃下加热至熔融, 加入阿奇霉素0.5 g及MCT 20 g, 搅拌至澄明状态, 60 ℃保温、避光氮气保护下, 继续搅拌0.5 h后冷却至室温, 即得阿奇霉素脂质纳米反胶束油溶液。
阿奇霉素脂质纳米反胶束的表征 取适量阿奇霉素脂质纳米反胶束油溶液分散在正庚烷中稀释1 000倍, 滴加于覆盖碳膜的铜网上, 用2%磷钨酸负染, 待反胶束中载液挥发后, 用TEM观察。
干乳制备 取阿奇霉素脂质纳米反胶束油溶液2 g, 加入二氧化硅1.6 g, 研磨固化。将所得的固化粉置于研钵中, 依次加入乳化剂、助悬剂、0.05% (w/v)樱桃香精和0.025%三氯蔗糖, 研磨混合均匀, 即得掩味干乳(临用时加入50 mL水分散服用)。
油相分散均匀性考察
染色实验 取适量阿奇霉素脂质纳米反胶束油溶液, 加入少量番茄红素溶液进行染色。将染色的油溶液按干乳制备中的固化方法进行固化, 并观察固化粉的染色情况[7]。
SEM观察 将双面胶带黏附于铜锭上, 取适量固化粉末喷于其上, 涂布均匀。喷金后用SEM观察粉末分散状况、形状和表面形态。
处方优化 将阿奇霉素脂质纳米反胶束油溶液固化粉的用量固定, 分别考察乳化剂Gelucire 44/14及助悬剂MCG 611P的不同用量对干乳粉末分散性及加水50 mL后乳滴分散状况的影响, 确定干乳的较优处方。
干乳固体粉末的表征
X-射线粉末衍射 取适量阿奇霉素原料药、空白干乳及阿奇霉素掩味干乳进行X-射线粉末衍射, 其中X-射线源为铜靶CuKα (λ = 1.540 5 μm), 探测器为阵列探测器。
SEM观察 将双面胶带黏附于铜锭上, 取适量阿奇霉素原料药、空白干乳及掩味干乳粉末喷于其上, 涂布均匀。喷金后用SEM观察粉末形状、表面形态及药物结晶状况。
乳化后乳剂的表征
粒径和zeta电位的测定 取阿奇霉素干乳加水稀释50倍, 轻摇5 min使分散乳化, 静置后取上清液, 用Zetasizer Nano ZS90测定其乳滴粒径及zeta电位。
TEM观察 取阿奇霉素干乳加水稀释50倍, 轻摇5 min, 充分分散乳化, 静置后取上清液滴加于覆盖碳膜的铜网上, 用2%磷钨酸负染, 待乳剂中载液挥发后, 用TEM观察乳滴的大小及形状。
口尝苦度的测定 招募志愿者进行苦味敏感度测试筛选, 最终选择了8名健康志愿者(男3名、女5名)作为受试者, 在试验前签订知情同意书。分别称取相当于10 mg阿奇霉素量的掩味干乳及上市制剂希舒美(美国Pfizer公司, 规格100 mg), 分散在20 mL水中, 让志愿者(n = 8) 进行口尝评分, 其中1分:不苦; 2分:微苦; 3分:中度苦; 4分:极苦。具体方法参照文献[8-10], 取5 mL待口尝溶液由志愿者含于口中, 计时15 s, 此间口腔做漱口动作, 以使舌头能充分感受药物苦味, 让志愿者按评分等级打分, 吐出, 漱口5次, 至口腔无苦味, 5 min后评价另一溶液。
模拟口腔释放
人工唾液的配制 取适量NaCl分散于1 L水中调节pH, 即得模拟口腔唾液。其中模拟唾液的pH为5.7~7.5, 渗透压为0.050~0.100 Osmol。
色谱条件 色谱柱: TechMate C18-STII, 250 mm × 4.6 mm, 5 μm。流动相: 0.5 mol·mL-1磷酸盐缓冲液(pH 8.0~8.2):乙腈为40:60 (v/v)。流速为1.0 mL·min-1, 柱温: 30 ℃, 检测器: UV, 检测波长: 210 nm, 进样量: 20 μL。
模拟口腔释放 分别称取相当于10 mg阿奇霉素量的掩味干乳、希舒美及阿奇霉素原料药, 加入20 mL模拟唾液中, 用磁力搅拌装置进行模拟释放实验。控制温度为37 ℃, 转速为100 r·min-1。释放实验分别在0、5、10、20和30 min时取样, 取样量为200 μL, 在转速4 000 r·min-1下离心后取上清液20 μL进行液相色谱测定, 计算峰面积, 测定绘制口腔释放曲线(n = 3) 并比较掩味干乳与希舒美的释放相似因子f2。
| $ {f_2} = 50\log \left[ {\frac{{100}}{{\sqrt {1 + \frac{{\sum\nolimits_{i = 1}^n {{{\left( {{R_t} - {T_t}} \right)}^2}} }}{n}} }}} \right] $ |
式中, Rt、Tt分别表示两种制剂在第n个取样点的平均累积释放度。
肠黏膜刺激性 取24只Wistar大鼠(由军事医学科学院动物中心提供, 合格证号: SCXK-军2012-0004) 分为4组, 每组6只, 禁食、禁水12 h后, 4组分别灌注相同体积的生理盐水(空白组)、阿奇霉素水混悬液(阿奇霉素组)、阿奇霉素掩味干乳(干乳组)及希舒美。除空白组外, 其他组均含阿奇霉素10 mg。动物禁食不禁水, 24 h后取大鼠空肠, 生理盐水轻微冲洗干净后, 放入4%福尔马林中固定48 h后, 制备石蜡切片, 在显微镜下进行观察肠黏膜情况。
结果 1 阿奇霉素脂质纳米反胶束的表征由TEM结果可观察形成的脂质反胶束, 其粒径小于100 nm, 类圆形(图 1)。

|
Figure 1 Transmission electron microscope (TEM) photomi crographs of azithromycin reverse nano-micelles |
从染色实验结果可以看出, 固化粉末染色均匀, 这表明含阿奇霉素油相在吸附载体二氧化硅中分散均匀。从SEM结果进一步说明油相在固化粉末中分散均匀, 颗粒平整均一且疏松, 没有出现团聚成块现象。番茄红素染色的阿奇霉素油溶液及其固化粉末如图 2A所示, 干乳固体粉末的扫描电镜结果见图 2B。

|
Figure 2 Typical dying tests and scanning electron microscope (SEM). A: Photographs of azithromycin oil solution and solidi fied powders with silicon dioxide (Syliod 244 FP); B: SEM photographs of dry emulsion (DE) powder |
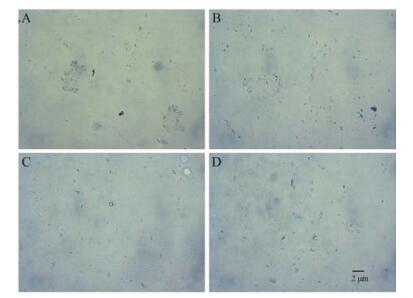
当固定MCG 611P的用量为0.6%时, 乳化剂Gelucire 44/14用量为0.2%、0.4%和0.6% (w/w)的掩味干乳乳化后, 乳滴分散显微图见图 3, 乳滴粒径和多分散系数(PDI)结果见表 1; 当固定Gelucire 44/14的用量为0.4%时, 助悬剂MCG 611P不同用量混悬剂的沉降比见表 2, 其中用量为0.2%时, 干乳加水混悬能立即再分散, 无沉降分层, 无需继续增加用量。结果表明, 干乳的较优处方为Gelucire 44/14用量为0.4%, MCG 611P用量为0.2%。
|
Figure 3 Photomicrographs of reconstitution emulsion droplets were dispersed by different amounts of Gelucire 44/14. A: 0.0%; B: 0.2%; C: 0.4%; D: 0.6% |
| Table 1 Particle sizes and polydispersity index (PDI) of recon stitution emulsion droplets were dispersed by different amounts of Gelucire 44/14 |
| Table 2 Sedimentation rate of different amounts of MCG 611P |
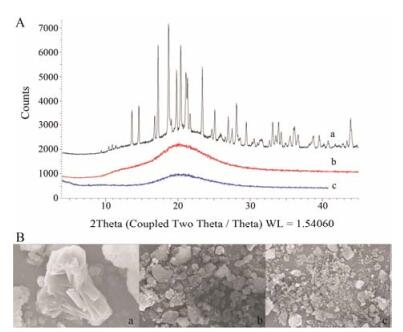
X-射线粉末衍射及SEM结果表明, 在油相吸附分散于二氧化硅载体中, 未见药物结晶析出, 药物以“溶解的分子状态”存在于制剂中。阿奇霉素原料药、空白干乳及掩味干乳的X-射线粉末衍射结果及SEM结果见图 4。
|
Figure 4 Typical powder X-ray diffractogram (A) and SEM (B) of azithromycin (a), pure excipients (b) and DE (c) |
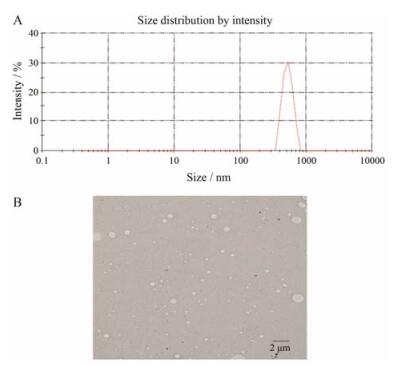
掩味干乳加水混悬后, 外观均一, 再分散性良好。结果表明, 在水中形成的乳滴粒径分布均匀, 平均粒径在530 nm左右, 且形态圆整。乳化后乳滴的zeta电位、粒径及PDI测定结果见表 3, 乳滴的粒径分布图及TEM结果见图 5。
| Table 3 Particle size, zeta potential and PDI of reconstitution emulsion droplets. n = 3, x± s |
|
Figure 5 Size distribution by dynamic light scattering (DLS) and typical TEM of reconstitution emulsion droplets. A: Size distribution by intensity of reconstitution emulsion droplets; B: Photomicrographs of reconstitution emulsion droplets |
口尝评分结果表明, 阿奇霉素掩味干乳制剂与希舒美的掩味效果相当, 其得分分别为1.88 ± 0.60和1.25 ± 0.43 (n = 8)。阿奇霉素掩味干乳与希舒美在模拟口腔中都表现出缓慢释放, 当阿奇霉素原料药累积释放量达到90%时, 两者分别仅释放8%和4%左右, 而释放曲线的相似因子f2为66.24, 表明两者释放曲线相似, 无明显差异。模拟口腔释放曲线见图 6。

|
Figure 6 The release profile of DE, azithromycin and zithromax in artificial saliva. n = 3, x± s |
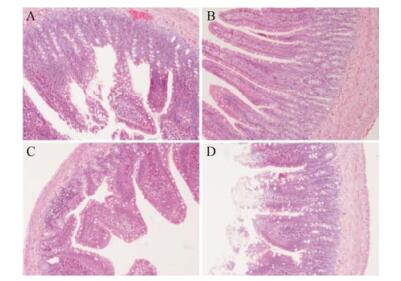
肠黏膜刺激性实验表明, 阿奇霉素干乳可减轻阿奇霉素原料药对肠黏膜的刺激性, 而希舒美则没有减少刺激的作用。观察空白组、阿奇霉素组、干乳组和希舒美组大鼠的空肠切片发现, 空白组肠壁黏膜层及黏膜下、浆膜层、肠壁全层结构清晰, 绒毛柱状上皮及杯状细胞等细胞成分分布均匀, 固有层中毛细血管、毛细淋巴及中央乳糜管未见显著变化; 干乳组与空白组相近, 但部分黏膜层表面偶见水肿、脱失, 黏膜下可见轻微局灶性炎性细胞浸润, 固有层中可见嗜酸细胞浸润; 希舒美组与阿奇霉素组对肠黏膜具有一定刺激性, 其黏膜层表面可见明显的绒毛顶端脱失, 局部可见明显的炎细胞浸润、毛细血管充血现象。希舒美组的肠黏膜刺激较干乳组更为严重。4组切片显微图见图 7。
|
Figure 7 Typical photographs of stimulatory in intestinal tract (100×). A: Azithromycin; B: Physiological saline; C: Dry emulsion of Azithromycin; D: Zithromax |
苦味来源于药物分子与味蕾蛋白相互作用, 苦味大小与药物浓度呈正相关, 所以阻碍药物分子在口腔唾液中的释放就成为掩蔽制剂苦味的关键[11, 12]。对儿童用制剂而言, 由于只能选择分散度和体积均较大的液体剂型, 这种制剂在给药时明显延长了在口腔中滞留的时间和接触的面积, 从而极大地提高了掩味的难度[13-15]。本研究中所选用的模型药物阿奇霉素具有给药剂量大(单剂量0.1 g)、苦味极其突出的特点, 作者前期研究发现水中含20 ppm以上的阿奇霉素, 就能产生成人都难以忍受的苦味。
脂质纳米反胶束技术以生物相容性很高的天然或合成磷脂为膜材, 成功实现了从蛋白多肽等大分子到普通小分子药物的包载, 使它们以油溶性纳米粒的形式稳定存在于植物油溶液中, 为后续实现多剂型(固体/液体)、多途径(口服/注射)给药奠定基础。将该技术用于阿奇霉素儿童用口服制剂的研究中, 由于绝大部分阿奇霉素都在油相中形成了稳定的纳米胶束, 在与口腔的短时间接触时, 只有极微量药物分子迁移到水相中, 从源头上达到掩蔽苦味的目的。采用胶态二氧化硅将油溶液固化, 制备得到阿奇霉素干乳。实验表明, 干乳与上市制剂的苦味评分相当, 口腔模拟释放曲线相似, 这说明了干乳的掩味效果与希舒美相近, 可以达到掩味的目的。
干乳的制备方法有吸附、喷雾干燥、冷冻干燥及旋转蒸发等方法[16-21], 这些步骤中都有先形成液态乳的一步, 这样可以使乳滴在形成干乳前分散均匀。本文是通过二氧化硅直接吸附油相制备干乳, 加水后是否能形成分散均匀的乳滴, 成为制剂质量评价的另一个重点。通过染色实验、乳化后乳滴粒径分布、SEM及TEM的结果可知, 本文制备的干乳可在加水分散后形成粒径分布均匀、形态圆整的乳滴。
处方中二氧化硅的作用非常关键, 一方面作为吸附剂吸附油相; 另一方面作为分散剂, 将油相均匀分散, 更是作为固体乳化剂与Gelucire 44/14和MCG 611P共同帮助油相在水相中的乳化。二氧化硅作为乳化剂早有文献报道[22, 23], 但乳化效果不足以完全将本制剂中的油相分散在水相中, 因而需要其他辅料帮助。Gelucire 44/14是一种水分散乳化剂, 在它的参与下可以很好地分散油滴, 由于它的水分散性, 可进一步提高制剂的再分散性, 使制剂在水中分散后的外观更均一。MCG 611P在处方中的作用主要是使制剂在混悬后能迅速分散, 也具有稳定乳剂的作用。
干乳与希舒美相比, 由于阿奇霉素以纳米胶束的形式从油相中缓慢释放, 降低与肠黏膜直接接触的药物浓度, 从而减少了肠黏膜刺激性。至于能否通过刺激脂酶、胆盐的分泌及增加淋巴转运的方式促进药物的吸收[24-28], 还需要在药物代谢动力学研究方面进一步验证。
阿奇霉素掩味干乳在相同剂量下可以达到与希舒美相近的掩味效果, 易于被儿童患者接受, 并且肠黏膜刺激性更小, 安全性更高, 因而作为儿童用口服制剂具有很好的发展前景和临床价值。
| [1] | Zhong YB. Clinical efficacy and safety of azithromycin in the treatment of children with acute bronchitis[J]. Chin Med Eng (中国医学工程), 2015, 23: 41–43. |
| [2] | Wang P, Li Y. Azithromycin, a new macrolioe antibiotic[J]. Chin J New Drugs (中国新药杂志), 1996, 5: 180–183. |
| [3] | Qi XD, Wang X, He XM. Transdermal delivery of fat-soluble and water-soluble drugs based on lecithin reverse micellar system[J]. Chin J Pharm (中国医药工业杂志), 2016, 47: 1275–1279. |
| [4] | Du X, Song N, Yang YW, et al. Reverse micelles based on β-cyclodextrin-incorporated amphiphilic polyurethane copolymers for protein delivery[J]. Polym Chem, 2014, 5: 5300–5309. DOI:10.1039/C4PY00278D |
| [5] | Wang T, Wang N, Song H, et al. Preparation of an anhydrous reverse micelle delivery system to enhance oral bioavailability and anti-diabetic efficacy of berberine[J]. Eur J Pharm Sci, 2011, 44: 127–135. DOI:10.1016/j.ejps.2011.06.015 |
| [6] | Jones MC, Gao H, Leroux JC. Reverse polymeric micelles for pharmaceutical applications[J]. J Control Release, 2008, 132: 208–215. DOI:10.1016/j.jconrel.2008.05.006 |
| [7] | Chambin O, Bellone C, Champion D, et al. Dry adsorbed emulsion: 1. Characterization of an intricate physicochemical structure[J]. J Pharm Sci, 2000, 89: 991–999. DOI:10.1002/(ISSN)1520-6017 |
| [8] | Kharb V, Saharan VA, Dev K, et al. Formulation, evaluation and 32 full factorial design-based optimization of ondansetron hydrochloride incorporated taste masked microspheres[J]. Pharm Dev Technol, 2014, 19: 839–852. DOI:10.3109/10837450.2013.836220 |
| [9] | Pein M, Preis M, Eckert C, et al. Taste-masking assessment of solid oral dosage forms——a critical review[J]. Int J Pharm, 2014, 465: 239–254. DOI:10.1016/j.ijpharm.2014.01.036 |
| [10] | Coupland JN, Hayes JE. Physical approaches to masking bitter taste: lessons from food and pharmaceuticals[J]. Pharm Res, 2014, 31: 2921–2939. DOI:10.1007/s11095-014-1480-6 |
| [11] | Hayashi N, Ujihara T, Chen R, et al. Objective evaluation methods for the bitter and astringent taste intensities of black and oolong teas by a taste sensor[J]. Food Res Int, 2013, 53: 816–821. DOI:10.1016/j.foodres.2013.01.017 |
| [12] | Lipchock SV, Reed DR, Mennella JA. Relationship between bitter-taste receptor genotype and solid medication formulation usage among young children: a retrospective analysis[J]. Clin Ther, 2012, 34: 728–733. DOI:10.1016/j.clinthera.2012.02.006 |
| [13] | Walch AC, Henin E, Berthiller J, et al. Oral dosage form administration practice in children under 6 years of age: a survey study of paediatric nurses[J]. Int J Pharm, 2016, 511: 855–863. DOI:10.1016/j.ijpharm.2016.07.076 |
| [14] | Shawahna R. Pediatric biopharmaceutical classification system: using age-appropriate initial gastric volume[J]. AAPS J, 2016, 18: 728–736. DOI:10.1208/s12248-016-9885-2 |
| [15] | Nunn T, Williams J. Formulation of medicines for children[J]. Br J Clin Pharmacol, 2005, 59: 674–676. DOI:10.1111/bcp.2005.59.issue-6 |
| [16] | Secolin VA, Souza CR, Oliveira WP. Spray drying of lipid-based systems loaded with Camellia sinensis polyphenols[J]. J Liposome Res, 2016, 27: 11–20. |
| [17] | Pongsamart K, Kleinebudde P, Puttipipatkhachorn S. Prepa-ration of fenofibrate dry emulsion and dry suspension using octenyl succinic anhydride starch as emulsifying agent and solid carrier[J]. Int J Pharm, 2016, 498: 347–354. DOI:10.1016/j.ijpharm.2015.12.041 |
| [18] | Lim ASL, Roos YH. Spray drying of high hydrophilic solids emulsions with layered interface and trehalose-maltodextrin as glass formers for carotenoids stabilization[J]. J Food Eng, 2016, 171: 174–184. DOI:10.1016/j.jfoodeng.2015.10.026 |
| [19] | Wang J, Hu Y, Li L, et al. Indomethacin-5-fluorouracil-methyl ester dry emulsion: a potential oral delivery system for 5-fluorouracil[J]. Drug Dev Ind Pharm, 2010, 36: 647–656. DOI:10.3109/03639040903410318 |
| [20] | Christensen KL, Pedersen GP, Kristensen HG. Preparation of redispersible dry emulsions by spray drying[J]. Int J Pharm, 2001, 212: 187–194. DOI:10.1016/S0378-5173(00)00596-2 |
| [21] | Christensen KL, Pedersen GP, Kristensen HG. Technical optimisation of redispersible dry emulsions[J]. Int J Pharm, 2001, 212: 195–202. DOI:10.1016/S0378-5173(00)00595-0 |
| [22] | Kawaguchi M. Silicone oil emulsions stabilized by polymers and solid particles[J]. Adv Colloid Interface Sci, 2016, 233: 186–199. DOI:10.1016/j.cis.2015.06.005 |
| [23] | Shen M, Resasco DE. Emulsions stabilized by carbon nanotube-silica nanohybrids[J]. Langmuir, 2009, 25: 10843–10851. DOI:10.1021/la901380b |
| [24] | Zhang JF, Liu C, Zhang J, et al. Preparation and evaluation of silybin nanocrystallines self-stabilizing Pickering emulsion[J]. Acta Pharm Sin (药学学报), 2016, 51: 813–820. |
| [25] | Yoshida T, Nakanishi K, Yoshioka T, et al. Oral tacrolimus oil formulations for enhanced lymphatic delivery and efficient inhibition of T-cell's interleukin-2 production[J]. Eur J Pharm Biopharm, 2016, 100: 58–65. DOI:10.1016/j.ejpb.2015.12.006 |
| [26] | Rezhdo O, Speciner L, Carrier R. Lipid-associated oral delivery: mechanisms and analysis of oral absorption enhancement[J]. J Control Release, 2016, 240: 544–560. DOI:10.1016/j.jconrel.2016.07.050 |
| [27] | Yáñrez JA, Wang SW, Knemeyer IW, et al. Intestinal lymphatic transport for drug delivery[J]. Adv Drug Deliv Rev, 2011, 63: 923–942. DOI:10.1016/j.addr.2011.05.019 |
| [28] | Sun M, Zhai X, Xue K, et al. Intestinal absorption and intestinal lymphatic transport of sirolimus from self-microe-mulsifying drug delivery systems assessed using the single-pass intestinal perfusion (SPIP) technique and a chylomicron flow blocking approach: linear correlation with oral bioavai-labilities in rats[J]. Eur J Pharm Sci, 2011, 43: 132–140. DOI:10.1016/j.ejps.2011.04.011 |
 2017, Vol. 52
2017, Vol. 52


