2. 军事医学科学院放射与辐射医学研究所, 北京 100850;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
Sirtuins家族是一类依赖NAD+的组蛋白去乙酰化酶, 属于组蛋白去乙酰化酶的第Ⅲ亚族[1]。人类sirtuins家族有7个成员: SIRT1~SIRT7, 其中: SIRT1和SIRT2的去乙酰化酶活性最强, 生理功能最为重要。已有研究表明, SIRT1和SIRT2在多种生理和病理过程中发挥重要作用[2]。
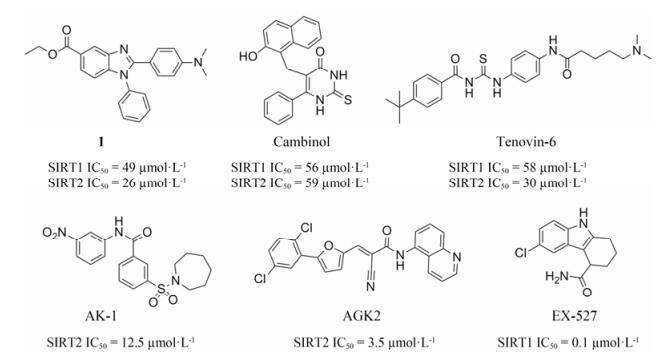
在过去的几年中, sirtuins已成为热门治疗靶点, 大量文献报道, 通过抑制sirtuins可以治疗包括2型糖尿病、心血管疾病、神经退行性疾病、炎症和肿瘤等多种疾病。但到目前为止, 高活性小分子抑制剂仍较少, 部分结构见图 1[3, 4]。其中, 化合物1、cambinol、和tenovin-6是非选择性sirtuins抑制剂, EX-527和AGK2、AK-1是已报道的活性较好的小分子选择性抑制剂, 然而在动物实验中, Tenovin-6是抗肿瘤活性最显著的化合物[5, 6]。
|
Figure 1 The structures of some known sirtuins inhibitors |
|
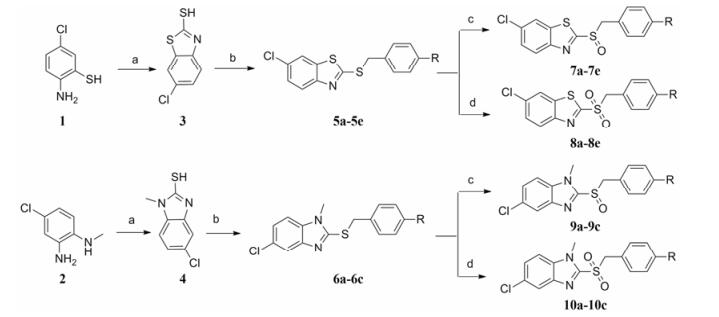
Scheme1 Synthetic route of the target compounds. Reagents and conditions: (a) Potassium O-ethyldithiocarbonate, microwave: 150 Psi, 45 W, 155 ℃, DMF; (b) 4-Substitute benzyl chloride, Et3N, CH2Cl2, r.t.; (c) m-CPBA, CH2Cl2, 0 ℃; (d) m-CPBA, CH2Cl2, r.t. |
本文设计了一系列新结构类型的苯并咪唑和苯并噻唑衍生物, 期望能够获得高活性的sirtuins抑制剂。目标化合物的合成见合成路线1[7, 8]:分别以2-氨基-5-氯苯硫酚或N-甲基-4-氯-2-氨基苯胺与乙基黄原酸钾为起始原料, 在微波条件下反应生成中间体3、4, 再经取代反应得到5a~5e和6a~6c, 然后经间氯过氧苯甲酸 (m-CPBA) 在适宜条件下氧化得到16个目标化合物7a~7e、8a~8e与9a~9c、10a~10c。
结果与讨论 1 目标化合物的结构确证合成了16个目标化合物, 结构均经1H NMR和HR-MS确证且未见文献报道, 其理化性质和谱学数据见表 1。
| Table 1 Physical and spectral data of target compounds |
以Tenovin-6和AGK2为阳性对照, 测定了16个目标化合物对SIRT1~SIRT3的抑制活性, 结果显示, 目标化合物对SIRT1~SIRT3均有一定抑制作用 (表 2)。
| Table 2 Theinhibitory activities against SIRT1-SIRT3 of target compounds |
对于苯并噻唑类衍生物 (7a~7e、8a~8e):当R为氟和甲氧羰基时, 化合物7b、7c和8b、8c对SIRT1抑制活性高于SIRT2和SIRT3, 其IC50值分别为76.8、85.1和80.7、82.3 μmol·L-1; 当R相同时, 苯并噻唑的2-位为砜和亚砜的化合物对SIRT1~SIRT3的抑制活性没有明显区别。
对于苯并咪唑类衍生物 (9a~9c、10a~10c):所有化合物对SIRT2抑制活性高于SIRT1和SIRT3, 有一定选择性。其中化合物10c对SIRT2的抑制活性最为显著, IC50值为2.8 μmol·L-1, 活性高于阳性对照Tenovin-6;化合物9a~9c的活性结果表明, 苯环上取代基R对活性的影响如下: CH3OCO > F > CH3O, 提示取代基R的电性效应及体积大小均可能影响抑酶活性, 化合物10a~10c呈现相似的构效关系; 当R相同时, 苯并咪唑环的2-位为砜的化合物比对应的亚砜化合物活性略高。
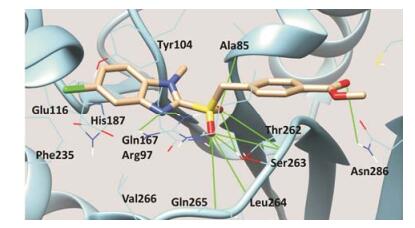
为预测苯并咪唑类新化合物的结合模式, 将活性最好的化合物10c对接到SIRT2的晶体结构中 (PDB code: 3ZGV, X-ray resolution = 2.30 )[9], 采用文献报道的方法进行计算。依据计算得到的结合能和结合方式的合理性, 选择最优结合模式。化合物10c与SIRT2的结合方式见图 2。化合物10c苯并咪唑环上的氮与Arg97形成氢键, 同时苯并咪唑环与Tyr104形成π-π相互作用; 砜基的两个氧原子均与Ser263、Thr262和Ala85形成氢键; 亚砜因为少一个氧原子, 减少了氢键的形成, 导致抑制活性没有对应的含砜化合物活性高; 其他的氢键 (3.5 内) 包括与His187、Asn286和Thr262相互作用。上述氢键, 与SIRT2和底物ADPr复合物对接形成的氢键的结合模式是一致的[9], 与其他的SIRT2抑制剂如化合物1、salermide和NF-675报道的结合模式亦相似[6, 10]。
|
Figure 2 Molecular interactions between 10c and SIRT2 |
基于已报道的sirtuins抑制剂结构和药效团特征, 设计了一系列结构新颖的苯并咪唑和苯并噻唑类化合物, 评价了它们对SIRT1~SIRT3的抑制活性, 获得了6个有显著SIRT2选择性抑制活性的新化合物。初步探讨了目标化合物抑制SIRT1~SIRT3活性的构效关系, 并通过分子对接研究了苯并咪唑类化合物10c与SIRT2可能的结合模式, 为此类化合物的进一步结构优化提供了参考。
实验部分熔点采用MP-J3熔点测定仪测定, 温度未校正; 1H NMR谱采用Varian 400 MHz Plus核磁共振仪测定 (TMS为内标); HR-MS采用ThermoExactivePlus质谱仪测定。所用试剂均为市售化学纯或分析纯。
1 化学合成 1.1 中间体3和4的合成通法 (以化合物3为例)2-巯基-6-氯苯并噻唑 (3) 的合成 将310 mg (1.94 mmol) 2-氨基-5-氯苯硫酚和790 mg (4.93 mmol) 乙基黄原酸钾置于10 mL微波管中, 加入3 mL DMF, 搅拌至全溶, 放入微波中, 在150 psi压力、45 W、155 ℃反应5 min。停止反应, 用30 mL水稀释, 用醋酸调pH至3~4, 析出灰色固体, 抽滤, 得到灰色固体 (3) 350 mg。用乙醇重结晶, 得到白色絮状固体 (3) 290 mg, 收率74%; mp 231~232 ℃; 1H NMR (400 MHz, CDCl3) δ: 13.86 (s, 1H), 7.86 (s, 1H), 7.44 (d, J = 8.6 Hz, 1H), 7.28 (d, J = 8.5 Hz, 1H)。通法合成4。
5-氯-2-巯基-N-甲基苯并咪唑 (4) 白色絮状固体; 收率66.4%; mp 239.5~241 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.87 (s, 1H), 7.39 (d, J = 8.5 Hz, 1H), 7.25 (d, J = 8.6 Hz, 1H), 7.19 (s, 1H), 3.64 (s, 3H)。
1.2 中间体5a~5e和6a~6c的合成通法 (以化合物5a为例)6-氯-2-[(4-甲氧基苄基) 硫基]苯并[d]噻唑 (5a) 的合成 将400 mg (2.0 mmol) 化合物3置于反应瓶中, 加入15 mL CH2Cl2、1 mL DMF, 加入0.3 mL (2.1 mmol) 4-甲氧基氯苄, 缓慢滴加0.39 mL (2.8 mmol) Et3N, 室温反应3 h。停止反应, 蒸出CH2Cl2, 加10 mL水, 析出固体, 抽滤, 得到浅褐色固体581 mg, 乙醇重结晶, 得到白色晶体 (5a) 430 mg, 收率67%; mp 103~104 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 8.17 (d, J = 1.8 Hz, 1H), 7.87 (d, J = 8.7 Hz, 1H), 7.50 (dd, J = 8.7, 2.0 Hz, 1H), 7.45~7.39 (m, 2H), 6.93~6.87 (m, 2H), 4.60 (s, 2H), 3.73 (s, 3H)。通法合成5b~5e, 以4代替3通法合成6a~6c。
6-氯-2-[(4-氟基苄基) 硫基]苯并[d]噻唑 (5b) 白色晶体; 收率54.8%; mp 84~85 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.79 (d, J = 8.6 Hz, 1H), 7.73 (d, J = 1.4 Hz, 1H), 7.45~7.36 (m, 3H), 7.05~6.97 (m, 2H), 4.57 (s, 2H)。
6-氯-2-[(4-甲氧羰基苄基) 硫基]苯并[d]噻唑 (5c) 白色晶体; 收率80%; mp 121~122 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.03~7.97 (m, 2H), 7.79 (d, J = 8.7 Hz, 1H), 7.72 (d, J = 1.9 Hz, 1H), 7.54~7.50 (m, 2H), 7.39 (dd, J = 8.7, 2.0 Hz, 1H), 4.63 (s, 1H), 3.90 (s, 3H)。
6-氯-2-[(4-氰基苄基) 硫基]苯并[d]噻唑 (5d) 白色絮状固体; 收率84%; mp 125~126 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.79 (d, J = 8.7 Hz, 1H), 7.73 (d, J = 1.9 Hz, 1H), 7.64~7.55 (m, 4H), 7.40 (dd, J = 8.7, 2.0 Hz, 1H), 4.63 (s, 2H)。
6-氯-2-[(4-溴基苄基) 硫基]苯并[d]噻唑 (5e) 白色晶体; 收率77%; mp 95~96 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.79 (d, J = 8.7 Hz, 1H), 7.72 (d, J = 2.0 Hz, 1H), 7.47~7.43 (m, 2H), 7.39 (dd, J = 8.7, 2.0 Hz, 1H), 7.35~7.31 (m, 2H), 4.54 (s, 2H)。
5-氯-2-[(4-甲氧基苄基) 硫基]-1-甲基-1H-苯并[d]咪唑 (6a) 白色晶体; 收率89%; mp 117~118 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.75 (s, 1H), 7.37~7.32 (m, 2H), 7.22 (d, J = 8.7 Hz, 1H), 7.15 (d, J = 8.6 Hz, 1H), 6.86~6.81 (m, 2H), 4.63 (s, 2H), 3.78 (s, 3H), 3.61 (s, 3H)。
5-氯-2-[(4-氟基苄基) 硫基]-1-甲基-1H-苯并[d]咪唑 (6b) 白色晶体; 收率79%; mp 85~86 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.81 (s, 1H), 7.47~7.39 (m, 2H), 7.30~7.24 (m, 1H), 7.20 (d, J = 8.2 Hz, 1H), 7.03~6.95 (m, 2H), 4.74 (s, 2H), 3.66 (s, 3H)。
5-氯-2-[(4-甲氧羰基苄基) 硫基]-1-甲基-1H-苯并[d]咪唑 (6c) 白色絮状固体; 收率82%; mp 122~123 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.00~7.94 (m, 2H), 7.79 (s, 1H), 7.55~7.50 (m, 2H), 7.27~7.25 (m, 1H), 7.18 (d, J = 8.6 Hz, 1H), 4.77 (s, 2H), 3.90 (s, 3H), 3.64 (s, 3H)。
1.3 目标化合物7a~7e和9a~9c的合成通法 (以化合物7a为例)6-氯-2-[(4-甲氧基苄基) 亚磺酰基]苯并[d]噻唑 (7a) 的合成 冰浴条件下, 将200 mg (0.62 mmol) 5a置于氩气保护的单口瓶中, 加入10 mL CH2Cl2, 搅拌10 min后, 加85%的m-CPBA 126 mg (0.62 mmol)。冰浴条件下反应30 min, 反应完全 (TLC跟踪)。用饱和碳酸氢钠溶液 (8 mL)、饱和氯化钠溶液 (8 mL) 洗涤, 无水硫酸钠干燥, 过滤, 浓缩, 柱色谱 (石油醚-乙酸乙酯, 体积比5:1) 纯化, 得白色晶体 (7a) 188 mg, 收率90%。通法合成目标物7b~7e和9a~9c。
1.4 目标化合物8a~8e和10a~10c的合成通法 (以化合物8a为例)6-氯-2-[(4-甲氧基苄基) 磺酰基]苯并[d]噻唑 (8a) 的合成 将310 mg (0.963 mmol) 5a置于氩气保护的单口瓶中, 加入20 mL二氯甲烷, 加85%的m-CPBA 782 mg (3.853 mmol)。室温搅拌反应1 h, 反应完全。用饱和碳酸氢钠溶液 (12 mL×3)、饱和氯化钠溶液 (12 mL) 洗涤, 无水硫酸镁干燥, 过滤, 浓缩, 柱色谱 (石油醚-乙酸乙酯, 体积比20:1) 纯化, 得白色晶体 (8a) 309 mg, 收率90.6%。通法合成目标物8b~8e和10a~10c。
2 SIRT1~SIRT3体外抑制活性实验参照文献[11]方法, 采用大肠杆菌表达纯化的SIRT1、SIRT2和SIRT3重组蛋白用于活性检测。底物肽段为: Ac-Arg-His-Lys-[Lys-(Ac)]-AMC。催化反应在60 μL的反应液中进行 (75 μmol·L-1 NAD+、25 μmol·L-1底物肽段、SIRT蛋白和不同浓度的待测化合物), 37 ℃放置1 h后向反应溶液中加入60 μL的样品处理液 (50 mmol·L-1 Tris-HCl, pH 8.0、100 mmol·L-1 NaCl、60 000 unit Trypsin和4 mmol·L-1 nicotinamide), 37 ℃放置20 min。将酶标仪设置为激发光355 nm, 吸收光为460 nm, 测定吸收强度。通过计算获得小分子化合物对于各个酶的抑制活性。
| [1] | Andrews KT, Tran TN, Wheatley NC, et al. Targeting histone deacetylase inhibitors for anti-malarial therapy[J]. Curr Top Med Chem, 2009, 9: 292–308. DOI:10.2174/156802609788085313 |
| [2] | Villalba JM, Alcaín FJ. Sirtuin activators and inhibitors[J]. Biofactors, 2012, 38: 349–359. DOI:10.1002/biof.v38.5 |
| [3] | Qin HT, Li HQ, Liu F. Selective histone deacetylase small molecule inhibitors: recent progress and perspectives[J]. Expert Opin Ther Pat, 2016, 29: 1–15. |
| [4] | Yoon YK, Oon CE. Sirtuin inhibitors: an overview from medicinal chemistry perspective[J]. Anticancer Agents Med Chem, 2016, 16: 1–14. |
| [5] | Sumit SM, Michele S, Smitha S, et al. Development of pyrazolone and isoxazol-5-one cambinol analogues as sirtuin inhibitors[J]. J Med Chem, 2014, 57: 3283–3294. DOI:10.1021/jm4018064 |
| [6] | Yeong KY, Mohamed AA, Ang CW, et al. Benzimidazoles as new scaffold of sirtuin inhibitors: green synthesis, in vitro studies, molecular docking analysis and evaluation of their anti-cancer properties[J]. Eur J Med Chem, 2014, 83: 448–454. DOI:10.1016/j.ejmech.2014.06.060 |
| [7] | Todor G, Deligeorgiev SS, Kaloyanova NY, et al. An envi-ronmentally begin procedure for the synthesis of substituted 2-thiobenzothiazoles, 2-thiobenzoxazoles, 2-thiobenzimidazoles, and 1, 3-oxazolopyridine-2-thiols[J]. Monatsh Chem, 2011, 142: 895–899. DOI:10.1007/s00706-011-0551-1 |
| [8] | Aviv G, Nir O, Israel P, et al. Tyrphostins 3. Structure-activity relationship studies of α-substituted benzylidene-malononitrile 5-S-aryltyrphostins[J]. Med Chem, 1993, 36: 3556–3564. DOI:10.1021/jm00075a010 |
| [9] | Moniot S, Schutkowski M, Steegborn C. Crystal structure analysis of human Sirt2 and its ADP-ribose complex[J]. Struct Biol, 2013, 182: 136–143. DOI:10.1016/j.jsb.2013.02.012 |
| [10] | Sakkiah S, Arooj M, Kumar MR, et al. Identification of inhibitor binding site in human Sirtuin 2 using molecular docking and dynamics simulations[J]. PLoS One, 2013, 8: e51429. DOI:10.1371/journal.pone.0051429 |
| [11] | Cui HQ, Zeeshan K, Teng A, et al. Discovery of potent and selective Sirtuin 2 (SIRT2) inhibitors using a fragment-based approach[J]. J Med Chem, 2014, 57: 8340–8357. DOI:10.1021/jm500777s |
 2017, Vol. 52
2017, Vol. 52


