2. 中山大学 附属第一医院器官移植科;
3. 中山大学 肿瘤防治中心药学部, 广东 广州 510080
2. Department of Kidney Transplant, the First Affiliated Hospital;
3. Department of Pharmacy, Cancer Center, Sun Yat-sen University, Guangzhou 510080, China
他克莫司 (tacrolimus, FK506) 是一种钙调磷酸酶抑制剂[1], 因其与环孢素A有相似的免疫抑制作用但浓度却不到环孢素A的5%, 所以取代了环孢素A成为了如今器官移植术后用以防治排斥反应的一线免疫抑制剂[2]。然而, 治疗窗窄、药动学个体差异大[3], 成为了他克莫司在临床应用上的一个巨大难题。临床治疗药物监测 (therapeutic drug monitoring, TDM) 是一种根据血药浓度调整药物剂量从而提高疗效、降低毒性的一种方法, 但它仅可以在药物施用后应用, 具有滞后性, 而在移植后的初始阶段达到治疗浓度是至关重要的, 因为在移植后的初始阶段器官排斥的风险最高, 所以TDM只能在一定程度上解决他克莫司的临床应用难题。因此探索他克莫司药动学个体差异大的原因, 在患者服药前制定出最合适的给药方案, 使药物浓度尽早达到治疗窗、提高疗效及降低不良反应的发生率, 具有重要意义。
他克莫司主要经肝脏及小肠的CYP3A4和CYP3A5代谢, 也经P-糖蛋白 (P-glycoprotein, P-gp) 的转运[4], 因此影响CYP3A4、CYP3A5及P-gp表达或功能的因素都有可能影响他克莫司的药动学。目前有关他克莫司药物基因组学的研究较多[5-7], 但唯一能够下定论的是CYP3A5*3 (6986A > G) 的基因多态性能够影响他克莫司的血药浓度。而在作者实验室的前期研究中, 也证实了CYP3A5*3的基因多态性能够解释30%的他克莫司浓度个体差异[8-10]。这样的研究结果也预示着还有其他可以解释他克莫司药动学个体差异大的遗传因素。
维生素D受体 (vitamin D receptor, VDR) 属于核受体NR1I亚家族成员。当VDR受到配体1, 25-二羟基维生素D3 (1, 25-dihydroxyvitamin D3, VD3) 激活时, 形成受体-配体复合物, 然后与视黄醇类X受体 (retinoid X receptor, RXR) 形成异二聚体, 结合到CYP3A4基因启动子远端的DR3元件和近端的ER6元件等, 从而诱导CYP3A4的表达[11-14]。并且, Lindh等[15]发现血清中VD3水平与他克莫司浓度存在相关性。因此, 推测VDR基因多态性可能会通过改变与配体VD3的结合, 对CYP3A4的表达水平产生影响, 进而导致他克莫司的药动学个体差异。本研究旨在探讨VDR基因多态性对肾移植术后早期患者他克莫司浓度的影响, 旨在为临床个体化用药提供参考。
材料与方法 试剂与仪器引物 (中国Sangon公司); Complete iPLEX Gold Genotyping Reagent Set 384试剂盒 (美国Agena Bioscience公司); Abbott Architect tacrolimus assay试剂盒 (美国Abbott公司)。Veriti梯度PCR仪 (美国ABI公司); DNA质谱阵列基因分析系统 (美国Agena Bioscience公司); IMX全自动免疫分析仪 (美国Abbot公司)。
受试对象本研究纳入2010年10月至2016年10月期间于中山大学附属第一医院器官移植中心进行活体肾移植手术的患者, 共114例。入选患者均为首次接受肾移植手术, 术后均采用他克莫司+霉酚酸酯+泼尼松三联免疫抑制疗法, 且肝功能指标正常。他克莫司起始给药剂量0.05~0.075 mg·kg-1, 每日两次, 随后根据谷浓度监测值调整剂量; 霉酚酸酯1.0~1.5 g/天; 手术当天至术后两天使用甲泼尼龙, 500 mg/天, 术后3~9天使用泼尼松, 30 mg/天, 本研究所纳入患者均使用泼尼松30 mg/天。合并使用的药物包括抗病毒药物 (更昔洛韦、缬更昔洛韦)、质子泵抑制剂 (雷尼替丁、法莫替丁) 或降压药 (美托洛尔、氯沙坦) 等, 不包括任何已报道的有可能对他克莫司代谢有影响的药物如地尔硫䓬、五酯片、维拉帕米、酮康唑、伊曲康唑、红霉素、克拉霉素、利福平等, 并排除发生排斥反应或急性感染、腹泻、接受多器官移植的患者。本研究符合赫尔辛基宣言规定, 并经中山大学附属第一医院伦理委员会批准, 所有患者均签署知情同意书。
他克莫司浓度检测患者连续服用同一剂量他克莫司至少3日后, 在术后第6~9天, 于清晨服药前 (即末次给药后12 h) 采集静脉血2 mL置于EDTA抗凝真空管, 采用基于微粒子酶免疫法原理的Abbott Architect tacrolimus assay试剂盒检测他克莫司全血谷浓度, 该方法的定量下限为2 ng·mL-1。由于临床上他克莫司按体重剂量给药, 但患者使用的他克莫司体重剂量也不完全相同, 为了便于进行个体间比较, 对他克莫司的浓度进行体重剂量校正, 即剂量校正谷浓度=全血谷浓度/剂量×体重 (C0/D)。
基因型检测取患者外周静脉血2 mL, 参照并优化Loparev等[16]的碘化钠-氯仿法提取基因组DNA。CYP3A5*3的基因型采用聚合酶链反应-限制性片段长度多态 (polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP) 法检测, VDR rs2853559和rs1540339的基因型采用Agena Biosci ence MassARRAY® system进行检测。所有引物均由美国Agena Bioscience公司在线软件Assay Design Suite设计得到 (https://www.mysequenom.com/Tools), 见表 1。
| Table 1 Primers for polymerase chain reaction and extension reaction. F: Forward primer; R: Reverse primer; E: Extension primer |
多重PCR反应体系5 μL, 包括1×PCR缓冲液、2 mmol·L-1氯化镁、500 mol·L-1 dNTPs、0.1 mol·L-1引物混合物、1 U PCR酶和全基因组DNA 10 ng。用0.5 U虾碱性磷酸酶 (shrimp alkaline phosphatase, SAP) 去除游离dNTP。单碱基延伸反应体系2 μL, 包括1.57 mol·L-1延伸引物混合物, 1×iPlex终止混合物, 1×iPlex酶。
PCR反应条件: 95 ℃预变性2 min; 95 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸60 s, 共45个循环; 最后72 ℃延伸5 min。SAP反应条件: 37 ℃孵育40 min, 85 ℃失活5 min。
单碱基延伸反应条件: 94 ℃预变性30 s; 94 ℃变性5 s, 以下步骤5个循环: 52 ℃退火5 s和80 ℃延伸5 s, 共40个循环; 最后72 ℃延伸5 min。
统计学处理采用SPSS22.0软件进行统计分析。数据以x±s表示; 采用χ2检验分析基因型是否符合Hardy-Weinberg平衡; 由于他克莫司剂量校正谷浓度不是正态分布, 因此采用非参数检验比较不同组别之间他克莫司剂量校正谷浓度的差异, 两组间比较采用Mann-Whitney U检验, 三组间比较采用Kruskal-Wallis H检验, 采用Spearman相关分析评估他克莫司剂量校正谷浓度与其他连续变量之间的相关性。采用逐步回归分析法综合分析各因素对他克莫司剂量校正谷浓度的影响。P < 0.05为差异有统计学意义。
结果 1 一般资料本研究共纳入114例中国汉族活体肾移植术后患者, 患者的性别、年龄、体重、红细胞比容、血红蛋白、肝功能、肾功能、移植肾功能延迟恢复指标见表 2, 经统计分析, 红细胞比容与他克莫司剂量校正谷浓度成正相关关系 (r = 0.271, P < 0.05), 其余各项因素与他克莫司剂量校正谷浓度无关。
| Table 2 Demographics, clinical characteristics of 114 renal transplant recipients |
VDR rs1540339、rs2853559、CYP3A5*3基因型及等位基因频率见表 3, 符合Hardy-Weinberg平衡 (P > 0.05), 研究资料具有群体代表性。
| Table 3 Genotype and allele frequency data of VDR rs1540339, rs2853559 and CYP3A5*3 in 114 Chinese renal transplant patients |
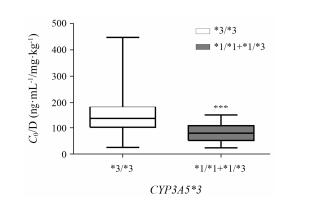
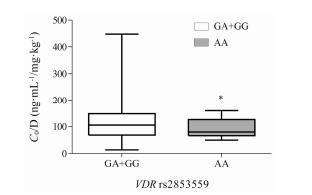
将CYP3A5*1/*1和CYP3A5*1/*3作为CYP3A5表达型组, CYP3A5*3/*3作为非表达型组。结果 (图 1) 显示, CYP3A5表达型组他克莫司剂量校正谷浓度显著低于CYP3A5非表达型组 (P < 0.001)。将VDR rs2853559基因型分为AA型组和GA+GG型组。结果 (图 2) 显示, GA+GG型组他克莫司剂量校正谷浓度显著高于AA型组 (P < 0.05)。而在rs1540339各基因型组中, 他克莫司剂量校正谷浓度均无统计学差异。
|
Figure 1 Influence of CYP3A5*3 polymorphisms on tacrolimus concentration/dose (C0/D). ***P < 0.001 vs *3/*3 |
|
Figure 2 Influence of VDR rs2853559 polymorphisms on tacrolimus C0/D. *P < 0.05 vs GA+GG |
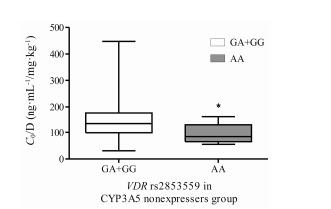
由于CYP3A5*3是目前公认的与他克莫司浓度密切相关的遗传因素, 为排除CYP3A5*3基因型作为混杂因素影响分析结果, 以CYP3A5*3基因型分层后再考察VDR rs2853559、rs1540339与他克莫司浓度相关性。以CYP3A5*1/*1和CYP3A5*1/*3作为CYP3A5表达型组, CYP3A5*3/*3作为非表达型组。结果 (图 3) 显示, 在CYP3A5非表达型组患者中, rs2853559 GA+GG型他克莫司剂量校正谷浓度显著高于AA型组 (P < 0.05)。然而, 在CYP3A5表达型组患者中则未发现存在相关性。无论在CYP3A5表达型还是非表达型患者中, VDR rs1540339各基因型组他克莫司剂量校正谷浓度均无统计学差异。
|
Figure 3 Influence of VDR rs2853559 polymorphisms on tacrolimus C0/D in CYP3A5 nonexpressers. *P < 0.05 vs GA+GG |
将上述分析中的显著影响因素 (P < 0.05, 包括CYP3A5*3、VDR rs2853559、红细胞比容) 及对数形式转化后的他克莫司剂量校正谷浓度进行多重线性回归分析, 如表 4所示, 发现CYP3A5*3及VDR rs2853559能分别解释34.5%和6.9%的他克莫司剂量校正谷浓度个体差异, 该模型能解释45.6%的他克莫司剂量校正谷浓度个体差异, 而红细胞比容在最终模型中被剔除。在CYP3A5非表达者中, 如表 5所示, VDR rs2853559能解释14.4%的他克莫司剂量校正谷浓度个体差异。
| Table 4 Stepwise forward selection multiple regression analysis of explanatory variables for log-transformed C0/D in 114 renal transplant recipients |
| Table 5 Stepwise forward selection multiple regression analysis of explanatory variables for log-transformed C0/D in 70 CYP3A5 nonexpressers renal transplant recipients |
核受体 (nuclear receptor, NR) 是细胞内一类转录因子的统称。它们在新陈代谢、性别决定与分化、生殖发育与体内稳态的维持等方面的生命活动都发挥着重要作用。近年研究发现核受体作为关键的转录调控因子在编码药物代谢酶及转运蛋白的基因的表达调控中起到重要作用。当VDR受到特定配体激活时, 形成受体-配体复合物, 然后与RXR形成异二聚体, 结合到靶基因启动子内的外源性化合物反应元件, 从而对基因的转录加以调控, 而它们的靶基因包括多种药物代谢酶的编码基因, 如CYP3A4等[11-14], 因此任何影响核受体自身表达的因素都可能会影响靶基因的表达和功能。
VDR基因定位于染色体12q12-q14上, 有11个外显子, 全长约75 kb, 5'端非编码区包括1A、1B、1C外显子, 2~9号外显子编码基因的蛋白产物。在体外实验中显示, VDR的配体VD3的抗癌作用依赖于VDR介导的对CYP3A4的诱导作用, 从而产生了针对毒性异生物质和化学致癌物质的保护机制[17]。另有研究表明, VDR能够抑制环氧合酶-2 (COX-2) 并增强羟基前列腺素脱氢酶 (HPGD) 的表达, 其组合作用可通过前列腺素活性的总体减少来限制前列腺素癌细胞的生长[18]。VDR调节前列腺素代谢的这种能力已被证实是通过VD3在前列腺癌细胞中诱导足以使细胞内睾酮代谢失活的CYP3A4的表达水平来实现的[19]。并且, Lindh等[15]发现血清中VD3水平与他克莫司浓度存在相关性, 更进一步证明了VDR在CYP3A4基因的表达调控中的重要作用。
VDR rs2853559是VDR基因的taqSNP, 位于内含子区域, 目前对这个位点的报道主要集中于疾病如近视及I型糖尿病发生的关系上[20, 21], 但暂未见该位点的具体功能研究。本研究发现VDR rs2853559 GA+GG型组他克莫司剂量校正谷浓度显著高于AA型组, 然而在以CYP3A5*3基因型分层后, 该影响仅存在于CYP3A5非表达型者中。体外研究发现[22], CYP3A5对他克莫司的固有清除率高于CYP3A4, 他克莫司的代谢更大程度上是依赖于CYP3A5。由于CYP3A5非表达型者体内CYP3A5蛋白缺失, 不表达CYP3A5的功能, 此时体内他克莫司的代谢主要依赖于CYP3A4, 因此本研究的发现也初步反映了VDR rs2853559对CYP3A4基因表达可能产生影响, 推测A等位基因与VDR对CYP3A4诱导表达作用较强有关, 从而使他克莫司代谢较快、浓度较低。本研究考察的另一个位点VDR rs1540339也是VDR基因的taqSNP, 位于内含子区域, 据报道, 该位点的突变与肠癌及类风湿关节炎的发生有关[23, 24], 但本研究暂未观察到其与他克莫司浓度的相关性, 由于本研究纳入的患者例数相对较少, 特别是CC型患者仅9例, 有待今后扩大样本量以明确该位点与他克莫司浓度的真实相关性。本研究纳入的是肾移植术后初期患者, 药物的吸收也可能受到诸如胃肠道功能恢复程度的影响, 今后将通过纳入术后稳定期患者以进一步探讨这两个SNP与他克莫司药动学的相关性。此外, 由于暂未有VDR rs2853559及rs1540339对CYP3A4基因表达影响的报道, 今后将进行相关机制探讨以进一步验证本研究的发现。
由于95%~98%的他克莫司分布在红细胞中, 因此红细胞比容水平也是评价全血他克莫司水平的重要因素, 已有研究发现红细胞比容与全血他克莫司浓度之间存在显著的正相关[25-28], 同样地, 作者研究也发现他克莫司剂量校正谷浓度和红细胞比容之间存在显著的正相关关系。
本研究通过探讨VDR基因多态性与他克莫司浓度的相关性, 发现VDR rs2853559 GA+GG型组与他克莫司剂量校正谷浓度较高相关, 此研究结果为运用药物基因组学寻找生物标志物、指导肾移植术后患者他克莫司个体化用药提供了参考依据。
| [1] | Tavira B, Diaz-Corte C, Coronel D, et al. Pharmacogenetics of tacrolimus: from bench to bedside?[J]. Nefrologia, 2014, 34: 11–17. |
| [2] | Kino T, Hatanaka H, Miyata S, et al. FK-506, a novel immunosuppressant isolated from a Streptomyces. Ⅱ. Immuno-suppressive effect of FK-506 in vitro[J]. J Antibiot (Tokyo), 1987, 40: 1256–1265. DOI:10.7164/antibiotics.40.1256 |
| [3] | Venkataramanan R, Swaminathan A, Prasad T, et al. Clinical pharmacokinetics of tacrolimus[J]. Drug Dispos, 1995, 29: 404–430. |
| [4] | Staatz CE, Tett SE. Clinical pharmacokinetics and pharma-codynamics of tacrolimus in solid organ transplantation[J]. Clin Pharmacokinet, 2004, 43: 623–653. DOI:10.2165/00003088-200443100-00001 |
| [5] | Zhu L SH, Wang QH. Effect of CYP3A4*18B, CYP3A5*3 gene polymorphism on dosage and concentration of tacrolimus in renal transplant patients[J]. Acta Pharm Sin (药学学报), 2012, 47: 878–883. |
| [6] | Liu XM, Li JL, Wang HY, et al. Associations of SUMO4 polymorphisms with tacrolimus concentrations in Chinese renal transplant recipients[J]. Acta Pharm Sin (药学学报), 2015, 50: 180–184. |
| [7] | Liu S, Chen RX, Li J, et al. Associations of SLCO1B1 polymorphisms with tacrolimus concentrations in Chinese renal transplant recipients[J]. Acta Pharm Sin (药学学报), 2016, 51: 1240–1244. |
| [8] | Chen SY, Li JL, Meng FH, et al. Individualization of tacrolimus dosage basing on cytochrome P450 3A5 polymor-phism-a prospective, randomized, controlled study[J]. Clin Transplant, 2013, 27: E272–281. DOI:10.1111/ctr.2013.27.issue-3 |
| [9] | Li JL, Wang XD, Chen SY, et al. Effects of diltiazem on pharmacokinetics of tacrolimus in relation to CYP3A5 genotype status in renal recipients: from retrospective to prospective[J]. Pharmacogenomics J, 2011, 11: 300–306. DOI:10.1038/tpj.2010.42 |
| [10] | Thervet E, Loriot MA, Barbier S, et al. Optimization of initial tacrolimus dose using pharmacogenetic testing[J]. Clin Pharmacol Ther, 2010, 87: 721–726. |
| [11] | Matsubara T, Yoshinari K, Aoyama K, et al. Role of vitamin D receptor in the lithocholic acid-mediated CYP3A induction in vitro and in vivo[J]. Drug Metab Dispos, 2008, 36: 2058–2063. DOI:10.1124/dmd.108.021501 |
| [12] | Pavek P, Pospechova K, Svecova L, et al. Intestinal cell-specific vitamin D receptor (VDR)-mediated transcriptional regulation of CYP3A4 gene[J]. Biochem Pharmacol, 2010, 79: 277–287. DOI:10.1016/j.bcp.2009.08.017 |
| [13] | Fang Y, van Meurs JBJ, d'Alesio A, et al. Promoter and 3'-untranslated-region haplotypes in the vitamin D receptor gene predispose to osteoporotic fracture: the Rotterdam study[J]. Am Soc Hum Genet, 2005, 77: 807–823. DOI:10.1086/497438 |
| [14] | Halsall JA, Osborne JE, Potter L, et al. A novel polymorphism in the 1A promoter region of the vitamin D receptor is associated with altered susceptibilty and prognosis in malignant melanoma[J]. Br J Cancer, 2004, 91: 765–770. |
| [15] | Lindh JD, Andersson ML, Eliasson E, et al. Seasonal variation in blood drug concentrations and a potential relationship to vitamin D[J]. Drug Metab Dispos, 2011, 39: 933–937. DOI:10.1124/dmd.111.038125 |
| [16] | Loparev VN, Cartas MA, Monken CE, et al. An efficient and simple method of DNA extraction from whole blood and cell lines to identify infectious agents[J]. J Virol Methods, 1991, 34: 105–112. DOI:10.1016/0166-0934(91)90126-K |
| [17] | Thummel KE, Brimer C, Yasuda K, et al. Transcriptional control of intestinal cytochrome P-4503A by 1α, 25-dihydroxy vitamin D3[J]. Mol Pharmacol, 2001, 60: 1399–1406. |
| [18] | Moreno J, Krishnan AV, Swami S, et al. Regulation of prostaglandin metabolism by calcitriol attenuates growth stimulation in prostate cancer cells[J]. Cancer Res, 2005, 65: 7917–7925. |
| [19] | Maguire O, Pollock C, Martin P, et al. Regulation of CYP3A4 and CYP3A5 expression and modulation of "intracrine" metabolism of androgens in prostate cells by liganded vitamin D receptor[J]. Mol Cell Endocrinol, 2012, 364: 54–64. DOI:10.1016/j.mce.2012.08.007 |
| [20] | Ramos-Lopez E, Jansen T, Ivaskevicius V, et al. Protection from type 1 diabetes by vitamin D receptor haplotypes[J]. Ann N Y Acad Sci, 2006, 1079: 327–334. DOI:10.1196/annals.1375.050 |
| [21] | Mutti DO, Cooper ME, Dragan E, et al. Vitamin D receptor (VDR) and group-specific component (GC, vitamin D-binding protein) polymorphisms in myopia[J]. Invest Ophthalmol Vis Sci, 2011, 52: 3918–3824. |
| [22] | Kamdem LK, Streit F, Zanger UM, et al. Contribution of CYP3A5 to the in vitro hepatic clearance of tacrolimus[J]. Clin Chem, 2005, 51: 1374–1381. DOI:10.1373/clinchem.2005.050047 |
| [23] | Budhathoki S, Yamaji T, Iwasaki M, et al. Vitamin D receptor gene polymorphism and the risk of colorectal cancer: a nested case-control study[J]. PLoS One, 2016, 11: e0164648. DOI:10.1371/journal.pone.0164648 |
| [24] | Cavalcanti CA, Silva Jde A, Pita Wde B, et al. Vitamin D receptor polymorphisms and expression profile in rheumatoid arthritis Brazilian patients[J]. Mol Biol Rep, 2016, 43: 41–51. DOI:10.1007/s11033-015-3937-z |
| [25] | Limsrichamrern S, Chanapul C, Mahawithitwong P, et al. Correlation of hematocrit and tacrolimus level in liver transplant recipients[J]. Transplant Proc, 2016, 48: 1176–1178. DOI:10.1016/j.transproceed.2015.12.096 |
| [26] | Nagase K, Iwasaki K, Nozaki K, et al. Distribution and protein binding of FK506, a potent immunosuppressive macrolide lactone, in human blood and its uptake by erythrocytes[J]. J Pharm Pharmacol, 1994, 46: 113–117. DOI:10.1111/jphp.1994.46.issue-2 |
| [27] | Chow FS, Piekoszewski W, Jusko WJ. Effect of hematocrit and albumin concentration on hepatic clearance of tacrolimus (FK506) during rabbit liver perfusion[J]. Drug Metab Dispos, 1997, 25: 610–616. |
| [28] | Minematsu T, Sugiyama E, Kusama M, et al. Effect of hematocrit on pharmacokinetics of tacrolimus in adult living donor liver transplant recipients[J]. Transplant Proc, 2004, 36: 1506–1511. DOI:10.1016/j.transproceed.2004.04.097 |
 2017, Vol. 52
2017, Vol. 52


