2. 上海中医药大学中药研究所, 中药标准化教育部重点实验室暨上海市复方中药重点实验室, 上海 201203
2. The Ministry of Education Key Laboratory for Standardization of Chinese Medicines and Shanghai Key Laboratory of Compound Chinese Medicines, Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
黄药子为薯蓣科植物黄独 (Dioscorea bulbifera L.) 的块茎。在临床上主要用于治疗甲状腺腺瘤、恶性肿瘤、亚急性甲状腺炎、宫颈炎和银屑病等。研究表明黄药子可致小鼠肝损伤[1, 2], 且呈一定的剂量依赖关系[3]。黄独素B (diosbulbin B, DB) 既是黄药子的抗肿瘤、抗炎和抗菌等作用的物质基础, 又是其主要肝毒性成分[4, 5]。脂肪酸在生物体内存在两种形式:游离脂肪酸 (non-esterified fatty acids, NEFA) 和酯化脂肪酸 (esterified fatty acids, EFA)。前者具有广泛的生物学意义, 后者在脂肪酶作用下降解生成NEFA。药源性肝损伤可能引起肝细胞线粒体功能异常[6], 肝脏在脂肪酸合成和代谢 (β-氧化) 及维持机体内脂肪酸水平发挥重要作用, 因此药源性肝损伤必然导致脂肪酸水平和代谢轮廓的变化。另部分游离脂肪酸具有细胞毒性, 可引发溶酶体膜和线粒体膜等微器官损坏, 加强肿瘤坏死因子和细胞介素等毒性, 导致肝实质变性和炎性细胞浸润等[7]。ω-3不饱和脂肪酸如二十二碳六烯酸通过调控炎症和细胞凋亡对肝脏具有保护作用[8]。体循环中ω-6不饱和脂肪酸与ω-3不饱和脂肪酸的比值降低能够显著抑制化学诱导急性肝损伤[9]。由此可见, 脂肪酸与肝损伤存在密切的关系。
目前黄药子的肝毒性研究仅限于一些常规的毒理实验, 黄药子的肝毒性与脂肪酸代谢的相关性研究尚未见报道。本研究在黄药子和DB诱导大鼠肝损伤的药理实验基础上, 采用气相-质谱联用技术对大鼠血清中NEFA和EFA进行定量分析, 结合多变量统计分析方法, 分析大鼠灌胃黄药子或DB后血清脂肪酸代谢轮廓的变化, 探究黄药子的肝毒性与脂肪酸代谢轮廓的相关性, 为深入研究黄药子的肝毒性分子机制奠定基础, 也为中药肝毒性的研究提供新的思路和方法。
材料与方法 材料黄药子采于安徽青阳县, 经安徽中医药大学刘守金教授鉴定为薯蓣科植物黄独 (Dioscorea bulbifera L.) 块茎。黄独素B (纯度 > 98%) 购于上海同田生物技术有限公司。月桂酸 (C12:0)、肉豆蔻酸 (C14:0)、棕榈酸 (C16:0)、棕榈油酸 (C16:1n7)、十七烷酸 (C17:0)、硬脂酸 (C18:0)、油酸 (C18:1n9)、异油酸 (C18:1n7)、亚油酸 (C18:2n6)、亚麻酸 (C18:3n3)、二十烷酸 (C20:0)、花生四烯酸 (C20:4n6)、二十碳三烯酸 (C20:3n6)、二十碳五烯酸 (C20:5n3)、二十二碳六烯酸 (C22:6n3) 和二十四烷酸 (C24:0) 购于美国Sigma公司。十九碳二烯酸 (C19:2n10) 及甲酯购于美国Nu-Chek公司。谷丙转氨酶 (ALT)、谷草转氨酶 (AST)、总胆红素 (TBIL) 和白蛋白 (ALB) 等生化试剂盒购于上海荣盛生物药业有限公司。
仪器6890气相-5975质谱联用仪 (Agilent Technologies, 美国), 7080型全自动生化分析仪 (Hitachi, 日本), Avanti J-25离心机 (Beckman Coulter, 德国), BP 211D电子天平 (Sartorius, 德国)。
毒性实验药物制备本实验室前期制备获得黄药子醇提取物 (ethanol extraction, ET), 方法见文献[10]。给药前ET和DB分别用适量0.5% CMC-Na溶液混悬。
实验动物24只SD大鼠, 雄性, 清洁级, 体重250 ± 25 g, 购于上海斯莱克实验动物有限公司, 动物合格证号: SCXK (沪2007-0005), 饲养于上海中医药大学实验中心动物房, 室温20 ± 2 ℃, 相对湿度60%~70%。
动物处理24只雄性SD大鼠喂养1周后, 按体重随机分成3组, 分别为空白组、ET组和DB组。ET组给药剂量为5.28 g·kg-1 (含90 mg·kg-1 DB), DB组给药剂量180 mg·kg-1, 空白组给予相同剂量的生理盐水, 灌胃给药 (ig), 给药后24 h眼眶静脉丛取血, 供分析血清生化指标和脂肪酸。
血清ALT、AST、TBIL和ALB测定全血室温静置1.5 h, 于4 ℃、1 000×g离心10 min, 取上层血清于eppendorf离心管中, -80 ℃保存。按试剂盒上规定的方法测定血清中ALT、AST、TBIL和ALB等生化指标的水平。
血清脂肪酸甲酯化[11]取血清100 μL, 加入1 mg·mL-1内标 (C19:2n10和C19:2n10甲酯) 20 μL, 用0.4 mol·L-1 KOH甲醇溶液甲酯化, 用1 mL正己烷配制成酯化脂肪酸的供试溶液; 剩余血清部分用5% H2SO4甲醇溶液甲酯化, 用1 mL正己烷配制成游离脂肪酸的供试溶液。
脂肪酸含量测定气相-质谱条件[11]: Agilent DB-225MS毛细管色谱柱 (0.25 µm, 60 m × 0.25 mm); 程序升温:初始温度70 ℃, 保持1 min, 以40 ℃·min-1速度升至200 ℃, 保持20 min, 再以5 ℃·min-1速度升至230 ℃, 保持25 min。电离方式EI, 选择离子扫描模式, 同时监测m/z 55、67、74和79的碎片离子。标准曲线制备:精密称定16种游离脂肪酸标准品, 用甲醇或正己烷配制成质量浓度为5 mg·mL-1贮备液。取各脂肪酸标准品200 μL至15 mL螺口离心管, N2吹干后用5% H2SO4甲醇溶液进行甲酯化, 用正己烷配制成1 mg·mL-1混合标准品溶液, 再逐步稀释配置成内标 (C19:2n10甲酯) 质量浓度为20 μg·mL-1的0.5、1、2、5、10、15、25、50和100 μg·mL-1 9种混合标准品溶液, 用于标准曲线的绘制。取游离脂肪酸供试溶液和酯化脂肪酸供试溶液各0.2 μL, 按内标法测定血清中脂肪酸的含量。
统计学分析血清生化指标水平和脂肪酸含量均用“均值±标准差”(x ± s) 表示。采用SIMCA-P13.0软件 (Umetrics, Umea, 瑞典) 进行主成分分析 (PCA) 和偏最小二乘法-判别分析 (PLS-DA)。SPSS 19.0统计软件进行Pearson相关分析和典型相关分析 (CCA)。
结果 1 ET和DB对ALT、AST活性及TBIL、ALB含量的影响ALT、AST、ALB和TBIL是目前临床诊断肝损伤的常用血清生化指标, 本实验通过测定这些生化指标的活性或含量评价ET和DB对大鼠肝损伤的程度。如图 1所示, 两毒性组的大鼠灌胃ET (5.28 g·kg-1) 和DB (180 mg·kg-1) 24 h后, 血清的ALT、AST、TBIL的水平均显著升高 (P < 0.05), 且ET组升高程度远大于DB组; 而ALB含量均没有显著变化 (P > 0.05), 表明ET和DB均对大鼠造成肝损伤, 且ET肝毒性明显强于DB。

|
Figure 1 Serum alanine aminotransferase (ALT), aspartate aminotransferase (AST) activities, and albumin (ALB), total billrubin (TBIL) amount in ethanol extraction of Rhizoma Dioscoreae Bulbiferae (ET)-and diosbulbin B (DB)-treated rats. n = 8, x ± s. P < 0.05, **P < 0.01, ***P < 0.001 vs control group |
ET组和DB组大鼠给药后24 h血清中游离脂肪酸和酯化脂肪酸的含量变化如表 1所示。从整体结果分析, ET组和DB组的游离脂肪酸水平变化趋势有差异, 而酯化脂肪酸水平变化趋势基本一致。游离脂肪酸含量变化: DB组C16:0、C18:0、C16:1n7、C18:1n9、C18:2n6、C18:1n7、C18:3n3、C20:3n6、C20:4n6和C22:6n3含量显著降低 (P < 0.05); ET组C18:2n6和C20:3n6含量显著上升 (P < 0.05或P < 0.001), C20:4n6和C22:6n3含量显著下降 (P < 0.001)。酯化脂肪酸含量变化: DB组和ET组C16:0、C18:0、C20:4n6、C20:5n3和C22:6n3含量均显著降低 (P < 0.01)。结果提示, ET和DB致大鼠肝损伤后血中部分脂肪酸含量发生显著变化。
| Table 1 Serum concentrations (μg·mL-1) of non-esterified fatty acids (NEFA) and esterified fatty acids (EFA) in rats dosed with ET (5.28 g·kg-1) and DB (180 mg·kg-1), respectively. n = 8, x ± s. P < 0.05, **P < 0.01, ***P < 0.001 vs control group |
以游离脂肪酸和酯化脂肪酸的含量值为X变量, 将空白组、ET组和DB组共24个样本进行2个主成分PCA分析, 该模型能解释73.9%原始数据。在二维空间的散点图上空白组、ET组和DB组的样本离散度较小, 且能互相分开 (图 2A)。在此基础上进行3个主成分PCA分析, 该模型显著提高了对原始数据的解释能力 (R2X = 86.4%)。在三维空间的散点图上能清晰地看到ET和DB两毒性组与空白组相比其矢量方向一致, 且DB组的样本分布在空白组和ET组样本之间 (图 2B)。PCA分析表明ET和DB对脂肪酸影响模式基本相同, 但ET的影响比DB大。因此, 从脂肪酸的代谢轮廓层面上分析可推测ET (5.28 g·kg-1) 对大鼠肝脏的毒性比DB (180 mg·kg-1) 大, ET应还含有其他肝毒性成分。

|
Figure 2 The 2D score plot (A) and 3D score plot (B) from principle component analysis (PCA) based on the metabolic profiles of NEFA and EFA from control, ET and DB groups. t[1], t[2] and t[3] are the first three eigenvectors of original data. The score plot indicated a clear separation between the control, ET and DB groups |
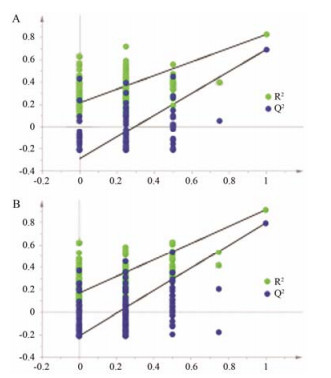
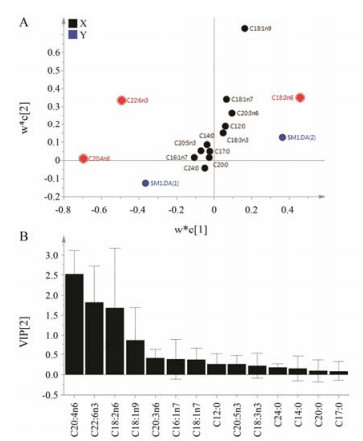
为了发现能够表征黄药子肝毒性的生物标识物, 对空白组和ET组进行PLS-DA建模。以游离脂肪酸水平为X变量和组别为Y变量, 建立2个主成分的PLS-DA模型。对该模型的variable importance in the projection (VIP) 大于1.0的变量进行t检验, 发现C16:0和C18:0的水平在这两组间没有显著差异 (P > 0.05) (表 1), 因此把这两个变量剔除后重新进行PLS-DA建模, 得到第1个PLS-DA模型 (R2X = 86.3%, R2Y = 82.6%, Q2 = 69.2%)。同理, 为了发现能够表征黄独素肝毒性的生物标识物, 对空白组和DB组进行2个主成分的PLS-DA分析, 得到第2个PLS-DA模型 (R2X = 82.4%, R2Y = 91.1%, Q2 = 79.4%)。对上述两个模型进行200次迭代的置换检验, 如图 3所示, 图中的所有Q2均低于原始值, 且Q2的回归截距为负值, 表明这两个模型均未过度拟合。根据第1个PLS-DA模型的载荷图和VIP值 (图 4), 可知C18:2n6、C20:4n6和C22:6n3是受ET诱导的大鼠肝毒性影响较大的脂肪酸, 且t检验表明这3个脂肪酸水平在两组间均有显著性差异 (P < 0.05) (表 1)。第2个PLS-DA模型的载荷图和VIP值分析表明, C16:0、C18:0、C20:4n6和C22:6n3是受DB给药后造成肝毒性影响较大的脂肪酸 (图 5), 且t检验表明这4个脂肪酸水平在两组间均有显著性差异 (P < 0.01) (表 1)。上述分析提示, C20:4n6和C22:6n3是能够表征黄药子和DB诱导大鼠肝损伤的共同潜在的生物标识物。
|
Figure 3 The results of permutation test (n = 200) of partial least squares-discriminate analysis (PLS-DA) model from control and ET groups (A), and PLS-DA model from control and DB groups (B). All blue Q2-values were lower than the original points to the right, and the blue regression line of the Q2-points intersected the vertical axis below zero (A, -0.29; B, -0.211). It indicated that the two original PLS-DA models were valid |
|
Figure 4 Analysis of potential biomarkers of liver injury induced by ET using PLS-DA. The PLS-DA model (R2X = 86.3%, R2Y = 82.6%, Q2 = 69.2%) was generated based on NEFA metabolic profile from control and ET groups. A: The PLS loading plot exhibited the correlation between ET-induced liver injury and individual fatty acid. ET-induced hepatic injury was strongly correlated with C20:4n6, C22:6n3 and C18:2n6, marked with ' |

|
Figure 5 Loading scatter plot (A) and VIP plot (B) in the PLS-DA model (R2X = 82.4%, R2Y = 91.1%, Q2 = 79.4%) based on NEFA metabolic profile from control and DB groups |
上述鉴定的游离脂肪酸生物标识物 (C20:4n6和C22:6n3) 及其对应的酯化脂肪酸与ET和DB肝损伤中有显著变化的ALT、AST和TBIL进行Pearson相关分析 (表 2)。表中的相关系数均为负值, 表明脂肪酸的含量与生化指标水平成负相关。ET组游离脂肪酸C20:4n6与TBIL水平呈显著相关性 (P < 0.05), 酯化脂肪酸C20:4n6和C22:6n3与ALT、AST、TBIL呈显著相关性 (P < 0.01)。DB组C20:4n6和C22:6n3与ALT、AST、TBIL呈显著相关性 (P < 0.05)。
| Table 2 The results of Pearson correlation analysis between the serum levels of fatty acids and biochemical indicators in control, ET and DB-treated rats. Correlation significance was defined as P < 0.05, **P < 0.01, ***P < 0.001. r: Pearson correlation coefficient |
为进一步揭示脂肪酸与生化指标的相关性, 对空白组、ET组和DB组的24个样本, 以C20:4n6和C22:6n3及其酯化脂肪酸为一组变量, ALT、AST和TBIL为另一组变量进行CCA。结果显示, 对原始数据提取出3对典型变量, 它们的典型相关系数依次为0.818 (P < 0.01)、0.724 (P < 0.05) 和0.322 (P > 0.5), 表明第1对典型变量和第2对典型变量均具有显著相关性。CCA结果进一步表明C20:4n6和C22:6n3与黄药子肝毒性具有良好相关性。
讨论ET组大鼠给药剂量中约含90 mg·kg-1DB, 是DB组的1/2给药剂量 (180 mg·kg-1)。药理学评价可知ET组的肝毒性大于DB给药组, 未显示出DB肝毒性的量效关系, 表明ET中除DB外应还有其他具有肝毒的化学成分。基于血清脂肪酸水平的PCA分析表明大鼠口服ET和DB 24 h后血清脂肪酸代谢轮廓明显偏离正常水平, 且ET组的偏离程度比DB组大, 从脂肪酸代谢层面分析也表明ET的肝毒性强于DB, 与药理学评价结果基本一致。
本研究发现, DB组大鼠血清中大部分游离不饱和脂肪酸以及两个主要饱和脂肪酸 (C16:0和C18:0) 的浓度显著低于对照组。氧化应激是DB肝毒性主要机制之一[12], 当DB诱导大鼠肝损伤发生时, 大鼠机体内膜系统上的不饱和脂肪酸发生脂质过氧化作用被大量消耗, 导致血清脂肪酸水平降低。肝脏是C20:4n6代谢和失活的主要场所, 也是C20:4n6及其代谢产物的作用靶器官。当肝脏损伤时, 肝脏对C20:4n6及其代谢物的摄取、代谢灭活及排泄功能势必发生障碍, 从而影响血、尿和胆汁中的水平变化[13]。C20:4n6可由必需脂肪酸C18:2n6转化而来。肝脏利用C18:2n6作为原料, 在肝脏内进行碳链的延长和去饱和后生成C20:4n6。在本实验中, ET组的C18:2n6水平显著升高, 而C20:4n6的表达则显著下降, 这两个游离脂肪酸的变化趋势可能是ET抑制了C18:2n6向C20:4n6转化通路的结果。有研究表明ET的氯仿萃取部位能显著升高肝细胞内钙离子浓度[14], 而花生四烯酸代谢通路的关键限速酶PLA2的活性与钙离子有正相关性。由于C20:4n6的含量在两个给药组中均显著下调, 因此ET和DB均可能激活花生四烯酸的炎症级联代谢通路代谢大量炎症因子导致肝脏实质变性和炎性细胞浸润等。
本研究从脂肪酸代谢的层面上评价了中药黄药子及毒性成分DB诱导大鼠肝损伤, 并结合化学计量学方法分析脂肪酸的代谢轮廓与黄药子的肝毒性相关性, 为深入研究黄药子的肝毒性分子作用机制奠定基础。
| [1] | Ma YB, Ji LL, Wang SC, et al. Protection of Grateloupia filicina polysaccharide against hepatotoxicity induced by Dioscorea bulbifera L[J]. Acta Pharm Sin (药学学报), 2013, 48: 1253–1258. |
| [2] | Niu CW, Ji LL, Wang ZT. Protection of Herba Scutellariae Barbatae against hepatotoxicity induced by Rhizoma Dioscoreae Bulbiferae and its mechanism[J]. Acta Pharm Sin (药学学报), 2016, 51: 373–379. |
| [3] | Zhao LG, Liu RN, Shi L, et al. Study on the "dosage-time-toxicity" relationship of hepatotoxicity induced by the decoction of airpotato Yam Rhizome in mice[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2013, 29: 96–98. |
| [4] | Wang JM, Cui DP, Cui Y. Research progress in chemical components, pharmacological actions and toxicity of diterpene lactones isolated from Dioscoreae Bulbifera L. Rhizome[J]. China J Chin Med (中医学报), 2011, 26: 1319–1321. |
| [5] | Niu CW, Lu B, Ji LL, et al. Study on diosbulbin B-induced acute liver injury in mice and its mechanism[J]. Chin J Chin Mater Med (中国中药杂志), 2014, 39: 1290–1292. |
| [6] | Labbe G, Pessayre D, Fromenty B. Drug-induced liver injury through mitochondrial dysfunction: mechanisms and detection during preclinical safety studies[J]. Fundam Clin Pharmacol, 2008, 22: 335–353. DOI:10.1111/fcp.2008.22.issue-4 |
| [7] | Day CP. Pathogenesis of steatohepatitis[J]. Best Pract Res Clin Gastroenterol, 2002, 16: 663–678. DOI:10.1053/bega.2002.0333 |
| [8] | El-Mowafy AM, Katary MM, Pye C, et al. Novel molecular triggers underlie valproate-induced liver injury and its allevia-tion by the omega-3 fatty acid DHA: role of inflammation and apoptosis [J]. Heliyon, 2: e00130. |
| [9] | Schmöcker C, Weylandt KH, Kahlke L, et al. ω-3 Fatty acids alleviate chemically induced acute hepatitis by suppression of cytokines[J]. Hepatology, 2007, 45: 864–869. DOI:10.1002/(ISSN)1527-3350 |
| [10] | Xu Y, Chen CC, Yang L, et al. Evaluation on hepatotoxicity caused by Dioscorea bulbifera based on analysis of bile acids[J]. Acta Pharm Sin (药学学报), 2011, 46: 39–44. |
| [11] | Xiong YH, Xu Y, Yang L, et al. Gas chromatography-mass spectrometry-based profiling of serum fatty acids in acetaminophen-induced liver injured rats[J]. J Appl Toxicol, 2014, 34: 149–157. DOI:10.1002/jat.v34.2 |
| [12] | Wang JM, Ji LL, Liu H, et al. Study of the hepatotoxicity induced by Dioscorea bulbifera L. rhizome in mice[J]. Biosci Trends, 2010, 4: 79–85. |
| [13] | Chen L, Wang BY, Mao XZ. Changes of plasma levels of several arachidonic acid metabolites and hormones in CCl4-induced liver injury[J]. Chin J Pathophys (中国病理生理杂志), 2000, 16: 858–860. |
| [14] | Wang JZ, Liu SM, Tang Q, et al. Toxic components of Dioscorea bulbifera L influence on the Ca2+ concentration in liver cells[J]. Inform Tradit Chin Med (中医药信息), 2012, 29: 15–16. |
 2017, Vol. 52
2017, Vol. 52


