2. 新疆医科大学第六附属医院, 新疆 乌鲁木齐 830002;
3. 新疆药物研究所, 新疆 乌鲁木齐 830002
2. The Sixth Affiliated Hospital, Xinjiang Medical University, Urumchi 830002, China;
3. The Xinjiang Institute of Materia Medica, Urumchi 830002, China
流行性感冒 (流感) 是由流感病毒引起的急性呼吸系统传染病, 每年在全球范围内爆发的季节性流感可使全球5%~15%的人口发病, 死亡人数约为300 000~500 000例, 对人类的健康造成严重威胁。流感具有发病率高、起病迅速、传播快和变异性强的特点, 目前经美国FDA批准上市的抗流感药物金刚烷胺类和神经氨酸酶 (NA) 抑制剂奥司他韦已有耐药性报道。因此, 研制新型预防或治疗流感的药物仍是目前的研究热点[1]。
与西药相比, 中药具有综合调节多靶点的特点, 不仅能减轻症状, 而且具有提高人体免疫功能的作用。据报道, 抗流感病毒的中药, 主要有直接和间接抗流感病毒的方式。直接抗病毒是通过阻断病毒繁殖过程中的某一环节而达到抗流感作用; 间接抗病毒是通过促进网状内皮系统的吞噬功能, 诱导干扰素, 促进巨噬细胞活化, 促进白介素产生, 增强机体细胞和体液免疫功能, 从而达到抵御流感病毒入侵的作用[2]。
复方一枝蒿颗粒是维吾尔医学中治疗感冒的纯中药临床经验方, 收载于《国家中成药标准汇编》, 处方由板蓝根、大青叶、一枝蒿3味中药组成, 主要用于治疗咽喉肿痛和感冒发烧等[3]。根据文献报道, 板蓝根是通过多种化学成分、多个靶点作用来发挥抗流感病毒作用。板蓝根凝集素可阻断新生流感病毒的核蛋白表达而对流感病毒具有直接杀灭作用; 同时尿苷、鸟苷、腺苷等核苷类成分能干扰病毒核酸的合成, 发挥直接的抗流感病毒作用; 另外, 多糖类成分具有免疫调节作用, 发挥间接的抗流感病毒作用[4-8]。大青叶水提物可从细胞免疫和体液免疫两方面调节免疫功能, 发挥间接的抗流感病毒作用[8, 9]。一枝蒿中的酮酸和黄酮类化合物可以抑制神经氨酸酶活性和膜融合作用, 发挥直接抗流感病毒作用; 一枝蒿的提取物能增强免疫功能, 发挥间接的抗病毒作用[10-12]。综上研究表明, 复方一枝蒿具有抑制流感病毒复制和调节机体免疫的双重作用, 推测可能是通过多个网络药理学靶点发挥作用的。但是, 关于复方一枝蒿中具有抑制流感病毒复制及调节机体免疫作用的具体成分及其网络作用机制尚未见系统的研究报道。
本文基于现有的药物靶点数据库和活性化合物数据库, 对流感病毒相关靶点、靶点相关活性化合物及非活性化合物进行收集。在此基础上, 利用朴素贝叶斯算法, 基于分子指纹和分子描述符, 建立了一系列抗流感药物靶点预测模型, 形成了抗流感多靶点预测平台。同时, 对复方一枝蒿的化学成分进行收集。利用靶点预测平台, 对复方一枝蒿的有效成分及其作用靶点进行预测, 并利用网络开发专业软件, 构建了化学成分-药物靶点网络及药物靶点-生物通路网络, 以揭示复方一枝蒿的多种有效成分抗流感的网络药理机制, 为复方一枝蒿抗流感的开发与临床应用提供理论依据。
材料与方法 中药化学成分的收集复方一枝蒿共包含3味中药, 即板蓝根、大青叶、一枝蒿。这些中草药的化学成分从TCM-Database@Taiwan数据库 (http://tcm.cmu.edu.tw)[13]、TCMSP数据库 (http://lsp.nwsuaf.edu.cn/tcmsp.php)[14]和PubChem Compound数据库 (https://www.ncbi.nlm.nih.gov/pccompound/) 获得。
靶点、靶点活性化合物及相应非活性化合物的收集从Thomson Reuters Integrity数据库输入关键词“influenza”, 收集流感相关靶点。再从Binding DB数据库下载各个靶点的活性化合物, 并剔除活性化合物小于50个的靶点。利用Discovery studio 2016从各个靶点的活性化合物中随机挑选出10%, 用于在DUD-E: A Database of Useful (Docking) Decoys-Enhanced (http://dude.docking.org/) 数据库收集相应非活性化合物, 并使用MOE软件进行相关格式转换。
构建并评价模型将收集到的靶点活性化合物及相应非活性化合物建立成训练集和测试集, 使训练集和测试集中包含的活性化合物及非活性化合物数目比例为3:1。再利用Discovery studio 2016采用朴素贝叶斯 (Naive Bayesian, NB) 的建模方法, 利用分子指纹描述符ECFP-6和分子描述符构建了18个抗流感重要靶点的理论预测模型, 并通过训练集的五倍交叉验证与测试集验证, 证明这些模型的预测精度。评价预测标准都是以真阳性 (true positive, TP)、真阴性 (true negative, TN)、假阳性 (false positive, FP)、假阴性 (false negative, FN) 的相关组合来评价的。如敏感度 (sensitivity, SE)、精确度 (specificity, SP)、总体预测精度 (overall prediction accuracy, Q)、马修斯相关系数 (Matthews correlation coefficient, MCC) 和受试集工作特征曲线的曲线下面积 (area under the receiver operating characteristic curve, AUC)[15]。各参数计算公式如下:
| $ \begin{array}{l} {\rm{SE = }}\frac{{{\rm{TP}}}}{{{\rm{TP}} + {\rm{FN}}}}\\ {\rm{SP = }}\frac{{{\rm{TN}}}}{{{\rm{TN}} + {\rm{FP}}}}\\ {\rm{Q = }}\frac{{{\rm{TP}} + {\rm{TN}}}}{{{\rm{TP}} + {\rm{TN}} + {\rm{FP}} + {\rm{FN}}}}\\ {\rm{MCC = }}\frac{{{\rm{TP}} \times {\rm{TN}} - {\rm{FN}} \times {\rm{FP}}}}{{\sqrt {({\rm{TP}} + {\rm{FN}})({\rm{TP}} + {\rm{FP}})({\rm{TN}} + {\rm{FN}})({\rm{TN}} + {\rm{FP}})} }} \end{array} $ |
另外, AUC数值越大, 说明预测结果越好, 最佳值为1。
靶点预测基于上述建模方法构建的针对流感疾病的药物靶点预测平台, 对复方一枝蒿的化学成分进行靶点预测, 进而分析中药有效成分与靶点之间的关联性[16]。
作用网络分析基于靶点预测结果利用Cytoscape-3.2.1构建化学成分-靶点的作用网络后, 再对中药化学成分作用靶点的代谢通路利用DAVID数据库进行Gene-Ontology (GO) 富集分析, 利用Cytoscape-3.2.1构建靶点-通路网络。
结果 1 中药化学成分的收集通过对TCM-Database @Taiwan数据库、TCMSP数据库及PubChem Compound数据库搜索, 合并重复的成分并去除成分中的长链烷烃后, 共收集到板蓝根化学成分127个、大青叶化学成分36个及一枝蒿化学成分52个。
2 流感相关靶点及其活性化合物、非活性化合物的收集从Thomson Reuters Integrity数据库收集到符合要求的流感疾病相关靶点18个, 其中流感病毒蛋白来源的靶点4个, 宿主蛋白来源的靶点2个, 流感相关抗炎免疫靶点12个, 靶点名称、缩写及分类如表 1所示。并从Binding DB数据库收集了各靶点相应的活性化合物, 对化合物数目进行整理, 如图 1所示。

|
Figure 1 The drug targets and the number of their active compounds |
| Table 1 Influenza related drug targets and their classification |
利用Discovery studio 2016构建了18个流感疾病相关重要靶点的理论预测模型, 通过训练集5倍交叉验证与测试集验证, 检定了这些模型的精确度, 结果如表 2和表 3。在表 2中, 所有模型的训练集5倍交叉验证结果中MCC大于0.93, AUC大于0.98;在表 3中, 所有模型的测试集验证结果中的MCC大于0.82, AUC大于0.98。说明各模型都具有较高的预测精度, 可用于复方一枝蒿有效化学成分和潜在靶点的预测。
| Table 2 The performance of the training set by 5-fold cross-validation. TP: True positive; FN: False negative; FP: False positive; TN: True negative; SE: Sensitivity; SP: Specificity; Q: The overall prediction accuracy; MCC: Matthews correlation coefficient; AUC: The area under the receiver operating characteristic curve |
| Table 3 The performance of the test set by 5-fold cross-validation |
基于上述模型对复方一枝蒿的板蓝根、大青叶和一枝蒿3个单味中药的化学成分分别进行活性预测, 作用于各个靶点的活性化学成分见表 4。并对3个单味药中不同作用靶点数目的化学成分的个数进行了统计, 结果见图 2, 这些化学成分平均有4.67个作用靶点。在此基础上, 分别对3味药中各靶点的活性化合物按化学结构进行分类, 将作用于相同靶点且结构骨架相似的化合物归于一类, 并选择具有代表性的化合物, 应用Cytoscape-3.2.1软件构建了3个单味药的化学成分-靶点网络, 见图 3~5。其中涉及到的用MOL ID或Pubchem ID表示的化合物名称见表 5。从综合结果来看, 作用于靶点IL-1β-CE、IL-1 RAK3、IL-8 Rα、RNA pol及Lysα-glu的有效化学成分较多。最后经DAVID数据库对GO biological pathway进行富集分析, 得到了5个靶点-生物通路网络, 结果见图 6。这些靶点涉及最多相关通路的是蛋白自身磷酸化, 其次是NF-κB转录因子活性的正向调节及天然免疫应答。验证了复方一枝蒿的化学成分不仅仅直接作用于流感病毒, 对于机体免疫也有调节作用。
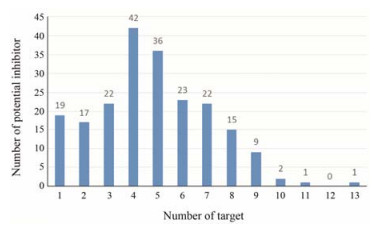
|
Figure 2 The number of potential inhibitors in Compound Yizhihao in different frequency of targets |
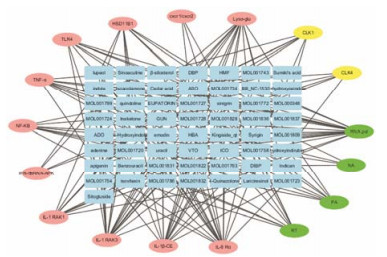
|
Figure 3 The constituent-target network for potential inhibitors from Radix isatidis. The blue rectangle means active compound, and the oval means drug target. Among them, the red oval means immune-related target, the yellow oval means host protein and the green oval means protein of influenza virus |

|
Figure 4 The constituent-target network for potential inhibitors from Folium isatidis. The blue rectangle means active compound, and the oval means drug target. Among them, the red oval means immune-related target, the yellow oval means host protein and the green oval means protein of influenza virus |

|
Figure 5 The constituent-target network for potential inhibitors from Artemisia rupestris. The blue rectangle means active compound, and the oval means drug target. Among them, the red oval means immune-related target, the yellow oval means host protein and the green oval means protein of influenza virus |
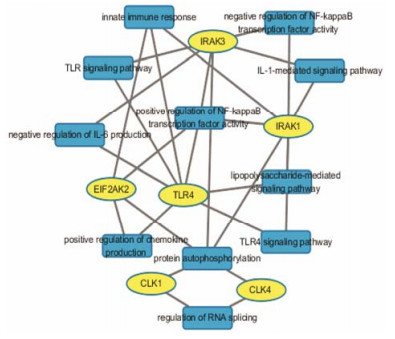
|
Figure 6 The target-pathway network by the enrichment analysis of Gene-Ontology (GO) biological pathway |
| Table 4 The number of potential inhibitors on each targets from Radix isatidis, Folium isatidis, Artemisia rupestris |
| Table 5 The name of compounds represented by MOL ID/Pubchem ID in Figure 3-5 |
复方一枝蒿作为维吾尔民族药应用于流感疾病的治疗, 具有确切的治疗效果, 但其物质基础及作用机制尚不明确。随着对流感病毒发病机制的不断认识, 流感的发生并非简单地由病毒自身组件侵害宿主而引起, 而是通过病毒组件-宿主因子复杂的相互作用网络而发生的[17]。2008年, Hopkins[18]明确提出“网络药理学”的概念, 指出疾病是多个通路、多途径分子功能网络相互作用的过程, 研发作用于网络靶点的新药是未来的研究模式。本文利用网络药理学的研究思路, 探讨了复方一枝蒿抗流感的网络作用机制。
本文采用朴素贝叶斯的建模方法, 利用分子指纹描述符ECFP-6和分子描述符, 构建了18个抗流感病毒重要靶点的理论预测模型, 并通过训练集5倍交叉验证与测试集验证的方法, 确证了这些模型均具有较强的预测能力, 形成了抗流感药物靶点和活性化学成分的预测系统, 该系统可用于化合物抗流感靶点的预测和中药抗流感活性化学成分的预测。
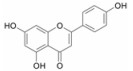
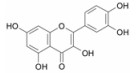
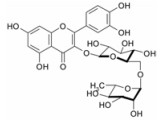
应用该预测系统, 对复方一枝蒿抗流感的化学成分和作用靶点进行了预测, 发现板蓝根的127个化学成分中, 有84个化学成分与流感病毒蛋白有关, 45个化学成分与病毒复制相关的宿主蛋白有关, 124个化学成分与抗炎免疫有关; 大青叶的36个化学成分中, 有24个化学成分与流感病毒蛋白有关, 9个化学成分与病毒复制相关的宿主蛋白有关, 35个化学成分与抗炎免疫有关; 一枝蒿的52个化学成分中, 有37个化学成分与流感病毒蛋白有关, 14个化学成分与病毒复制相关的宿主蛋白有关, 52个化学成分与抗炎免疫有关。在复方一枝蒿的215个化学成分中具有3个以上靶点作用的化合物151个。其中许多成分已有文献报道, 如一枝蒿酮酸体外研究显示该化合物具有较强的抗B型流感病毒活性[10]; 靛玉红、靛蓝, 4-3 (H) 喹唑酮、异牡荆苷、紫丁香苷、琥珀酸、黑芥子苷、新橙皮苷、异甘草素、表告依春和蒙花苷具有体外抗流感病毒作用[19]; 落叶松脂素-4, 4'-二-O-β-D-二葡萄糖苷通过干扰流感病毒早期核蛋白的表达和核输出途径, 阻断病毒早期的复制繁殖[20]; 靛玉红通过抑制流感病毒感染的人支气管上皮细胞活化趋化因子的表达发挥作用[21]等。经整合分析, 作用靶点3个以上的典型化学成分、在DrugBank中记载的作用靶点及预测靶点, 如表 6所示。这些对于多靶点抗流感药物设计将提供重要信息。
| Table 6 The typical examples of multi-target constituents |
从3个单味中药的化学成分-药物靶点作用网络可以看出, 它们的化学成分对各靶点均有不同程度的作用。其中, 板蓝根的已知化学成分最多, 其作用网络也最为复杂, 核心靶点 (有45个以上的化合物与之作用) 有免疫相关靶点, 包括IL-1 RAK3、IL-8 Rα和IL-1β-CE, 还有与流感病毒蛋白相关的RT以及与病毒复制相关的宿主蛋白CLK1等; 大青叶的核心靶点与板蓝根类似; 一枝蒿的化学成分对于RNA pol以及炎症相关靶点HSD11B1的作用相对较多。这些研究结果充分说明, 复方一枝蒿中各组分之间在抗流感作用方面相辅相成, 协同发挥作用。最后的代谢通路富集结果说明复方一枝蒿的化学成分作用于多条免疫相关通路, 从而参与机体免疫调节, 发挥抗流感作用。
综上所述, 复方一枝蒿具有抑制流感病毒复制和抗炎免疫的药效作用, 通过多成分、多靶点和多通路发挥网络药理的抗流感作用。本研究将为复方一枝蒿抗流感的临床应用、多靶点抗流感新药设计提供重要信息, 也为研究其他中药复方的抗流感作用靶点和活性化学成分提供预测工具。
| [1] | Ehrhardt C, Seyer R, Hrincius ER, et al. Interplay between influenza A virus and the innate immune signaling[J]. Microbes Infect, 2010, 12: 81–87. DOI:10.1016/j.micinf.2009.09.007 |
| [2] | Wang LQ, Yang R, Yuan BC, et al. The antiviral and antimicrobial activities of licorice, a widely-used Chinese herb[J]. Acta Pharm Sin B, 2015, 5: 310–315. DOI:10.1016/j.apsb.2015.05.005 |
| [3] | Jiang W, Yao H, Chen Q, et al. Antivirus effect of compound Yizhihao pellets on influenza virus H1N1 infection in mice[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2015, 31: 135–137. |
| [4] | Li L, Yang ZF. Review of anti-influenza virus effect of Radix isatidis on multi-target[J]. J New Chin Med (新中医), 2014, 46: 202–204. |
| [5] | Shin EK, Kim DH, Lim H, et al. The anti-inflammatory effects of a methanolic extract from Radix isatidis in murine macrophages and mice[J]. Inflammation, 2010, 33: 110–118. DOI:10.1007/s10753-009-9164-9 |
| [6] | Xiao P, Ye W, Chen J, et al. Antiviral activities against influenza virus (FM1) of bioactive fractions and representative compounds extracted from Banlangen (Radix isatidis)[J]. J Tradit Chin Med, 2016, 36: 369–376. DOI:10.1016/S0254-6272(16)30051-6 |
| [7] | Zhou W, Zhang XY. Research progress of Chinese herbal medicine Radix isatidis (banlangen)[J]. Am J Chin Med, 2013, 41: 743–764. DOI:10.1142/S0192415X1350050X |
| [8] | Muluye RA, Bian YH, Alemu PN. Anti-inflammatory and antimicrobial effects of heat-clearing Chinese herbs: a current review[J]. J Tradit Complement Med, 2014, 4: 93–98. DOI:10.4103/2225-4110.126635 |
| [9] | Liu Z, Yang ZQ, Xiao H, et al. Antiviral activity of the effective monomers from Folium isatidis against influenza virus in vitro[J]. J South-Central Univ Natl (Nat Sci) (中南民族大学学报 (自然科学版)), 2009, 28: 42–46. |
| [10] | Yong JP, Lu CZ, Aisa HA. Advances in studies on the rupestonic acid derivatives as anti-influenza agents[J]. Mini Rev Med Chem, 2013, 13: 310–315. |
| [11] | Dong HJ, Jiang YT, Yu KY, et al. Advances in research on artemisia rupestris L[J]. Chin Med J Res Prac (现代中药研究与实践), 2013, 27: 73–77. |
| [12] | Ji TF, Yang JB, Song WX, et al. Studies on chemical constituents of Artemisia rupestris (Ⅱ)[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 1187–1189. |
| [13] | Chen CYC. TCM Database@Taiwan: the world's largest traditional Chinese medicine database for drug screening in silico[J]. PLoS One, 2011, 6: e15939. DOI:10.1371/journal.pone.0015939 |
| [14] | Ru JP, Li J, Wang W, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [15] | Fang JS, Yang RY, Gao L, et al. Predictions of BuChE inhibitors using support vector machine and naive bayesian classification techniques in drug discovery[J]. J Chem Inf Model, 2013, 53: 3009–3020. DOI:10.1021/ci400331p |
| [16] | Fang JS, Wu P, Yang RY, et al. Inhibition of acetylcholi-nesterase by two genistein derivatives: kinetic analysis, molecular docking and molecular dynamics simulation[J]. Acta Pharm Sin B, 2014, 4: 430–437. DOI:10.1016/j.apsb.2014.10.002 |
| [17] | Vijaykrishna D, Smith GJ, Pybus OG, et al. Long-term evolution and transmission dynamics of swine influenza A virus[J]. Nature, 2011, 473: 519–522. DOI:10.1038/nature10004 |
| [18] | Hopkins AL. Network pharmacology: the next paradigm in drug discovery[J]. Nat Chem Biol, 2008, 4: 682–690. DOI:10.1038/nchembio.118 |
| [19] | Ye WY, Li X, Chen JW. Screening of 11 antiviral effect constituents from Radix isatidis[J]. J Emerg Tradit Chin Med (中国中医急症), 2011, 20: 1772–1774. |
| [20] | Yang ZF, Wang YT, Zheng ZG, et al. Antiviral activity of Isatisindigotica root-derived clemastanin B against human and avian influenza A and B viruses in vitro[J]. Int J Mol Med, 2013, 31: 867–873. |
| [21] | Mak NK, Leung CY, Wei XY, et al. Inhibition of RANTES expression by indirubin in influenza virus-infected human bronchial epithelial cells[J]. Biochem Pharm, 2004, 67: 167–174. DOI:10.1016/j.bcp.2003.08.020 |
 2017, Vol. 52
2017, Vol. 52