帕金森氏病 (Parkinson’s disease, PD) 是发病率居第二位的神经退行性疾病。主要病理改变是黑质致密部多巴胺能神经元丢失, 导致多巴胺能神经元功能低下而胆碱能神经元占优势[1], 引起患者静止性震颤、僵直、行动迟缓、站立不稳、自主活动障碍并伴有情感和认知障碍。PD的主要病理标志是脑内出现以α-突触核蛋白 (α-synuclein, α-Syn) 为主要成分的路易小体。按遗传方式分为家族性和散发性PD, 其中家族性PD与α-Syn的基因错义突变 (A53T、A30P和G46L) 相关[2]。全基因组关联分析表明α-Syn与散发性PD也有密切的关系, 是散发性PD路易小体的主要成分[3]。除此之外, PD的发病还受到其他因素的影响, 其中神经炎症在PD的发生和发展中起着重要的作用[4]。在受到外界致病因子刺激时, 脑内小胶质细胞被激活, 吞噬损伤的组织和异物, 有利于组织修复。若炎症持续存在, 变成慢性炎症, 胶质细胞被过度激活, 释放多种炎症趋化因子、细胞因子和兴奋性氨基酸等毒性物质损伤神经元[5]。受损的神经元释放出细胞内蛋白, 与胶质细胞膜表面受体结合, 激活胶质细胞, 从而在神经元凋亡和胶质细胞激活之间形成恶性循环, 导致神经元慢性进行性死亡和丢失[6]。因此, 炎症因素和遗传因素共同参与了PD的发病。
由于PD是多种因素长期刺激的结果, 单一因素引起的PD病理改变不能全面模拟PD发病的病程和特点。为了更好地模拟PD的病因和病理过程, 本研究运用脂多糖 (lipopolysaccharide, LPS) 联合α-Syn基因突变, 模拟炎症和遗传因素双重打击小鼠, 观察其运动协调能力、多巴胺能神经元的功能和脑内炎症反应, 最后采用蛋白质组学寻找该模型中差异蛋白并进行验证。通过以上研究旨在模拟并阐明在长期炎症和遗传因素双重打击下, PD模型小鼠的运动功能障碍和脑内病理变化, 为研究PD提供更理想和更有效的动物模型。
材料与方法 动物分组和处理4月龄清洁级雄性α-Syn (A53T) 杂合子转基因小鼠[201503826; B6; C3-Tg (Prnp-SNCA*A53T) 83Vle/Jnju]由南京大学模式动物所提供。实验分为野生型 (WT) 组、WT+LPS组、α-Syn组和LPS+α-Syn组。LPS (Sigma-Aldrich公司) 溶于生理盐水, 5 mg·kg-1腹腔注射, 每周1次, 连续8周, 对照组小鼠注射等体积生理盐水。所有实验均按北京市实验动物伦理委员会规定进行操作。
小鼠运动行为学测试转棍法 转棍仪 (中国医学科学院药物研究所研制) 为直径3 cm, 长约为50 cm, 用隔板分隔为5段的水平杆, 保证动物彼此不受影响。转棍仪转速设为恒速14 r·min-1。将小鼠置于杆上, 打开开关, 开始计时, 记录从开始转棍到小鼠从杆上掉下的时间, 记为潜伏期 (即第1次掉落的时间), 以此表示其运动协调能力。于小鼠腹腔注射LPS 8周后的第7天进行转棍测试, 每只小鼠测试2次, 每次间隔1 h, 取平均值。
爬杆法 爬杆法用一直径13 mm, 高50 cm, 顶部有一直径3 cm木球的光滑木杆 (中国医学科学院药物研究所研制), 垂直放置, 将小鼠头向下放置在杆的顶部球上, 让其沿杆自然爬下, 观察动物在爬下过程中的行为。小鼠爬下过程中的行为按标准记分, 评分标准如下: 5分:四肢并用, 一步一步协调向下爬行; 4分:一步一步向下爬行但兼有后肢滑行行为; 3分:爬过一半距离后向下滑行, 但可抱紧杆; 2分:未爬过一半距离即出现滑行行为; 1分:爬过一半距离后不能抓杆从杆上掉落; 0分:未爬过一半距离即不能抓杆, 从杆上掉落。实验前每只小鼠训练2次。于小鼠腹腔注射LPS 8周后的第7天进行爬杆测试, 每只小鼠测试2次, 每次间隔1 h, 按照上述标准进行评分, 取平均值。
Western blot 小鼠于末次行为学结束后, 断头取中脑, 用非变性裂解液 (北京普利莱公司) 匀浆提蛋白。匀浆液离心后煮沸5 min。10% SDS聚丙烯酰胺凝胶电泳分离蛋白, 然后转移到PVDF膜上。转移上蛋白的PVDF膜用5% TBST配制的脱脂奶粉 (北京普利莱公司) 室温封闭2 h。4 ℃下与TBST稀释的一抗TH (tyrosinehydroxylase)、Bcl-2、Bax (Santa Cruz公司)、COX7RP、CD99L2、RCN1或Claudin-11 (Cell Signaling公司) 孵育过夜。用TBST洗3遍, 然后在TBST稀释的辣根过氧化酶偶联的二抗中孵育2 h, 再用TBST洗3遍后, 在LAS4000化学发光系统 (Fujifilm, 日本) 检测, Gel-Pro Analyzer 4.0分析条带灰度。
免疫组化 行为学实验后, 每组随机取4只小鼠, 灌流固定后取脑, 标本完全包埋后, 在黑质部位行连续冠状面切片, 厚度20 μm。3% H2O2室温孵育10 min, PBST洗3次, 每次5 min; 用羊血清原液室温封闭30 min, 加入稀释好的TH (Santa Cruz公司) 或Iba1 (Abcam公司) 抗体4 ℃孵育过夜。然后加生物素标记的二抗, 室温孵育2 h。加辣根过氧化物酶 (HRP) 标记链亲合素, 室温孵育2 h。用DAB工作液显色2 min左右; 显微镜下控制染色程度, 自来水终止显色反应。将脑切片固定于用黏片液处理过的载玻片上, 自然晾干。75%、80%、90%、95%梯度酒精依次脱水, 二甲苯透明2次, 中性树脂封片。在光学倒置显微镜下观察小鼠TH神经元数量的变化。计数黑质致密部TH或Iba1阳性神经元数目, 取平均值。
多巴胺检测 分离小鼠纹状体, 按照1:5 (w/v), 即1 mg组织样品加入A液 (0.6 mol·L-1高氯酸溶液中加入异丙肾上腺素, 其终质量浓度为0.375 μg·mL-1) 5 μL的比例加入, 匀浆, 4 ℃、20 000 ×g离心20 min, 吸取一定量上清, 加入半体积的B液 (柠檬酸钾20 mmol·L-1, 磷酸氢二钾300 mmol·L-1, EDTA·Na2 2 mmol·L-1), 冰浴30 min, 20 000 ×g、4 ℃离心20 min, 吸取上清, 4 ℃保存待测。Waters电化学检测器 (Waters公司, 美国) 检测多巴胺的含量。流动相为乙酸钠-柠檬酸缓冲液 (柠檬酸85 mmol·L-1, 无水乙酸钠100 mmol·L-1, EDTA·Na2 0.2 mmol·L-1, 甲醇15%, pH 3.68)。泵流速1.2 mL·min-1, 检测器检测灵敏度10 nA, 玻碳工作电极, Ag/AgCl参比电极, 检测电位0.76 V, 柱温25 ℃。
ELISA 小鼠分离中脑, 非变性裂解液匀浆, 离心后取上清, 用TNF-α和IL-1β ELISA试剂盒 (eBioscience公司) 检测TNF-α和IL-1β的含量, 按照试剂盒说明书进行操作。
蛋白质组学研究蛋白提取和消化小鼠中脑于蛋白裂解液 (50 mmol·L-1 Tris-HCl, 2.5 mol·L-1 thiourea, 8 mol·L-1 urea, 4% CHAPS, 65 mmol·L-1 DTT) 提取总蛋白。过滤后使用微波辅助蛋白质样品制备方法进行酶切, 然后用C18柱 (3 cc, 60 mg, Oasis) 脱盐, 500 μL 0.1%甲酸洗7次, 500 μL 100% ACN洗脱, 洗脱液真空离心干燥, -80 ℃保存。
iTRAQ标记 消化后的样品与等比例的内标混匀, 用116、117和118 iTRAQ标记。标记按照说明书进行操作 (ABsciex), 冻干后进行2D-LC/MS/MS检测。
2D-LC/MS/MS将标记的样品用高pH柱分离 (Waters, 250 mm × 4.6 mm, C18, 3 μm)。洗脱梯度为5%~90%洗脱液 (90%乙腈, pH 10), 洗脱60 min。每分钟收集一次洗脱肽段。用自制反向C18柱 (100 mm × 75 μm, 3 μm) 分析样品。洗脱梯度为5%~30%洗脱液 (0.1%甲酸, 99.9%乙腈), 洗脱100 min。用Triple-OF 5600 (Waters公司, 美国) 分析样品。每个扫描之后, 系统进行30个MS/MS分析, 碰撞能量是35%。电荷扫描带+2~+4个电荷的母离子, 15 s内采用动态排除。MS/MS扫描的范围是100~1 800 m/z, 扫描时间100 ms。
数据库搜索 用Mascot software version 2.3.02 (Matrix Science, UK) 软件在Uniprot网站 (http://www.uniprot.org) SwissProt小鼠数据库搜索MS/MS图谱。条件如下:胰酶:允许有2个错切的位点, Carbamidomethylation和iTRAQ 4-plex标作为固定修饰。搜索时肽段和例子的误差是0.05 Da。其他筛选条件:蛋白水平允许有1%假阳性率, 每个蛋白有2个特异肽段。
统计分析 采用SPSS 17.0统计软件进行数据分析, 数据均以均数±标准差x ± s表示, 不同组间的差异比较用双因素方差分析 (two-way ANOVA), 然后采用LSD检验。P < 0.05表示结果具有统计学差异。
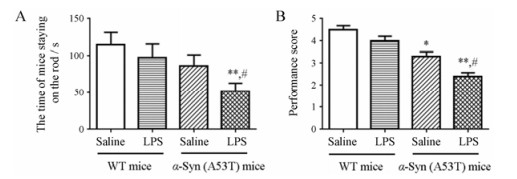
结果 1 LPS加重α-Syn转基因小鼠运动协调能力障碍选用4月龄α-Syn转基因小鼠腹腔注射5 mg·kg-1 LPS模拟炎症刺激和遗传因素双重打击。8周后用转棍法和爬杆法测试小鼠运动协调能力。结果显示单独注射LPS后, 小鼠的运动能力与WT小鼠相比有下降的趋势, 即在转棍上停留的时间减少和爬杆评分降低, 但无统计学差异。α-Syn转基因小鼠爬杆评分明显降低, 而在转棍上停留的时间与WT小鼠无显著性差异。而α-Syn转基因小鼠注射LPS与LPS单独注射或α-Syn转基因小鼠相比在棍上停留的时间和爬杆评分都进一步降低 (图 1), 表明α-Syn基因突变联合LPS双重打击可加重小鼠运动功能障碍。
|
Figure 1 Lipopolysaccharide (LPS) potentiated the movement dysfunction of α-Syn (A53T) transgenic mice. Wide type (WT) and α-Syn transgenic mice were injected with LPS once a week for 8 weeks, the movement behaviour was detected by rotarod test and pole test. A: Rotarod test; B: Pole test. n = 12, x ± s. P < 0.05, **P < 0.01 vs WT mice; #P < 0.05 vs LPS-injected mice or α-Syn transgenic mice |
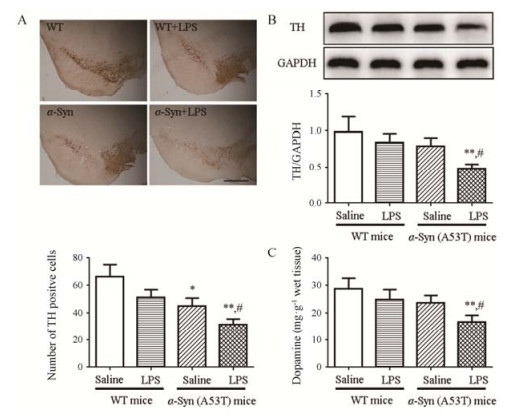
PD的主要病理改变是黑质多巴胺能神经元变性丢失, 从而导致纹状体多巴胺水平下降。研究结果显示, 小鼠腹腔注射LPS后, 黑质致密部TH阳性神经元的数量减少, 中脑TH的表达降低, 纹状体多巴胺的水平下降, 但与WT小鼠相比均无统计学差异。α-Syn转基因小鼠TH阳性神经元的数量与WT小鼠相比均显著降低, 而TH的表达和多巴胺的水平与WT小鼠相比无显著性差异。LPS联合α-Syn基因突变双重刺激后, 以上3个指标降低更为明显, 多巴胺能神经元功能出现明显下降 (图 2)。以上结果表明, LPS刺激可加重α-Syn转基因小鼠多巴胺能神经元的损伤。
|
Figure 2 LPS potentiated dopaminergic neuronal dysfunction α-Syn (A53T) transgenic mice. WT and α-Syn transgenic mice were injected with LPS once a week for 8 weeks, the tyrosinehydroxylase (TH) positive cells, TH expression and dopamine levels were detected. A: TH positive cells (n = 4), bar = 500 μm; B: TH expression (n = 3); C: Dopamine content (n = 6), x ± s. P < 0.05, **P < 0.01 vs WT mice; #P < 0.05 vs LPS-injected mice or α-Syn transgenic mice |
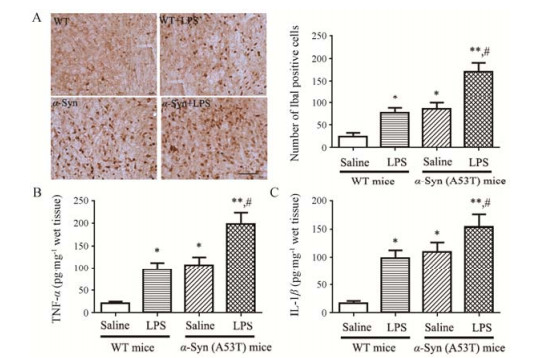
本研究继续研究LPS是如何加重α-Syn转基因小鼠多巴胺能神经元损伤的。发现单独LPS或α-Syn刺激均可引起脑内炎症反应, 表现在小鼠黑质处小胶质细胞活化标志物离子钙接头蛋白分子1 (ionized calcium binding adapter molecule 1, Iba1) 表达升高, 中脑炎症因子TNF-α和IL-1β水平升高。而LPS联合α-Syn刺激后, 小鼠中脑Iba1表达、TNF-α和IL-1β水平均明显高于LPS或α-Syn单独刺激 (图 3), 表明LPS与α-Syn联合打击可加重神经炎症反应, 这可能是LPS导致α-Syn转基因小鼠多巴胺能神经元损伤加重的直接原因。
|
Figure 3 LPS increased the neuroinflammatory response in the brains of α-Syn (A53T) transgenic mice. WT and α-Syn transgenic mice were injected with LPS once a week for 8 weeks, Iba1 expression, TNF-α and IL-1β productions were assayed. A: Iba1 positive cells (n = 4), bar = 32 μm; B: TNF-α production (n = 6); C: IL-1β production (n = 6), x ± s. P < 0.05, **P < 0.01 vs WT mice, #P < 0.05 vs LPS-injected mice or α-Syn transgenic mice |
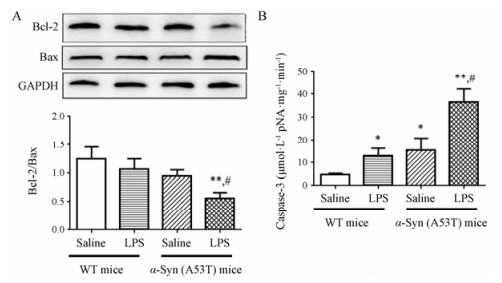
PD的神经退行性变与神经元凋亡有密切的关系, 研究发现Bcl-2与Bax蛋白水平高低与调控凋亡直接相关, Bcl-2增高可抑制细胞凋亡, Bax高表达可促进细胞凋亡, 因而Bcl-2/Bax比值可反映细胞凋亡程度。结果显示LPS和α-Syn小鼠Bcl-2/Bax的比值有下降的趋势, 提示有一定的神经元凋亡, 但无统计学差异。当α-Syn小鼠注射LPS后Bcl-2/Bax的比值进一步降低, 表明出现神经元凋亡。Caspase家族在介导细胞凋亡的过程中起着非常重要的作用, 其中caspase-3为关键的执行分子, 在凋亡信号传导的许多途径中发挥作用。结果表明LPS和α-Syn小鼠中脑caspase-3的活性均升高, 但升高幅度不大。而当α-Syn小鼠注射LPS后, 小鼠中脑caspase-3的活性明显提高 (图 4)。以上结果表明, LPS联合α-Syn可加重神经元的凋亡。
|
Figure 4 LPS induced moreneuronal apoptosis in α-Syn (A53T) transgenic mice. WT andα-Syn transgenic mice were injected with LPS once a week for 8 weeks, Bcl-2, Bax and caspase-3 were assayed. A: Bcl-2/Bax (n = 3); B: Caspase-3 activity (n = 6), x ± s. P < 0.05, **P < 0.01 vs WT mice; #P < 0.05 vs LPS-injected mice or α-Syn transgenic mice |
为探讨α-Syn转基因小鼠注射LPS后引起多巴胺能神经元损伤的作用机制, 本研究通过iTRAQ标记的蛋白质组学研究了α-Syn转基因小鼠腹腔注射LPS后小鼠与WT小鼠中脑蛋白表达的差异。一共定量了3 844种蛋白, 变化≥1.5倍的蛋白定义为差异蛋白, 以此标准一共有22种蛋白符合标准, 这些蛋白主要与炎症、细胞凋亡及脱髓鞘相关 (表 1)。
| Table 1 Differential protein qualified by proteomic study (n = 3). Fold of changes = α-Syn+LPS/WT |
在以上这些差异蛋白中, 挑选了报道与炎症、凋亡或神经退行性疾病相关的蛋白进行验证, 分别为cytochrome C oxidase subunit 7A-related protein (COX7RP)、CD99 antigen-like protein 2 (CD99L2)、reticulocalbin-1 (RCN1) 和claudin-11。Western blot结果显示, 变化最明显的蛋白为CD99L2, α-Syn联合LPS刺激小鼠中脑CD99L2的表达为WT小鼠的2.3倍, 其次为COX7RP, α-Syn联合LPS刺激小鼠中脑COX7RP的表达为WT小鼠的1.5倍, 而RCN1和claudin-11的表达均无统计学差异 (图 5)。对于CD99L2和COX7RP在神经退行性疾病, 特别是在PD发病中的作用及机制有待于进一步研究和探讨。
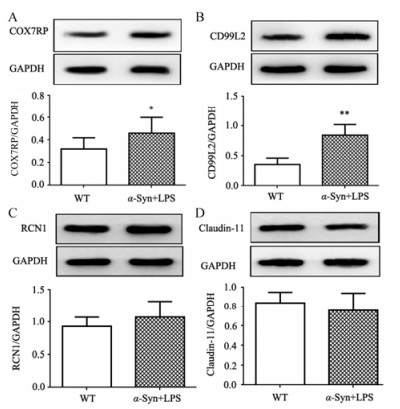
|
Figure 5 Verification of proteins associated with inflammation and apoptosis by Western blot. Differentially expressed proteins associated with inflammation and apoptosis were selected for Western blot analysis in the midbrains of WT mice and LPS injected α-Syn transgenic mice. A: COX7RP; B: CD99L2; C: RCN1; D: Claudin-11 (n = 3), x ± s. P < 0.05, **P < 0.01 vs WT mice |
本研究采用LPS腹腔注射α-Syn转基因小鼠双重打击引起小鼠PD样病理改变, 发现在该刺激条件下, 6月龄转基因小鼠出现了明显的运动功能障碍、多巴胺神经元损伤以及神经炎症反应。差异蛋白质组学鉴定结果显示, 与神经炎症和细胞凋亡相关的蛋白CD99L2及COX7RP明显提高。另外, LPS联合α-Syn双重打击无论在运动协调障碍还是病理改变上都明显较二者单独刺激加重, 表现出协同效应, 表明炎症和遗传因素双重打击是较为理想的建立PD模型的一种方法。
PD是多因素导致的神经退行性疾病, 家族遗传是其发病的另一个重要原因。α-Syn基因突变可导致其在细胞内异常蓄积聚集, 已被确定为家族性PD的主要原因, 而且与散发性PD亦密切相关。α-Syn聚集过程中形成的寡聚体可与细胞膜结合, 具有较强的细胞毒性, 可导致神经元凋亡[7]。另外, 聚集的α-Syn可激活小胶质细胞引起炎症反应, 激活小胶质细胞产生细胞因子或氧自由基对多巴胺能神经元造成神经毒性[8, 9], 这同时也提示损伤或死亡的神经元释放的α-Syn聚集体会进一步对神经元造成长期持续的损伤[10]。α-Syn转基因小鼠8~10月龄时才能出现明显的运动障碍和病理改变。本研究发现, 6月龄α-Syn转基因小鼠脑内出现了一定程度的炎症反应和神经元凋亡以及多巴胺能神经元功能障碍, 小鼠表现出运动功能下降的趋势, 但均不明显。
黑质致密部多巴胺能神经元退行性变导致纹状体多巴胺水平降低, 后者是调节人体躯体运动的重要神经递质, 是引起PD患者运动功能障碍的直接原因[11]。胶质细胞持续活化介导的神经炎症可引起神经元变性坏死, 导致中枢神经系统功能紊乱, 与神经退行性疾病的发生发展有密切的关系。研究发现, 在PD患者脑内有大量活化的小胶质细胞, 表明神经炎症参与PD的病理过程。体内外研究发现LPS诱导的炎症可导致多巴胺能神经元凋亡[12, 13]。将LPS直接脑内注射可引起明显的炎症反应和神经元凋亡[12], 但LPS不能透过血脑屏障, 所以该方法不能完全模拟PD发病。而通过腹腔注射LPS诱发中枢炎症而导致神经元凋亡的周期较长, 一般为10~12个月[14]。本实验中小鼠腹腔注射LPS 8周, 发现脑内出现一定程度炎症反应, 但并没导致运动功能和多巴胺能神经系统功能出现明显障碍, 进一步证明单纯炎症刺激不足以引起较为明显的PD病理改变。当在遗传因素的基础上引入LPS刺激, 即在α-Syn转基因小鼠腹腔注射LPS, 小鼠的以上病理改变和运动协调障碍均明显加重, 表明LPS联合α-Syn刺激小鼠能较好地模拟PD的症状和病理改变。本实验同时提示, LPS联合α-Syn刺激更符合PD的发病过程, 即在基因突变的基础上加上炎症刺激, 小鼠在6月龄即出现明显的病理改变, 是建立PD模型的一种较为理想的方法。
为进一步阐明LPS联合α-Syn双重打击导致PD病理改变的机制, 采用差异蛋白质组学研究了小鼠中脑蛋白表达变化。本实验一共定量了3 844种蛋白, 有22种蛋白符合筛选标准, 这些蛋白主要与炎症、细胞凋亡及脱髓鞘相关。进而选出4个感兴趣的蛋白进行验证, 发现CD99L2和COX7RP的表达与蛋白质组学结果一致, 均明显升高。研究发现CD99L2是重要的黏附分子, 可引起中性粒细胞的聚集, 在中性粒细胞、单核细胞和T淋巴细胞的外渗中起着重要作用, 其抗体可明显抑制炎症反应[15, 16]。小鼠敲除CD99L2基因后炎症反应减弱[17]。与上述研究结果一致, 本研究发现伴随着小鼠脑内炎症的发生, CD99L2的表达也相应升高, 表明CD99L2在PD的发病中起着重要的作用。COX7RP是存在于线粒体复合物Ⅳ中的雌激素应答基因[18]。研究表明COX7RP在超级复合体的组装中起着重要作用, 过表达COX7RP可提高细胞色素C的氧化能力[19], 表明其在线粒体氧化磷酸化中可能发挥重要作用。在本实验中COX7RP在LPS联合α-Syn双重打击PD模型中表达明显升高, 表明该蛋白可能与线粒体氧化应激有关。对于CD99L2和COX7RP这两种蛋白在PD发病中的作用和机制还有待于进一步研究和探讨。
本研究主要阐明了LPS联合α-Syn双重打击对PD病理进程的影响, 发现二者联合比单独刺激更易加剧PD小鼠病理改变和运动功能障碍, 这表明LPS联合α-Syn双重打击是建立PD模型较为理想的方法。而LPS联合α-Syn双重打击的协同效应可能与其长期刺激诱发的脑内炎症反应所致血脑屏障通透性增加有关, 这还有待于进一步研究探讨。
| [1] | Kamel F. Epidemiology. Paths from pesticides to Parkin-son's[J]. Science, 2013, 341: 722–723. DOI:10.1126/science.1243619 |
| [2] | Uversky VN. Alpha-synuclein misfolding and neurodegen-erative diseases[J]. Curr Protein Pept Sci, 2008, 9: 507–540. DOI:10.2174/138920308785915218 |
| [3] | Edwards TL, Scott WK, Almonte C, et al. Genome-wide association study confirms SNPs in SNCA and the MAPT region as common risk factors for Parkinson disease[J]. Ann Hum Genet, 2010, 74: 97–109. DOI:10.1111/ahg.2010.74.issue-2 |
| [4] | Tansey MG, Goldberg MS. Neuroinflammation in Parkin-son's disease: its role in neuronal death and implications for therapeutic intervention[J]. Neurobiol Dis, 2010, 37: 510–518. DOI:10.1016/j.nbd.2009.11.004 |
| [5] | Pal R, Tiwari PC, Nath R, et al. Role of neuroinflammation and latent transcription factors in pathogenesis of Parkinson's disease[J]. Neurol Res, 2016, 38: 1111–1122. DOI:10.1080/01616412.2016.1249997 |
| [6] | Qian L, Flood PM, Hong JS. Neuroinflammation is a key player in Parkinson's disease and a prime target for therapy[J]. J Neural Transm (Vienna), 2010, 117: 971–979. DOI:10.1007/s00702-010-0428-1 |
| [7] | Ysselstein D, Joshi M, Mishra V, et al. Effects of impaired membrane interactions on α-synuclein aggregation and neuro-toxicity[J]. Neurobiol Dis, 2015, 79: 150–163. DOI:10.1016/j.nbd.2015.04.007 |
| [8] | Zhang QS, Heng Y, Yuan YH, et al. Pathological α-synuclein exacerbates the progression of Parkinson's disease through microglial activation[J]. Toxicol Lett, 2017, 265: 30–37. DOI:10.1016/j.toxlet.2016.11.002 |
| [9] | Kim C, Ho DH, Suk JE, et al. Neuron-released oligomeric α-synuclein is an endogenous agonist of TLR2 for paracrine activation of microglia[J]. Nat Commun, 2013, 4: 1562. DOI:10.1038/ncomms2534 |
| [10] | Zhang W, Wang T, Pei Z, et al. Aggregated alpha-synuclein activates microglia: a process leading to disease progress in Parkinson's disease[J]. FASEB J, 2005, 19: 533–542. DOI:10.1096/fj.04-2751com |
| [11] | Chang CK, Wang NL, Lin MT. Inhibition of the dopamine system in rat amygdala attenuates the picrotoxin-induced locomoter hyperactivity and hypertension[J]. Clin Exp Pharmacol Physiol, 2004, 31: 284–288. DOI:10.1111/cep.2004.31.issue-5-6 |
| [12] | He H, Guo WW, Xu RR, et al. Alkaloids from piper longum protect dopaminergic neurons against inflammation-mediated damage induced by intranigral injection of lipopolysaccharide[J]. BMC Complement Altern Med, 2016, 16: 412. DOI:10.1186/s12906-016-1392-6 |
| [13] | Okuyama S, Semba T, Toyoda N, et al. Prenyloxy phenyl-propanoids suppress microglial activation and dopaminergic neuronal cell death in a lipopolysaccharide-induced model of Parkinson's disease [J]. Int J Mol Sci, 2016, 17: pii: E1716. |
| [14] | Wang Q, Qian L, Chen SH, et al. Post-treatment with an ultra-low dose of NADPH oxidase inhibitor diphenyleneio-donium attenuates disease progression in multiple Parkinson's disease models[J]. Brain, 2015, 138: 1247–1262. DOI:10.1093/brain/awv034 |
| [15] | Schenkel AR, Dufour EM, Chew TW, et al. The murine CD99-related molecule CD99-like 2 (CD99L2) is an adhesion molecule involved in the inflammatory response[J]. Cell Commun Adhes, 2007, 14: 227–237. DOI:10.1080/15419060701755966 |
| [16] | Bixel MG, Petri B, Khandoga AG, et al. A CD99-related antigen on endothelial cells mediates neutrophil, but not lymphocyte extravasation in vivo[J]. Blood, 2007, 109: 5327–5336. DOI:10.1182/blood-2006-08-043109 |
| [17] | Rutledge NS, Weber EW, Winger R, et al. CD99-like 2 (CD99L2)-deficient mice are defective in the acute inflamma-tory response[J]. Exp Mol Pathol, 2015, 99: 455–459. DOI:10.1016/j.yexmp.2015.08.011 |
| [18] | Seelan RS, Grossman LI. Cytochrome C oxidase subunit VIIa isoforms. Characterization and expression of bovine cDNAs[J]. J Biol Chem, 1991, 266: 19752–19757. |
| [19] | Ikeda K, Shiba S, Horie-Inoue K, et al. A stabilizing factor for mitochondrial respiratory supercomplex assembly regulates energy metabolism in muscle[J]. Nat Commun, 2013, 4: 2147. |
 2017, Vol. 52
2017, Vol. 52


