2. 石药集团中奇制药技术 (石家庄) 有限公司, 河北 石家庄 050035;
3. 河北中医学院, 河北 石家庄 050200
2. CSPC ZhongQi Pharmaceutical Technology (Shijiazhuang) Co., Ltd., Shijiazhuang 050035, China;
3. Hebei University of Chinese Medicine, Shijiazhuang 050200, China
过敏反应 (hypersensitivity reactions, HSRs) 传统上被分为4类, 分别是Ⅰ~Ⅳ型, 其中Ⅰ型过敏反应被定义为IgE介导的急性反应, 其他几类分别是由IgG、免疫复合物或者是淋巴细胞引发或介导的亚急性或慢性免疫变化[1]。但是临床上还存在一种急性过敏反应, 符合Ⅰ型过敏反应的标准, 却不需要IgE诱发或介导, 这类反应占全部免疫介导的直接过敏反应的77%[2], 严重时可导致患者死亡[3]。已知能够诱发这类反应的物质包括造影剂、非类固醇类抗炎药物、止痛剂、吗啡、昆虫毒液、脂质体和胶束溶剂 (如紫杉醇注射液中的Cremophor EL), 其中脂质体、造影剂和Cremophor EL引起的过敏反应都由补体激活引发, 因此, 这类抗原激活补体引发的过敏反应被暂时命名为补体激活相关的假性过敏反应 (complement activation-related pseudo-allergic reactions, CARPA)[4-6]。
由于CARPA普遍性, 美国FDA建议在药物免疫毒性检测中增加体外或/和体内的补体活性检测, 以便更好地预测药物在临床上发生假性过敏反应的风险[7]。此外, 由于CARPA与药物的理化性质有关, 因此, 药物对补体活性影响的检测也被建议用于仿制与参比制剂的一致性评价[8]。
在进行药物对补体活性影响的体内检测时, 由于不同物种的免疫系统存在差异, 导致不同物种对药物的敏感性和反应强度不同, 常用的实验动物 (如大鼠和小鼠) 并不适用于此项研究, 有文献报道, 猪是最敏感的模型, 而在某些指标上犬也有明显优势[9], 此外, 不同个体对药物的免疫反应也存在差异, 因此需要较大的样本量来保证结果的真实性[6, 8]。综上所述, 开展动物体内实验操作复杂, 且成本高。
在进行药物对补体活性影响的体外检测时, 通常通过ELISA的方法检测各补体因子的含量变化[4-8]。目前, 商业化用于检测动物补体因子的ELISA试剂盒或抗体非常少, 仅可以检测补体因子C3[8], 检测其他补体因子仍十分困难。此外, 由于动物与人的补体系统存在差异, 使用动物血清与人血清进行的实验得到结果可能不一致, 仅可作为参考。但是, 如果使用人血清进行体外实验, 则存在血清样本很难获得和不同检测批次之间的结果难以比较的问题。
为了解决上述问题, 本研究将采集得到的人血清混合后作为标准反应血清, 并考察了放置对其稳定性和活性的影响; 通过加入热聚集IgG和酵母多糖刺激标准反应血清制备得到标准阳性对照; 将SC5b-9、C5a、C4d和Bb作为检测指标, 并确定结果的评价标准, 最终建立了药物对补体活性影响的体外评价模型。
该模型具有以下优点: ① 能够快捷、经济地对多种药物进行补体激活的评价, 尤其适用于药物的处方筛选和多个批次药物的评价; ② 使用人血清作为反应血清避免了动物和人之间的差异, 并通过将40个个体血清混合避免了个体间的差异; ③ 通过考察稳定性, 确定血清在合适的保存条件下稳定, 解决了反应血清来源的问题; ④ 通过使用标准阳性对照, 可以比较不同检测批次之间的结果。
本文以抗真菌类药物两性霉素B的不同处方和注射用伏立康唑作为研究对象, 对该评价模型在药物的免疫机制研究、免疫毒性评价和药物的一致性评价等方面的应用开展了初步研究。
材料与方法 仪器多功能酶标仪 (美国Thermo公司, Varios kan Flash)。
试剂与药品真空促凝采血管购自鑫乐医疗器械股份有限公司; 人免疫球蛋白IgG和酵母多糖zymosan A购自Sigma公司, 货号分别为14506和Z4250;甲磺酸萘莫司他购自Santa Cruz公司, 货号SC-201307;人补体SC5b-9、C4d和Bb因子ELISA试剂盒购自Quide公司, 货号分别为A020、A008和A027;人补体C5a试剂盒购自BD Bioscience公司, 货号为557965;补体活性评价试剂盒购自EURO Diagnostica公司, 货号为CompL300;两性霉素B脂质体 (Ambisome, 吉利德公司, 批号分别为0424A3AA、005783和005608);自制两性霉素B脂质体 (L-AMB, 批号为150416和151104), 自制两性霉素B胆固醇硫酸钠复合物 (ABCD, 批号: 443130901), 注射用伏立康唑 (VF-S, 仿Vfend, 批号: 140502) (石药集团)。注射用两性霉素B (d-Amb, 华北制药, 批号FCLD151101);注射用伏立康唑 (Vfend, 辉瑞制药, 批号: 0856002)。
血清的采集与保存本研究使用的血清采集自40例健康志愿者, 在采集之前已经告知志愿者采集的血液样品用于药物补体反应的体外相关研究, 并经过志愿者同意。之后40个志愿者的全血用10 mL真空玻璃促凝采血管收集。全血在室温放置30 min使其凝固, 之后用3 000 r·min-1离心5 min收集血清。每份样品分别分装后于-80 ℃保存。此外, 分别从40份样品中取200 μL置于15 mL离心管中制成标准反应血清, 充分混合后, 分装, 于-80 ℃保存。
检测血清样品中3条补体途径的活性使用补体途径活性检测试剂盒来检测血清样品中3条途径中的补体因子是否具有活性[10]。血清样品取出后在37 ℃水浴中快速融化, 之后立刻置于冰上。实验设置如下:标准反应血清组 (serum)、各个途径的阳性对照 (positive control, PC)、阴性对照 (negative control, NC) 和稀释液组 (blank), 所有样品按照说明书要求的稀释倍数稀释, 取100 μL稀释后样品加入到对应孔中孵育, 洗涤后加入碱性磷酸酶标记的SC5b-9抗体, 最后检测光吸收值。按照说明书中%补体活性的公式: Complement activity (%) = (sample-NC) / (PC-NC), 计算标准反应血清中各个补体途径的%补体活性。
考察反复冻融对血清中补体活性的影响标准反应血清取出后在37 ℃的水浴中快速融化, 之后立刻置于冰上, 取出部分样品用于检测, 剩余样品再次冻存到-80 ℃, 共反复冻融3次。将冻融不同次数的血清都分成两份, 一份加入热聚集IgG (HAIgG) 和酵母多糖 (zymosan A) 激活, 检测补体因子SC5b-9含量的变化 (激活方法参照标准阳性对照的制备方法); 另一份血清直接检测SC5b-9。标准阳性对照的制备根据文献中的方法[11], 在标准反应血清中加入HAIgG (100 mg·mL-1人IgG溶液于63 ℃加热15 min, 之后立刻置于冰上直到IgG沉淀) 和zymosan A, 激活血清中的各补体成分, 用该激活血清作为标准阳性对照, 用于不同检测批次之间的相对定量。得到的标准阳性对照血清分装后保存于-80 ℃。
体外补体激活按照文献中方法[6, 12, 13], 血清取出后在37 ℃的水浴中快速融化, 之后立刻置于冰上, 从中取出40 μL血清加入10 μL药物, 在37 ℃振荡水浴 (80 r·min-1) 中孵育30 min, 反应结束后, 加入终浓度为20 mmol·L-1 EDTA终止反应, 之后样品放置于冰上以备检测或置于-80 ℃保存。
体外补体活性检测激活后的血清样品用样品稀释液稀释20倍, 取100 μL加入到SC5b-9 ELISA试剂盒的96孔板中, 后续操作按照SC5b-9的说明书进行, 最后在450 nm处检测吸光度值并计算浓度。其他补体活性因子C5a、C4d和Bb检测方法如下:激活后的血清样品按照各自说明书的建议稀释, 加入到ELISA试剂盒的对应孔中, 后续操作按照各自的说明书进行, 在450 nm处测光吸收值并计算浓度。
统计分析实验的检测结果用x±s的形式表示 (n = 3), 采用SPSS 13.0统计软件进行处理, 采用t检验进行显著性分析。
结果 1 标准反应血清的补体活性检测补体系统有3条途径, 分别为经典途径 (classical pathway, CP)、替代途径 (alternative pathway, AP) 和甘露聚糖结合凝集素途径 (mannan-binding lectin pathway, MBL-P)。补体途径活性检测试剂盒中微孔板分别用CP、AP和MBL-P途径的特异性激活因子IgM、脂多糖 (LPS) 和甘露糖包被, 被检测的血清样品分别用3条途径特异性的稀释液稀释, 稀释液中含有特殊的阻断剂, 可以保证只有特定的途径被激活, 当血清加入到对应的孔中, 相应的补体因子被激活, 最后通过检测不同通路共同的终产物SC5b-9来评价血清样品中3条途径的活性。通过检测发现, 与试剂盒的PC组相比, 在CP途径与AP途径中, 标准反应血清的光吸收值略低于对照, MBL-P途径标准反应血清的光吸收值与对照基本一致 (图 1)。按照计算公式, 各途径的补体活性分别为: CP途径79.6%、MBL-P途径97.2%和AP途径90.7%。

|
Figure 1 Three complement pathway activity of standard reaction serum. n = 3, x ± s. P < 0.05, **P < 0.01 vs PC group. AP: Alternative pathway; Blank: Diluent for three pathways; CP: Classical pathway; MBL-P: Mannan-binding lectin pathway; NC: Negative control; PC: Positive control; Serum: Standard reaction serum |
由于补体试剂盒的不同生产批次、不同的运输和保存条件或不同的操作条件, 都可能导致多次检测之间的结果不具有可比性, 因此, 通过制备标准的血清对照品, 每次检测时加入标准对照品对结果进行标定, 使不同的检测批次之间可以互相比较。由于HAIgG可以激活补体的CP途径, 而zymosan A可以激活MBL-P和AP途径, 按照文献[11]中的方法, 向标准反应血清中加入HAIgG和zymosan A, 可以得到所有补体因子都被激活的血清对照品。结果显示, 激活后血清与未激活的标准反应血清相比, 3条补体途径的终产物SC5b-9、过敏毒素C5a、CP途径的特异性因子C4d及AP途径特异性因子Bb的含量都显著升高 (图 2)。
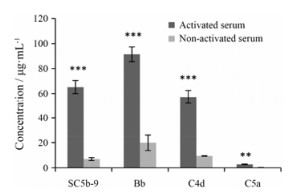
|
Figure 2 Concentration changes of complement factors in the standard positive control. n = 3, x± s. **P < 0.01, ***P < 0.001 vs non-activated serum |
标准反应血清在-80 ℃保存经过反复冻融后, 血清中的补体因子可能会失活或被非特性的激活, 因此需要考察反复冻融对血清的影响。SC5b-9是3条补体途径的共同终点, 因此, 检测SC5b-9含量的变化能够反映血清中补体因子整体的变化。将需要检测的血清分成两份, 一份直接检测, 可以用来判断血清是否发生非特异性的激活; 另一份加入HAIgG和zymosan A激活, 可以用来判断血清中的补体因子是否失活。
从图 3中可以看出, 标准反应血清在经过3次冻融之后, 血清中的SC5b-9含量没有明显变化; 加入HAIgG和zymosan A激活后, 不同冻融次数的血清中SC5b-9的含量都大幅增加, 并且不同冻融次数之间没有明显差异。
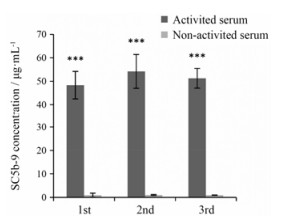
|
Figure 3 Effect of freeze-thaw times on complement activity of standard reaction serum. n = 3, x ± s. ***P < 0.001 vs non-activited serum |
难溶性药物紫杉醇和多西他赛在制备成注射液时, 分别使用Cremophor-EL和Tween-80来增加其溶解性, 已有文献[1, 14]报道, Cremophor-EL和Tween-80注射到体内后能够引起体内的补体激活, 从而在临床上表现为CAPRA。抗真菌药物两性霉素B和伏立康唑也是难溶性药物, 在制备成注射液时分别使用脱氧胆酸钠和磺丁基醚-β-环糊精作为增溶剂, 而至今尚无文献报道这两种制剂能否引起补体激活。因此, 本研究将注射用两性霉素B和注射用伏立康唑加入到标准反应血清中, 使用上述经HAIgG和zymosan A激活的标准阳性对照作为PC, 以加入5%葡萄糖注射液的血清作为NC, 通过比较补体系统的最终反应产物SC5b-9来判断这两类制剂能否激活补体。从图 4中可以看出, 与NC组比较, 加入Vfend和VF-S之后, 血清中检测到的SC5b-9含量都没有增加, 而d-AmB组与NC组相比, 血清中的SC5b-9显著增加了181% (P < 0.01), 说明d-AmB能够引起血清中的补体激活, 而Vfend和VF-S不能。
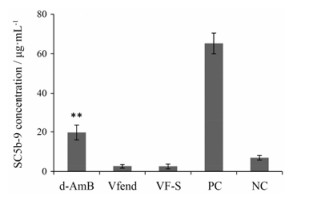
|
Figure 4 Complement activation by d-AMB, Vfend and VF-S in standard reaction serum. n = 3, x ± s. **P < 0.01 vs NC group |
目前, 常见的市售两性霉素B有3种处方, 分别为两性霉素B脂质体 (Ambisome)、两性霉素B盘状复合物 (ABCD) 以及传统的两性霉素B脱氧胆酸钠注射液 (d-AmB)。有文献报道, Ambisome在体内能够激活补体, 引起CARPA[12]; 而本研究结果也表明d-Amb在体外能引起补体激活; 此外, 有文献[12]表明补体激活反应与药物粒子的形状有关, 例如阿霉素脂质体 (Doxil) 与未装载药物的空白脂质体相比, 形状接近椭球体, 而不是正球体, 更容易被补体系统识别, 因此, 与空白脂质体相比, 其激活补体的能力更强。ABCD为盘状, 与球型的纳米粒相比形变较大, 该处方能否引起补体激活以及与其他两种处方相比激活补体的途径是否一致, 尚不得而知。因此, 本研究将两性霉素B不同处方加入到标准反应血清中, 使用标准阳性对照作为PC, 以加入5%葡萄糖注射液的血清作为NC, 通过比较SC5b-9、C5a、C4d及Bb的含量变化来判断这些处方能否激活补体以及激活的补体途径。由图 5可以看出, 与NC组相比, Ambisome和d-AmB组的SC5b-9含量都有明显升高, 分别增加了218%和181%, 而ABCD组与NC组相比仅增加35%。Ambisome组检测到C5a的含量也有显著增加, 增加了178%, ABCD增加86%, 而d-AmB组C5a的含量没有变化。ABCD组的C4d和Bb因子的含量与NC组相比均没有变化, Ambisome组C4d和Bb因子的含量与NC组相比都有显著升高, 分别增加了181%和141%; d-AmB组C4d含量与NC组相比没有差异, 而Bb的含量增加了73%。这些结果表明, 3种处方中, Ambisome和d-AmB激活补体的能力较强, 其中Ambisome能够同时激活CP和AP两种途径, 而d-AmB仅能激活AP途径。

|
Figure 5 Complement activation by different formulations of amphotericin B in standard reaction serum. n = 3, x ± s. P < 0.05, **P < 0.01 vs NC group. ABCD: Amphotericin B lipid complex for injection; d-AmB: Sodium desoxycholate-amphotericin B for injection; Ambisome: Amphotericin B liposome for injection |
对于脂质体或其他纳米粒药物, 其补体激活能力与药物粒子本身的性质, 如组成、粒径、电荷及粒子形状等有关, 有研究者建议药物对补体活性的影响可作为评价一致性的指标之一[8]。根据文献和本文的研究结果可知, 两性霉素B脂质体能够在体外激活补体。因此, 本研究选择3批市售的两性霉素B脂质体 (吉利德公司, RLD1、RLD2和RLD3) 和自制的2批两性霉素B脂质体 (石药集团, Test1和Test2), 将相同剂量 (以两性霉素B计) 的自制和市售制剂加入到标准反应血清中孵育, 通过比较补体途径的共同终产物SC5b-9和过敏因子C5a的含量变化, 来比较自制和市售制剂激活补体能力的差异, 从而比较自制制剂和市售制剂的一致性。从图中可以看出, 与血清孵育后, 3批市售制剂血清中检测到SC5b-9的含量基本一致, 平均值为 (22.16 ± 0.63) μg·mL-1, 相对标准偏差RSD为2.85%, 而C5a的含量则变化较大, 平均值为 (571.32 ± 106.12) ng·mL-1, 相对标准偏差RSD为18.6%。两批自制制剂血清中SC5b-9和C5a的含量与市售制剂的平均值相比都有显著性差异, 150416批制剂含量低于市售制剂平均值, 另一批151104制剂则高于市售制剂 (图 6)。
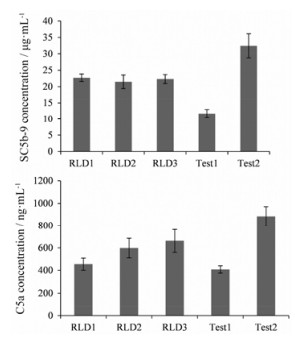
|
Figure 6 Complement activation by self-made (Test1, Test2) and commercial (RLD1, RLD2, RLD3) amphotericin B liposomes in standard reaction serum. n = 3, x ± s |
CARPA占全部免疫介导的直接过敏反应的77%[2], 已上市的一些脂质体药物 (如Doxil和Ambisome) 和小分子胶束药物 (如Taxol和Taxotere) 在临床上能够引起补体激活, 从而导致CARPA发生。因此, 美国FDA建议在药物免疫毒性检测中增加体外或/和体内的补体活性检测, 以便更好地预测药物在临床上发生假性过敏反应的风险[7]。此外, 由于CARPA与纳米粒药物的理化性质有关, 因此, 补体活性检测也被建议用于仿制药与被仿制剂的一致性评价[8]。
由于动物补体活性检测实验的成本过高、操作复杂、使用动物血清开展体外实验可检测的参数少、动物的免疫系统与人体存在差异、使用人血清进行体外检测存在样本不好获取等问题, 使得不能很好地研究药物对补体活性的影响, 因此, 需要建立一个操作简单便捷、结果可信的体外模型, 用于药物免疫毒性、免疫机制的研究以及自制制剂和参比制剂的一致性评价。该评价模型应该包括:本底均一、补体因子完整且具有活性、能够稳定保存的血清, 一个能够标定不同检测批次差异的标准血清对照, 合适的检测指标以及结果的评价标准。
将40例个体的血清取相等的量混合后, 形成标准反应血清, 可以避免个体间存在的免疫差异, 并且简化实验操作, 将其分装后置于-80 ℃长期保存。通过检测, 标准反应血清的3条补体途径的所有补体因子都具有活性, 按照试剂盒的计算方法, 其补体途径活性分别为: CP途径79.6%、MBL-P途径97.2%和AP途径90.7%。此外, 考察了标准反应血清在经过3次冻融后补体活性的变化, 通过结果可以发现, 在冻融3次的过程中, 血清中补体因子没有自发激活或失活。上述实验证明标准反应血清的补体因子完整、具有活性, 且在保存过程中稳定。
根据文献[11]的方法, 通过向反应血清中加入HAIgG和zymosan A, 得到3条补体途径都被激活的血清, 该血清中所有的补体因子都处于激活状态, 且该标准血清在4 ℃可以稳定放置30天或反复冻融10次后, 大多数补体因子的含量都不会发生改变。通过检测, 激活的血清样品中C5a、Bb、C4d和SC5b-9的含量都有明显升高。将该激活血清作为标准对照血清, 分装后置于-80 ℃长期保存。利用该标准血清, 可以标定不同检测批次之间的差异, 使不同批次检测的样品之间具有可比性。
由于SC5b-9为3条补体途径的共同终产物, 且生成后含量不会发生改变。因此, 在不能确定某种药物是否可以激活补体时, 应先检测SC5b-9含量的变化。而C4d和Bb作为CP和AP途径的特有因子[13], 在区分药物激活的不同补体途径时, 可以选择C4d和Bb作为检测指标。过敏毒素C3a和C5a可以直接与效应细胞上的受体结合, 使效应细胞释放细胞因子, 从而产生过敏反应[1], 因此, 还应该检测补体因子C3a或C5a。
有研究表明, 药物激活血清中SC5b-9浓度与baseline (PBS组) 相比, 如果增加在30%~100%之间, 被认为是温和的补体反应, 临床上出现过敏反应的可能性极小; 增加100%~300%, 被认为在临床上出现过敏反应的风险增加; 当浓度增加超过300%时, 被认为在临床上会出现补体激活、发生过敏反应风险较高[13]。因此, 本研究建立的体外模型中各补体因子的评价也参照上述标准。
在本研究中, 通过检测SC5b-9的含量来判断脱氧胆酸钠和磺丁基醚-β-环糊精作为增溶剂的两种制剂d-AmB和Vfend能否激活补体, 结果表明d-AmB能引起SC5b-9含量的增加, 而Vfend则不能。这一结果可能是因为脱氧胆酸钠是离子型表面活性剂, 在d-Amb的制剂中也可以形成胶束[15], 而这种胶束结构可能是引起补体激活的主要原因。
通过比较两性霉素B的3种不同处方激活补体能力的差异, 发现d-AmB和Ambisome组与NC组相比, SC5b-9的含量增加均在100%~300%之间, 而ABCD则小于100%, 这说明d-AmB和Ambisome在临床上激活补体的风险更大, 并且Ambisome可能同时激活CP和AP途径, 而d-AmB则可能只激活AP途径。
利用市售和自制两性霉素B脂质体体外补体激活能力的异同来评价其一致性, 分别检测了SC5b-9和C5a两个指标, 其中3批市售制剂的SC5b-9含量增加基本一致, 而C5a含量变化较大, 这一结果可能是由于SC5b-9作为补体激活反应的终产物, 在血清中含量较高且较稳定, 而C5a含量较低检测时误差加大。两批自制制剂与市售制剂相比, SC5b-9和C5a都有显著差异, 说明这两批样品在粒子属性方面与市售制剂仍存在差异, 需对工艺进行进一步的摸索和调整。然而, 就评价制剂一致性而言, 首先应该使用更多批次的市售制剂, 通过多次检测, 确定市售制剂激活血清中补体因子的含量范围, 以该含量范围为标准, 判断自制制剂与市售制剂的一致性才更为合理, 本研究仅提供一种方法。
结论本研究通过将采集到的40例健康志愿者的新鲜血清混合, 得到一份用于体外补体活性检测的标准反应血清, 经检测该血清均一、稳定且3条补体途径的补体因子都具有活性; 通过加入HAIgG和zymosan A激活反应血清, 得到一份3条补体途径中的因子都被激活的标准阳性对照, 该对照可用于比较多次检测间的结果; 此外, 还确定了检测指标和结果评价标准, 建立起用于评价药物对补体活性影响的体外模型。利用该模型, 对几种抗真菌制剂进行初步研究, 表明该模型可应用于药物免疫毒性、免疫机制的研究, 以及自制制剂和参比制剂的一致性评价研究。
| [1] | Szebeni J. Complement activation-related pseudoallergy: a new class of drug-induced acute immune toxicity[J]. Toxi-cology, 2005, 216: 106–121. |
| [2] | Demoly P, Lebel B, Messaad D, et al. Predictive capacity of histamine release for the diagnosis of drug allergy[J]. Allergy, 1999, 54: 500–506. DOI:10.1034/j.1398-9995.1999.00020.x |
| [3] | Szebeni J. Complement activation-related pseudoallergy caused by liposomes, micellar carriers of intravenous drugs and radiocontrast agents[J]. Crit Rev Ther Drug Carrier Syst, 2001, 18: 567–606. |
| [4] | Szebeni J, Alving C. Complement-mediated acute effects of liposome-encapsulated hemoglobin[J]. Artif Cells Blood Substit Immobil Biotechnol, 1999, 27: 23–41. DOI:10.3109/10731199909117481 |
| [5] | Szebeni J, Baranyi B, Savay S, et al. Liposome induced pulmonary hypertension: properties and mechanism of a complement-mediated pseudoallergic reaction[J]. Am J Physiol Heart Circ Physiol, 2000, 279: H1319–H1328. |
| [6] | Szebeni J, Baranyi B, Savay S, et al. The role of complement activation in hypersensitivity to pegylated liposomal doxorubicin (Doxil®)[J]. J Liposome Res, 2000, 10: 367–381. |
| [7] | Hastings KL, Center for Drug Evaluation and Research, US Food and Drug Administration. Implications of the new FDA/CDER immunotoxicology guidance for drugs[J]. Int Immunopharmacol, 2002, 2: 1613–1618. DOI:10.1016/S1567-5769(02)00061-9 |
| [8] | Szebeni J, Storm G. Complement activation as a bioequiva-lence issue relevant to the development of generic liposomes and other nanoparticulate drugs[J]. Biochem Biophys Res Commun, 2015, 468: 490–497. DOI:10.1016/j.bbrc.2015.06.177 |
| [9] | Szebeni J. Complement activation-related pseudoallergy: a stress reaction in blood triggered by nanomedicines and biological[J]. Mol Immunol, 2014, 61: 163–173. DOI:10.1016/j.molimm.2014.06.038 |
| [10] | Seelen MA, Roos A, Wieslander J, et al. Functional analysis of the classical, alternative, and MBL pathways of the complement system: standardization and validation of a simple ELISA[J]. J Immunol Methods, 2005, 296: 187–198. DOI:10.1016/j.jim.2004.11.016 |
| [11] | Bergseth G, Ludviksen JK, Kirschfink M, et al. An interna-tional serum standard for application in assays to detect humancomplement activation products[J]. Mol Immunol, 2013, 56: 232–239. DOI:10.1016/j.molimm.2013.05.221 |
| [12] | Szebeni J, Bedocs P, Rozsnyay Z, et al. Liposome-induced complement activation and related cardiopulmonary distress in pigs: factors promoting reactogenicity of Doxil and AmBisome[J]. Nanomedicine, 2012, 8: 176–184. DOI:10.1016/j.nano.2011.06.003 |
| [13] | van den Hoven JM, Nemes R, Metselaar JM, et al. Comple-ment activation by PEGylated liposomes containing predniso-lone[J]. Eur J Pharm Sci, 2013, 49: 265–271. DOI:10.1016/j.ejps.2013.03.007 |
| [14] | Weiszhár Z, Czúcz J, Révész C, et al. Complement activation by polyethoxylated pharmaceutical surfactants: Cremophor-EL, Tween-80 and Tween-20[J]. Eur J Pharm Sci, 2012, 45: 492–498. DOI:10.1016/j.ejps.2011.09.016 |
| [15] | Hamill RJ. Amphotericin B formulations: a comparative review of efficacy and toxicity[J]. Drugs, 2013, 73: 919–934. DOI:10.1007/s40265-013-0069-4 |
 2017, Vol. 52
2017, Vol. 52


