恶性肿瘤是目前人类死亡的主要原因之一, 已经成为危害人类生命健康的一类主要疾病[1]。科学家们一直在努力探索各种方式来治疗肿瘤, 但是, 在临床上, 肿瘤的治愈率仍然没有显著的提高。随着肿瘤生物学与肿瘤免疫学基础理论的发展, 肿瘤免疫治疗的研究也突飞猛进。肿瘤免疫治疗是将免疫相关效应分子或免疫细胞输入机体内, 通过提高肿瘤细胞的免疫原性, 增强免疫效应细胞对肿瘤细胞的杀伤作用, 同时刺激和增强机体的抗肿瘤免疫反应, 进而利用机体免疫系统的作用来杀伤肿瘤细胞和抑制肿瘤生长。
手术治疗、放化疗以及靶向治疗等传统的癌症治疗方式均具有不同程度的局限性。手术治疗是常用的癌症治疗手段之一, 是初期肿瘤的首选治疗方法, 但对于敏感部位的肿瘤, 手术危险性大、成功率低, 而且对于已经发生转移的肿瘤, 手术治疗更是无能为力。放疗和化疗是目前癌症治疗最常见的方式, 能够大面积杀伤肿瘤细胞, 但其对机体的正常组织细胞也会产生不同程度杀伤作用, 引起不良反应。靶向治疗效果明显、耐受性好, 但是肿瘤细胞很快就会对其产生耐药性[2]。因此, 传统的癌症治疗方式不但有各种不良反应, 而且不能有效防止肿瘤的复发。肿瘤免疫治疗则是通过刺激和增强机体的自身免疫系统来治疗肿瘤, 因此具有反应快、不良反应小等优点[3]。此外, 免疫治疗因免疫系统具有良好的记忆能力, 容易形成记忆型免疫, 对防止肿瘤复发有显著优势。因此, 肿瘤免疫治疗与传统癌症治疗方式相比, 具有反应快、不良反应小和疗效持久等优势[4], 是继手术治疗、放化疗及靶向治疗后又一种新的肿瘤治疗方式, 成为战胜恶性肿瘤的新希望。
α-半乳糖神经酰胺 (α-galactosylceramide, αGC) 是从海洋生物的海绵体中提取分离出来的鞘糖脂, 是一种免疫调节剂, 目前在临床试验中将其作为一种抗癌剂, 对多种实体瘤具有显著疗效[5]。αGC与树突状细胞 (dendritic cells, DC) 上的CD1d分子结合后, 能够激活自然杀伤性T细胞 (natural killer T cells, NKT)[6]。NKT细胞对肿瘤细胞有直接杀伤作用, 此外, NKT细胞还能通过分泌白细胞介素-2和干扰素γ (interferon γ, IFN-γ) 等细胞因子诱导机体抗肿瘤免疫细胞如自然杀伤细胞 (natural killer cell, NK)、CD8+T细胞和巨噬细胞的活化。活化后的CD8+T细胞和NK细胞可通过分泌颗粒酶、穿孔素及表达FasL来杀伤肿瘤细胞[7]。同时, αGC诱导NKT细胞产生的IFN-γ还可增加对肿瘤具有特异性的细胞毒性T淋巴细胞 (cytotoxic T lymphocyte, CTL) 产生, 其对于肿瘤转移活性具有抵抗作用[8]。因此, αGC作为一种抗癌剂具有显著疗效。但是, 已有研究表明, 多次注射αGC后, GC对NKT细胞的激活能力明显下降, 导致NKT细胞的脱敏失活, 严重限制了αGC在抗肿瘤治疗方面的应用, 而将其包裹于脂质体后可以避免这一现象的发生[9]。
脂质体具有良好的靶向性和生物相容性, 常作为传递各类药物的载体[10]。普通脂质体很容易从机体内清除, 利用聚乙二醇[poly (ethylene glycol), PEG]对脂质体进行修饰后, 能够显著延长脂质体在体内的循环时间, 从而较多地蓄积在作用部位发挥作用[11]。为了进一步将更多的药物递送入细胞内, 可对脂质体表面进行配体修饰[12]。TH [AGYLLGHINLHHLAHL (Aib) HHIL-Cys]是一种具有pH敏感性的穿膜肽, 在微酸环境下可以高效地介导脂质体入胞。在本实验室的前期研究中, 曾将TH修饰于脂质体的表面而得到能够在肿瘤部位深层穿透的脂质体[13]。基于此, 本文将免疫佐剂αGC包载于TH修饰的脂质体上, 对其提高荷瘤小鼠的免疫功能的能力及具体的免疫作用机制进行了初步的研究。
材料与方法试剂与药物 α-半乳糖神经酰胺 (αGC, 美国Cayman公司); 卵磷脂 (SPC, 上海泰威化工公司); 胆固醇 (CHO, 成都科隆化学品有限公司); RPMI-1640培养基 (美国Gibco公司); 胎牛血清 (FBS, 美国Hyclone公司); TH (AGYLLGHINLHHLAHL (Aib) HHIL-Cys, 中国肽有限公司); 12-distearoyl-sn-glyc ero-3-phospho-ethano-lamine-N-methoxy (polyethylene glycol)-2000 (DSPE-PEG2000)、1, 2-dis-tearoyl-sn-glycero-3-phosphoethalamine N-[maleimide (polyethylene glycol)-2000] (DSPE-PEG2000-Mal) (上海艾韦特医药科技有限公司); 1, 2-dioleoyl-sn-glycero-3-phosphoethanolamine N-(car-boxyfluorescein) (CFPE, 美国Avanti Polar Lipids公司); Anti-Mouse alpha GalCer: CD1d复合物抗体、异硫氰酸荧光素 (FITC) 标记的抗小鼠CD86、藻红蛋白 (PE) 标记的抗小鼠CD11c、FITC标记的抗小鼠CD8α、FITC标记的抗小鼠NK1.1、FITC标记的抗小鼠CD14 (美国eBioscience公司); 白细胞介素-2 (IL-2) ELISA试剂盒、白细胞介素-4 (IL-4) ELISA试剂盒 (美国R & D Systems公司); 其他试剂均为市售分析纯。
仪器 旋转蒸发仪 (RE-200B, 上海亚荣生化仪器厂); 恒温空气摇床 (ZHWY-100B, 上海智城医疗仪器厂); 激光粒度仪/zeta电位分析仪 (Nano ZS90, 英国Malvern公司); 超声波细胞粉碎机 (JY92-Ⅱ, 宁波新芝科器研究所); 流式细胞仪 (CytomicsTM FC500, 美国Beckman Coulter公司)。
DSPE-PEG2000-TH合成 将DSPE-PEG2000-Mal (3 μmol) 和TH (4.5 μmol) 溶解于氯仿和甲醇的混合液 (2:1, v/v), 该混合液中含有三乙胺 (6 μmol)。室温下, 将上述混合溶液在氩气保护下避光反应24 h, 采用薄层分析色谱法检测 (展开剂:二氯甲烷/甲醇= 10:1), 可见原料DSPE-PEG2000-Mal点基本消失。过滤有机溶剂, 并通过旋转蒸发将滤液蒸发。将残余物用氯仿再次溶解, 并再次过滤以纯化产物。所得的产物即为DSPE-PEG2000-TH[13]。
脂质体的制备 薄膜分散-探头超声法[14]制备脂质体。精密称取处方量的脂质材料SPC、Chole、DSPE-PEG2000 (摩尔比33:59:8) 溶于氯仿和甲醇的混合溶液 (2:1, v/v), 用于制备空白长循环脂质体 (PEG-Lip); 另精密称取处方量的脂质材料SPC、Chole、DSPE-PEG2000及DSPE-PEG2000-TH (摩尔比33:59:2:6) 两份, 溶于氯仿和甲醇的混合溶液 (2:1, v/v), 其中一份加入适量的αGC (αGC终质量浓度为0.05 mg·mL-1), 用于制备TH修饰的αGC脂质体 (αGC-TH-Lip), 另一份不加药物用于制备TH修饰的空白脂质体 (TH-Lip)。进一步将上述脂质材料和药物加至25 mL茄形瓶中, 在37 ℃条件下通过旋转蒸发除去氯仿至形成薄膜, 真空干燥过夜。加入10 mmol·L-1 Hepes缓冲液 (pH 7.4) 1 mL, 放入摇床中, 37 ℃水化30 min, 在冰浴条件下探头超声 (80 W, 100 s)。制备的脂质体在4 ℃条件下保存备用。对于CFPE标记的脂质体, 将适量CFPE氯仿溶液加入至脂质材料中共同旋蒸形成薄膜, 使得所形成的脂质体中CFPE终质量浓度为15 μg·mL-1。
脂质体的表征及血清中稳定性的研究 将制备得到的脂质体在不同pH条件 (pH 7.4及6.0) 下进行粒径和电位的检测。在50%胎牛血清环境中, 通过48 h内对其浊度测定 (750 nm处), 考察脂质体的稳定性。
αGC溶液的制备 将αGC溶解在10 mmol·L-1 Hepes溶液 (含5.6%蔗糖、0.75%组氨酸和0.5% Tween 20) 中, 80 ℃加热3 min[15]即可。
TH修饰在脂质体被DC2.4细胞摄取过程中的作用 小鼠树突状细胞系DC2.4细胞用含有10%胎牛血清、100 u·mL-1链霉素和100 u·mL-1青霉素的RPMI-1640培养基在37 ℃、5% CO2条件下培养[16]。将DC2.4细胞接种到6孔板中, 每孔的细胞数为1×106个, 在37 ℃、5% CO2的培养箱中培养24 h后, 加入CFPE标记TH-Lip和PEG-Lip。每孔中CFPE的质量浓度为2 μg·mL-1, 孵育6 h后将培养基吸出, PBS漂洗3次, 然后用胰酶消化, 离心, 用PBS 0.3 mL重悬细胞, 流式细胞仪测定细胞的荧光强度。
给药后荷瘤小鼠体内抗肿瘤相关免疫细胞的激活情况检测 取6~8周龄的雌性C57BL/6小鼠 (成都达硕实验动物有限公司, 生产许可证号SCXK (川) 2015-030) 12只, 用4%水合氯醛腹腔麻醉, 刮其背部右侧下方毛, 于皮下接种细胞数为每毫升5×107个B16F10细胞悬液200 µL。待实体瘤体积长到约50~100 mm3时, 随机分为3组: Hepes、Free αGC和αGC-TH-Lip组, 每组4只。各组小鼠分别在0天和第3天尾静脉注射给予各对应组的药物, 给药量为200 μL。在第2次给药7天后, 处死小鼠并收集脾脏, 利用小鼠脾脏组织解离试剂盒制备脾细胞悬液。使用荧光标记抗体标记特异性细胞类型如下: PE标记的抗小鼠CD3e和FITC标记的抗鼠NK1.1抗体标记NKT细胞; FITC标记的抗鼠NK1.1标记NK细胞; FITC标记的抗小鼠CD14标记巨噬细胞; PE标记抗小鼠CD11c和FITC标记的抗小鼠CD86标记成熟的DC细胞; FITC标记的抗小鼠CD8α标记CTL细胞。分别将标记后的脾细胞悬液用流式细胞仪测定。
IL-2和IL-4的测定 动物分组和给药同上, 在第3天和第6天对小鼠心脏穿刺取血, 3 000 r·min-1离心5 min, 取上清液。用IL-2和IL-4 ELISA试剂盒测量血清中IL-2和IL-4的含量。
数据统计分析 实验数据用均数±标准差 (x±s) 表示, 采用SPSS19.0软件进行统计分析, 组间两两比较采用双侧t检验; P < 0.05说明差异有显著性意义。
结果 1 脂质体的表征及血清中稳定性αGC-TH-Lip在不同pH条件下的粒径及电位情况见表 1。从表 1可知, 在中性条件下 (pH 7.4), αGC-TH-Lip的粒径约117.9 nm, zeta电位为-8.37 mV左右。而在微酸性环境中 (pH 6.3), αGC-TH-Lip的粒径没有明显变化, 但zeta电位从负电状态翻转成为正电状态, 有利于入胞, 说明TH能够在脂质体表面有效地修饰并发挥pH敏感的作用。
| Table 1 Size and zeta potential of αGC-TH-Lip under different pH conditions. n = 3, x± s. αGC: α-Galactosylceramides; TH: AGYLLGHINLHHLAHL (Aib) HHIL-Cys; Lip: Liposome; PDI: Polydispersity index |
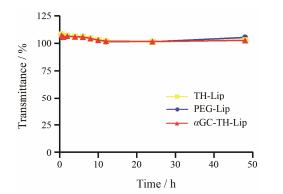
此外, 为了考察脂质体的稳定性, 将αGC-TH-Lip、TH-Lip和PEG-Lip分别放入50%胎牛血清中, 于750 nm处检测其在48 h内的浊度变化, 如图 1所示。3种脂质体, 在48 h内浊度的变化不明显, 没有显著性差异, 说明各脂质体在血清环境中较稳定存在, 不会发生明显的聚集或蛋白吸附。
|
Figure 1 The variations in turbidity (represented by transmittance) of αGC-TH-Lip, TH-Lip and PEG-Lip in 50% FBS within 48 h at 37 ℃. n = 3, x± s. PEG: Polyethylene glycol; FBS: Fetal bovine serum |
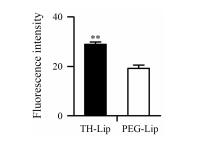
αGC能够激活NKT细胞, NKT细胞通过释放大量的IFN-γ来诱导抗肿瘤相关免疫细胞的活化。NKT细胞的激活需要抗原提呈细胞 (antigen processing cell, APC) 的参与, 而DC细胞是动物体内最强的APC, 也是调节免疫应答的专职APC[17]。将荧光标记的TH-Lip或PEG-Lip与DC2.4细胞共同孵育一段时间, 测定其被摄取后的细胞荧光强度。由DC2.4细胞对不同脂质体的摄取结果 (图 2) 可知, DC2.4细胞对TH-Lip的摄取是PEG-Lip的1.48倍, 表明TH修饰脂质体后能够促进脂质体被DC2.4细胞摄取, 即促进脂质体被APC摄取。
|
Figure 2 The quantitative result of the fluorescence intensity in DC2.4 cells incubated with TH-Lip or PEG-Lip. n = 5, x± s. **P < 0.01 vs PEG-Lip group |
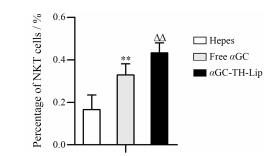
αGC与DC细胞上的CD1d分子结合后, 能够激活NKT细胞, 对肿瘤细胞有直接杀伤作用, 此外, NKT细胞还能通过分泌IFN-γ细胞因子激活在固有免疫中起重要作用的NK细胞、CD4+T细胞及CD8+T细胞等, 进一步发挥抗肿瘤的作用。T细胞表面既表达T细胞表面标志, 如CD3、TCRαβ, 又表达NK细胞的表面标志, 如NK1.1、CD16、CD56等[18]。故选择NKT细胞上表达的CD3和NK1.1作为NKT细胞的标志, 测定NKT细胞的数量, 结果如图 3。由图 3可知, αGC-TH-Lip组和游离αGC组的NKT细胞数量均高于Hepes组, 表明αGC确实能够激活NKT细胞, 而αGC-TH-Lip组的NKT细胞数量明显高于游离αGC组, 说明αGC包载于脂质体后激活NKT细胞的作用增强, 可发挥更强的抗肿瘤作用。
|
Figure 3 The relative amount of NKT cells at day 7 after twice systemic administrations of samples. n = 4, x± s. **P < 0.01 vs Hepes group; △△P < 0.01 vs free αGC group |
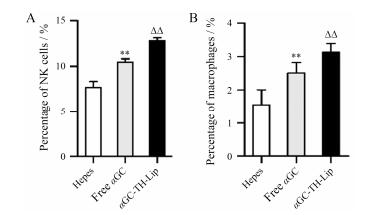
NKT细胞通过分泌IFN-γ和IL-2等细胞因子诱导机体抗肿瘤免疫细胞NK细胞和巨噬细胞的活化, 消除循环的肿瘤细胞并抑制原发肿瘤的转移, 因此NK细胞和巨噬细胞的激活对肿瘤的免疫治疗具有重要作用且能间接反映NKT细胞的激活情况。分别用带有FITC标记的抗鼠NK1.1抗体和FITC标记的CD14抗体对NK细胞和巨噬细胞进行标记后, 流式细胞仪测定结果如图 4所示。αGC-TH-Lip组的NK细胞和巨噬细胞的量均最高, 较游离αGC组有显著差异, 这表明将αGC包载于TH修饰的脂质体后能增强αGC免疫方面的作用, 即能激活更多的NK细胞和巨噬细胞, 增强机体的免疫功能, 发挥更强抗肿瘤作用。另外, αGC-TH-Lip组、游离αGC组的NK细胞和巨噬细胞的激活结果具有一致性, 均与NKT细胞的激活效果一致, 验证了αGC对NKT细胞的激活作用, 继而NKT细胞释放IFN-γ激活NK细胞和巨噬细胞, 发挥其肿瘤免疫治疗作用。
|
Figure 4 Relative amount of immune cells (NK cells, macro phages) in spleens at day 7 after twice systemic administrations of samples. A: The relative amount of NK cells in spleens. B: The relative amount of macrophages in spleens. n = 4, x± s. **P < 0.01 vs Hepes group; △△P < 0.01 vs free αGC group |
DC细胞是调节免疫应答的专职APC, 未成熟的DC细胞具有较强的迁移能力, 而成熟的DC细胞则能有效激活初始型T细胞, 是启动、调控和维持免疫应答的关键。成熟的DC细胞表达共刺激分子B7-1和B7-2 (CD86), 以及CD1a、CD11c等, 同时高表达主要组织相容性复合体和黏附分子[19]。因此选择成熟的DC细胞上表达的CD86和CD11c作为DC细胞的标志。本文用带有PE标记的抗鼠CD86和FITC标记的CD11c抗体来对脾脏的脾细胞进行标记, 并用流式细胞仪测定。结果如图 5所示, 双阳性细胞同时表达CD86和CD11c, 代表成熟的DC细胞。αGC-TH-Lip组和游离αGC组双阳性细胞的百分比较Hepes组均有显著性差异, 表明注射αGC对于促进DC细胞的成熟有极强的刺激作用。同时αGC-TH-Lip组的双阳性细胞百分比显著高于游离αGC组, 即αGC-TH-Lip组能促进更多的DC细胞成熟, 这是由于将αGC包载于TH修饰的脂质体后, DC细胞对其摄取增强, 对NKT细胞的激活能力也增强, 激活的NKT细胞释放IFN-γ, 进而促进更多的DC细胞成熟, 诱发更强大的抗肿瘤免疫作用。
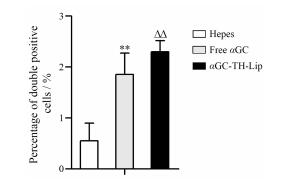
|
Figure 5 The relative amount of double positive cells (repre senting mature DC cells) in spleens at day 7 after twice systemic administrations of samples. n = 4, x± s. **P < 0.01 vs Hepes group; △△P < 0.01 vs free αGC group |
DC细胞成熟后激活初始型T淋巴细胞, T细胞随血液到达胸腺, 双阴细胞在胸腺内经历阳性选择、阴性选择后发育成熟, 移行至外周淋巴组织, 形成CD4+T细胞和CD8+T细胞。CD4+T细胞继续发育成为辅助性T细胞 (helper T cell, Th), 继而分化为3种Th细胞: Th1、Th2和Th17[20]。被活化的CD8+T细胞自分泌IL-2, 引起增殖、分化, 成为不同的细胞毒性T细胞, CTL通过多种途径介导细胞毒效应来杀死癌细胞, 如分泌穿孔素、颗粒酶及一些诱导细胞凋亡的途径[21]。
CD8是一条有着两条链的多肽, 由α链和β链组成CD8αβ或由α链和α链组成CD8αα。因此, 用CD8α来标记CD8+T细胞具有代表性, 能标记所有的CD8+T细胞[22]。因此可以将CD8α的量作为CTL细胞数量的观察指标。图 6结果显示αGC-TH-Lip组的CTL数量最多, 与游离αGC组相比具有显著性差异, 这一结果直接表明将αGC包载于TH修饰的脂质体后, 能够促进荷瘤小鼠体内CTL的产生, 进而CTL可通过细胞毒作用和诱导靶细胞凋亡的方式直接杀伤肿瘤细胞, 发挥更为强大的抗肿瘤作用。此结果与DC细胞被促进成熟的结果一致, 间接证明了其对DC细胞成熟的促进作用。
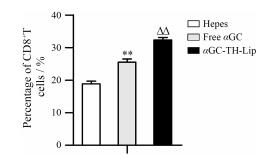
|
Figure 6 The relative amount of CD8+T cells (representing CTL) in spleens at day 7 after twice systemic administrations of samples. n = 4, x± s. **P < 0.01 vs Hepes group; △△P < 0.01 vs free αGC group |
初始CD4+T被活化后, 首先分化成Th0细胞, 它在局部微环境中不同种类的细胞因子调控下进行分化。IL-2、IFN-γ等细胞因子可促进Th0细胞向Th1细胞分化; IL-4、IL-10等细胞因子可促进Th0细胞向Th2细胞分化。Th1细胞主要介导细胞免疫应答, Th2细胞主要介导体液免疫应答[23]。体液免疫主要通过效应B细胞分泌抗体, 并与抗原发生特异性结合来清除游离在寄主细胞外的抗原及其产生的有毒物质; 细胞免疫主要通过效应T细胞及其分泌的细胞因子使靶细胞溶解死亡, 因此能发挥较强大的抗肿瘤作用。通过间接检测IL-2、IL-4细胞因子的含量来判断给药后荷瘤小鼠体内Th0细胞分化的方向, 进而确定αGC-TH-Lip促进的机体免疫类型, 进一步验证αGC-TH-Lip肿瘤靶向递药系统抗肿瘤作用的强弱。由图 7可知, 第1次给药后3天时αGC-TH-Lip组IL-2的含量显著高于游离αGC组, 表明可促进Th0向Th1分化。而各组的IL-4水平几乎没有表现出差异, 说明αGC-TH-Lip对Th0向Th2分化没有显著影响。第2次给药后3天时 (即第6天) 时, 各组之间的IL-2水平的总体趋势保持不变, 但与第3天相比都有所下降, 与游离αGC相比, αGC-TH-Lip的IL-2含量降低较少, 表明其引起了更稳定的IL-2分泌, 而此时各组的IL-4水平仍基本保持不变。说明αGC-TH-Lip对Th1细胞分化有最强的诱导效应, 主要促进细胞免疫, 对体液免疫几乎没有促进作用, 这有利于其发挥更强的抗肿瘤免疫治疗的作用。
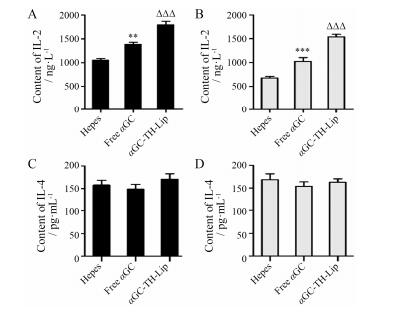
|
Figure 7 The secretion of IL-2 and IL-4 after intravenous administration of samples. A: IL-2 level measured on the 3rd day after administration process. B: IL-2 level measured on the 6th day after administration process. C: IL-4 level measured on the 3rd day after administration process. D: IL-4 level measured on the 6th day after administration process. n = 4, x± s. **P < 0.01, ***P < 0.001 vs Hepes group; △△△P < 0.001 vs free αGC group |
肿瘤的免疫治疗是一种旨在激活人体免疫系统, 依靠自身免疫功能杀死癌细胞和肿瘤组织的抗癌疗法, αGC是一种脂质抗原, 其被DC细胞摄取后能与CD1d分子结合激活NKT细胞, 激活的NKT细胞分泌大量IFN-γ, 进一步诱导机体抗肿瘤免疫细胞如NK细胞、CD8+T细胞和巨噬细胞的活化, 能够产生较强的抗肿瘤作用。已有研究表明, 多次注射游离的αGC会引起NKT细胞的脱敏失活, 严重限制了其在抗肿瘤治疗方面的应用, 而将其包裹于脂质体后可以避免此现象发生。因此, 作者构建了TH修饰的载有免疫佐剂αGC肿瘤靶向递药系统αGC-TH-Lip, 并研究其对荷瘤小鼠免疫功能的作用。
首先, 在体外研究了pH敏感的穿膜肽TH修饰脂质体在DC细胞中的摄取情况, 发现TH修饰的脂质体在DC细胞中的摄取较未修饰的PEG-Lip显著增加, 表明TH修饰能够促进DC细胞对脂质体的摄取, 这种现象的产生很有可能是因为脂质体表面多肽的修饰使其抗原性增强而有助于被抗原提呈细胞摄取。之后, 对给予αGC-TH-Lip后荷瘤小鼠体内各种免疫细胞的激活作用和数量进行了研究, 发现荷瘤小鼠体内NKT细胞、NK细胞、巨噬细胞和CTL数量较游离αGC组均显著增多, 同时, 与游离αGC相比, αGC-TH-Lip能促进更多的DC细胞成熟, 进而激活T淋巴细胞发挥免疫效应。该结果不仅验证了αGC作为一种免疫佐剂能激活NKT细胞, 进一步诱导机体抗肿瘤免疫细胞如NK细胞、CD8+T细胞和巨噬细胞的活化, 同时也表明将αGC包载于脂质体后
较游离的αGC能产生更显著的作用。最后, 通过测定给药后荷瘤小鼠体内IL-2和IL-4分泌情况研究了αGC-TH-Lip对Th0细胞分化方向的影响进而确定主要促进的免疫类型。结果显示, 两次给药后IL-4的含量均无显著变化, 而IL-2的含量较对照组显著增加, 表明αGC-TH-Lip对Th1细胞分化有最强的诱导效应, 主要促进细胞免疫, 从而能够加强CTL对于肿瘤细胞的杀伤, 而对体液免疫没有显著促进作用。
总之, 本研究初步证明了所构建的TH修饰的载αGC脂质体能够提高荷瘤小鼠的免疫功能, 具有潜在的抗肿瘤免疫治疗作用。尚待进一步考察该脂质体在体内的靶向性、抗肿瘤活性和安全性, 以全面验证其抗肿瘤效果。
| [1] | Chen XG, Zhang Y. Recent advance in the study of novel anti-tumor targets and drugs-aurora kinase and Pin1[J]. Acta Pharm Sin (药学学报), 2009, 44: 264–269. |
| [2] | He QY. Tumor heterogeneity and drug resistance of targeted antitumor agents[J]. Acta Pharm Sin (药学学报), 2016, 51: 197–201. |
| [3] | Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade:a common denominator approach to cancer therapy[J]. Cancer cell, 2015, 27: 450–461. DOI:10.1016/j.ccell.2015.03.001 |
| [4] | Miller JFAP, Sadelain M. The journey from discoveries in fundamental immunology to cancer immunotherapy[J]. Cancer Cell, 2015, 27: 439–449. DOI:10.1016/j.ccell.2015.03.007 |
| [5] | Schneiders FL, Scheper RJ, von Blomberg BME, et al. Clinical experience with α-galactosylceramide (KRN7000) in patients with advanced cancer and chronic hepatitis B/C infection[J]. Clin Immunol, 2011, 140: 130–141. DOI:10.1016/j.clim.2010.11.010 |
| [6] | Nishimura T, Kitamura H, Iwakabe K, et al. The interface between innate and acquired immunity:glycolipid antigen presentation by CD1d-expressing dendritic cells to NKT cells induces the differentiation of antigen-specific cytotoxic T lymphocytes[J]. Int Immunol, 2000, 12: 987–994. DOI:10.1093/intimm/12.7.987 |
| [7] | Richter J, Neparidze N, Zhang L, et al. Clinical regressions and broad immune activation following combination therapy targeting human NKT cells in myeloma[J]. Blood, 2013, 121: 423–430. DOI:10.1182/blood-2012-06-435503 |
| [8] | Hong C, Lee H, Park YK, et al. Regulation of secondary antigen-specific CD8+ T-cell responses by natural killer T cells[J]. Cancer Res, 2009, 69: 4301–4308. DOI:10.1158/0008-5472.CAN-08-1721 |
| [9] | Thapa P, Zhang G, Xia C, et al. Nanoparticle formulated alpha-galactosylceramide activates NKT cells without inducing anergy[J]. Vaccine, 2009, 27: 3484–3488. DOI:10.1016/j.vaccine.2009.01.047 |
| [10] | Lim SB, Banerjee A, Önyüksel H. Improvement of drug safety by the use of lipid-based nanocarriers[J]. J Control Release, 2012, 163: 34–45. DOI:10.1016/j.jconrel.2012.06.002 |
| [11] | Tang J, Zhang L, Fu H, et al. A detachable coating of cholesterol-anchored PEG improves tumor targeting of cell-penetrating peptide-modified liposomes[J]. Acta Pharm Sin B, 2014, 4: 67–73. DOI:10.1016/j.apsb.2013.12.004 |
| [12] | Zhang L, Wang Y, Gao HL, et al. The construction of cell-penetrating peptide R8 and pH sensitive cleavable polyethylene glycols co-modified liposomes[J]. Acta Pharm Sin (药学学报), 2015, 50: 760–766. |
| [13] | Zhang W, Song J, Zhang B, et al. Design of acid-activated cell penetrating peptide for delivery of active molecules into cancer cells[J]. Bioconjugate Chem, 2011, 22: 1410–1415. DOI:10.1021/bc200138d |
| [14] | Bozzuto G, Molinari A. Liposomes as nanomedical devices[J]. Int J Nanomed, 2015, 10: 975–999. |
| [15] | Nakamura T, Yamazaki D, Yamauchi J, et al. The nanopar-ticulation by octaarginine-modified liposome improves α-galactosylceramide-mediated antitumor therapy via systemic administration[J]. J Control Release, 2013, 171: 216–224. DOI:10.1016/j.jconrel.2013.07.004 |
| [16] | Hwang DW, Son S, Jang J, et al. A brain-targeted rabies virus glycoprotein-disulfide linked PEI nanocarrier for delivery of neurogenic microRNA[J]. Biomaterials, 2011, 32: 4968–4975. DOI:10.1016/j.biomaterials.2011.03.047 |
| [17] | Shen Z, Reznikoff G, Dranoff G, et al. Cloned dendritic cells can present exogenous antigens on both MHC class Ⅰ and class Ⅱ molecules[J]. J Immunol, 1997, 158: 2723–2730. |
| [18] | Wilson SB, Byrne MC. Gene expression in NKT cells:defining a functionally distinct CD1d-restricted T cell subset[J]. Curr Opin Immunol, 2001, 13: 555–561. DOI:10.1016/S0952-7915(00)00258-2 |
| [19] | Jeras M, Bergant M, Repnik U. In vitro preparation and functional assessment of human monocyte-derived dendritic cells-potential antigen-specific modulators of in vivo immune responses[J]. Transplant Immunol, 2005, 14: 231–244. DOI:10.1016/j.trim.2005.03.012 |
| [20] | Weaver CT, Harrington LE, Mangan PR, et al. Th17:an effector CD4 T cell lineage with regulatory T cell ties[J]. Immunity, 2006, 24: 677–688. DOI:10.1016/j.immuni.2006.06.002 |
| [21] | Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class Ⅰ-restricted CTLs[J]. Nature, 1998, 392: 86–89. DOI:10.1038/32183 |
| [22] | Saunders KO, Ward-Caviness C, Schutte RJ, et al. Secre-tion of MIP-1β and MIP-1α by CD8+ T-lymphocytes correlates with HIV-1 inhibition independent of coreceptor usage[J]. Cell Immunol, 2011, 266: 154–164. DOI:10.1016/j.cellimm.2010.09.011 |
| [23] | Neurath MF, Finotto S, Glimcher LH. The role of Th1/Th2 polarization in mucosal immunity[J]. Nat Med, 2002, 8: 567–573. DOI:10.1038/nm0602-567 |
 2017, Vol. 52
2017, Vol. 52


