小白菊内酯 (parthenolide, 图 1) 是小白菊 (Tanacetum parthenium) 中的主要活性成分, 占小白菊干物质量约0.1%~0.2%[1]。小白菊在全世界尤其是欧洲长期以来被用于治疗包括偏头痛、牙痛、风湿性关节炎、哮喘及皮疹在内的多种疾病[2], 近年来, 实验发现小白菊内酯除抗炎外, 还具有抗肿瘤的功效, 对急性髓细胞白血病、恶性胶质瘤、前列腺癌、肺癌、乳腺癌、肝癌、胃癌、胰腺癌等多种癌症均有治疗作用[3-6]。小白菊内酯抗肿瘤的作用机制已有报道, 主要包括以下方面:抑制核转录因子κB (NF-κB)、信号传导与转录激活因子 (STAT) 等信号通路, 诱导活性氧 (ROS) 生成, 抑制组蛋白去乙酰化酶 (HDAC), 抑制微管、炎性体生成, 阻滞细胞周期等[1, 7]。因此, 小白菊内酯是一种非常有潜力的中草药单体候选药物, 尤其是对肿瘤干细胞的独特机制, 使得它对肿瘤的选择性更高, 可以被开发为单独使用或与其他药物联合使用的抗癌药物[8]。
|
Figure 1 The chemical structures of parthenolide and costuno lide (the internal standard) |
虽然小白菊内酯的药理学活性已有详尽研究, 但是对于其类药性质的研究尚存在许多空白。小白菊内酯属于倍半萜类化合物, 结构中包含α-亚甲基-γ-内酯及环氧基结构, 这两种结构使小白菊内酯可与生物大分子的亲核位点结合[9], 从而导致其在各种生物介质中的化学稳定性降低。Jin等[10]曾采用HPLC方法考察过含有小白菊内酯的各种制品在不同储存条件下的稳定性及一致性, 发现小白菊内酯在酸性 (pH低于3)、碱性 (pH高于7)、温度高于40 ℃、以及潮湿等条件下均不稳定。除对pH敏感外, 小白菊内酯也容易受到酶的破坏。在一项I期临床试验中, 志愿者连续28天每日服用小白菊内酯5 mg, 但在其血浆中检测不到任何小白菊内酯[11]。此外, 啮齿类动物的体内实验数据也缺乏小白菊内酯的药效-浓度定量关系。例如, 当给予小鼠有效剂量的小白菊内酯后, 其在血浆中达到的最大浓度也远低于在肿瘤细胞实验中得到的IC50浓度[9]。因此, 小白菊内酯作为一种有效的抗肿瘤潜在药物, 需要进一步研究其给药剂量, 探究血浆及靶器官浓度与药效强度之间不一致的原因。这些原因可能包括了小白菊内酯特殊的药代动力学性质, 尤其是在体外生物介质中以及体内的稳定性。
本研究的目的是确定小白菊内酯在体外生物介质血浆中的稳定性, 以及在大鼠体内的药代动力学性质。首先建立了一种新的LC-MS/MS检测方法, 用来特异、灵敏并准确地定量大鼠血浆中的小白菊内酯, 然后应用到稳定性及其药动学研究。研究得到的实验结果能为更好地理解大鼠体内小白菊内酯的药代动力学性质提供参考, 进而有助于了解小白菊内酯在整体动物水平的药效。
材料与方法仪器与试剂 Agilent 1290快速高效液相色谱仪和Agilent 6460三重四级杆串联质谱仪 (美国安捷伦公司), 配备Jet Stream (ESI) 离子源以及MassHunter数据采集和处理系统 (版本号5.0.280.1)[12]; 分析天平 (Sartorius BT 25S型, 德国赛多利斯仪器有限公司); Eppendorf微量移液器和移液管; 高速离心机 (Thermo Pico 21型, 美国ThermoFisher Scientific公司); 小白菊内酯购自上海麦约尔生物公司, 内标化合物木香内酯购自百灵威科技公司, 标示纯度均 > 98%;色谱纯级别甲醇和乙酸乙酯购自ThermoFisher Scientific公司; 实验用水采用Millipore Milli Q系统纯化; 其余实验使用试剂纯度级别均高于分析纯级。
待测物及内标储备液的配制 分别精密称取小白菊内酯及木香内酯适量, 加甲醇溶解并定容, 得到质量浓度为1 mg·mL-1的溶液作为储备液, 保存于-20 ℃。
血浆样品处理 向100 μL实际血浆样品、校正样品或质控样品中加入内标溶液 (浓度为200 ng·mL-1, 由内标储备液用甲醇稀释得到) 10 μL及萃取剂 (乙酸乙酯-氯仿, 9:1) 1 mL, 剧烈振荡萃取3 min, 以16 900×g转速离心10 min, 分离吸取上清液850 μL, 转移至另一2 mL EP管中。在37 ℃下以氮气流温和吹干后, 残渣用初始流动相 (水-甲醇, 25:75) 100 μL复溶, 剧烈振荡2 min, 以16 900×g转速离心20 min, 吸取上清液60 μL, 转移至进样瓶中, 进样2 μL供LC-MS/MS分析。样品处理过程中随行空白血浆, 得到空白样品溶液。
色谱条件 采用Agilent Zorbax SB-C18 (2.1 mm × 50 mm, 5 μm) 色谱柱 (含预柱, C18, 5 μm, 美国菲罗门公司) 对小白菊内酯及内标进行梯度洗脱分离; 流动相为水 (A)-甲醇 (B), 采用梯度洗脱, 梯度洗脱条件为: 0~0.5 min, 75%甲醇; 0.5~2 min, 75%~90%甲醇; 2~4 min, 90%甲醇; 4~4.2 min, 90%~75%甲醇; 4.2~5.5 min, 75%甲醇。柱温设定为40 ℃; 流速为0.1 mL·min-1。进样体积为2 μL。总分析时间为5.5 min, 柱后平衡时间为1 min。
质谱条件 在ESI正离子模式下, 采用MRM模式对化合物进行检测, 监测离子对分别为:小白菊内酯, 质荷比249.1→185.1 (定量), 249.1→231.1 (定性); 内标化合物, 质荷比233.1→187.1 (定量), 233.1→ 215.0 (定性)。毛细管出口电压设定为:小白菊内酯, 110 V; 内标化合物, 100 V。小白菊内酯及内标化合物的碰撞能均设定为8 eV。其余经优化的离子源参数包括:干燥气温度为300 ℃, 流速为10 L·min-1; 雾化气压力为25 psi (1 psi ≈ 6.9 kPa); 鞘气温度为350 ℃, 流速为11 L·min-1; 碰撞气压力为1.6 MPa。此外, 毛细管入口电压优化为2 000 V, 喷嘴电压优化为2 000 V。通过切换阀切换, 每次运行仅记录2~ 4.5 min的MS/MS数据。
方法学考察
专属性 取6份不同来源的大鼠空白血浆, 按上述血浆样品处理方法及LC-MS/MS方法进行分析, 将色谱图与其中一个浓度的校正样品的色谱图进行比较, 考察在小白菊内酯与内标化合物保留时间处是否有杂质干扰, 考察方法的专属性。
标准曲线 将小白菊内酯储备液用甲醇逐级稀释成终质量浓度为20、40、80、160、320、640和1 280 ng·mL-1的校正样品的工作液。向100 μL空白大鼠血浆中加入各浓度的校正样品工作液10 μL, 得到终质量浓度分别为2、4、8、16、32、64和128 ng·mL-1的校正样品。按“血浆样品处理”项处理上述样品后进行LC-MS/MS分析, 使用1/x权重, 以相对提取离子色谱峰峰面积值 (待测物/内标物) 对相对浓度 (待测物/内标物) 进行线性回归, 得到标准曲线, 并计算相关系数。定量下限浓度定义为标准曲线的下限浓度, 在该浓度处精确度 (相对标准偏差, RSD) 及准确度 (相对误差, RE) 均在± 20%以内, 且信噪比不低于10。
精密度 将小白菊内酯储备液用甲醇分别稀释成低、中、高3个浓度的质控样品工作液 (40、160和1 150 ng·mL-1)。向100 μL空白大鼠血浆中加入各浓度的质控样品工作液10 μL, 得到终质量浓度分别为4、6和115 ng·mL-1的质控样品 (重复6份)。按“血浆样品处理”项下的方法处理后进行LC-MS/MS分析, 用随行标准曲线计算相应的药物浓度, 计算同一质控浓度的RSD和RE, 进行方法的日内精密度及准确度考察; 连续测定3天, 进行方法的日间精密度及准确度考察。
回收率 向EP管中加入大鼠空白血浆100 μL, 加入质控样品工作液10 μL, 使小白菊内酯的质量浓度分别为4、16和115 ng·mL-1 (重复6份), 按“血浆样品处理”项下的方法操作, 记录待测物和内标峰面积 (A1); 另取EP管加入大鼠空白血浆100 μL, 按“血浆样品处理”项下的方法操作, 复溶时, 加入质控样品工作液10 μL、内标溶液10 μL、初始流动相80 μL, 使小白菊内酯的质量浓度分别为4、16和115 ng·mL-1 (重复6份), 记录待测物和内标峰面积 (A2); 向EP管中直接加入质控样品工作液10 μL、内标溶液10 μL、初始流动相80 μL, 使小白菊内酯的质量浓度分别为4、16和115 ng·mL-1 (重复6份), 混匀后进行LC-MS/MS分析, 记录待测物和内标峰面积 (A3)。以峰面积的比值A1/A2计算得血浆中待测物和内标物的回收率, 以峰面积的比值A2/A3计算得血浆中待测物和内标物的基质效应。
体外血浆稳定性 向EP管中加入大鼠空白血浆100 μL, 加入质控样品工作液10 μL, 使小白菊内酯的质量浓度分别为4、16和115 ng·mL-1 (重复6份), 振荡混合后在室温下放置10~120 min, 按“血浆样品处理”项处理后进行LC-MS/MS分析, 用随行标准曲线计算相应的药物浓度。向EP管中加入大鼠空白血浆100 μL, 加入质控样品工作液10 μL, 使小白菊内酯的质量浓度分别为4、16和115 ng·mL-1 (重复6份), 振荡混合, 按“血浆样品处理”项处理样品, 并进行LC-MS/MS分析, 用随行标准曲线计算相应的药物浓度, 然后计算放置样品与立即处理样品的浓度比值。
大鼠体内药动学研究 取雄性SD大鼠18只, 体重180~220 g, 随机平均分为3组, 禁食但可自由饮水12 h后, 从尾静脉分别给予20、40和80 mg·kg-1小白菊内酯 (配制质量浓度分别为5、10和20 mg·mL-1的溶液, 给药体积均为4 mL·kg-1)。于给药后5、10、20、40、60、90、120和240 min眼底静脉丛取血约200 μL, 置于肝素处理的试管中, 以5 500 ×g转速在4 ℃下离心15 min后取血浆, 立刻按“血浆样品处理”项处理血浆样品, 进行LC-MS/MS分析, 测定大鼠血浆中小白菊内酯的浓度, 使用GraphPad Prism软件 (版本号5.0, 美国GraphPad软件公司) 绘制浓度-时间曲线。利用药动学数据处理软件Winnonlin (版本号5.2.1, 美国Pharsight公司) 按非房室模型计算主要的药动学参数。
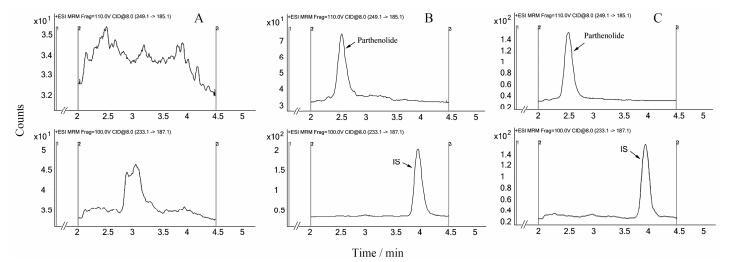
结果 1 LC-MS/MS分析方法建立和验证 1.1 专属性图 2显示, 在小白菊内酯 (2.56 min) 及内标 (3.93 min) 的保留时间处, 空白样品无内源性杂质产生的干扰。
|
Figure 2 Representative MRM chromatograms of parthenolide (PTL) and costunolide (IS) in rat plasma: a blank plasma sample (A), a plasma sample spiked with PTL and IS at LLOQ concentration of 2 ng·mL-1 (B), and a plasma sample collected at 20 min after intra venous administration of 40 mg·kg-1 PTL (C) in rats |
通过对系列校正样品进行LC-MS/ MS分析, 由MassHunter数据处理软件 (版本号5.0.280.1, 美国安捷伦公司) 给出各目标化合物的线性回归曲线和相关系数。结果显示, 当采用1/x权重时, 小白菊内酯的响应值与浓度呈良好线性关系, 回归方程为Y= 1.20 X-0.056 6 (r2 > 0.99), 线性范围为2~128 ng·mL-1, 定量下限为2 ng·mL-1, 定量下限处信噪比>10, 精密度及准确度均满足定量要求。
1.3 日内及日间精密度、准确度结果如表 1所示。待测物的日内精密度RSD≤14.42%, RE在-9.36%~3.96%;日间精密度RSD≤13.02%, RE在-14.36%~4.80%。结果证明, 此方法对大鼠血浆中小白菊内酯的检测准确、可靠、可重复, 可以用于定量。
| Table 1 The intra-and inter-day precision and accuracy for the quantification of parthenolide by LC-MS/MS in rat plasma. n= 6, mean ± SD |
结果表明, 小白菊内酯在低、中、高3个质控浓度的回收率为89.55%~95.79%, 内标的回收率为96.87%。小白菊内酯在低、中、高3个质控浓度的基质效应为90.24%~95.99%, 内标的回收率为100.79%, RSD均小于15% (重复6份)。结果证明, 待测物及内标的提取回收率较高并接近, 血浆内源性物质对待测物的电离存在轻微抑制效应, 但强度在接受范围内 (±15%)。
2 体外血浆内稳定性采用低、中、高3个浓度的质控样品 (重复6份) 在室温放置, 验证小白菊内酯在体外血浆中的短期稳定性。图 3显示, 在室温放置60 min后, 低浓度质控样品中小白菊内酯的浓度已下降超过20%;在室温放置30 min后, 中、高浓度质控样品中小白菊内酯的浓度已下降超过15% (均与混匀后立刻处理样品相比)。结果证明, 小白菊内酯在大鼠血浆中稳定性较差, 因此需要更快速的样品处理过程, 在大鼠药动学实验中, 一旦取得血浆样品, 需要在30 min内加入内标溶液并进行液-液萃取。此外, 在解释小白菊内酯大鼠体内药动学数据时, 需要考虑这一重要因素。

|
Figure 3 The in vitro stability of parthenolide at room tem perature in blank rat plasma at low, medium and high QC levels during 0-120 min (n=6, mean ± SD) |
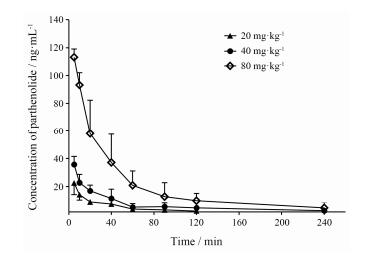
大鼠静脉给予20、40和80 mg·kg-1小白菊内酯后, 药-时曲线见图 4, 由Winnonlin软件按非房室模型处理得到分别静脉给予大鼠20、40和80 mg·kg-1小白菊内酯后药代动力学参数如表 2所示。由实验结果可知, 在80 mg·kg-1高剂量组中, 小白菊内酯的初始浓度也仅有138.86 ± 8.60 ng·mL-1。小白菊内酯的血浆浓度在5~60 min迅速下降, 而在60 min后下降速度减慢; 3组的体内半衰期都小于90 min。当剂量从20 mg·kg-1上升至40 mg·kg-1时, AUC有大约2倍的增加; 而当剂量从40mg·kg-1上升至80mg·kg-1时, AUC增大了3.3倍, 与剂量的增加不成比例。将AUC经剂量归一化后 (AUC0-4 h/Dose) 使用学生t-检验发现, 40 mg·kg-1组与80 mg·kg-1组存在显著性差异 (P < 0.05)。
|
Figure 4 The plasma concentration versus time profiles of parthenolide after intravenous administration of parthenolide with the doses at 20, 40 and 80 mg·kg-1. Results were mean ± SD of six rats of each group |
| Table 2 The pharmacokinetic parameters of parthenolide after intravenous injection of 20, 40 and 80 mg·kg-1 in rats. n= 6, x±s |
在建立分析检测方法的过程中, 为了降低基质效应, 对色谱、质谱及样品处理方法条件进行了优化。首先考察了血浆蛋白沉淀及液-液萃取这两种样品处理方法的基质效应程度, 证明后者残留的内源性干扰更少, 且操作步骤简单。液-液萃取考察了不同种类及体积比的萃取剂对萃取效率及基质效应程度的影响, 最终采用了10倍血浆体积的乙酸乙酯/氯仿 (体积比9:1) 的混合溶剂进行大鼠血浆样品的萃取, 达到较高的提取回收率及较小的基质效应。其次, 考察了色谱条件对基质效应的影响。0.1 mL·min-1的流速能使待测物在离子源处更充分地电离, 尽量避免内源性物质对待测物电离的抑制; 同时设置最佳的梯度洗脱程序, 使待测物与内标尽可能分离, 且保留时间处有尽可能少的内源性物质共流出。最后, 将进样体积优化至2 μL, 使基质效应程度保持在100%上下浮动。
由于小白菊内酯的α-亚甲基-γ-内酯环结构, 它的稳定性格外受到重视。在体外环境中, 小白菊内酯的粉末及用甲醇配制的储备液都相对稳定[10]。然而, 将小白菊内酯与大鼠血浆混合后, 有关其是否稳定存在不同结论。Zhao等[13]在进行了短期及长期稳定性实验后, 得出小白菊内酯稳定的结论。但在本实验中, 小白菊内酯在加入大鼠空白血浆、并放置在室温环境下120 min后, 浓度有显著性下降。此外, Yang等[14]也报道了与本研究相似的小白菊内酯在大鼠血浆中的半衰期数值。以上不同结果的原因可能是由于新鲜制备的大鼠血浆中含有大量酶类, 如酯酶类, 可以水解小白菊内酯的α-亚甲基-γ-内酯环结构, 并且小白菊内酯与血浆接触时间越长, 遭到破坏的越多, 因此被检测到的浓度越低。其次, 有报道显示小白菊内酯可以与含有巯基的血浆蛋白共价结合, 或与红细胞结合生成谷胱甘肽加合物[15]。这些共价结合物在有机溶剂萃取的过程中不会解离, 从而导致一部分小白菊内酯的损失。因此, 血浆中酶的破坏和血浆蛋白以及红细胞的不可逆结合, 可能使小白菊内酯的生物利用度下降, 使其能通过全身循环到达靶器官、杀伤癌细胞的部分减少。此外, Lesiak等[16]也曾报道, 将小白菊内酯与细胞培养基预先混合孵育一段时间后, 小白菊内酯的细胞毒性下降, 其原因可能是细胞培养基中加入了胎牛血清, 同样含有大量血浆酶/蛋白所导致的结果。
在本研究中, 大鼠药动学实验采用静脉给药方式以期避免化合物被胃酸环境破坏和首过效应, 尽管静脉给予大鼠80 mg·kg-1的高剂量, 并在给药5 min后就开始采血, 然而血浆内的小白菊内酯浓度仍然较低。因此, 作者认为先前一项有关小白菊内酯的I期临床试验, 其检测血药浓度失败原因可能包括不合适的给药方式和间隔、过低的剂量以及不够灵敏的血液样品检测方法。本研究证明了小白菊内酯在体外血浆中稳定性较差, 肝药酶及血浆酶作用可能导致其在体内的快速消除。小白菊内酯体内暴露量的增加与给药剂量不成等比例的现象可能由多种原因造成, 如血浆和/或肝脏代谢酶、肝脏摄取和/或外排转运体在高给药剂量下的饱和等, 需要对它的分布、代谢、排泄性质进行更深入的研究, 来更加清楚地了解小白菊内酯依从的非线性药代动力学特征。这一现象提示在临床前或临床研究时, 需要考虑剂量爬坡时体内暴露量的显著性增加, 避免不良反应的产生。
综上分析, 本文研究了小白菊内酯的一些类药性质包括血浆稳定性和药动学性质, 揭示了其药理活性方面的药效-浓度关系, 为进一步开发小白菊内酯成为抗肿瘤药物提供了重要帮助。
| [1] | Ghantous A, Sinjab A, Herceg Z, et al. Parthenolide:from plant shoots to cancer roots[J]. Drug Discov Today, 2013, 18: 894–905. DOI:10.1016/j.drudis.2013.05.005 |
| [2] | Heinrich M, Bremner P. Ethnobotany and ethnopharmacy-their role for anti-cancer drug development[J]. Curr Drug Targets, 2006, 7: 239–245. DOI:10.2174/138945006776054988 |
| [3] | Anderson KN, Bejcek BE. Parthenolide induces apoptosis in glioblastomas without affecting NF-κB[J]. J Pharmacol Sci, 2008, 106: 318–320. DOI:10.1254/jphs.SC0060164 |
| [4] | Kawasaki BT, Hurt EM, Kalathur M, et al. Effects of the sesquiterpene lactone parthenolide on prostate tumor-initiating cells:an integrated molecular profiling approach[J]. Prostate, 2009, 69: 827–837. DOI:10.1002/pros.v69:8 |
| [5] | Zhou J, Zhang H, Gu P, et al. NF-κB pathway inhibitors preferentially inhibit breast cancer stem-like cells[J]. Breast Cancer Res Treat, 2008, 111: 419–427. DOI:10.1007/s10549-007-9798-y |
| [6] | Liu D, Liu Y, Liu M, et al. Reversing resistance of mul-tidrug-resistant hepatic carcinoma cells with parthenolide[J]. Future Oncol, 2013, 9: 595–604. DOI:10.2217/fon.13.15 |
| [7] | Fuchs O. Transcription factor NF-κB inhibitors as single therapeutic agents or in combination with classical chemo-therapeutic agents for the treatment of hematologic malignancies[J]. Curr Mol Pharmacol, 2010, 3: 98–122. DOI:10.2174/1874467211003030098 |
| [8] | Ghantous A, Gali-Muhtasib H, Vuorela H, et al. What made sesquiterpene lactones reach cancer clinical trials?[J]. Drug Discov Today, 2010, 15: 668–678. DOI:10.1016/j.drudis.2010.06.002 |
| [9] | Shanmugam R, Jayaprakasan V, Gokmen-Polar Y, et al. Restoring chemotherapy and hormone therapy sensitivity by parthenolide in a xenograft hormone refractory prostate cancer model[J]. Prostate, 2006, 66: 1498–1511. DOI:10.1002/(ISSN)1097-0045 |
| [10] | Jin P, Madieh S, Augsburger LL. The solution and solid state stability and excipient compatibility of parthenolide in feverfew[J]. AAPS PharmSciTech, 2007, 8: E105. DOI:10.1208/pt0802043 |
| [11] | Curry EA 3rd, Murry DJ, Yoder C, et al. Phase Ⅰ dose escalation trial of feverfew with standardized doses of parthenolide in patients with cancer[J]. Invest New Drugs, 2004, 22: 299–305. DOI:10.1023/B:DRUG.0000026256.38560.be |
| [12] | Chen A, Qin X, Lu J, et al. Development of a validated LC-MS/MS method for the determination of ailanthone in rat plasma with application to pharmacokinetic study[J]. J Pharm Biomed Anal, 2015, 102: 514–518. DOI:10.1016/j.jpba.2014.10.022 |
| [13] | Zhao AQ, Zhao JH, Zhang SQ, et al. Determination of parthenolide in rat plasma by UPLC-MS/MS and its application to a pharmacokinetic study[J]. J Pharm Biomed Anal, 2016, 119: 99–103. DOI:10.1016/j.jpba.2015.11.039 |
| [14] | Yang ZJ, Ge WZ, Li QY, et al. Syntheses and biological evaluation of costunolide, parthenolide, and their fluorinated analogues[J]. J Med Chem, 2015, 58: 7007–7020. DOI:10.1021/acs.jmedchem.5b00915 |
| [15] | Wagner S, Kratz F, Merfort I. In vitro behaviour of sesquiterpene lactones and sesquiterpene lactone-containing plant preparations in human blood, plasma and human serum albumin solutions[J]. Planta Med, 2004, 70: 227–233. DOI:10.1055/s-2004-815539 |
| [16] | Lesiak K, Koprowska K, Zalesna I, et al. Parthenolide, a sesquiterpene lactone from the medical herb feverfew, shows anticancer activity against human melanoma cells in vitro[J]. Melanoma Res, 2010, 20: 21–34. DOI:10.1097/CMR.0b013e328333bbe4 |
 2017, Vol. 52
2017, Vol. 52


