2. 新乡医学院, 河南 新乡 453003
2. Xinxiang Medical University, Xinxiang 453003, China
活性氧 (reactive oxygen species, ROS) 是一类化学性质活泼的含氧化合物, 包括单线态氧 (1O2)、超氧阴离子自由基 (O2·-)、过氧化氢 (H2O2) 和羟基自由基 (HO·) 等[1]。研究表明, 机体处于氧化应激状态时会产生过量ROS, 导致组织脂质过氧化水平升高, 引起DNA氧化损伤和蛋白质的表达异常[2]。ROS在心肌损伤性疾病如心肌缺血再灌注损伤、心力衰竭和高血压的发病过程中扮演着重要角色[3]。抑制氧化应激诱导的心肌细胞凋亡是减轻心肌损伤的有效途径[4]。姜黄素 (curcumin, Cur) 被认为在氧化应激介导的病理状态中发挥重要作用。
Cur是从姜黄根茎中提取的一种酚性色素, 具有抗氧化、抗动脉粥样硬化及抑制肿瘤等多种生物学效应[5, 6], 在心血管疾病中具有重要药用价值[7, 8]。已有研究发现Cur可以清除HO·、超氧化物和过氧化物, 同时具有强烈的抑制脂质过氧化的能力[9, 10]。研究表明, Cur毒性很低 (小鼠灌胃LD50 > 2 g·kg-1)[11], 但其生物利用度不高 (大鼠口服绝对生物利用度4.13%)[12], 这主要是因为Cur水溶性极低 (25 ℃水中溶解度10.76 mg·L-1), 因此限制了其临床医学应用。
介孔氧化硅纳米粒 (mesoporous silica nanopar ticles, MSNs) 作为一种新型药物载体, 具有良好的生物相容性和可降解性[13], 可增加药物的吸收, 提高其生物利用度, 并可使药物在体内达到控释和靶向治疗等优点, 被广泛用作药物/基因输送的辅助生物材料[14]。
基于以上的分析, 本研究以MSNs为药物载体材料, Cur为模型药物, 构建了一种新型纳米给药缓释系统 (Cur@MSNs)。过氧化氢 (H2O2) 作为一种最稳定的ROS, 具有细胞穿透性并极易攻击细胞成分引起链式脂质过氧化反应。本研究用乳鼠心肌细胞系H9c2作为模型细胞, 建立H2O2心肌损伤模型, 观察Cur@MSNs对H2O2诱导的乳鼠心肌细胞氧化损伤的作用。同时初步探究其细胞作用机制, 为该药物缓释系统的临床应用提供理论支撑。
材料与方法药品与试剂 姜黄素 (上海晶纯生化科技股份有限公司); 磷酸盐缓冲液 (PBS, 北京索莱宝生物有限公司); 2', 7'-二氯双氢荧光素二乙酸酯 (DCFH-DA)、异硫氰酸荧光素 (FITC)、3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐 (MTT)、3-氨丙基三甲氧基硅氧烷 (APTES) 和胰蛋白酶 (美国Sigma公司); 胎牛血清和DMEM/High Glucose (美国Gibco公司); 细胞凋亡4', 6-二脒基-2-苯基吲哚 (DAPI) 检测试剂盒 (南京凯基生物技术公司); 其他试剂 (分析纯) 均购自国药集团化学试剂有限公司。
仪器 场发射透射电子显微镜 (TEM, JEM-2100F, 日本JEOL公司); 激光粒度zeta电位仪 (Zatasizer-3000HS, 英国Malvern公司); 倒置荧光显微镜 (Olympus IX71, 日本Olympus公司); 酶标仪 (Bio-TekELx800, 美国伯乐公司); 荧光光谱仪 (FluoroMax®-4, 法国Horiba公司); 紫外可见 (UV-vis) 分光光度计 (UV-3100, 日本Shimadzu公司)。
实验细胞株 乳鼠心肌细胞系H9c2购自中国科学院上海细胞库。常规培养于含10%胎牛血清的DMEM高糖培养基。
Cur@MSNs制备和表征 依照文献[15]方法制备MSNs。将制得的MSNs分散到Cur/DMSO溶液中, 室温搅拌24 h。产物离心、去离子水洗涤后冷冻干燥, 制得负载Cur的介孔氧化硅纳米粒 (Cur@MSNs)。取适量Cur@MSNs, 以去离子水为分散介质, 采用激光粒度仪分别测定其粒径分布和zeta电位。另取适量纳米粒悬液滴于铜网上, 滤纸吸去过量液体, 加1滴2%磷钨酸复染, 自然晾干, 置于TEM下观察、拍照。
Cur@MSNs体外释药实验 准确称量Cur@MSNs粉末后装入透析袋 (截留分子质量3 000~4 000 Da), 将透析袋封口后浸没在含十二烷基硫酸钠 (0.08%, w/v) 的PBS溶液 (pH 7.4)[16, 17]。37 ℃下恒温振荡, 定时取样, 并立即补加等量释药介质。样品用水系滤膜过滤后采用UV-vis分光光度计测定其吸光度, 根据标准曲线计算累积释放量。
制备FITC荧光标记的Cur和Cur@MSNs 将FITC 10 mg和APTES 24 μL加入甲醇溶液中避光反应24 h制得氨基化的FITC (FITC-NH2)。将Cur和Cur@MSNs 50 mg分别分散到3 mL FITC-NH2溶液中, 缓慢搅拌12 h。产物离心、甲醇洗涤后真空避光干燥, 得到FITC荧光标记的Cur和Cur@MSNs, 分别定义为Cur-FITC和Cur@MSNs-FITC。
荧光显微镜观察细胞吞噬 将H9c2细胞接种于玻底培养皿培养过夜。吸弃原培养基, 分别换成含Cur-FITC和Cur@MSNs-FITC的培养基, 继续培养12 h。细胞经多聚甲醛固定后对细胞核进行DAPI染色:弃去原培养基, 加入DAPI工作液500 μL, 染色15 min。弃去染色液, 加入1 mL台盼蓝淬灭细胞外荧光。甲醇漂洗1次, 用倒置荧光显微镜观察、拍照。
荧光显微镜及光谱仪检测细胞内ROS 将H9c2细胞接种于培养皿培养过夜。去除原培养基, 换成含Cur@MSNs的培养基, 继续培养6 h。除去液体培养基, PBS冲洗3次, 加入DCFH-DA 100 μL, 继续培养30 min, PBS洗涤3次, 采用倒置荧光显微镜观察并拍照。
同上对细胞荧光标记, 对贴壁细胞消化后将其分散到5 mL新鲜培养基制成细胞悬液。用血细胞计数板对悬液细胞准确计数。随后, 对细胞悬液离心并重新分散于新鲜培养基制成细胞悬液, 采用荧光光谱仪检测细胞悬液的荧光强度。
MTT法评价Cur及Cur@MSNs体外细胞毒性 对H9c2细胞消化、计数后以每毫升5×104个细胞接种于96孔板, 37 ℃培养24 h使细胞贴壁。之后, 将原培养基分别换成含有Cur和Cur@MSNs (Cur浓度均为2、8、14 μmol·L-1) 的培养基, 继续培养4或24 h。培养结束后, 用冷PBS清洗2次, 向每孔中加入MTT溶液20 μL, 继续培养4 h。最后, 吸去MTT, 向每孔中加入DMSO溶液150 μL, 轻轻摇晃孔板使甲瓒结晶溶解后在酶标仪 (λ=490 nm) 上检测溶液的吸光度值 (OD)。将新鲜培养基上细胞的成活率归一化为100%, 并作为空白对照组。
H9c2细胞形态观察 H9c2细胞经胰酶消化后接种于培养皿, 培养过夜使细胞贴壁, 用倒置显微镜观察贴壁后的细胞形态。去除原培养基, 换成含Cur@MSNs的培养基, 继续培养24 h。之后, 除液体培养基, PBS冲洗细胞3次, 倒置显微镜观察细胞形态。
统计学方法 采用SPSS进行统计学显著性分析。数据之间比较用Student’s t-test。P < 0.05有显著性差异。
结果和讨论 1 Cur@MSNs粒径分析图 1A是Cur@MSNs的TEM照片。从图中可看出Cur@MSNs直径约为150 nm。激光粒度仪分析发现, Cur@MSNs平均粒径为153.8 nm, 多分散指数 (polydispersity index, PI) 为0.149, 分布较为均匀 (图 1B)。

|
Figure 1 TEM image of Cur-loaded delivery system (Cur@MSNs, A) and dynamic light scattering particle size distribution of Cur@MSNs (B). Cur: Curcumin |
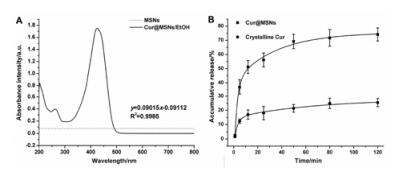
用UV-vis分光光度计检测Cur@MSNs中Cur的装载量。配制不同浓度的Cur乙醇标准溶液, 分别测定其在425 nm处的吸收峰强度 (图 2A)。根据朗伯-比尔定律绘制标准曲线。通过评价MSNs装载Cur前后Cur乙醇溶液的OD来评价溶液中Cur含量, 并由此计算Cur装载量。结果发现, Cur@MSNs中Cur装载量为14.7%。
|
Figure 2 UV-vis absorption spectra of mesoporous silica nanoparticles (MSNs) and Cur@MSNs/EtOH solution (A). Release profile of Cur from Cur@MSNs and crystalline Cur in PBS under sink condition (B). n=3, x±s |
已有研究[18, 19]表明, 介孔氧化硅可明显改善难溶性药物 (如白藜芦醇、布洛芬和喜树碱) 的水溶性。本研究发现, 将Cur装入MSNs可明显改善其溶解度。图 2B是自由的Cur和Cur@MSNs在PBS中Cur的溶解/释放曲线。与自由的Cur相比, Cur@MSNs中的Cur在PBS中的释放速率明显提高。120 min后, Cur@MSNs中Cur的释放量为74.1%, 而从Cur晶体中溶解出来的Cur只有25.4%。
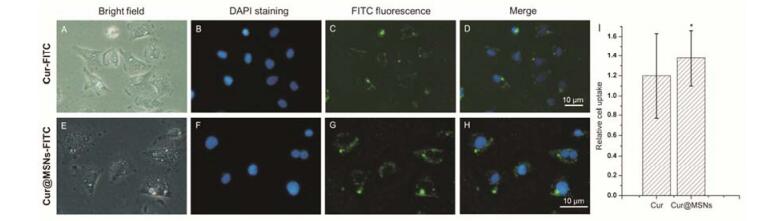
3 细胞摄取Cur和Cur@MSNs以H9c2细胞为模型细胞, 用FITC对Cur和Cur@MSNs标记 (Cur-FITC和Cur@MSNs-FITC) 后, 观察H9c2能否有效摄取Cur和Cur@MSNs。图 3A~D和图 3E~H分别是H9c2对Cur-FITC和Cur@MSNs-FITC的摄取结果。其中, 图 3A和3E是H9c2细胞的明场成像 (相差模式), 图 3B和3F是DAPI标记后的细胞核成像, 从图中可看出蓝色细胞核成像。图 3C和3G是FITC的荧光成像, 从图中可看到细胞质中充满了绿色的FITC荧光点, 说明细胞可有效摄取荧光标记的Cur和Cur@MSNs, 且Cur@MSNs-FITC的荧光强度明显高于Cur-FITC, 说明细胞可摄取更多Cur@MSNs。已有研究发现, 小分子药物通常通过被动扩散进入细胞[20]。由于Cur水溶性很低, 使得Cur的细胞摄取量大大降低。而MSNs主要通过内吞方式进入细胞[20], 且MSNs与细胞膜表面的磷脂层具有很高的亲和力[21], 提高了Cur@MSNs的细胞摄取量。细胞内绿色荧光强度定量分析 (图 3I) 发现, 与Cur@MSNs-FITC共培养后, H9c2细胞内的绿色荧光强度明显高于Cur-FITC, 进一步说明细胞可摄取更多Cur@MSNs。
|
Figure 3 Cellular uptake of FITC-labeled Cur (Cur-FITC, A-D) and Cur@MSNs (Cur@MSNs-FITC, E-H) by H9c2 cells. A, E: Bright field images of H9c2 cells; B, F: Blue fluorescence images of cell nuclei stained with DAPI; C, G: Green fluorescence images of Cur-FITC and Cur@MSNs-FITC in cells; D, H: Merged fluorescence images; I: Green fluorescence intensity of H9c2 cells after incubation with Cur-FITC and Cur@MSNs-FITC for 4 h at 37 C. n=3, x±s±s. *P < 0.05 vs Cur group |
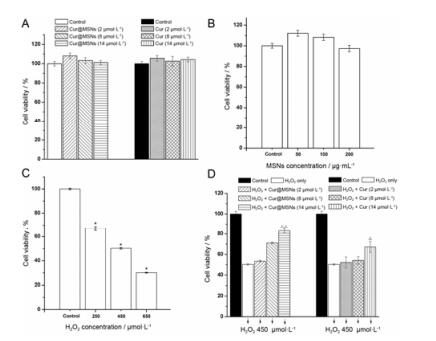
用MTT比色实验评价不同浓度Cur及Cur@MSNs对H9c2细胞的体外毒性作用, 并以此检测Cur及Cur@MSNs中释放出来的Cur的药理活性差异。将无血清空白培养基中的细胞活性归一化为100%作为空白对照组。从图 4A中可看出, 低剂量的Cur和Cur@MSNs (Cur浓度均为2、8、14 μmol·L-1) 对H9c2细胞几乎无毒性, 二者的细胞活性数据无显著性差异, 说明所制备的Cur@MSNs中Cur保持了良好的药理活性。从图 4B中可看出, 制备出的MSNs在适当的浓度条件下具有良好的生物相容性。用H2O2刺激H9c2细胞建立心肌细胞氧化损伤模型, 实验结果如图 4C所示, H9c2细胞成活率依赖于H2O2的作用浓度, 250、450和650 μmol·L-1 H2O2处理H9c2细胞4 h后, 细胞存活率分别为66.96%、50.26%和30.09%, 且细胞成活率间呈显著性差异 (P < 0.05)。为了评价Cur及Cur@MSNs对细胞氧化应激损伤的作用, H2O2氧化刺激细胞后, 给予Cur及Cur@MSNs培养24 h。如图 4D所示, H2O2 (450 μmol·L-1) 与Cur@MSNs (含2、8、14 μmol·L-1 Cur) 共同作用后, 细胞成活率从50.26%分别显著升高至53.3%、71.1%和82.9% (P < 0.01)。而H2O2 (450 μmol·L-1) 与Cur (含2、8、14 μmol·L-1 Cur) 共同作用后, 细胞成活率从50.26%分别升高至52.2%、74.1%和67.2% (P < 0.05)。结果说明Cur和Cur@MSNs可明显改善H2O2引起的心肌细胞氧化损伤, 且Cur@MSNs比Cur作用更明显。之前实验结果发现, 与Cur相比, 细胞可以摄取更多Cur@MSNs, 且Cur@MSNs可明显改善Cur的溶解度, 增加细胞内Cur的浓度, 从而增强其对心肌细胞氧化损伤的保护作用。
|
Figure 4 Invitro cytotoxicity evaluations by MTT assay. Fresh culture media without samples were used as controls. Cytotoxicity comparison of Cur and Cur@MSNs with equivalent Cur (2, 8, 14 μmol·L-1) (A). In vitro cytotoxicity of MSNs (50, 100, 200 μg·mL-1) against H9c2 cells after 24 h incubation (B). In vitro cytotoxicity of H2O2 (250, 450, 650 μmol·L-1) (C). In vitro cytotoxicity of H2O2 (450 μmol·L-1) + Cur@MSNs or Cur (containing 2, 8, 14 μmol·L-1 Cur) against H9c2 cells after 24 h co-incubation (D). n=6, x±s±s. *P < 0.05 vscontrol group; △P < 0.05, △△P < 0.01 vsH2O2 group |
从细胞形态看, 给予MSNs培养时, 细胞排列整齐, 贴壁性良好 (图 5A); 给予Cur@MSNs培养时, 细胞仍保持良好的活性, 细胞形态完整 (图 5B), 这与细胞活力实验结果一致 (图 4A), 说明Cur@MSNs本身无明显毒性, 因而单独使用Cur@MSNs不会对正常细胞产生毒副作用。但给予H2O2刺激时, 细胞质发生肿胀并出现大量液泡化现象 (图 5C), 这是细胞氧化应激引起的细胞坏死表现, 该结果与细胞活力结果也是一致的 (图 4C)。而给予H2O2刺激并给予Cur@MSNs共培养时 (图 5D), 细胞数量有所减少, 这可能是部分细胞活性降低贴壁性减弱随细胞冲洗脱落引起的。从细胞形态来看, 细胞活性及贴壁性良好。结合细胞活力实验 (图 4D), 说明Cur@MSNs可明显降低H2O2氧化应激对细胞造成的损伤。

|
Figure 5 Microscopic images of H9c2 cells exposed to MSNs (50 μg·mL-1, A), Cur@MSNs (containing 8 μmol·L-1 Cur, B), H2O2 (450 μmol·L-1, C) and H2O2 (450 μmol·L-1) + Cur@MSNs (containing 8 μmol·L-1 Cur) (D) for 24 h. The scale bar is 10 μm |
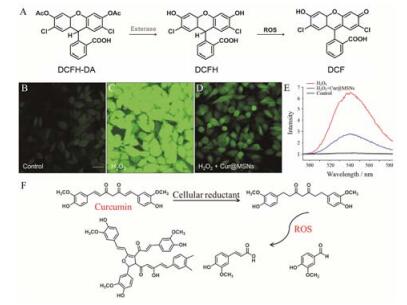
H2O2作为一种ROS, 具有诱发细胞内生物大分子氧化损伤、抑制蛋白质功能、破坏脂质、引发DNA链断裂进而引发细胞凋亡的活性。从体外细胞活性实验结果可见, Cur@MSNs可抑制H2O2诱导的心肌细胞氧化应激凋亡。为了探究Cur@MSNs的抗氧化损伤机制, 采用ROS荧光探针DCFH-DA对细胞内ROS进行标记。DCFH-DA本身无荧光, 但可穿透细胞膜, 并被细胞内酯酶分解产生DCFH。DCFH无荧光, 且不能穿透细胞膜, 但可选择性地与细胞内ROS反应产生荧光物质2', 7'-二氯荧光素 (DCF) (图 6A)。DCF不能穿透细胞膜, 因而DCF的含量反映了细胞内ROS含量。给予新鲜培养基培养1 h后对其进行DCFH-DA (10 μmol·L-1) 荧光标记30 min, 以此为空白对照。倒置荧光显微镜观察发现, 对照组细胞内出现了微弱的DCF绿色荧光 (图 6B), 这主要是由DCFH-DA在细胞内自动氧化引起的。当给予H2O2培养1 h后对其进行DCFH-DA标记时, 细胞内出现了明亮的DCF绿色荧光 (图 6C), 说明细胞内产生了大量ROS。相比之下, 当给予H2O2培养1 h, 再给予Cur@MSNs培养时, 细胞内DCF荧光明显减弱 (图 6D), 说明细胞内ROS含量明显降低。用荧光光谱仪对细胞内荧光强度定量分析结果 (图 6E) 与荧光显微镜观察结果一致。综上结果说明Cur@MSNs可明显降低细胞内的ROS含量。这主要是因为Cur分子结构的两个苯环中各有一个酚羟基和一个甲氧基 (图 6F)。之前的研究表明, 具有1, 2-二羟基基团的酚类物质具有很强的抗氧化活性, 会捕获ROS产生香兰醛、阿魏酸和姜黄素的二聚体, 该二聚体具有稳定的二氢呋喃结构, 在Cur的抗氧化过程中起重要作用[22, 23]。
|
Figure 6 Illustration of intracellular reaction of DCFH-DA with reactive oxygen species (ROS), leading to the generation of fluorescent DCF. The DCF fluorescence intensity indicates the ROS amount in cells (A). Fluorescence images of ROS in H9c2 cells after incubation with H2O2 and H2O2 + Cur@MSNs (B-D). Fluorescence emission spectra of DCF in H9c2 cells after incubation with H2O2 and H2O2 + Cur@MSNs (E). Cells incubated with fresh culture media were used as the control. Illustration of intracellular reaction mechanism of Cur@MSNs with ROS (F) |
在临床工作中, 药物的用量直接关系到药物的使用效果, 尤其是针对水溶性差的药物, 不得不使用更高的药物浓度以达到良好的使用效果。但是高浓度的药物会带来更高的毒副作用。Cur本身因为在水溶性介质中的溶解度极低, 因此其临床应用受到了很大限制。与目前国内外研究工作相比, 本研究利用MSNs为载体材料, 构建负载Cur的药物缓释体系, 可明显增加Cur在水溶性介质中的药物浓度。同时, 利用MSNs的载体作用可明显改善Cur的细胞摄取量, 从而降低Cur的给药浓度, 提高其生物利用度, 因此具有良好的临床应用前景。
结论本研究制备了具有规则孔道结构的MSNs并以此为药物载体, Cur为模型药物, 构建了一种新型纳米给药缓释系统 (Cur@MSNs)。MSNs规则的孔道结构可实现对Cur的高效负载和缓慢释放, 且可以改善Cur的水溶性并提高其生物利用度。体外细胞实验用乳鼠心肌细胞系H9c2为模型细胞, 建立H2O2心肌损伤模型, 实验结果发现Cur@MSNs及Cur对H2O2诱导的H9c2细胞氧化损伤均有明显的保护作用。与Cur相比, Cur@MSNs输送系统具有更高的药理活性及心肌细胞保护效应。体外荧光探针标记发现Cur@MSNs可明显降低H2O2氧化应激产生的ROS, 从而降低了ROS引发的心肌细胞氧化凋亡。
| [1] | Ishikawa K, Takenaga K, Akimoto M, et al. ROS-generating mitochondrial DNA mutations can regulate tumor cell metastasis[J]. Science, 2008, 320: 661–664. DOI:10.1126/science.1156906 |
| [2] | Dröge W. Free radicals in the physiological control of cell function[J]. Physiol Rev, 2002, 82: 47–95. DOI:10.1152/physrev.00018.2001 |
| [3] | Buja LM. Myocardial ischemia and reperfusion injury[J]. Cardiovasc Pathol, 2005, 14: 170–175. DOI:10.1016/j.carpath.2005.03.006 |
| [4] | Kim YS, Kim JS, Kwon JS, et al. BAY 11-7082, a nuclear factor-kappaB inhibitor, reduces inflammation and apoptosis in a rat cardiac ischemia-reperfusion injury model[J]. Int Heart J, 2010, 51: 348–353. DOI:10.1536/ihj.51.348 |
| [5] | Ammon HP, Wahl MA. Pharmacology of curcuma longa[J]. Planta Med, 1991, 57: 1–7. DOI:10.1055/s-2006-960004 |
| [6] | Hatcher H, Planalp R, Cho J, et al. Curcumin:from ancient medicine to current clinical trials[J]. Cell Mol Life Sci, 2008, 65: 1631–1652. DOI:10.1007/s00018-008-7452-4 |
| [7] | Miriyala S, Panchatcharam M, Rengarajulu P. Cardiopro-tective Effects of Curcumin[M]//Aggarwal BB, Surh YJ, Shishodia S. The Molecular Targets and Therapeutic Uses of Curcumin in Health and Disease. US:Springer, 2007, 359-377. |
| [8] | Wongcharoen W, Phrommintikul A. The protective role of curcumin in cardiovascular diseases[J]. Int J Cardiol, 2009, 133: 145–151. DOI:10.1016/j.ijcard.2009.01.073 |
| [9] | Ak T, Gulciu I. Antioxidant and radical scavenging properties of curcumin[J]. Chem Biol Interact, 2008, 174: 27–37. DOI:10.1016/j.cbi.2008.05.003 |
| [10] | Jitoe-Masuda A, Fujimoto A, Masuda T. Curcumin:from chemistry to chemistry-based functions[J]. Curr Pharm Design, 2013, 19: 2084–2092. |
| [11] | Huang MT, Smart RC, Wong CQ, et al. Inhibitory effect of curcumin, chlorogenic acid, caffeic acid, and ferulic acid on tumor promotion in mouse skin by 12-O-tetradecanoylphorbol-13-acetate[J]. Cancer Res, 1988, 48: 5941–5946. |
| [12] | Zhang LK, Wang XZ, Li WS, et al. Pharmacokinetics and absolute bioavailability of curcumin in rats[J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 1458–1462. |
| [13] | Tang FQ, Li LL, Chen D. Mesoporous silica nanoparticles:synthesis, biocompatibility and drug delivery[J]. Adv Mater, 2012, 24: 1504–1534. DOI:10.1002/adma.201104763 |
| [14] | Li ZX, Barnes JC, Bosoy A, et al. Mesoporous silica nanoparticles in biomedical applications[J]. Chem Soc Rev, 2012, 41: 2590–2605. DOI:10.1039/c1cs15246g |
| [15] | Chen Y, Yin Q, Ji XF, et al. Manganese oxide-based multifunctionalized mesoporous silica nanoparticles for pH-responsive MRI, ultrasonography and circumvention of MDR in cancer cells[J]. Biomaterials, 2012, 33: 7126–7137. DOI:10.1016/j.biomaterials.2012.06.059 |
| [16] | Li C, Deng L, Zhang Y, et al. Silica-coated ethosome as a novel oral delivery system for enhanced oral bioavailability of curcumin[J]. Acta Pharm Sin (药学学报), 2012, 47: 1541–1547. |
| [17] | Chen D, Liu Y, Fan KY, et al. Relation between drug release and the drug status within curcumin-loaded microsphere[J]. Acta Pharm Sin (药学学报), 2016, 51: 140–146. |
| [18] | Yang XJ, Liu Z, Li ZH, et al. Near-infrared-controlled, targeted hydrophobic drug-delivery system for synergistic cancer therapy[J]. Chem Eur J, 2013, 19: 10388–10394. DOI:10.1002/chem.201204624 |
| [19] | He QJ, Gao Y, Zhang LX, et al. One-pot self-assembly of mesoporous silica nanoparticle-based pH-responsive anti-cancer nano drug delivery system[J]. J Mater Chem, 2011, 21: 15190–15192. DOI:10.1039/c1jm13598h |
| [20] | Conner SD, Schmid SL. Regulated portals of entry into the cell[J]. Nature, 2003, 422: 37–44. DOI:10.1038/nature01451 |
| [21] | Mornet S, Lambert O, Duguet E, et al. The formation of supported lipid bilayers on silica nanoparticles revealed by cryoelectron microscopy[J]. Nano Lett, 2005, 5: 281–285. DOI:10.1021/nl048153y |
| [22] | Manikandan P, Sumitra M, Aishwarya S, et al. Curcumin modulates free radical quenching in myocardial ischaemia in rats[J]. Int J Biochem Cell Biol, 2004, 36: 1967–1980. DOI:10.1016/j.biocel.2004.01.030 |
| [23] | Masuda T, Toi Y, Bando H, et al. Structural identification of new curcumin dimers and their contribution to the antioxidant mechanism of curcumin[J]. J Agric Food Chem, 2002, 50: 2524–2530. DOI:10.1021/jf011601s |
 2017, Vol. 52
2017, Vol. 52


