2. 国家中成药工程技术研究中心, 辽宁 本溪 117000
2. NERC for the Pharmaceutical of Traditional Chinese Medicines, Benxi 117000, China
感冒灵颗粒是由三叉苦、岗梅、野菊花、金盏银盘4味中药材和马来酸氯苯那敏、咖啡因、对乙酰氨基酚3种化学药组成的解热镇痛药, 用于感冒引起的头痛、发热、鼻塞、流涕、咽痛等症状[1]。感冒灵颗粒生产工艺复杂, 保证每一个工艺环节产品质量的稳定是最终产品安全、有效的依靠。但是, 如同多数中成药制造过程一样, 目前感冒灵颗粒生产过程中的质量检测和控制手段不足, 通常以采集样品至分析室测量的方法进行质量检测, 分析方法也为高效液相色谱法、紫外分光光度法等耗时、信息滞后的技术, 此种现状严重影响着产品质量的可靠性和生产的成本[2]。因此, 亟待开发一种快速、准确的检测技术。
2004年, 美国食品药品监督管理局 (Food and Drug Administration, FDA) 发布了关于制药行业实施过程分析技术 (process analytical technology, PAT) 的指导性文件[3]。文件旨在为制药行业提供一个法规框架, 提高对生产过程的理解, 并鼓励挖掘过程中的关键参数, 且以合适的方法进行监控[4]。近红外 (near infrared, NIR) 光谱法是一种合适的PAT工具, 如今在制药行业已经有许多关于近红外光谱的研究及应用[5-10]。近红外光范围从780~2526 nm, 其光谱区域与有机分子中的含氢基团 (如C-H、N-H、O-H、S-H) 的倍频或合频振动的吸收谱相一致[11]。因此, 通过扫描近红外光谱, 可以获得样品中含氢基团的特征信息。近红外光谱法具有高效、经济、无损等优点, 正受到制药行业越来越多的青睐[12]。
近红外光谱法在制药过程中的应用研究已经有很多。但是这些研究多数仍旧停留在实验室规模, 致力于数学模型的优化, 以及各个生产过程的可行性研究。如Yang等[13]研究了声光可调滤光器近红外光谱技术在淫羊藿浓缩过程中的在线检测, 所建模型具有较好相关系数及预测能力。Li等[14]使用124个金银花提取液样品建立了6个有机酸的定量模型, 实现了该对象的快速无损分析。同时, 对于在线生产过程中的近红外应用的研究也有报道。如Qin等[15]提出了一种运用OPC通讯技术实现近红外仪器与现场自动化设备双向数据传输的方法, 并成功应用于中药生产过程。同时, 还提出并设计了一套完整的用于中药关键生产过程的在线近红外监控系统, 该系统包括硬件、软件、数据库等方面的内容, 成功在实际生产过程中进行应用[16]。实验室规模下的研究结果往往忽视实际应用的问题, 并没有真正发挥出过程分析技术对中药制药行业质量控制的巨大作用。
本研究以感冒灵颗粒浓缩过程为对象, 在浓缩设备的循环通道上搭建了一条近红外检测管路, 通过远程连接自控系统、光谱仪等设备, 实现了近红外与自动化控制系统的结合。综合考虑生产中常规检测项目及研究对象药效成分, 本研究选择绿原酸、蒙花苷、固含量、相对密度4个指标进行分析。研究完成了光谱采集与建模工作, 建立了绿原酸、蒙花苷、固含量、相对密度4个关键性指标的偏最小二乘法 (partial least squares regression, PLSR) 模型, 并将模型导入工作站, 对新的生产批次进行实时预测, 成功实现了该方法在感冒灵浓缩过程中的自动在线检测。
材料与方法材料与设备 感冒灵提取液在浓缩实验前一天制备, 用于提取的三叉苦、野菊花、金盏银盘、岗梅药材由国家中成药工程技术研究中心提供; 绿原酸 (批号MUST-15041814)、蒙花苷 (批号MUST-15101207) 对照品购自成都曼斯特有限公司, 纯度大于99.5%;甲酸 (分析纯) 购自阿拉丁试剂公司, 乙腈 (色谱纯) 购自默克公司。浓缩罐 (2.3 m2加热室) 购自浙江温兄机械阀业有限公司; 近红外流通池购自Solvias公司, 型号为OP2-NIR-2m, 光程为2 mm; 近红外光谱仪Matrix-F及光纤购自德国布鲁克公司; 工作站配有OPUS近红外软件及西门子WinCC自动化控制软件; 高效液相色谱仪为Agilent 1260系列, 配备四元泵、自动进样器、柱温箱和紫外检测器。
在线检测系统构建 感冒灵颗粒提取液在真空环境下使用蒸汽加热进行浓缩。药液经泵输送进入近红外光谱检测管路, 经过除气泡过滤器、流通池后返回浓缩罐。具有2 mm光程的流通池通过光纤与远程分析室的近红外光谱仪连接, 进行光信号的传递。近红外光谱工作站通过计算光谱得出药液中关键指标的含量值, 传递给控制系统电脑。控制系统分别控制浓缩设备中阀门及泵的运行和近红外光谱仪器的工作。该近红外光谱系统的工作模式如图 1所示。建模阶段, 控制系统通过控制气动阀门的开关及近红外光谱仪的工作进行光谱扫描和样品采集。首先保持流通池内药液循环, 然后关闭阀门, 采集静态药液光谱, 随后打开取样阀门, 收集少量样品供含量测定。反复循环, 进行多个浓缩批次的取样, 获取足够的样品数以供建立定量模型。建模完成后, 导入模型至近红外光谱工作站, 扫描光谱后计算得到药液的实时含量值。近红外光谱工作站计算得到的含量数据, 通过OPC通讯传输至控制系统, 以趋势图的形式显示在系统界面, 达到直观、实时监测的目的。
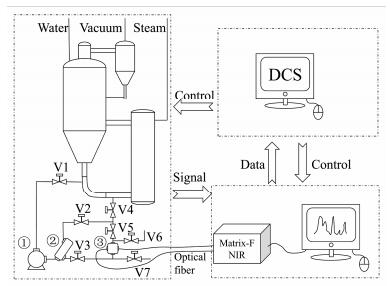
|
Figure 1 Near infrared detecting system in concentration process of Ganmaoling granules (① pump; ② filter; ③ flow cell; V1−V7 valves) |
近红外光谱仪以透射模式扫描药液的吸光度, 以空气为背景, 流通池内的光程精密调整为2 mm。扫描范围为4 000~12 000 cm-1, 分辨率为16 cm-1, 每张光谱为连续32次扫描后求得的平均光谱。实验共进行了8个批次的浓缩以获取建模样品, 进行偏最小二乘法定量模型的建立。并在建模完成后进行了2个批次的验证实验, 考察模型的预测准确性。以上实验样品均为在线采集。实验选取绿原酸、蒙花苷、固含量、相对密度共4个关键性指标进行在线检测。
标准测量方法 使用高效液相色谱法测定药液中绿原酸和蒙花苷的含量, 使用Waters X-Bridge Shield RP18 (5 μm, 250 mm × 4.6 mm) 色谱柱, 以乙腈A-水 (0.5%甲酸) B为流动相进行梯度洗脱。线性梯度程序为: 0~7 min, 87% B; 27 min 70% B; 35 min, 65% B; 40 min, 10% B; 40.01 min, 87% B; 55 min, 87% B。样品经0.45 μm混合膜过滤后直接进样, 进样量为10 μL, 流速为1.0 mL·min-1, 柱温为30 ℃, 检测波长为334 nm。
线性考察 精密称取绿原酸对照品50.64 mg于25 mL量瓶中, 用甲醇溶解后定容。取上述溶液用甲醇稀释得0.04、0.08、0.12、0.16、0.20、0.24、0.28和0.32 mg·mL-1系列对照品溶液。经0.45 μm混合膜过滤后, 按上述液相色谱条件分析, 以峰面积对浓度计算线性回归方程及相关系数。在0.04~0.32 mg·mL-1内, 绿原酸的线性回归方程为Y=2.94×107X + 9.71×104, r2=0.999。精密称取蒙花苷对照品50.10 mg于25 mL量瓶中, 用少量N, N-二甲基甲酰胺溶解后, 用甲醇定容。取上述溶液用甲醇稀释得0.10、0.20、0.40、0.60、0.80、1.00、1.20和1.40 mg·mL-1系列对照品溶液。经0.45 μm混合膜过滤后, 按上述液相色谱条件分析, 以峰面积对浓度计算线性回归方程及相关系数。在0.10~1.40 mg·mL-1内, 蒙花苷的线性回归方程为Y=1.90×107X + 1.11×106, r2=0.990。
准确度考察 向已知含量的浓缩液样品分别加入绿原酸或蒙花苷对照品, 每种浓度水平平行3份, 按照上述液相色谱条件分析, 计算绿原酸或蒙花苷的加样回收率。绿原酸的平均加样回收率为99.06%, 蒙花苷的平均加样回收率为99.73%。
精密度考察 取同一样品, 经0.45 μm混合膜过滤后, 按文中所述液相色谱条件连续进样6次, 计算峰面积RSD。结果显示绿原酸RSD为0.43%, 蒙花苷RSD为0.09%。
重复性考察 取一份浓缩液样品, 经0.45 μm混合膜过滤制备6份样品, 按文中所述液相色谱条件分别进样, 计算峰面积RSD。结果显示绿原酸RSD为0.32%, 蒙花苷RSD为0.97%。
稳定性考察 取一份浓缩液样品, 经0.45 μm混合膜过滤后, 按文中所述液相色谱条件分别在0、4、8、12、16、20、24、28、32和36 h时进样分析, 计算峰面积RSD。结果显示, 绿原酸RSD为0.69%, 蒙花苷RSD为0.93%。
实验采用烘干法测定浓缩液固含量。取药液约5 mL到已烘至恒重的称量瓶, 于105 ℃烘箱中烘干至恒重, 计算干燥物与药液的质量比。
相对密度测定在取样时直接进行, 以玻璃密度计进行测量。
数据处理 以偏最小二乘法 (partial least square, PLS) 分别对绿原酸、蒙花苷、固含量、相对密度4个指标建模。建模时通过计算F值排查异常值, 并通过不同光谱波段和预处理方法的筛选, 建立最优模型。F值通过式1计算光谱残差以判断其是否为异常值[17, 18]。
| $ {F_i} = \frac{{(M-1) \times {{({\rm{SpecRe}}{{\rm{s}}_i})}^2}}}{{\sum\nolimits_{j \ne i} {{{({\rm{SpecRe}}{{\rm{s}}_j})}^2}} }} $ | (1) |
光谱预处理方法有:无光谱预处理 (no data preprocessing), 消除常数偏移量 (subtraction of a constant offset), 减去一条直线 (subtraction of a straight line), 矢量归一化 (vector normalization), 最小-最大归一化 (min-max-normalization), 多元散射校正 (multiplicative scatter correction), 一阶导数 (first derivative) 以及二阶导数 (second derivative)。
以相关系数r及校正均方根误差RMSEC (root mean square error of calibration) 为模型参数对校正模型进行考察, 选择相关系数高且误差值小的模型作为最优模型, 并对其进行外部验证集的检验, 考察其对未知样品的预测精度, 以预测相对标准偏差RSEP (relative standard error of prediction) 为参数进行评价, 通常认为一个合格的模型对未知样品的预测偏差控制在10%以内[19]。
结果与讨论 1 光谱与数据整理实验共计获得8个批次进行建模, 包含229个浓缩液样品。另有2个批次的验证实验在建立模型之后进行, 包含45个样品。经标准方法含量测定, 绿原酸含量范围为0.01~1.14 mg·mL-1, 蒙花苷含量范围为0.05~1.45 mg·mL-1, 固含量范围为1.13%~33.40%, 相对密度值范围为0.90~1.13 g·mL-1。某一典型批次的浓缩液样品的近红外光谱图如图 2所示。约5 400 cm-1以下的波段由于水中O-H键吸收的干扰, 造成吸收饱和, 4 000~4 500 cm-1波段具有较强噪声, 在建模波段选取时舍去。傅立叶转换近红外光谱仪通常可以使用2.5吸光度以下的波段用于建模。因此应选择一级倍频区、二级倍频区、三级倍频区作为建模选择波段。
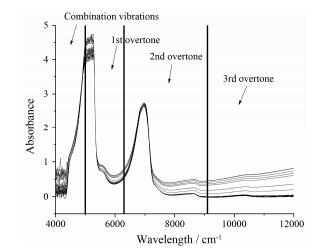
|
Figure 2 Near infrared spectra of concentration solutions from one typical batch |
经过不同的建模波段及预处理方法的比较, 所选最优模型的参数如表 1所示。使用导数对光谱进行预处理可以有效消除光谱变换带来的噪声。选择适当的波段可以有效缩短模型计算时间, 提取有用的光谱信息, 剔除干扰信息[20, 21]。以所选波段建模, 绿原酸、蒙花苷、固含量以及相对密度的模型均有大于0.9的相关系数, 相对密度模型的相关系数相对较低, 为0.918, 但是其校正偏差较小, 仅0.015。各模型的因子数经过比较筛选所得, 以绿原酸为例, 从图 3可知, 当因子数为“1”时, r值为0.808, RMSEC为0.146;当因子数为“2”时, r值为0.963, RMSEC为0.067, 模型得到显著提升, 之后随着因子数增加, 模型性能提升缓慢, 选择尽可能小的因子数以保证模型稳健性, 避免出现“过拟合”现象[22], 因此选择因子数“2”作为绿原酸定量模型的参数。其他3个指标的最优因子数使用同样方法进行选择。
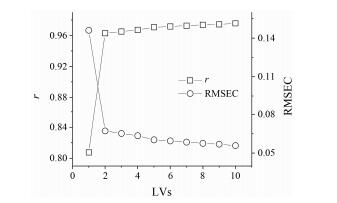
|
Figure 3 Correlation between factors and r and RMSEC of chlorogenic acid model |
| Table 1 Parameters of optimal models for four indexes. RMSEC: Root mean square error of calibration |
以额外2个批次的感冒灵颗粒浓缩液样品对已建立模型进行外部验证集考察, 以RSEP为指标。计算结果显示, 绿原酸、蒙花苷、固含量、相对密度4个模型的RSEP值分别为3.71%、4.28%、4.17%和0.24%。均远小于10%的预测误差, 表明这些模型均具有较高的预测精度。如图 4所示, 通过标准方法测得的值与通过模型预测所得的值所绘制的变化曲线几乎吻合, 表明这些模型可以应用于生产中的实时检测。其中相对密度指标的预测相对标准偏差仅为0.24%, 准确性非常高, 尽管相对密度不是化学成分的指标, 但是可能存在与其相关的共线性的成分。在复杂的近红外光谱之中, 除了化学成分之外, 也包含样品的物理特性信息[23]。
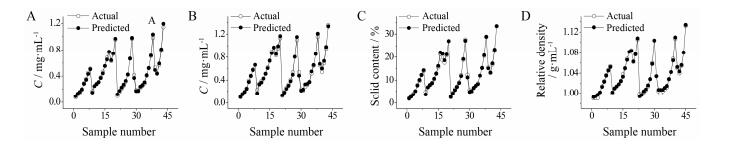
|
Figure 4 External validation results of chlorogenic acid model (A), linarin model (B), solid content model (C), and relative density model (D) |
用于验证模型预测精度的批次样品同时作为近红外光谱检测系统的测试。近红外光谱工作站通过计算样品光谱, 得出4个指标的预测含量, 通过OPC协议传输至自控系统电脑, 以含量变化趋势图的形式, 实时显示于控制界面。系统同时对每一次获得的数据进行记录, 达到生产过程中含量实时监控以及后期产品质量追溯的功能。目前, 许多近红外光谱检测技术的研究多数停留于离线实验或者小规模的模拟实验, 此类实验仅可验证研究对象在近红外光谱快速检测方法中的可行性, 保证对象中的指标可以用于建立准确的定量模型, 但是缺乏实际指导意义, 与真正对生产过程的质量监控仍有一定距离。本研究提出的近红外检测系统能有效应用于感冒灵颗粒生产浓缩过程, 通过过滤器、静态扫描光谱等方法, 克服检测管路中杂质、气泡、流速等干扰因素。通过不同阶段的阀门控制, 保证了检测管路中药液快速更新, 重复循环, 达到了自动化扫描近红外光谱, 并实时预测含量, 上传至控制系统的功能实现。
由于各种因素的变动, 可能造成后期模型性能下降的情况, 影响因素来自于蒸汽压力、真空度等各种工况的变动, 不同季节、不同产地、不同年份获得的药材间的差异等。这些原因都会造成前期建立的定量模型不适用于后期扫描获得近红外光谱, 导致预测精度的下降。因此, 应当定期对模型进行更新维护, 通过获取新样品, 增加至原数据集进行重新建模, 保证此检测系统的准确性[24, 25]。
结论本研究以感冒灵颗粒浓缩过程中的样品为对象, 以近红外光谱法结合自控系统, 建立了用于生产过程中的绿原酸、蒙花苷、固含量、相对密度等4个指标的实时测量系统。实验通过建立的近红外光谱检测管路及信息传输线路, 首先建立了4个指标的偏最小二乘法定量模型, 模型具有较好的相关系数及预测能力, 能够用于浓缩液样品的快速检测。通过导入模型的近红外光谱工作站与自控系统的结合, 系统能实时检测浓缩过程中样品的含量, 并传输至控制系统, 达到监测和控制生产过程的目的。本研究是首次对感冒灵浓缩过程实行近红外光谱在线检测, 也是近红外光谱检测技术与生产控制系统相结合的一次尝试, 对运用过程分析技术提高中药制药行业的质量控制水平具有一定的借鉴意义。
| [1] | Lan LP, Xue M, Gao YL. Research on quality standard of compound Ganmaoling granules[J]. Mod Hosp (现代医院), 2009, 9: 84–86. |
| [2] | Li S, Yang SM. The problems and analysis of a new ver-sion of the GMP in Chinese medicine production enterprises[J]. Chin Pharm (中国药业), 2014, 23: 6–9. |
| [3] | US Food and Drug Administration. Guidance for Industry:PAT-A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance[S]. Rockville, MD:DHHS, 2004. |
| [4] | Bakeev KA. Process Analytical Technology:Spectroscopic Tools and Implementation Strategies for the Chemical and Pharmaceutical Industries[M]. 2nd ed.. Chichester, UK: John Wiley & Sons, 2010. |
| [5] | Jamrógiewicz M. Application of the near-infrared spectroscopy in the pharmaceutical technology[J]. J Pharm Biomed Anal, 2012, 66: 1–10. |
| [6] | Peinado A, Hammond J, Scott A. Development, validation and transfer of a near infrared method to determine in-line the end point of a fluidised drying process for commercial production batches of an approved oral solid dose pharmaceutical product[J]. J Pharm Biomed Anal, 2011, 54: 13–20. DOI:10.1016/j.jpba.2010.07.036 |
| [7] | Ozaki Y. Near-infrared spectroscopy-its versatility in analytical chemistry[J]. Anal Sci, 2012, 28: 545–563. DOI:10.2116/analsci.28.545 |
| [8] | Li W, Cheng Z, Wang Y, et al. Quality control of Lonicerae Japonicae Flos using near infrared spectroscopy and chemometrics[J]. J Pharm Biomed Anal, 2013, 72: 33–39. DOI:10.1016/j.jpba.2012.09.012 |
| [9] | Liu XS, Sun FF, Jin Y, et al. Application of near infrared spectroscopy combined with particle swarm optimization based least square support vactor machine to rapid quantitative analysis of Corni Fructus[J]. Acta Pharm Sin (药学学报), 2015, 50: 1645–1651. |
| [10] | Geng S, Chen Y, Jin Y, et al. Rapid quantitative determina-tion of multi-indicators in Lonicerae Japonicae Flos by near-infrared spectroscopy[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2016, 33: 144–150. |
| [11] | Ferrari M, Quaresima V. A brief review on the history of human functional near-infrared spectroscopy (fNIRS) development and fields of application[J]. Neuroimage, 2012, 63: 921–935. DOI:10.1016/j.neuroimage.2012.03.049 |
| [12] | Ciurczak EW, Igne B. Pharmaceutical and Medical Applications of Near-infrared Spectroscopy[M]. Boca Raton, US: CRC Press, 2014. |
| [13] | Yang L, Li J, Liu CH, et al. Detection of concentration from Epimedium brevicornum Maxim. In processing line with AOTF near-infrared spectroscopy[J]. Chin Med Herald (中国医药导报), 2014, 11: 111–114. |
| [14] | Li WL, Wang Y, Qu HB. Near infrared spectroscopy as a tool for the rapid analysis of the honeysuckle extracts[J]. Vib Spectrosc, 2012, 62: 159–164. DOI:10.1016/j.vibspec.2012.07.005 |
| [15] | Qin BD, Li L, Yang H, et al. Application of OPC technology in near-infrared online intelligent monitoring system in production process of traditional Chinese medicine[J]. Mod Comput, 2011, 7: 023. |
| [16] | Qin BD. Design and Implementation of Online Near-Infrared Quality Surveillance System in Key Productive Processes of TCM (中药关键生产过程在线近红外质量监控系统的设计与实现)[D]. Guilin: Guilin University of Electronic Technology, 2011. |
| [17] | Li H, Goulden M, Cocciardi R, et al. Fourier transform near infrared spectroscopy as a quality control tool for the analysis of lecithin and by-products during soybean oil processing[J]. J Am Oil Chem Soc, 2009, 86: 835–841. DOI:10.1007/s11746-009-1421-4 |
| [18] | Conzen JP. Multivariate Calibration-A Practical Guide for Developing Methods in the Quantitative Analytical Chemistry[M]. Ettlingen, Germany: Bruker Optik GmbH, 2006: 74-79. |
| [19] | Jiang C, Liu Y, Qu H. Data fusion strategy based on near infrared spectra and ultraviolet spectra for simultaneous determination of ginsenosides and saccharides in Chinese herbal injection[J]. Anal Methods, 2013, 5: 4467–4475. DOI:10.1039/c3ay26540d |
| [20] | Sharma S, Goodarzi M, Ramon H, et al. Performance evaluation of preprocessing techniques utilizing expert information in multivariate calibration[J]. Talanta, 2014, 121: 105–112. DOI:10.1016/j.talanta.2013.12.053 |
| [21] | Mehmood T, Liland KH, Snipen L, et al. A review of variable selection methods in partial least squares regression[J]. Chemometr Intell Lab, 2012, 118: 62–69. DOI:10.1016/j.chemolab.2012.07.010 |
| [22] | Gowen AA, Downey G, Esquerre C, et al. Preventing over-fitting in PLS calibration models of near-infrared (NIR) spectroscopy data using regression coefficients[J]. J Chemometr, 2011, 25: 375–381. DOI:10.1002/cem.v25.7 |
| [23] | Burns DA, Ciurczak EW. Handbook of Near-Infrared Analysis[M]. Boca Raton, US: CRC Press, 2007. |
| [24] | Farrell JA, Higgins K, Kalivas JH. Updating a near-infra-red multivariate calibration model formed with lab-prepared pharmaceutical tablet types to new tablet types in full production[J]. J Pharm Biomed Anal, 2012, 61: 114–121. DOI:10.1016/j.jpba.2011.11.003 |
| [25] | Shahbazikhah P, Kalivas JH. A consensus modeling ap-proach to update a spectroscopic calibration[J]. Chemometr Intell Lab, 2013, 120: 142–153. DOI:10.1016/j.chemolab.2012.06.006 |
 2017, Vol. 52
2017, Vol. 52


