2. 中国科学院上海药物研究所, 上海 201203;
3. 苏州泽璟生物制药有限公司, 江苏 昆山 215300
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Suzhou Zelgen Biopharmaceuticals Co., Ltd., Kunshan 215300, China
索拉非尼是德国拜耳公司开发的多靶点抗肿瘤药物。它具有双重的抗肿瘤作用, 一方面通过抑制RAF/MEK/ERK信号传导通路直接抑制肿瘤生长, 另一方面通过抑制VEGFR和PDGFR而阻断肿瘤新生血管的形成, 间接地抑制肿瘤细胞的生长[1]。2005~2007年, FDA先后批准索拉非尼用于治疗晚期肾细胞癌[2]和治疗无法手术切除的肝细胞癌[3]。索拉非尼N-氧化物是人体循环中的主要活性代谢物, 在体外与索拉非尼具有同等的药理活性[4]。
多纳非尼是苏州泽璟生物制药有限公司开发的1.1类化学新药, 将索拉非尼分子上的一个甲基取代为三氘代甲基, 目的是减慢其体内代谢, 获得更好的药动学性质。
已有文献[5-9]报道采用LC-MS/MS法测定人血浆中的索拉非尼。Li等[10]采用LC-MS/MS法同时测定人血浆中的索拉非尼及其N-氧化物。Shimada等[11]采用HPLC-UV法同时测定人血浆中的索拉非尼及其N-氧化物。本文参考上述文献中测定索拉非尼的方法, 对多纳非尼及其N-氧化物的测定进行了方法开发, 旨在建立准确、快速、灵敏的LC-MS/MS法同时测定人血浆中多纳非尼及其N-氧化物, 并将确证后的方法应用于甲苯磺酸多纳非尼片的人体药动学研究。
材料与方法药品和试剂 多纳非尼 (批号026-100-01, 纯度98.6%, 同位素纯度99.9%)、甲苯磺酸索拉非尼 (批号018-070, 纯度99.97%)、多纳非尼N-氧化物 (批号083-90-06, 纯度98.6%, 同位素纯度99.9%)、索拉非尼N-氧化物 (批号092-028-C-7, 纯度99.03%) 均由苏州泽璟生物制药有限公司提供。甲醇及乙腈 (德国Merck公司)、甲酸 (德国Fluka公司)、醋酸铵 (美国ROE公司) 均为色谱纯; 去离子水由法国Millipore超纯水仪制备。人空白血浆由曙光医院临床试验机构提供。
仪器 质谱系统为API 4000型三重四极杆串联质谱仪, 配备电喷雾电离源 (ESI源), 加拿大AB Sciex公司; 采用Analyst 1.5.2数据采集软件, 加拿大AB Sciex公司; 岛津液相色谱系统 (包括DGU-20A3型脱气机, LC-20AD型二元输液泵, SIL-20AC型自动进样器和CTO-20A型柱温箱), 日本岛津公司。
色谱条件 色谱柱为Gemini C18色谱柱 (50 mm × 2.0 mm, 5 μm, 美国Phenomenex公司); 预柱: C18保护柱 (4.0 mm × 3.0 mm, 5 μm, 美国Phenomenex公司); 流动相为: A相 (5 mmol·L-1醋酸铵水溶液, 含0.2%甲酸), B相 (乙腈); 采用的梯度洗脱程序如下: 0~1.0 min, 50% B; 1.0~2.1 min, 50%~95% B; 2.0~3.0 min, 95% B; 3.0~3.1 min, 95%~50% B; 3.1~5.0 min, 50% B (3.1~4.9 min的流速为1.5 mL·min-1)。初始流速为0.7 mL·min-1; 柱温为室温; 进样量为10.0 μL。
质谱条件 离子源为电喷雾电离源 (ESI源); 正离子方式检测; 源喷射电压为4.2 kV; 温度为550 ℃; 离子源气体1 (N2) 压力为345 kPa; 离子源气体2 (N2) 压力为345 kPa; 气帘气体 (N2) 压力为207 kPa; 扫描方式为多反应监测 (MRM), 碰撞气压力为28 kPa; 扫描时间为100 ms。待测物用于MRM检测的定量离子转化为: m/z 468.2 → m/z273.2 (多纳非尼)、m/z 465.2 → m/z 270.2 (索拉非尼)、m/z484.2 → m/z 289.2 (多纳非尼N-氧化物)、m/z 481.2 → m/z 286.2 (索拉非尼N-氧化物)。
标准系列样品和质控样品的制备 分别精密称取多纳非尼和多纳非尼N-氧化物对照品各两份, 用甲醇溶解并定容, 分别获得质量浓度约为1.00 mg·mL-1的多纳非尼和多纳非尼N-氧化物的储备液。一份用于标准系列溶液的配制, 另一份用于质控 (QC) 样品的配制。取多纳非尼和多纳非尼N-氧化物储备液以甲醇-水 (50:50) 稀释, 获得多纳非尼/多纳非尼N-氧化物溶液质量浓度为10.0/2.00、30.0/6.00、100/ 20.0、400/80.0、1 600/320、4 000/800和10 000/2 000 ng·mL-1的混合标准系列溶液。用人空白血浆稀释多纳非尼和多纳非尼N-氧化物QC储备液, 获得质控样品的血浆质量浓度分别为5.00/1.00 ng·mL-1 (定量下限)、10.0/2.00 ng·mL-1 (低浓度)、500/100 ng·mL-1 (中浓度)、4 000/800 ng·mL-1 (高浓度)。
血浆样品预处理 取血浆样品100 μL, 置1.5 mL离心管中。分别加入25.0 μL内标溶液[1 000/200 ng·mL-1的索拉非尼/索拉非尼N-氧化物溶液, 甲醇-水 (50:50) 配制]、50.0 μL甲醇-水 (50:50) 和200 μL乙腈, 涡流1 min, 离心5 min (11 000 r·min-1)。取上清液100 μL, 加入5 mmol·L-1醋酸铵水溶液 (含0.2%甲酸) 100 μL, 涡流混匀, 取10.0 μL进行LC-MS/MS分析。
方法学考察标准曲线和定量下限 系列样品按“血浆样品预处理”项下操作, 以每个待测物浓度为横坐标, 待测物与内标的峰面积比值为纵坐标, 用加权 (W=1/x2) 最小二乘法进行回归运算, 求得标准曲线。取LLOQ血浆样品 (多纳非尼/多纳非尼N-氧化物血浆质量浓度为5.00/1.00 ng·mL-1), 进行6样本分析, 连续测定3天, 并根据当日标准曲线计算每一样本测得浓度, 求得多纳非尼及其N-氧化物的定量下限。
精密度与准确度 取低、中、高3个浓度 (多纳非尼/多纳非尼N-氧化物血浆质量浓度10/2、500/100和4 000/800 ng·mL-1) 的质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行6样本分析, 测定3天。根据当日的标准曲线, 计算QC样品的测得浓度, 根据QC样品结果计算本方法的准确度与精密度。
样品处理回收率 取低、中、高3个浓度的质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行6样本分析。同时另取空白血浆100 μL, 除不加内标溶液外, 按“血浆样品预处理”项下操作, 取全部上清液, 加入相应浓度对照质控溶液 (多纳非尼/多纳非尼N-氧化物的溶液分别是10.0/2.00、500/100和4 000/800 ng·mL-1) 50.0 μL和内标溶液25.0 μL, 涡流1 min后, 取上清液100 μL, 加入5 mmol·L-1醋酸铵水溶液 (含0.2%甲酸) 100 μL, 涡流混匀后进样分析。以每一浓度两种处理方法的峰面积比值计算处理回收率。
基质效应 分别取6个不同来源的人空白血浆和一份溶血空白血浆, 除不加内标溶液外, 按“血浆样品预处理”项下操作, 分取全部上清液, 加入对照质控溶液50.0 μL和内标溶液25.0 μL, 取上清液100 μL, 加入5 mmol·L-1醋酸铵水溶液 (含0.2%甲酸) 100 μL, 涡流混匀后进样分析。同法以水代替空白血浆, 按上述方法处理, 每一浓度进行三样本分析, 获得相应的平均峰面积。以两种处理方法的峰面积比值计算待测物的基质效应。
药动学研究 临床试验经四川大学华西医院伦理委员会批准后实施。6名晚期恶性实体瘤患者, 自愿签署书面知情同意书。受试者于试验前一天清淡饮食后禁食过夜。试验日清晨空腹口服甲苯磺酸多纳非尼片200 mg。在给药前和给药后1.0、2.0、3.0、4.0、6.0、12.0、24.0、48、72、96和120 h静脉取血2 mL。血样在采集后置于含肝素的抗凝管中, 立即在3 000 r·min-1下离心10 min, 获得的血浆样品于-70 ℃冷冻保存。采用Phoenix WinNonlin®6.3 (美国Pharsight公司) 软件以非房室模型对测得的药动学数据进行处理和统计分析。
结果 1 质谱分析在上述质谱条件下, 多纳非尼、多纳非尼N-氧化物、内标索拉非尼和索拉非尼N-氧化物主要生成m/z 468.2、m/z484.2、m/z 465.2、m/z 481.2的[M+H]+峰。选择性对[M+H]+峰进行产物离子扫描, 多纳非尼和内标索拉非尼的主要碎片离子为m/z273.2和m/z 270.2, 多纳非尼N-氧化物和内标索拉非尼N-氧化物的主要碎片离子为m/z 289.2和m/z 286.2, 将这些主要碎片作为定量分析时检测的产物离子。待测物及内标的产物离子扫描质谱图及可能的断裂方式见图 1。

|
Figure 1 The chemical structures and product mass spectra of [M+H]+ ions of donafenib (A), sorafenib (B), donafenib N-oxide (C) and sorafenib N-oxide (D) |
取6个不同来源人空白血浆样品以及相应空白血浆配制的LLOQ样品进行LC-MS/MS分析。与空白对照对比, 空白血浆中的内源性物质不干扰待测物多纳非尼、多纳非尼N-氧化物及内标索拉非尼、索拉非尼N-氧化物的测定。典型色谱图见图 2。

|
Figure 2 Typical MRM chromatograms of donafenib (Ι), sora fenib (ΙΙ), donafenib N-oxide (ΙΙΙ), sorafenib N-oxide (ΙV) in human plasma. A: Blank plasma; B: Blank plasma spiked with 250 ng·mL-1 sorafenib and 50 ng·mL-1 sorafenib N-oxide; C: Blank plasma spiked with 5.00 ng·mL-1 donafenib, 1.00 ng·mL-1 donafenib N-oxide, 250 ng·mL-1 sorafenib and 50 ng·mL-1 sorafenib N-oxide; D: A plasma sample from No.305 patient 3.0 h after oral 200 mg donafenib tosilate tablet |
标准曲线的相关系数 (r2) 均大于0.99。测定人血浆多纳非尼和多纳非尼N-氧化物的线性范围分别为5.00~5 000 ng·mL-1和1.00~1 000 ng·mL-1。典型标准曲线回归方程为:多纳非尼, y=0.000 486 x+ 0.000 437 (r=0.998 4);多纳非尼N-氧化物, y=0.018 5 x+ 0.002 92 (r=0.998 3)。
LLOQ血浆样品 (多纳非尼/多纳非尼N-氧化物血浆质量浓度为5.00/1.00 ng·mL-1) 的多纳非尼的日内精密度为7.5%, 日间精密度为8.0%, 准确度为-2.5%;多纳非尼N-氧化物的日内精密度为9.3%, 日间精密度为7.3%, 准确度为1.6%。结果表明, LC-MS/MS法测定人血浆中多纳非尼和多纳非尼N-氧化物的定量下限分别可达5.00 ng·mL-1和1.00 ng·mL-1。
2.3 精密度与准确度准确度与精密度数据见表 1。每一浓度水平多纳非尼的QC样品的日内精密度 (RSD) 均小于2.7%, 日间精密度 (RSD) 均小于5.2%, 准确度 (RE) 在-5.3%~-1.4%之间; 每一浓度水平多纳非尼N-氧化物的QC样品的日内精密度 (RSD) 均小于3.5%, 日间精密度 (RSD) 均小于5.1%, 准确度 (RE) 在-4.3%~-2.4%之间。待测物低、中、高质控样品的日内和日间的精密度和准确度均符合生物样品测定相关要求[12, 13]。
| Table 1 The intra-and inter-day precision and accuracy data of the QC samples of donafenib and donafenib N-oxide (n=18) |
多纳非尼在低、中、高浓度的回收率分别为89.5%、90.8%和88.6%;多纳非尼N-氧化物在低、中、高浓度的回收率分别为90.2%、91.1%和89.7%。
2.5 基质效应多纳非尼在低、高两浓度经内标校正的基质效应分别为106%和108%, 相对标准差均小于2.5%;多纳非尼N-氧化物在低、高两浓度经内标校正的基质效应分别为93.7%和101%, 相对标准差均小于2.8%。结果表明, 待测物及其内标在本实验选择的色谱和质谱条件下, 可忽略基质效应的影响。
2.6 稳定性已有文献[10, 11]报道索拉非尼及其N-氧化物的稳定性。本文考察了多纳非尼及其N-氧化物低、高两浓度血浆样品在不同储存条件下的稳定性。结果表明, 血浆样品室温放置6 h (多纳非尼和多纳非尼N-氧化物的RE分别在-2.4%~0.6%和-1.3%~0之间); 血浆样品经预处理后室温放置24 h (多纳非尼和多纳非尼N-氧化物的RE分别在-0.6%~0.4%和-1.4%~-1.2%之间); 经历3次冷冻-解冻循环 (多纳非尼和多纳非尼N-氧化物的RE分别为-5.7%~1.4%和3.2%~5.1%之间); -70 ℃放置302天 (多纳非尼和多纳非尼N-氧化物的RE分别为2.5%~3.6%和-9.0%~-5.2%之间); -20 ℃放置245天 (多纳非尼和多纳非尼N-氧化物的RE分别为4.2%~5.8%和-7.8%~-6.0%之间)。在上述条件下, 血浆样品均稳定。
2.7 稀释实验测得多纳非尼的精密度和准确度分别为2.0%和-2.0%。测得多纳非尼N-氧化物的精密度和准确度分别为1.8%和1.3%。结果表明, 人血浆样品经空白人血浆稀释10倍后测定不影响结果的准确度。
3.3 药动学研究将所建立并经过验证的方法应用于甲苯磺酸多纳非尼片的人体药动学研究。受试者单次口服甲苯磺酸多纳非尼片200 mg, 多纳非尼和多纳非尼N-氧化物的平均药时曲线见图 3。
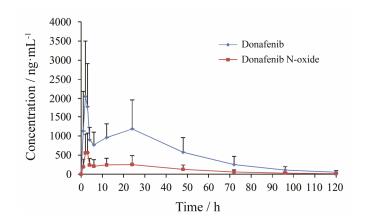
|
Figure 3 Mean plasma concentration-time curves of donafenib and donafenib N-oxide after a single oral dose of 200 mg to 6 patients with cancer |
多纳非尼为索拉非尼的稳定同位素标记物, 多纳非尼N-氧化物为索拉非尼N-氧化物的稳定同位素标记物, 稳定同位素标记物与原形的理化性质相似, 质谱断裂方式相同。所以本实验中将索拉非尼和索拉非尼N-氧化物分别作为待测物多纳非尼和多纳非尼N-氧化物的内标, 减少了基质对于定量测定的影响, 提高了分析结果的准确度与精密度。
本实验考察了甲醇和乙腈作为有机相的分离效果。结果发现, 以乙腈作为有机相, 待测物的分离效果优于甲醇。醋酸铵缓冲液可以稳定流动相的pH值, 使保留时间的重现性良好。在水相中加入一定比例的甲酸, 有助于改善待测物的峰形。采用梯度洗脱, 实现了多纳非尼与多纳非尼N-氧化物同时测定。
通常N-氧化物在强酸或强碱、高温、抗氧化剂存在条件下容易失去氧原子, 转化成原形药物[14]。N-氧化物常常发生源内裂解[15, 16], 而影响原形药物的测定。在本实验条件下, 避免了N-氧化物在离子源内裂解而对多纳非尼测定的影响。经考察, 多纳非尼及其N-氧化物在本实验条件下均稳定。
结论本实验建立了灵敏、准确的LC-MS/MS同时测定人血浆中多纳非尼及其N-氧化物的分析方法, 进行了完整的方法验证, 并成功应用于甲苯磺酸多纳非尼片的人体药动学研究。结果表明, 对于氘代药物, 采用非氘代原形和代谢物作为内标, 非常有利于药动学生物样品分析。
致谢: 四川大学华西医院开展多纳非尼的临床实验。| [1] | Wilhelm S, Carter C, Lynch M, et al. Discovery and devel-opment of sorafenib:a multikinase inhibitor for treating cancer[J]. Nat Rev Drug Discov, 2006, 5: 835–844. DOI:10.1038/nrd2130 |
| [2] | Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear-cell renal-cell carcinoma[J]. N Engl J Med, 2007, 356: 125–134. DOI:10.1056/NEJMoa060655 |
| [3] | Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359: 378–390. DOI:10.1056/NEJMoa0708857 |
| [4] | Keating GM, Santoro A. Sorafenib:a review of its use in advanced hepatocellular carcinoma[J]. Drugs, 2009, 69: 223–240. DOI:10.2165/00003495-200969020-00006 |
| [5] | Zhao M, Rudek MA, He P, et al. A rapid and sensitive method for determination of sorafenib in human plasma using a liquid chromatography/tandem mass spectrometry assay[J]. J Chromatogr B, 2007, 846: 1–7. DOI:10.1016/j.jchromb.2006.06.005 |
| [6] | Jain L, Gardner ER, Venitz J, et al. Development of a rapid and sensitive LC-MS/MS assay for the determination of sorafenib in human plasma[J]. J Pharm Biomed Anal, 2008, 46: 362–367. |
| [7] | Blanchet B, Billemont B, Cramard J, et al. Validation of an HPLC-UV method for sorafenib determination in human plasma and application to cancer patients in routine clinical practice[J]. J Pharm Biomed Anal, 2009, 49: 1109–1114. |
| [8] | Bobin-Dubigeon C, Heurgue-Berlot A, Bouche O, et al. A new rapid and sensitive LC-MS assay for the determination of sorafenib in plasma:application to a patient undergoing hemodialysis[J]. Ther Drug Monit, 2011, 33: 705–710. DOI:10.1097/FTD.0b013e3182357891 |
| [9] | Par D, Le S, Ki W. Development and validation of the determination of sorafenib in human plasma using tandem mass spectrometry coupled with liquid chromatograph[J]. J Life Sci, 2012, 22: 1456–1462. DOI:10.5352/JLS.2012.22.11.1456 |
| [10] | Li L, Zhao M, Navid F, et al. Quantitation of sorafenib and its active metabolite sorafenib N-oxide in human plasma by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2010, 878: 3033–3038. DOI:10.1016/j.jchromb.2010.08.049 |
| [11] | Shimada M, Okawa H, Maejima T, et al. A quantitative HPLC-UV method for determination of serum sorafenib and sorafenib N-oxide and its application in hepatocarcinoma patients[J]. Tohoku J Exp Med, 2014, 233: 103–112. DOI:10.1620/tjem.233.103 |
| [12] | US Food and Drug Administration. Guidance for Industry:Bioanalytical Method Validation (draft)[S/OL]. 2013[2016-09-28]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInforma-tion/Guidances/UCM368107. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInforma%20tion/Guidances/UCM368107.pdf |
| [13] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Vol 4. Beijing: China Medical Science Press, 2015: 363-368. |
| [14] | Li W. Handbook of LC-MS Bioanalysis:Best Practices, Experimental Protocols, and Regulations[M]. Hoboken, New Jersey: John Wiley & Sons, Inc., 2013: 461-470. |
| [15] | Ramanathan R, Su AD, Alvarez N, et al. Liquid chromatography/mass spectrometry methods for distinguishing N-oxides from hydroxylated compounds[J]. Anal Chem, 2000, 72: 1352–1359. DOI:10.1021/ac9911692 |
| [16] | Jemal M, Ouyang Z, Xia YQ. Systematic LC-MS/MS bioanalytical method development that incorporates plasma phospholipids risk avoidance, usage of incurred sample and well thought-out chromatography[J]. Biomed Chromatogr, 2010, 24: 2–19. |
 2017, Vol. 52
2017, Vol. 52


