2. 解放军第302医院, 全军中药研究所, 北京 100039;
3. 成都市食品药品检验研究院, 四川 成都 610045;
4. 成都中医药大学, 药学院, 四川 成都 611137
2. China Military Institute of Chinese Materia Medica, 302 Military Hospital, Beijing 100039, China;
3. Chengdu Institute for Food and Drug Control, Chengdu 610045, China;
4. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
大黄, 又名将军、黄良、火参、肤如, 享有“药中四维”的美誉。大黄为典型的多基原、多功效、多炮制品的中药, 不同来源、不同炮制方法的大黄饮片在临床应用中表现出了较大的疗效差异。目前, 大黄的植物化学[1-3]和药理作用[4-12]研究的较为深入, 但是如何结合临床功效评价大黄的品质——“以效辨品质”、如何结合临床功效发现药效物质基础——“以效寻物质”仍是当今中医药研究的难点和热点。因此, 针对大黄不同的功效建立相应的个性化品质评价方法显得尤为重要。
活血化瘀是大黄的重要功效之一。《神农本草经》曰[13]:主下淤血, 血闭, 寒热, 破症瘕积聚, 留饮, 宿食, 荡涤肠胃, 推陈致新, 通利水杀, 调中化食, 安和五脏, 生山谷。可见古人早已认识到大黄除了具有泻下通便作用之外, 还具有较强的活血化瘀作用。但是有关大黄活血化瘀的研究报道较少[14, 15], 目前还没有方法可以有效的评价其活血化瘀作用的差异。大黄中活血化瘀的药效物质基础尚不清楚, 也没有找到与活血化瘀功效相关联的化学成分作为其质量控制的指标。
现代研究表明[16], 造成血瘀的一个重要因素是由血小板聚集性异常增高所致。因此, 本文从血栓生成机制得到启发, 着眼于大黄活血化瘀功效, 选取与活血化瘀有密切关联的血小板为研究对象, 以血小板最大聚集率为研究指标, 定量的测定大黄体外对血小板聚集的抑制率, 探索建立一种能关联大黄活血化瘀功效的生物效价测定方法, 以期初步探明大黄活血化瘀的药效物质基础, 为建立大黄不同临床功效的品质评价方法奠定基础。
材料与方法仪器与材料 Aggram血小板聚集分析仪 (Helena, USA); 光学系统:镭射光源; 通道:四通道; 波长: 650 nm; 比色管:镀硅的硼硅玻璃比色管 (7.67 mm × 60 mm); 台式低速大容量离心机 (L-550, 湖南湘仪离心机仪器有限公司), 2.7 mL一次性真空采血管 (含有0.109 mol·L-1枸橼酸钠, 美国BD公司); 采血针 (天津哈娜好医材有限公司, 规格: H-5E-1, 批号: 150809) Waters Acquity超高效液相色谱仪 (Waters, USA), 自动进样器, 光电二极管阵列检测器, Empower 2色谱工作站; XS-205电子天平 (Mettler Toldeo), AL-204电子天平 (Mettler Toldeo); 10~100 μL移液枪 (Pipeman); 超声仪 (南京新辰生物科技有限公司, 40 KHz); Milli-Q超纯水制备系统 (Millipore, USA)。
动物与试剂 雄性SD大鼠, SPF级, 体重240~260 g, 动物许可证号: SCXK-(军) 2012-0004。苯巴比妥钠 (Sigma公司), 腺苷二磷酸 (ADP, 购买于美国Helena Lab, 批号: 2-15-551189)。芦荟大黄素-8-O-β-D-葡萄糖苷 (供含量测定以98.61%计)、大黄酸-8-O-β-D-葡萄糖苷 (供含量测定以98.35%计)、大黄酚-8-O-β-D-葡萄糖苷 (供含量测定以98.42%计)、大黄素-8-O-β-D-葡萄糖苷 (供含量测定以98.45%计)、大黄素甲醚-8-O-β-D-葡萄糖苷 (供含量测定以98.41%计) 均由成都克洛玛生物科技有限公司提供。芦荟大黄素 (供含量测定以98.30%计)、大黄酸 (供含量测定以99.21%计)、大黄素 (供含量测定以98.01%计)、大黄酚 (供含量测定以98.58%计)、大黄素甲醚 (供含量测定以99.27%计) 均由成都普瑞法生物科技有限公司提供。色谱级甲醇 (Thermo Fisher Scientific, USA), 色谱级磷酸 ([85% (w/w)], Thermo Fisher Scientific, USA), ACS级Dimethyl sulfoxide (DMSO, AMRESCO)。
大黄供试品 24批次大黄药材采集于四川、青海、甘肃等大黄的主产区, 经解放军第302医院全军中药研究所肖小河研究员鉴定, 确定Rh01~Rh08为唐古特大黄 (Rheum tanguticumMaxim. ex Balf.)、Rh09~Rh20为掌叶大黄 (Rheum palmatum L.)、Rh21~Rh24为药用大黄 (Rheum officinale Baill.)。样品详细采集信息见表 1。取同一批次大黄原药材 (Rh05), 按照2015版《中国药典》大黄项下规定, 炮制成为生大黄、酒大黄、熟大黄和大黄炭。
| Table 1 Detailed information about 24 batches of rhubarb. Rh01-08:Rheum tanguticumMaxim. ex Balf. Rh09-20: Rheumpalmatum L. Rh21-24: Rheum officinale Baill |
乏血小板血浆和富血小板血浆的制备 雄性SD大鼠, 体重240~260 g, 先用苯巴比妥钠 (60 mg·kg-1) 麻醉, 再用2.7 mL真空采血管从腹主动脉取血, 立即置于离心机内在转速800 r·min-1、温度为18~25 ℃模式下离心15 min, 小心吸取上清液置于洁净的5 mL EP管内; 剩余血液重复操作一次, 小心吸取上清液置于前述EP管内, 得到富血小板血浆 (platelet-rich plasma, PRP); 剩余血液在转速3 000 r·min-1模式下离心30 min, 小心吸取上清液置于另一支5 mL EP管内, 得到乏血小板血浆 (platelet-poor plasma, PPP), 备用。PRP和PPP需要保持在18~25 ℃内, 并尽量不要扰动。
诱导剂的制备 每瓶含有200 μmol·L-1腺苷二磷酸, 用去离子水1 mL复溶, 轻轻摇晃直到完全溶解, 作为诱导剂储备液。吸取适量储备液用生理盐水按照1:3的比例稀释储备液, 作为诱导剂工作液。复溶后的储备液保存在2~6 ℃可稳定一周或在-80 ℃下可保存3个月。工作液应在制备后3 h内使用。
大黄供试品的制备 准确称取各批次大黄药材5.0 g, 置于50 mL沸水中煎煮5 min, 过滤, 取滤液进行冷冻干燥, 备用。准确称取不同批次大黄药材的冷冻干燥粉末适量, 用PPP溶解, 作为大黄药材供试品母液。准确称取大黄不同炮制品5.0 g, 置于50 mL沸水中煎煮5 min, 过滤, 取滤液进行冷冻干燥, 备用。准确称取不同炮制品的冷冻干燥粉末适量, 用PPP溶解, 作为大黄炮制品供试品母液。
血小板聚集率的测定 将配制的大黄对照药材溶液和供试品溶液按1:0.6剂间距稀释, 以大黄对照药材溶液 (Rh09) 为对照品组 (standard), 不同批次大黄样品溶液为供试品组 (sample), 按照 (4, 4) 法分别测定对照品组和供试品组含药PRP的血小板最大聚集率 (Max%), 每组平行测定2次。具体操作如下:血小板聚集仪提前开机预热30 min, 待预热完成后, 先用PPP样本400 μL进行透光度调零, 每根玻璃比色管分别加入PRP 125 μL和含药PPP 100 μL混匀 (空白组加入不含药的PPP), 再加入一粒搅拌子, 把比色管放入预备通道内37 ℃预热3 min, 再将玻璃比色管放入经过调零后的检测通道内, 加入ADP诱导剂25 μL, 迅速按下检测按钮进行检测, 待检测完毕后, 记录聚集波形和最大聚集率。检测时限应在血液采集后2 h内完成, 检测室温环境应保持在18~25 ℃内。
大黄药材的活血效价计算方法 血小板聚集率测定过程中, 由于拮抗血小板聚集的药物使血小板最大聚集率降低, 由此可以计算药物对血小板聚集过程的最大抑制程度, 即抑制率, 见公式1。
| $ 药物的抑制率({\rm{\% }}) = \frac{{空白组最大聚集率-给药组最大聚集率}}{{空白组最大聚集率}} \times 100{\rm{\% }} $ | (1) |
根据简化概率单位法的计算原理计算活血效价[17]。由于目前尚无用于活血化瘀生物效价测定的大黄标准对照药材, 实验中对大黄对照药材 (Rh09) 进行原始效价赋值, 定义大黄对照药材效价为10 000 U·g-1, 计算不同批次大黄样品的效价和效价的可信限率 (FL%), 并进行可靠性检验。
超高效液相色谱条件 色谱柱为Waters Acquity BEH C18柱 (2.1 mm × 100 mm, 1.7 μm), 流动相为甲醇 (A) 和0.1%磷酸水溶液 (B) 的混合液, 梯度洗脱条件为: 0~5.00 min, 39%~42% A; 5.01~7.00 min, 42%~51% A; 7.01~12.00 min, 51%~56% A; 12.01~15.00 min, 56%~70% A; 15.01~17.00 min, 70~77% A; 17.01~21.00 min, 77%~78% A; 21.01~25.00 min, 78%~88% A; 流速为0.20 mL·min-1, 检测波长为410 nm, 柱温为30 ℃, 柱平衡时间为5 min。
对照品溶液的制备 精密称取芦荟大黄素-8-O-β-D-葡萄糖苷等10个对照品适量, 用4.0 mL DMSO溶解, 再用甲醇稀释至7.00~60.00 μg·mL-1, 对照品溶液于4 ℃储存备用。
供试品溶液的制备 准确称取各批次大黄粉末0.200 0~0.210 0 g (过4号筛), 精密加入甲醇25 mL, 称定重量, 超声处理60 min (500 W, 40 kHz), 再称定重量, 用甲醇补足遗失的重量。采用0.22 μm微孔滤膜 (Agilent Technologies, USA) 过滤, 取续滤液作为供试品溶液。
供试品的测定 准确吸取以上对照品溶液和供试品溶液各2.0 μL注入超高效液相色谱仪进行测定, 记录色谱图。
结果 1 血小板聚集率测定根据上述测定方法对28批次大黄药材和不同炮制品的拮抗血小板最大聚集率进行测定, 计算得到各个批次大黄药材和炮制品对ADP诱导的血小板聚集的抑制率, 典型的血小板聚集率波形图见图 1。
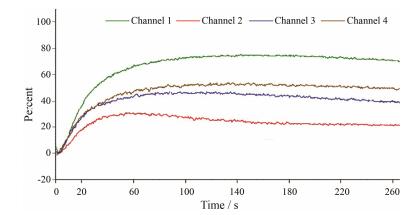
|
Figure 1 Typical oscillogram of platelet aggregation rate. Channel 1: Blank control group; Channel 2-4: Raw rhubarb 15.11, 9.07, 5.44 mg·L-1, respectively |
根据生物检定质反应坐标转换原理, 实验中对对照品组和供试品组的给药剂量和抑制率进行了坐标转换, 如图 2所示。
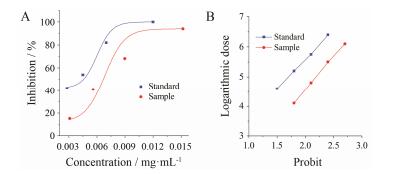
|
Figure 2 Coordinate transformation of qualitative response. A: Relationship between concentration of tested drugs andinhibition rate; B: Relationship between logarithmic doses and probit |
取同一份大黄供试品 (Rh09) 溶液, 按上述方法测定6次其对血小板聚集抑制率, 计算大黄平均活血效价值为9 411 U·g-1, RSD为11.24%。
3.2 重复性考察取同一批大黄样品 (Rh09) 6份, 制成供试品溶液, 按上述方法测定, 计算大黄平均效价值为9348 U·g-1, RSD为9.43%。
3.3 中间精密度考察不同实验室2名不同实验人员在3个不同时间段内, 分别按上述方法重复测定3次, 计算大黄供试品 (Rh09) 平均效价值为9 292 U·g-1, RSD为13.58%, 说明不同实验人员对测定结果影响较小。
3.4 可靠性检验可靠性结果表明, 回归项有非常显著意义 (P < 0.01), 说明随着大黄测试剂量的增加, 大黄对血小板聚集的抑制率有规律地增加; 剂量间差异非常显著 (P < 0.01), 说明大黄测试剂量比例安排合理; 同时偏离平行、二次曲线不显著 (P > 0.05), 说明供试品和对照品呈平行直线关系, 可用 (4, 4) 法检测不同批次大黄的活血效价。
4 大黄供试品活血生物效价的测定 4.1 大黄药材活血生物效价的测定根据上述测定法得到的24批次大黄药材的拮抗血小板最大聚集率, 计算得到各批次大黄药材对血小板聚集的抑制率, 将抑制率和剂量进行坐标转换后, 输入效价计算软件得到各个批次大黄药材的活血效价, 测定结果见表 2。
| Table 2 Biological potency assay results of 24 batches ofrhubarb. aR represents determination of coefficient. b95% FL represents confidence limits |
测定结果显示, 唐古特大黄 (Rh01~Rh08) 的活血效价为3 827~5 982 U·g-1, 掌叶大黄 (Rh09~Rh20) 的活血效价为6 036~9 336 U·g-1, 药用大黄 (Rh21~Rh24) 的活血效价为5 038~6 312 U·g-1。结果表明不同基原、不同产地的大黄药材活血效价存在较大差异:掌叶大黄的活血效价明显高于唐古特大黄和药用大黄, 其中掌叶大黄 (Rh09) 的活血效价可以达到唐古特大黄 (Rh06) 的2.4倍。
4.2 大黄炮制品活血生物效价的测定根据上述方法得到大黄4批不同炮制品对ADP诱导的血小板聚集的抑制率, 将抑制率和剂量进行坐标转换后输入效价计算软件得到大黄不同炮制品的活血效价, 坐标转换和效价计算结果见图 3。
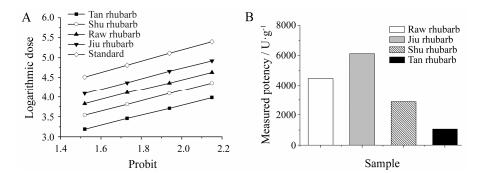
|
Figure 3 Biological potency assay results of different wine processed rhubarb products. A: Relationship between logarithmic doses of different processed rhubarb and probit; B: Results of biological potency assay of different processed rhubarb |
血小板抑制率测定结果显示, 生大黄经过用黄酒炮制之后, 在相同测试浓度下, 酒大黄拮抗血小板聚集显著强于其他炮制品。活血生物效价计算结果显示, 生大黄炮制为酒大黄时, 活血效价由4 490增至6 130 U·g-1, 进一步炮制成为熟大黄时, 活血效价降低为2 887 U·g-1, 进一步炮制成为大黄炭时活血效价降为1 068 U·g-1。此结果与酒大黄长于活血化瘀, 而大黄炭长于凉血止血的功效理论吻合。
5 大黄UPLC色谱指纹图谱的建立将经过积分处理的28批次大黄药材和炮制品的色谱图原始数据导入中药色谱指纹图谱相似度评价系统 (2012版本, 国家药典委员会), 进行峰匹配。结果共有23个色谱共有峰, 其中能够确认的共有10个色谱峰。典型的大黄色谱指纹图谱见图 4。

|
Figure 4 Typical UPLC fingerprint chromatograms of standard solution (A) and Rh01 sample solution (B). 1: Aloe-emodin-8-O-β-D-glucoside; 3: Rhein-8-O-β-D-glucoside; 12: Chrysophanol-8-O-β-D-glucoside; 13: Emodin-8-O-β-D-glucoside; 16: Physcion-8-O-β-D-glucoside: 17: Aloe-emodin; 20: Rhein; 21: Emodin; 22: Chrysophanol; 23: Physcion; others are not identified |
利用SPSS 22.0软件的双变量 (bivariate) 相关分析方法, 分析不同批次大黄供试品的10个共有色谱峰与抗血小板聚集活性指标的相关性, 以皮尔森相关系数 (R) 表示。1、3、12、13、16、20和21号色谱峰与药材活血效价强弱相关显著, 且均呈现正相关关系, 见表 3。
| Table 3 Results of correlation analysis between chromatographic peaks and biological potency. aR represents Pearson correlation coefficient between chromatographic peaks and actical measured biological potency; bP < 0.05 represents the results are statistically different |
选取相关系数最大的3个活性成分大黄酸-8-O-β-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷和大黄酸, 利用其化学单体对照品进行活血效价的测定。
经过文献调研后综合考虑, 以国际公认的抗血小板聚集药物阿司匹林纯品暂定为对照品, 参考生物制品的效价设定, 实验中暂定阿司匹林对照品的活血效价为10 000 U·L·μmol-1。准确称取大黄酸-8-O-β-D-葡萄糖苷等3个化学对照品适量, 用DMSO 50 μL溶解, 混匀, 精确吸取20 μL加入到480 μL PPP中, 吹打均匀, 作为供试品母液。实验过程用PPP逐渐稀释供试品母液进行试验, 直到拮抗血小板聚集率与空白组无明显差异为止。按照上述测定法进行化学单体成分拮抗血小板聚集的最大聚集率测定, 活血效价计算结果见图 5。
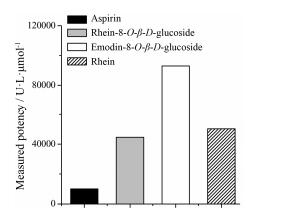
|
Figure 5 Biological potency assay results of rhein-8-O-β-D-glucoside, emodin-8-O-β-D-glucoside and rhein |
测定结果显示, 大黄酸-8-O-β-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷在最大溶解浓度时, 对ADP诱导的血小板聚集具有很强的拮抗作用, 大黄酸在nmol·L-1浓度水平即显现出较强的活血作用, 活血效价测定结果与谱效相关分析结果一致, 提示大黄酸-8-O-β-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷和大黄酸等3种化学成分能够作为反映大黄活血化瘀功效的优质性评价的指标性成分, 这与课题组前期研究结果相吻合[18]。值得注意的是, 大黄酸的起效浓度远远低于阿司匹林的起效浓度, 提示大黄酸等游离蒽醌化合物有望开发成为新的抗血小板聚集药物。
讨论根据本文建立的活血生物效价测定方法, 对28批次的大黄药材和炮制品进行了活血生物效价的测定。测定结果表明不同来源的大黄药材和不同的炮制品之间存在较大的品质差异: ①掌叶大黄的活血效价普遍高于唐古特大黄和药用大黄; ②活血化瘀是酒大黄的重要功效, 但是由于目前酒大黄中活血化瘀功效的药效物质基础尚不清楚, 阻碍了酒大黄的质量评控。本文建立的基于测定血小板聚集率模型的活血生物效价检测方法对于酒大黄的炮制过程中的质量控制具有一定的参考价值; ③同一基原的唐古特大黄 (Rh01~Rh08) 的活血效价也具有一定的差异, 从最低3 827至最高5 982 U·g-1, 可见除了基原等因素之外, 生长环境、年限、栽培/野生等其他因素也会影响大黄的品质, 进一步提示对大黄质量一致性评价的重要性。
对大黄化学指纹图谱和生物活性的相关性分析后, 本文选取了相关系数最大的3个成分化学单体对照品进行活血效价的测定, 验证谱效相关分析结果的准确性。结果表明三者均具有较强的抑制血小板聚集的作用, 大黄素-8-O-β-D-葡萄糖苷活血作用强于大黄酸的活血作用, 但是结合型蒽醌糖苷类化合物在人体不易吸收, 在肠道内容易被细菌转化为游离型蒽醌衍生物, 因此大黄发挥活血化瘀功效的药效物质可能是大黄酸等游离型蒽醌衍生物。
中药品质评控方法的建立应符合中药多功效的特点, 定量测定其中的一个或几个化学成分并不能全面有效的表征中药的整体品质[19-21]。例如2015版《中国药典》中以盐酸水解后的游离蒽醌总量作为大黄质量合格性的评价指标[22], 但是游离蒽醌的含量多寡并不能反应大黄泻下、活血化瘀功效的强弱, 也就无法保障临床用药的安全性和有效性。另外, 现行的中药质量评价标准中测定的化学成分大多数并不是药材的药效成分或专属性成分。例如2015版《中国药典》中大黄、何首乌、虎杖等中药均以定量测定大黄素的含量作为质量评价指标[22], 而大黄素是否为泻下 (大黄)、解毒消痈截疟 (何首乌)、散瘀止痛 (虎杖) 等功效的药效物质基础, 目前并无明确科学证据。针对现行中药质量评控模式的局限性, 综合分析中药、化学药和生物制品的质量评控模式的利弊[23], 课题组提出“应借鉴生物制品质量评控模式, 建立基于临床功效为导向的中药质量评价模式”, 并以大黄为模式药, 建立了基于泻下生物效价检测的大黄品质评价方法[24]。本文建立了基于活血化瘀生物效价检测的大黄品质评价方法, 初步证实了不同来源的大黄存在较大的品质差异, 为大黄的临床精准用药提供了数据参考, 同时为其他多功效中药的品质评控提供了新的思路和方法。
| [1] | Zhen JH, Guo DA. Modern Research on Rhubarb (大黄的现代研究)[M]. Beijing: Peking University Medical Press, 2007: 251-346. |
| [2] | Fu XS, Chen F, Liu XH, et al. Progress in research of chemical constituents and pharmacological actions of rhubarb[J]. Chin J New Drugs (中国新药杂志), 2011, 20: 1535–1538. |
| [3] | Gao LL. Studies on the Chemical Constituents and Biological Activity of Rheum tanguticum Maxim. ex Balf., Rheum officinale Baill. and Rheum palmatum L (唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究)[D]. Beijing:Peking Union Medical College, 2012. |
| [4] | Jin L. Pharmacological action and clinical application progress of rhubarb[J]. Guide China Med (中国医药指南), 2013, 11: 487–488. |
| [5] | Agarwal SK, Sudhir S, Sushma V, et al. Antifungal activity of anthraquinone derivatives from Rheum emodi[J]. J Ethnopharmacol, 2000, 72: 43–46. DOI:10.1016/S0378-8741(00)00195-1 |
| [6] | Lin CW, Wu CF, Hao NW, et al. Aloe-emodin is an interferon-inducing agent with antiviral activity against Japanese encephalitis virus and enterovirus[J]. Int J Antimicrob Agents, 2008, 32: 355–359. DOI:10.1016/j.ijantimicag.2008.04.018 |
| [7] | Ga oD, Xiao XH, Wang JB, et al. Rhubarb anthraquinones protect rats against mercuric chloride (HgCl2)-induced acute renal failure[J]. Molecules, 2016, 21: 298. DOI:10.3390/molecules21030298 |
| [8] | Zhang ZH, Vaziri ND, Wei F, et al. An integrated lipidomics and metabolomics reveal nephroprotective effect and biochemical mechanism of Rheum officinale in chronic renal failure[J]. Sci Rep, 2016, 6: 2215. |
| [9] | Zheng L. The research progress of rhubarb treatment of chronic renal failure[J]. World Latest Med Inf (世界最新医学信息文摘), 2015, 15: 133–134. |
| [10] | Zhao YL, Wang JB, Xiao XH, et al. Investigations of free anthraquinones from rhubarb against α-naphthylisothiocyanate-induced cholestatic liver injury in rats[J]. Basic Clin Pharmacol Toxicol, 2009, 104: 463–469. DOI:10.1111/pto.2009.104.issue-6 |
| [11] | Raal A, Pokk P, Arend A, et al. trans-Resveratrol alone and hydroxystilbenes of rhubarb (Rheum rhaponticum L.) root reduce liver damage induced by chronic ethanol administration:a comparative study in mice[J]. Phytother Res, 2009, 23: 525–532. DOI:10.1002/ptr.v23:4 |
| [12] | Dong GZ, Lee YI, Jeong JH, et al. Stilbenoids from Rheum undulatum protect hepatocytes against oxidative stress through AMPK activation[J]. Phytother Res, 2015, 29: 1605–1609. DOI:10.1002/ptr.5442 |
| [13] | Huang J. Sheng Nong Herbal Classic (神农本草经)[M]. Beijing: Traditional Chinese Medicine ancient books Publishing House, 1980: 67. |
| [14] | Huang ZD, Jiang ML, Yi YK, et al. Effects of processed Radix Salviae Miltiorrhizae and Radix et Rhizoma Rhei with wine on functions of blood platelet and anticoagulation of rat[J]. Chin Tradit Pat Med (中成药), 2001, 23: 341–342. |
| [15] | Liu X. Studies of HPLC Fingerprint Electropherogram of Rhubarb and Rhubarb Stir-fried with Wine's Pharmacological Action Position Which Relates to Activating Blood Circulation to Dissipate Blood Stasis (大黄和酒大黄活血祛瘀药理作用部位的HPLC指纹图谱研究)[D]. Chengdu: Chengdu University of Technology, 2008. |
| [16] | Ma M. Resecarch of Microscopic Mechanism of Formation of Blood Stasis Syndrome Type (血瘀证形成的微观机理研究)[D]. Jinan: Shandong Traditional Chinese Medicine University, 2003. |
| [17] | Zhou HJ. Drug Biological Analysis (药品生物检定)[M]. Beijing: People's Medical Publishing House, 2005: 127-134. |
| [18] | Wang JB, Zhang XR, Xiao XH, et al. Rationality of commercial specification of rhubarb based on chemical analysis[J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 470–475. |
| [19] | Zhang HZ, Xiao XH, Wang JB, et al. Consistency of efficacy-equivalent:key essential point of quality control for Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 1571–1575. |
| [20] | Liu ZJ, Shi ZL, Tu Can, et al. An activity-calibrated chemical standardization approach for quality evaluation of Salvia miltiorrhiza Bge[J]. RSC Adv, 2017, 7: 5331–5339. DOI:10.1039/C6RA26281C |
| [21] | Zhang HZ, Liu DH, Zhang DK, et al. Quality assessment of Panax notoginseng from different regions through the analysis of marker chemicals, biological potency and ecological factors[J]. PLoS One, 2016, 11: 0164384. |
| [22] | China Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. 2015 ed.. Beijing: China Medical Science Press, 2015: 23-209. |
| [23] | Zhang HZ, Xiao XH, Wang JB, et al. Consistency of efficacy-equivalent:key essential point of quality control for Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 1571–1575. |
| [24] | Li HF, Wang JB, Xiao XH, et al. Methodological study on quality evaluation of rhubarb based on purgative bioassay[J]. China J Chin Mater Med (中国中药杂志), 2008, 33: 1309–1312. |
 2017, Vol. 52
2017, Vol. 52


