人绒促性素 (human chorionic gonadotrophin, hCG), 又称人绒毛膜促性腺激素, 是人胎盘滋养层分泌的一种促性腺激素。注射用人绒促性素属国家基本药物, 在临床用于不孕症、黄体功能不足、功能性子宫出血、先兆性流产或习惯性流产等。在国内外已上市销售的hCG包括从尿中提取纯化的u-hCG和通过DNA重组技术表达的r-hCG。无论u-hCG还是r-hCG, 均由α亚基和β亚基非共价组成。从生物学功能上看, α亚基与信号传导、亚基折叠有重要关系[1, 2], 而β亚基与hCG体内清除及体内生物活性密切相关[3, 4]。因此, 治疗用hCG须以全蛋白的形式才具有预期的药效, 而游离α亚基或游离β亚基可能会失去其生物学活性。根据文献报道, 蛋白在高盐[5]、高温[6]、酸性[7]、光照[8]等条件下, 其亚基容易发生解离从而使其活性受到影响。因此, hCG会由于上述因素可能在生产、运输、货架期过程中产生解离亚基, 从而影响产品的有效性甚至安全性。
对于hCG的质量控制, 在各国药典的各论中有一些基本的控制。2015年版中国药典各论中, 对尿源hCG产品相关杂质 (包括解离亚基) 未做要求。国内外文献[9-11]有一些深入研究的报道, 如使用反向液相色谱 (RP-HPLC)、分子排阻色谱 (SEC-HPLC)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE)、等电聚焦 (IEF) 等方法对产品的杂质及批间一致性进行评价; 但少有提及对解离亚基的控制, 主要原因之一是缺乏稳定可靠的定量测定方法。hCG在有机溶剂、酸、高温等条件下均容易发生解离[2], 因此RP-HPLC因有机溶剂的使用不适用于解离亚基的测定; SEC-HPLC则因全蛋白与两种亚基 (及其他工艺或产品相关物质) 分子量接近而难以实现有效分离[11]; SDS-PAGE的方法是蛋白分析的经典方法, 但使用考马斯亮蓝染色的方法灵敏度较低, 而银染等染色方法灵敏度较高但准确度和精密度却难以用于定量分析。对于其他蛋白的解离亚基分析, 文献中曾使用凝胶电泳[12]、质谱[13]、光散射及X射线衍射等[8]技术进行表征研究, 但并不能满足制药行业对解离亚基含量作为常规质控的要求。本文采用的十二烷基硫酸钠-毛细管电泳法 (CE-SDS) 使用高精密度的全自动毛细管电泳仪, 具有高的分离度、精密度、灵敏度和准确性。在生物制药领域, 如单克隆抗体药物, CE-SDS法被广泛用于质量控制[14, 15]。
本文为了实现对r-hCG中解离亚基含量的控制, 通过优化样品处理方法和电泳分离条件, 并经过方法学验证, 建立了定量分析r-hCG解离亚基的CE-SDS方法。应用CE-SDS测定法, 对本单位生产的r-hCG的纯化工艺和制剂工艺过程中间品的解离亚基进行监控, 指导工艺开发。此外, 该方法亦可使用于u-hCG和重组人促卵泡激素 (r-FSH) 的解离亚基检测。
材料与方法试剂 分离胶为SDS-MW凝胶溶液购于Sciex公司 (原Beckman, 美国); 50 μm内径熔融石英毛细管购于Sciex公司或Polymicro Technologies (Molex, 美国)。样品 (制备) 缓冲液、酸洗液 (0.1 mol·L-1 HCl)、碱洗液 (0.1 mol·L-1 NaOH) 为自制, 所使用其他化学试剂均为分析纯, 超纯水为Milli-Q制备。
仪器 PA800 plus毛细管电泳仪 (美国Sciex公司), 配备二极管阵列检测器及32Karat数据处理工作站。Mini-PROTEAN Tetra凝胶电泳系统 (美国Bio-Rad公司), 配备制胶装置、电源、垂直电泳槽等。Agilent 1200高效液相色谱 (美国Agilent公司), 配备VWD检测器及Chem Station工作站。
样品 r-hCG重组人绒促性素为自产或购自默克-雪兰诺 (商品名:艾泽), u-hCG尿源人绒促性素购买自中国食品药品检定研究院 (绒促性素标准品) 或由丽珠制药厂 (注射用绒促性素) 提供, r-FSH重组人促卵泡激素购自默克-雪兰诺 (商品名:果纳芬)。
RP-HPLC 选用美国Sepax公司Bio-C18色谱柱 (250 mm × 4.6 mm, 5 μm); 设定流速0.8 mL∙min-1, 检测波长214 nm, 柱温35 ℃。使用梯度洗脱, 流动相B在28 min内从20%至40%。流动相A: 0.1% TFA, 100%超纯水; 流动相B: 0.1% TFA, 100%乙腈。在反向液相色谱中, 通过流分收集, 经浓缩及置换溶剂, 获得完全解离的α亚基、β亚基。将获得的流分重新进行RP-HPLC分析, 两亚基具有很好的纯度。
电泳样品制备 样品制备:取r-hCG 45 μg, 加样品缓冲溶液至100 μL, 暂存于10 ℃待检。含4%解离亚基样品制备 (系统适应性样品):取r-hCG样品溶液, 沸水浴加热10 min, 冷却至室温, 取4μL与新制r-hCG溶液96 μL混合。其他含不同比例解离亚基样品的制备, 可按比例进行调整。
CE-SDS 设置毛细管温度为20 ℃, 样品盘温度为10 ℃。PDA波长为220 nm, 带宽为10 nm。样品分析方法:依次设置如下, 使用碱洗液在70 psi (1 psi ≈ 6.9 kPa) 冲洗3 min, 酸洗液在70 psi冲洗1 min, 超纯水在70 psi冲洗1 min, SDS-MW凝胶溶液在70 psi冲洗10 min进胶, 超纯水中蘸洗毛细管2次, 然后在10 kV反相电极中进样20 s, 超纯水中蘸洗毛细管1次, 最后在15 kV 20 psi反相电极中电泳分离40 min。
样品制备缓冲体系优化 配制并考察不同样品制备缓冲体系 (Tris-盐酸缓冲、磷酸缓冲、硼酸硼砂缓冲、碳酸缓冲体系); 然后配制考察pH值为6、7、8、9、10, 盐浓度为20、50、100、150、200 mmol·L-1 Tris-盐酸缓冲, 以及添加0.2%、0.5%、1%、2%、5% SDS对分离的影响。
电泳分离条件优化 分别考察分离高压为10、15、20和25 kV, 分离温度为15、20、30、40和50 ℃, 毛细管有效长度为10、20、30和40 cm。
SDS-PAGE 按“电泳样品制备”方法制备含解离亚基为0%、0.5%、1%、5%、10%、100%的r-hCG样品, 采用5%浓缩胶10%分离胶的聚丙烯酰胺凝胶, 每孔上样10 μL (约4 μg), 在Tris-甘氨酸缓冲体系中进行电泳分离。凝胶根据需要进行考马斯亮蓝染色或银染染色。
制剂筛选 将r-hCG通过超滤置换至一定浓度的磷酸缓冲液中 (pH 6.5~7.5, 含蔗糖), 即配方1;或超滤置换至不含蔗糖的相同缓冲溶液中, 即配方2。在两种配方中的r-hCG放入经过校验的培养箱中, 40 ℃温育0~1个月后待检。
结果 1 CE-SDS方法建立及验证 1.1 CE-SDS方法建立 1.1.1 解离α亚基和β亚基的确认将使用RP-HPLC制备获得的纯α亚基、β亚基进行CE-SDS分析, 确认CE-SDS中α亚基、β亚基及全蛋白的迁移时间。
1.1.2 实验条件优化选定通过考察不同缓冲体系、pH范围、缓冲盐浓度范围、SDS浓度范围等进行样品制备体系及分离条件优化, 选定样品制备缓冲液为100 mmol·L-1 Tris-盐酸缓冲液 (pH 9.0), 含1% SDS; 选择电泳分离电压为15 kV, 毛细管温度为20 ℃, 毛细管长30 cm (有效长度20 cm)。
1.2 CE-SDS方法验证 1.2.1 专属性样品 (制备) 缓冲溶液、r-hCG制剂缓冲溶液在亚基及全蛋白处均无吸收峰。添加4%解离亚基 (解离α亚基和解离β亚基占总蛋白的量) 的r-hCG样品, α亚基与β亚基、β亚基与全蛋白的分离度均大于1.5, 该方法具有很好的专属性。
1.2.2 精密度不同分析人员在3天里分别每次制备3个含约4%总解离亚基的r-hCG样品。结果表明, 全蛋白含量RSD < 0.5%, 解离α亚基和解离β亚基等低含量组分RSD均小于10%, 方法的精密度良好。
1.2.3 准确度制备含解离亚基为0.5%、1%、2%、4%、6%、8%和10%的r-hCG样品, 进行CE-SDS分析 (n=3)。图 1A为选取其中一次的1%~10%解离亚基添加的CE-SDS电泳图, 可见α亚基、β亚基的峰面积随总添加量显著增加。将样品总解离亚基峰面积百分比实测值与总解离亚基理论添加量作比值, 计算回收率。测得当总解离亚基添加量1%~10%时, 回收率在80%~120% (表 1)。

|
Figure 1 Representative electrophorograms (A) of spiked samples with 0-10% dissociated subunits from bottom to top, and Calibration curves (B) of the peak areas (y-values) of α-subunit (×) and β-subunit (▼) over concentrations (x-values) of 1%-10% total spiked dissociated subunits. Peak areas are expressed as mean±SD (n=3) |
| Table 1 Recovery of spiked samples (n=3) |
在总解离亚基添加量为1%~10%内, 分别以α亚基和β亚基的峰面积 (纵坐标) 与总添加量 (横坐标) 进行线性拟合 (图 1B)。α亚基的线性回归方程为: y=616 853 x+ 138 (r2=0.999), β亚基的线性回归方程为: y=940 114 x+ 3 321 (r2=0.984)。
1.2.5 定量限当总解离亚基为1%时, α亚基 (0.4%) 测定的信噪比为10, 同时具有很好的精密度 (n=3, RSD < 10%) 与准确度 (回收率=118%)。定量限以α亚基计算, 相当于蛋白总量的0.4%, 即2 μg∙mL-1。
1.3 SDS-PAGE当SDS-PAGE使用考马斯亮蓝染色时, 全蛋白及低含量解离亚基均几乎不可见。仅当使用银染时有较强的显色。如图 2所示, 解离亚基的黑度在一定程度上随含量递增, α亚基仅在2%总解离亚基水平能重复观察。因此, SDS-PAGE的方法可用于r-hCG的限度或半定量分析, 其检出限为2%总解离亚基, 或以α亚基计算相当于蛋白总量的0.8%。
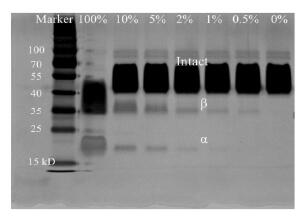
|
Figure 2 SDS-PAGE analysis with silver staining of r-hCG spiked with 0.5%-10% dissociated subunits. Numbers on the top indicate the percentage of spiked dissociated subunits. α-and β-subunit could be observed when more than 2% dissociated subunits were spiked |
通过细胞培养获得的产品, 在经过工艺步骤1 (step 1) 时含约3%总解离亚基 (及少量其他杂质), 在工艺步骤2时解离亚基被去除约1%, 到工艺步骤3时解离亚基被全部去除, 最终收获的原液 (drug substance) 不含解离亚基 (表 2)。结果表明, 本方法能对hCG纯化工艺进行有效监控, 精确评估每一步工艺对解离亚基的清除效率。
| Table 2 Dissociated subunit content as determined by CE-SDS during process development and stability study. ND: Not detected |
采用40 ℃高温破坏性实验, 产品在配方1 (Lot 1) 和配方2 (Lot 2) 中储存, 均逐渐产生解离亚基; 但在配方2中生成解离亚基的速率显著高于配方1, 至30天时配方2为21%, 配方1为5%。因此可判定配方1在维持r-hCG亚基稳定性中更为有效 (表 2)。在选定配方1后进行正式稳定性研究中, 在4 ℃冷藏保存6个月及-20 ℃冷冻保存24个月, 产品均未检出解离亚基。结果表明, 方法可用于稳定性研究, 以评估产品的有效期及研究降解路径。
2.2 CE-SDS分析尿源人绒促性素 (u-hCG) 与重组人促卵泡激素 (r-FSH) 2.2.1 u-hCG如图 3A曲线3所示, u-hCG产品中发现含有较大量的解离亚基, 特别是解离β亚基, 及其他未知低分子量物质。与r-hCG相比, u-hCG含有大量的解离亚基及其他杂质, 而r-hCG产品在有效期内均几乎不含解离亚基。鉴于尿源hCG单位重量活性远低于重组hCG, 大量的解离亚基可能是其比活性较低的一个重要原因。
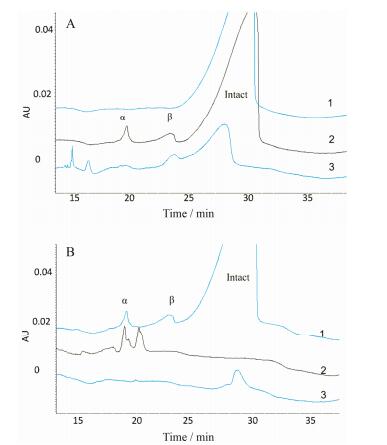
|
Figure 3 CE-SDS analysis of subunit dissociation of u-hCG (A) and r-FSH (B). A: Compared with intact r-hCG (A1) and r-hCG spiked with dissociated subunits (A2), u-hCG (A3) had much more content of dissociated subunits and unknown low-molecular-weight species. B: r-FSH was analyzed directly (B3) or under condition that all intact protein was dissociated (B2). Compared with r-hCG spiked with dissociated subunits (B1) and forced dissociated r-FSH (B2), native r-FSH (B3) might have little dissociated subunit |
采用与hCG相同的CE-SDS方法分析测定r-FSH。当不经加热处理时, 全蛋白迁移时间与r-hCG相当 (图 3B曲线3);当经沸水浴加热后, r-FSH发生解离 (图 3B曲线2), 同样产生α亚基和β亚基。由于FSH与hCG的α亚基氨基酸序列相同, 两者迁移时间基本一致, 而β亚基氨基酸序列不同, 两者迁移时间则有一定差异。从图 3可知, 本r-FSH产品解离亚基含量基本低于检出限。对u-hCG与r-FSH的分析, 反映了本方法对不同类型促性腺激素药物解离亚基测定的普遍适用性, 另一方面也证实了解离亚基的普遍存在。
讨论考虑到解离亚基对hCG生物学活性的潜在影响, 作者曾测定尿素变性解离后r-hCG ( > 95%解离) 的生物学活性, 发现其几乎丧失促小鼠卵巢增重的功能。基于这个发现, 建立解离亚基含量的定量测定方法在这类生物制品中显得尤为重要。
在方法建立过程中, 本文考察了不同缓冲体系、pH范围、缓冲盐浓度范围、SDS浓度范围对分离的影响。实验观察到Tris-盐酸缓冲液与磷酸缓冲液较优; 盐浓度较大或pH较低时抑制进样, 降低灵敏度。同时, 对毛细管电泳分离条件进行优化, 并观察到电压越高、温度越高、毛细管越短, 分析时间越短; 但同时分离度或基线噪音可能随之变差。综合考虑分离度、进样量、缓冲能力、分离时间等选定当前条件。实验中还发现hCG在制备过程中对温度较为敏感, r-hCG全蛋白与样品缓冲混合后30 ℃、1 h检出少量解离亚基, 沸水浴10 min完全解离, 应注意控制制备条件。
然而, 即使进行了上述优化, 仍发现β亚基与全蛋白有较显著的前伸。作者认为该现象可能与hCG复杂的糖基化有关。β亚基有2个N-糖和4个O-糖修饰, 根据文献报道, 蛋白的糖基化可能显著影响电泳行为, 包括使亚基电泳峰 (或条带) 展宽、分子量偏移、产生多个电泳峰 (或条带)[16, 17]。进一步优化分离条件, 特别是对商品化分离胶配方的优化选择, 可能改善分离。尽管如此, 目前这种影响在解离亚基含量较低时也相对较小。系统的方法学验证结果表明, 在总解离亚基1%~10%内, 该CE-SDS方法具有较好的专属性、精密度、准确度、线性, 满足产品质量控制的要求。相对于文献报道的结构表征类方法, 以及本文建立的SDS-PAGE方法, CE-SDS方法更能有效分离并准确定量hCG的各解离亚基。
结论综上所述, 本文通过优化样品制备及电泳分离条件, 建立并验证了定量分析hCG解离亚基的CE-SDS方法。方法可应用于不同厂家、不同生产工艺、不同来源 (尿源、重组) 的hCG的质量研究与控制, 甚至推广到其他促性腺激素 (如FSH) 解离亚基的分析。该方法被证明适用于指导工艺开发、制剂筛选及产品稳定性研究等质量控制。因此对于hCG这类生物制品的解离亚基含量测定, 本文建立的CE-SDS方法将是其中最快速有效的定量工具。
致谢: 本单位工艺开发部门的丁建坤、卢懿在工艺研究样品的提供, 临床前研究部门的陈序在生物测定法研究中给予帮助。| [1] | Matzuk MM, Boime I. The role of the asparagine-linked oligosaccharides of the alpha subunit in the secretion and assembly of human chorionic gonadotrophin[J]. J Cell Biol, 1988, 106: 1049–1059. DOI:10.1083/jcb.106.4.1049 |
| [2] | Carvalho CM, Oliveira JE, Almeida BE, et al. Efficient isolation of the subunits of recombinant and pituitary glycoprotein hormones[J]. J Chromatogr A, 2009, 1216: 1431–1438. DOI:10.1016/j.chroma.2008.12.096 |
| [3] | Fares FA, Suganuma N, Nishimori K, et al. Design of a long-acting follitropin agonist by fusing the C-terminal sequence of the chorionic gonadotropin beta subunit to the follitropin beta subunit[J]. Proc Natl Acad Sci U S A, 1992, 89: 4304–4308. DOI:10.1073/pnas.89.10.4304 |
| [4] | Fares F. The role of O-linked and N-linked oligo-saccharides on the structure-function of glycoprotein hormones:development of agonists and antagonists[J]. Biochim Biophys Acta, 2006, 1760: 560–567. DOI:10.1016/j.bbagen.2005.12.022 |
| [5] | Mio K, Ogura T, Kiyonaka S, et al. Subunit dissociation of TRPC3 ion channel under high-salt condition[J]. J Electron Microsc, 2007, 56: 111–117. DOI:10.1093/jmicro/dfm012 |
| [6] | Tolan DR, Schuler B, Beernink PT, et al. Thermodynamic analysis of the dissociation of the aldolase tetramer substituted at one or both of the subunit interfaces[J]. Biol Chem, 2003, 384: 1463–1471. |
| [7] | Zhao MM, Yuan BB, Luo DH, et al. Subunit dissociation of soybean protein isolates in acid conditions[J]. J South China Univ Sci Technol Nat Sci Ed (华南理工大学学报自然科学版), 2011, 39: 22–27. |
| [8] | Conrad KS, Bilwes AM, Crane BR. Light-induced subunit dissociation by a light-oxygen-voltage domain photoreceptor from Rhodobacter sphaeroides[J]. Biochemistry, 2013, 52: 378–391. DOI:10.1021/bi3015373 |
| [9] | van de Weijer BH, Mulders JW, Bos ES, et al. Compo-sitional analyses of a human menopausal gonadotrophin preparation extracted from urine (menotropin). Identification of some of its major impurities[J]. Reprod Biomed Online, 2003, 7: 547–557. DOI:10.1016/S1472-6483(10)62071-8 |
| [10] | Wolfenson C, Groisman J, Couto AS, et al. Batch-to-batch consistency of human-derived gonadotrophin preparations compared with recombinant preparations[J]. Reprod Biomed Online, 2005, 10: 442–454. DOI:10.1016/S1472-6483(10)60819-X |
| [11] | Zheng LX, Shi ZW, Wu LH, et al. Study on the purity determination of chorionic gonadotrophin for injection[J]. Chin J Pharm Anal (药物分析杂志), 2012, 32: 333–336. |
| [12] | Shoemaker CJ, Eyler DE, Green R. Dom34:Hbs1 pro-motes subunit dissociation and peptidyl-tRNA drop-off to initiate no-go decay[J]. Science, 2010, 330: 369–372. DOI:10.1126/science.1192430 |
| [13] | Boeri Erba E, Ruotolo BT, Barsky D, et al. Ion mobility-mass spectrometry reveals the influence of subunit packing and charge on the dissociation of multiprotein complexes[J]. Anal Chem, 2010, 82: 9702–9710. DOI:10.1021/ac101778e |
| [14] | Nunnally B, Park SS, Patel K, et al. A series of collabora-tions between various pharmaceutical companies and regulatory authorities concerning the analysis of biomolecules using capillary electrophoresis[J]. Chromatographia, 2006, 64: 359–368. DOI:10.1365/s10337-006-0003-y |
| [15] | Shi Y, Li Z, Lin J. Advantages of CE-SDS over SDS-PAGE in mAb purity analysis[J]. Anal Methods, 2012, 4: 1637–1642. DOI:10.1039/c2ay25208b |
| [16] | Bharadwaj D, Harris RJ, Kisiel W, et al. Enzymatic re-moval of sialic acid from human factor IX and factor X has no effect on their coagulant activity[J]. J Biol Chem, 1995, 270: 6537–6542. DOI:10.1074/jbc.270.12.6537 |
| [17] | Garcia-Campayo V, Sugahara T, Boime I. Unmasking a new recognition signal for O-linked glycosylation in the chorionic gonadotropin beta subunit[J]. Mol Cell Endocrinol, 2002, 194: 63–70. DOI:10.1016/S0303-7207(02)00189-2 |
 2017, Vol. 52
2017, Vol. 52


