2. 四川大学 华西医院生物治疗国家重点实验室, 四川 成都 610041
2. State Key Laboratory of Biotherapy, West China Hospital, Sichuan University, Chengdu 610041, China
RAF-MEK-ERK通路是细胞凋亡通路中重要成员。其中, MEK是一种可磷酸化靶蛋白上丝氨酸/苏氨酸和酪氨酸残基的双特异性激酶, MEK作为MAPK通路关键激酶, 近年来受到越来越多的关注与研究[1]。MEK抑制剂通过下调MEK的自身活性, 抑制异常的RAS和RAF对MEK的过度激活, 降低整条MAPK通路的活性[2], 起到抑制肿瘤细胞增长的目的。利用MEK抑制剂来干预肿瘤的发生和发展已经成为现实, 曲美替尼作为第一个上市的MEK抑制剂, FDA于2013年5月批准其用于治疗伴有BRAF V600E或V600K突变的不可切除或转移性黑色素瘤[3]。MEK抑制剂的研究已经成为肿瘤治疗领域的重要研究内容[4]。
现有激酶抑制剂大部分属于ATP竞争性抑制剂, 而MEK蛋白激酶抑制剂由于活性区域的结构特点, 可以考虑设计ATP非竞争性抑制剂, 期待能避免由于激酶在ATP口袋的高度同源性而引发抑制剂不可预测的多激酶抑制不良反应, 已公布的相关研究结果也证明了这一点:一些ATP非竞争性抑制剂临床前及临床试验均显示较好的肿瘤抑制活性, 并且较少存在多激酶同时抑制的情况[5], 是MEK作为肿瘤治疗药物研发重要靶点的原因之一。
已报道的MEK小分子抑制剂从与靶点结合特点的角度考虑可以分为3类:第1类是由辉瑞公司开发的PD系列 (如CI1040[6]、PD0325901等) 及罗氏公司开发的G系类化合物[7, 8], 这类化合物主要占据MEK的A、C结合区域, 小分子在C结合区域含有肟基、羰基、双羟基。双羟基与ATP的γ-磷酸残基形成氢键来稳定复合物的结合能力。第2类化合物是由日本中外制药株式会社研发的CH系列[9], 如CH4858060、CH4858061、CH4987655、CH5126766, 该类化合物相比第一类化合物增加了B结合区域的占据, 在C结合区域仍然保留了羰基、肟基、羟基等典型基团, 取得了不错的临床效果。其中化合物CH5126766放弃了C结合区域, 在B结合区域做了更多的尝试, 占据了该区域的更多空间。第三类化合物以葛兰素史克公司研发的系列小分子和拜尔公司研发的系列抑制剂为代表, 这类抑制剂相比于第二类抑制剂简化了C结合区域的基团, 只保留较短的基团链。该系列化合物具有很好的抑制活性, 上市的药物有曲美替尼 (GSK1120212)。部分化合物分子结构见图 1~5。
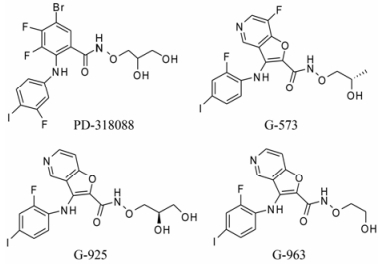
|
Figure 1 Structures of PD-318088 and G series of compounds |
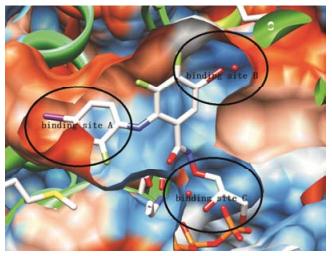
|
Figure 2 PD318088 and MEK protein complexes (PDBID: 1S9J)[10] |
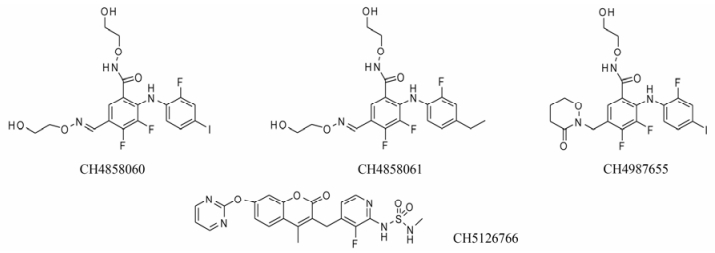
|
Figure 3 Structures of some CH series compounds |
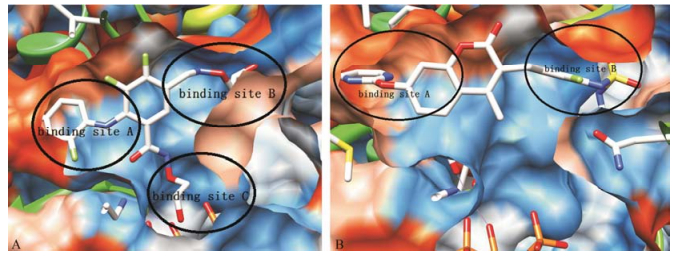
|
Figure 4 Crystal complex of MEK and CH4858061 (A) and MEK and CH5126766 (B) |

|
Figure 5 Sructure of trametinib (GSK1120212) |
PD系列抑制剂是前期开发MEK小分子抑制剂的通用结构模型, 它们与蛋白的结合呈“7”型形态, 当研究者发现在B结合区域有很大的空间, 它们开始兼顾A、B、C结合区域, 设计出与蛋白呈“T”型结合的系列小分子。随着研究的深入, 简化甚至放弃结合区域C处的基团, 重点考虑与蛋白A、B结合区域的作用, 这一设计思路被提出, 于是与MEK蛋白呈“一”型形态结合的小分子开始出现。目前大多数早期上市MEK抑制剂在给药一段时间后, 普遍产生强烈的耐药性。但是CH系列中的CH5126766小分子并没有产生同样的耐药性[11], 该小分子与MEK蛋白的结合呈“一”型形态, 且相比于同系列中小分子, 该小分子强化了与蛋白B结合区域的作用。CH5126766设计的成功, 说明“一”型形态小分子的设计策略是可行的, 蛋白B结合区域可能与耐药性有关。
相比与“经典”结合, 与MEK蛋白结合位点呈“一”型结合形态的小分子抑制剂很少, 且早期的小分子抑制剂对B结合区域研究较少, 而B结合区域又与耐药性有很大的关系。综上提出如下设计思路:小分子主要占据MEK蛋白的A、B结合区域, 放弃或者简化C区域的占据, 重点考察小分子在蛋白B结合区域变化对生物活性的影响, 希望获得非ATP竞争、低耐药性的高效MEK抑制剂。
通过分子模拟和对接, 确定了已报道的活性较好的小分子抑制剂与MEK蛋白A、B、C结合区域的作用特点。结合区域A:放置用小基团 (如卤素、甲基等) 单取代或二取代的苯环。用碘原子取代的苯环占据结合区域A效果较好, 它能与MEK蛋白上的氨基酸残基Val128、Lys98形成卤键作用。结合区域A、B过渡区:采用单或者稠合的芳香杂环占据, 着重考虑氨基酸残基Ser213和Val212。结合区域B:引入长的基团链和环状基团。研究发现, MEK蛋白B结合区域的Ser223是RAF激活MEK的重要磷酸化位点, 小分子抑制剂与MEK蛋白B区域的Asn222和Ser223形成作用力, 可以克服小分子的耐药性, 因此氨基酸残基Ser223与Asn222是重点考虑的氨基酸 (图 6)。
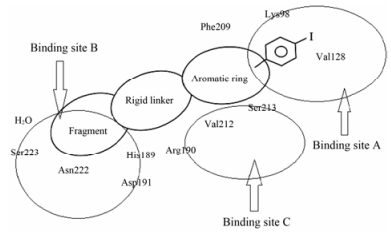
|
Figure 6 Design strategy of target compounds |
根据上述设计思路, 参考已报道小分子与MEK蛋白作用特点, 设计了200多个化合物。
分别将这200多个化合物与MEK蛋白进行对接, 根据以下挑选原则最终选定了10个化合物进行合成。① Autodock对接结果分析, 小分子能够很好地匹配在P1、P2、P3及P4区域, 化合物主要构型簇的平均结合能及预测的Ki值要足够低; ②对关键位点、关键氨基酸的占据要符合期望; ③选取的化合物符合类药性五规则。最终选择合成的这10个化合物为全新化合物, 未见文献报道, 其中化合物1~6主要与MEK呈“一”型结合形态, 占据MEK蛋白的A、B结合区域。嘧啶类即化合物7~10占据MEK蛋白A、B结合区域外, 还占据了部分C结合区域。
目标化合物1~10的合成过程见合成路线1。化合物1~6以5-硝基吲哚为起始原料, 用对碘苄溴取代吲哚氮上的活泼氢原子得到化合物15, 化合物15发生付克酰基化反应得到化合物16, 化合物16发生还原反应得到化合物17, 化合物17与二氯乙基氨基发生合环反应得到化合物18, 化合物18发生缩合反应得到各个目标化合物。化合物7~10以6-氯嘌呤为起始原料, 经过取代反应和缩合反应得到各个目标化合物。
结果与讨论 1 化合物的合成目标化合物的结构经NMR的验证, 其理化性质见后文实验部分。
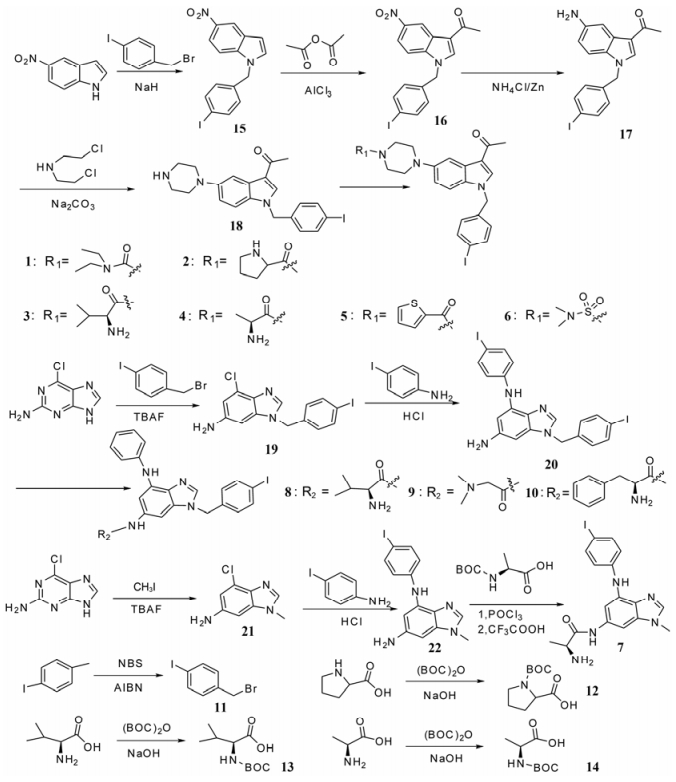
|
Scheme1 Synthetic route of target compounds |
目标化合物1~10的抗肿瘤活性见表 1。采用MTT法对10个化合物进行了初步活性测定, 结果表明化合物对4个细胞系均表现出了较高的抑制率, 其中化合物4、6、7、8、10的表现尤为突出。有些化合物对细胞株表现出一定的选择性, 化合物2对人肺癌细胞株A549的抑制率达到了80%, 但对人胰腺癌细胞PANC-1却没有抑制效果。化合物9对人神经癌细胞SY5Y有较好的抑制效果, 但对其他3个细胞株的抑制效果相比对人神经癌细胞的抑制效果要差很多。
| Table 1 In vitro inhibition of MCF-7, PANC-1, SY5Y, and A549 |
所设计的化合物都用碘苯占据MEK的A结合区域, 采用芳香环和刚性连接子过渡到MEK的B结合区域, B结合区域基团的变化为影响活性数值的主要因素。对活性较好的化合物4、6、7、8、10进行对接分析, 发现化合物4、7、8、10与MEK蛋白B结合区域的Asn222形成了稳定的氢键作用, 并且与Ser223形成了疏水作用, 这可能是它们活性优于其他化合物的主要原因。化合物6在MEK的B结合区域采用磺酰胺基类基团占据, 有文献报道这类化合物对MEK有特殊的抑制活性[12], 通过对接分析, 推测这与Arg190形成的稳定氢键有关, 但由于样本太少, 需要进一步研究才能证实。
4 小结从初步的活性结果可知, 设计与蛋白呈“一”型结合的小分子抑制剂是可行的。MEK蛋白B结合位点上的氨基酸Asn222、Ser223对小分子活性及耐药性影响较大, 且围绕B位点设计的酰胺类是很好的骨架。放置碘原子取代的苯环占据A位点与Val128形成卤键是合理的策略。本文设计的吲哚骨架和嘧啶骨架是很好的骨架, 对此骨架进行优化和改造以获得更好活性的小分子抑制剂未来值得研究。
实验部分1H NMR与13C NMR采用Varian Unity NOVA400/ 54和Bruker Ac-E200核磁共振仪测定; 熔点测定使用XT-4双目显微熔点测试仪; 柱色谱所用硅胶G/H为青岛海洋化工厂所生产; 薄层色谱板产于青岛海洋化工厂; 所用化学试剂来自成都贝斯特有限责任公司和天津希恩思生化科技有限公司, 溶剂均为分析纯, 来自成都科龙化工试剂厂。抗肿瘤活性实验所用的人乳腺癌细胞MCF-7、人胰腺癌细胞PANC-1、人神经癌细胞株SY5Y、人肺癌细胞A549来自上海细胞库。
1 化学合成 1.1 化合物11的合成取对碘甲苯436 mg (2.0 mmol)、AIBN (偶氮二异丁腈, 0.1 mmol) 加入到50 mL单口圆底反应瓶中, 加入四氯化碳20 mL, 取NBS (N-溴代丁二酰亚胺) 373 mg (2.1 mmol) 加入到反应瓶中, 80 ℃回流反应, 过夜 (12 h以上)。反应结束后, 室温冷却, 减压蒸馏除去溶剂, 加入乙酸乙酯 (EA) 溶解, 旋干, 柱色谱纯化得粉红色固体化合物582 mg, 收率98%[13]。
1.2 化合物12~14的合成取脯氨酸230 mg (2.0 mmol) 于25 mL单口圆底反应瓶中, 加入5 mL水, 搅拌; 称量 (Boc)2O 650 mg (3.0 mmol), 溶解于5 mL四氢呋喃中, 加入反应瓶; 称取氢氧化钠176 mg (4.4 mmol) 加到反应瓶中; 室温搅拌13 h后减压旋蒸除去溶剂, 加5 mL水, 用1 mol·L-1的盐酸溶液调节pH=1~2, EA萃取3次, 合并有机相, 旋干的粗品422 mg, 得白色粉末12, 收率98%。Boc-缬氨酸 (13)、Boc-丙氨酸 (14) 的制备方法同Boc-脯氨酸的制备, 产物均为白色粉末, 收率分别为97%、98%。
1.3 化合物15的合成取5-硝基吲哚324 mg (2.0 mmol) 放入25 mL单口圆底反应瓶中, 加入无水四氢呋喃5 mL, 冰浴下搅拌10 min, 称取氢化钠 (60%) 96 mg (2.4 mmol) 缓慢加入到反应瓶中, 冰浴下搅拌5 min, 室温下搅拌30 min。取对碘苄溴730 mg (2.4 mmol) 溶于5 mL无水四氢呋喃中, 冰浴条件下缓慢滴加到反应瓶中, 大约30 min, 滴加完撤去冰浴, 室温下反应16 h后, 减压旋蒸除去溶剂, 加入EA溶解, 倒入冰水中, EA层用饱和氯化钠溶液洗涤两次, 合并所有水层并用EA萃取两到三次, 合并所用EA层, 旋干, 柱色谱纯化, 得到黄色固体718 mg, 收率95%[14]。
1.4 化合物16的合成取无水二氯甲烷15 mL加入到100 mL磨口圆底烧瓶中, 取无水氯化铝2.825 g (18 mmol), 快速加入到反应瓶中, 冰浴条件下搅拌5 min; 取醋酸酐1.081 g (9 mmol) 冰浴条件下滴加到反应瓶中, 约40 min滴加结束, 在冰浴条件下搅拌30 min; 取化合物15 1.081 g (3 mmol) 滴加到反应瓶中, 约30 min滴加完毕, 室温下反应2 h。TLC (PE:EA=3:1) 监测反应进程。反应结束后加入二氯甲烷30 mL稀释反应液, 冰饱和食盐水洗涤两次, 收集所有水层, EA萃取两次, 收集所有有机层, 柱色谱纯化, 得深黄色固体1.071 g, 收率85%[15]。1H NMR (600 MHz, CDCl3) δ 9.28 (s, 1H, Ar-H), 8.13 (d, J=9.0 Hz, 1H, Ar-H), 7.85 (s, 1H, Ar-H), 7.69 (d, J=8.4 Hz, 2H, Ar-H), 7.30 (d, J=9.0 Hz, 1H, Ar-H), 6.89 (d, J=7.8 Hz, 2H, Ar-H), 5.36 (s, 2H, Bn-H), 2.06 (s, 3H, COCH3)。
1.5 化合物17的合成分别取化合物16、氯化铵、锌粉: 1.840 g (4.3 mmol)、2.385 g (43.0 mmol)、2.925 g (43.0 mmol), 加入到100 mL单口圆底烧瓶中; 取50 mL甲醇、5 mL水混合后倒入反应瓶中; 搅拌回流反应16 h。TLC (PE:EA=1:2) 监测反应进程, 反应结束后, 自然冷却至室温, 减压旋蒸除去溶剂, 加入乙酸乙酯溶解固体, 加入饱和碳酸氢钠溶液, 充分搅拌30 min; 减压过滤, 用乙酸乙酯充分洗涤固体残渣, 至滴下的EA无色为止; 收集有机相, 饱和食盐水洗涤两次; 收集水层, EA萃取两次; 合并有机层, 旋干, 柱色谱纯化, 得887 mg深红色固体, 收率53.1%[16]。
1.6 化合物18的合成分别取化合物17、双 (2-氯乙基) 氨基: 780 mg (2.0 mmol)、390 mg (2.2 mmol), 加入到50 mL单口圆底烧瓶中, 加入正丁醇, 称取碳酸钠42 mg加入到反应瓶中, 120 ℃搅拌回流反应; 反应24 h后加入碳酸钠粉末42 mg; 反应48 h后再次加入碳酸钠粉末42 mg; 反应72 h后TLC检测反应进度, 反应进行4~6天。反应完全后, 自然冷却到室温, 减压旋蒸除去溶剂, 加入二氯甲烷20 mL溶解; 用pH=1的盐酸溶液洗涤4次, 合并水层; 搅拌下向水层中缓慢加入氢氧化钠, 调节pH至13左右, 用二氯甲烷萃取5次; 合并有机层旋干, 柱色谱纯化, 得棕色固体413 mg, 即化合物18, 收率53%[17]。
1.7 目标化合物1、5的合成分别称取化合物18、研磨后的碳酸钾粉末: 121 mg (0.3 mmol)、24 mg (0.2 mmol) 加入到25 mL单口圆底烧瓶中; 加入适量无水二氯甲烷, 室温搅拌10 min; 取二乙胺基甲酰氯40 mg (0.3 mmol) 滴加到反应瓶中, 室温搅拌3 h。反应完全后减压旋干反应液, EA溶解, 饱和食盐水洗涤2~3次, 萃取水层2次, 合并有机层, 旋干后柱色谱纯化, 制得暗红色固体123 mg, 即化合物1, 收率85%, 熔点92~93 ℃。1H NMR (400 MHz, CDCl3) δ 7.96 (s, 1H, Ar-H), 7.69 (s, 1H, Ar-H), 7.32 (m, 2H, Ar-H), 7.19 (d, J=9.2 Hz, 1H, Ar-H), 7.14 (d, J=6.0 Hz, 1H, Ar-H), 7.01 (d, J=8.4 Hz, 1H, Ar-H), 5.03 (s, 1H, Bn-H), 3.38 (m, 4H, piperazine-H), 3.25 (m, 4H, -CH2-), 2.20 (m, 4H, piperazine-H), 2.48 (s, 3H, COCH3), 1.15 (t, J=8.0 Hz, 6H, -CH3); 13C NMR (100 MHz, CDCl3) δ 193.00 (C=O), 164.43 (C=O), 138.00 (Ar-C), 135.77 (Ar-C), 135.15 (Ar-C), 132.31 (Ar-C), 128.93 (Ar-C), 128.09 (Ar-C), 127.171 (Ar-C), 126.84 (Ar-C), 116.93 (Ar-C), 116.33 (Ar-C), 110.33 (Ar-C), 109.21 (Ar-C), 50.96 (-CH2-), 50.74 (2C, piperazine-C), 47.19 (2C, piperazine-C), 41.71 (-CH2-), 21.41 (-CH2-), 13.16 (-CH3)。
目标化合物5的制备同上, 暗红色固体, 收率83%, 熔点142~143 ℃。1H NMR (400 MHz, CDCl3) δ 8.00 (s, 1H, Ar-H), 7.71 (s, 1H, Ar-H), 7.47 (d, J=4.0 Hz, 1H, Ar-H), 7.33 (d, J=8.0 Hz, 2H, Ar-H), 7.29 (s, 1H, Ar-H), 7.21 (d, J=12 Hz, 1H, Ar-H), 7.15 (d, J=8 Hz, 2H, Ar-H), 7.07 (t, J=4.0 Hz, 1H, Ar-H), 7.03 (s, 1H, Ar-H), 5.32 (s, 1H, Bn-H), 3.94 (s, 4H, piperazine-H), 3.26 (s, 4H, piperazine-H), 2.49 (s, 3H, COCH3); 13C NMR (100 MHz, CDCl3) δ 193.07 (C=O), 163.65 (C=O), 147.73 (Ar-C), 135.78 (Ar-C), 135.33 (Ar-C), 132.66 (Ar-C), 129.04 (Ar-C), 129.94 (Ar-C), 128.681 (Ar-C), 128.21 (Ar-C), 127.28 (Ar-C), 126.92 (Ar-C), 126.72 (Ar-C)117.05 (Ar-C), 116.420 (Ar-C), 110.80 (Ar-C), 109.92 (Ar-C), 51.49 (2C, piperazine-C), 50.85 (2C, piperazine-C), 29.68 (-CH2-), 27.07 (-CH3)。
1.8 目标化合物2~4的合成分别称取化合物12、EDCI (1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺盐酸盐)、HOBT (1-羟基苯并三唑): 215 mg (1 mmol)、230 mg (1.2 mmol)、162 mg (1.2 mmol), 将三者加入到单口圆底反应中瓶, 加入无水二氯甲烷, 室温搅拌1 h; 称取200 mg (0.4 mmol) 化合物18, 加入到反应瓶中, 室温搅拌12 h。反应完全后加入少量二氯甲烷稀释, 饱和氯化钠溶液洗涤3次, 水层用EA萃取2次, 合并有机相, 减压旋干, 柱色谱纯化, 制得145 mg灰白色固体Boc-2, 收率为62%。将Boc-2加入到10 mL单口圆底反应瓶, 量取2 mL无水二氯甲烷加入到反应瓶中, 冰浴下搅拌, 量取三氟乙酸2 mL加入到反应瓶中, 冰浴搅拌30 min, 室温搅拌7 h。反应完全后减压蒸馏除去溶剂, 加入二氯甲烷溶解, 饱和碳酸氢钠洗涤3次, 水层用二氯甲烷萃取两次, 合并有机相, 柱色谱制得113 mg的浅黄色固体, 即化合物2, 收率85%, 熔点117~118 ℃。1H NMR (400 MHz, CDCl3) δ 7.94 (s, 1H, Ar-H), 7.69 (s, 1H, Ar-H), 7.30 (d, J=8.0 Hz, 2H, Ar-H), 7.17 (d, J=8.0 Hz, 1H, Ar-H), 7.11 (d, J=4.0 Hz, 1H, Ar-H), 6.95 (d, J=8.0 Hz, 1H, Ar-H), 5.28 (s, 1H, Bn-H), 3.99 (m, 1H, CO-H), 3.76 (m, 2H, NHC-H), 3.64~3.01 (m, 8H, piperazine-H), 2.45 (s, 3H, COCH3), 2.17~1.65 (m, 4H, -CH2-); 13C NMR (100 MHz, CDCl3) δ 192.97 (C=O), 170.21 (C=O), 138.00 (Ar-C), 147.53 (Ar-C), 135.69 (Ar-C), 135.60 (Ar-C), 128.94 (Ar-C), 128.12 (Ar-C), 127.16 (Ar-C), 126.83 (Ar-C), 116.92 (Ar-C), 116.39 (Ar-C), 110.76 (Ar-C), 109.89 (Ar-C), 57.99 (-CH2-), 51.24 (piperazine-C), 51.06 (piperazine-C, 50.76 (piperazine-C), 47.14 (piperazine-C), 45.21 (-CH2-), 42.54 (-CH2-), 30.52 (-CH3), 27.388 (-CH2-), 25.72 (-CH2-)。
目标化合物3的制备同上, 浅黄色固体, 收率81%, 熔点100~101 ℃。1H NMR (400 MHz, CDCl3) δ 7.97 (s, 1H, Ar-H), 7.71 (s, 1H, Ar-H), 7.29~7.36 (m, 2H, Ar-H), 7.19 (d, J=8.0 Hz, 1H, Ar-H), 7.14 (d, J=6.0 Hz, 2H, Ar-H), 6.97~7.00 (m, 1H, Ar-H), 5.30 (s, 1H, Bn-H), 3.89 (m, 1H, CO-H-NH2), 3.78~3.63 (m, 4H, piperazine-H), 3.23~3.08 (m, 4H, piperazine-H), 2.49 (s, 3H, COCH3), 1.91 (m, 1H, -CH-), 1.03~0.92 (m, 6H, -CH3); 13C NMR (100 MHz, CDCl3) δ 192.98 (C=O), 173.11 (C=O), 147.73 (Ar-C), 135.72 (Ar-C), 135.25 (Ar-C), 132.54 (Ar-C), 128.96 (Ar-C), 128.17 (Ar-C), 127.23 (Ar-C), 126.85 (Ar-C), 116.97 (Ar-C), 116.39 (Ar-C), 110.74 (Ar-C), 109.70 (Ar-C), 55.94 (-CH2-), 51.60 (piperazine-C), 51.14 (piperazine-C), 50.79 (piperazine-C), 45.53 (piperazin-C), 42.19 (-CH2-), 31.89 (-CH2-), 27.39 (-CH3), 20.05 (-CH3), 16.52 (-CH3)。
目标化合物4的制备同上, 浅黄色固体, 收率82%, 熔点130~131 ℃。1H NMR (400 MHz, CDCl3) δ 7.95 (s, 1H, Ar-H), 7.70 (s, 1H, Ar-H), 7.32 (d, J=4.0 Hz, 2H, Ar-H), 7.19 (d, J=8.8 Hz, 1H, Ar-H), 7.14 (d, J=7.2 Hz, 2H, Ar-H), 6.97 (d, J=8.8 Hz, 1H, Ar-H), 5.30 (s, 1H, Bn-H), 3.95 (d, J=6.0 Hz, 1H, CO-H-NH2), 3.79 (s, 2H, piperazine-H), 3.64 (s, 2H, piperazine-H), 3.18 (m, 4H, piperazine-H), 2.68 (s, 3H, COCH3), 1.33 (d, J=6.4 Hz, 1H, -CH3); 13C NMR (100 MHz, CDCl3) δ 193.02 (C=O), 173.85 (C=O), 147.72 (Ar-C), 135.71 (Ar-C), 135.29 (Ar-C), 132.58 (Ar-C), 128.98 (Ar-C), 128.16 (Ar-C), 127.21 (Ar-C), 126.87 (Ar-C), 116.98 (Ar-C), 116.40 (Ar-C), 110.75 (Ar-C), 109.81 (Ar-C), 51.41 (-CH2-), 51.15 (piperazine-C), 50.80 (piperazine-C), 46.82 (piperazine-C), 45.20 (piperazin-C), 42.26 (-CH2-), 27.40 (-CH2-), 20.99 (-CH3)。
1.9 目标化合物6的合成取化合物95 mg (0.2 mmol) 的化合物18, 溶于无水二氯甲烷的单口圆底反应瓶中, 置于冰浴下, 二甲胺基磺酰氯43 mg (0.3 mmol) 滴加到反应瓶中, 约20 min滴加完毕, 冰浴下搅拌30 min。反应完全后用二氯甲烷稀释, 饱和食盐水洗涤2次, 二氯甲烷萃取水层3次, 收集有机相, 旋干, 柱色谱纯化制得酒红色固体化合物6, 重100 mg, 收率88%, 熔点96~97 ℃。1H NMR (400 MHz, CDCl3) δ 7.98 (s, 1H, Ar-H), 7.71 (s, 1H, Ar-H), 7.33 (d, J=7.2 Hz, 2H, Ar-H), 7.19 (d, J=8.8 Hz, 1H, Ar-H), 7.14 (d, J=6.8 Hz, 1H, Ar-H), 6.98 (d, J=8.4 Hz, 1H, Ar-H), 5.31 (s, 1H, Bn-H), 3.42 (t, J=4.0 Hz, 4H, piperazine-H), 3.23 (t, J=4.0 Hz, 4H, piperazine-H), 2.87 (s, 6H, -CH3), 2.48 (s, 3H, COCH3); 13C NMR (100 MHz, CDCl3) δ 193.00 (C=O), 147.68 (Ar-C), 135.75 (Ar-C), 135.27 (Ar-C), 132.64 (Ar-C), 129.00 (Ar-C), 128.17 (Ar-C), 127.22 (Ar-C), 126.88 (Ar-C), 117.01 (Ar-C), 116.53 (Ar-C), 110.75 (Ar-C), 109.94 (Ar-C), 51.06 (-CH2-), 50.82 (piperazine-C), 46.43 (piperazine-C), 38.24 (-CH2-), 29.64 (-CH2-), 27.42 (-CH3)。
1.10 化合物19、21的合成分别取6-氯嘌呤、对碘苄溴: 200 mg (1.29 mmol)、540 mg (1.81 mmol) 加入到反应瓶, 乙腈作溶剂, 常温下搅拌15 min; 将溶于乙腈的四丁基氟化铵570 mg (TBAF, 2.20 mmol) 滴入反应液中, 反应48 h。后处理:将反应液旋干, 溶于EA, 用饱和NaCl水溶液洗3次, 取有机层, 旋干后柱色谱分离, 得化合物19, 重290 mg, 黄色固体, 收率为63.4%。
化合物21的反应步骤同上, 收率52.3%。
1.11 化合物20、22的合成分别取化合物19、对碘苯胺: 410 mg (1.01 mmol)、270 mg (1.2 1 mmol) 于反应瓶中, 加入THF 12 mL做溶剂, 搅拌溶解, 滴入两滴浓盐酸, 68 ℃下回流5 h后反应完全。后处理:将反应液旋干, 用EA溶解, 加入1 mol·L-1 K2CO3水溶液搅拌30 min, 置于分液漏斗, 取有机层并用饱和NaCl水溶液洗3遍, 旋干, 柱色谱分离得化合物20, 淡红色固体510 mg, 收率为85.1%。
化合物22的反应步骤同上。
1.12 目标化合物7、8、10的合成分别取化合物20、Boc-缬氨酸: 120 mg (0.21 mmol)、40 mg (0.25 mmol) 溶于吡啶, 置于-15 ℃的冰盐浴中20 min, 滴加POCl360 mg (0.39 mmol), 冰盐浴中反应30 min。后处理:将反应液倒入冰水中, 搅拌。静置至室温, 加入EA, 用饱和NaCl洗, 取有机层旋干。后加入无水二氯甲烷3 mL, 置于冰浴, 滴入三氟乙酸3 mL。反应约3 h。将反应液旋干, 用10 mL EA溶解, 饱和NaHCO3水溶液洗3遍, 饱和NaCl水溶液洗3遍, 取有机层, 旋干, 柱色谱分离。得化合物8, 淡黄色粉末90 mg, mp 116~117 ℃, 收率为62.3%。1H NMR (600 MHz, DMSO-d6) δ 10.07 (s, 1H, NH), 8.30 (s, 1H, N=C-H), 8.15 (d, J=8.4 Hz, Hz, 2H, Ar-H), 7.71 (d, J=7.8 Hz, 2H, Ar-H), 7.58 (d, J=8.4 Hz, 2H, Ar-H), 7.12 (d, J=8.4 Hz, 2H, Ar-H), 5.34 (s, 1H, -CH2), 2.05 (t, 1H, -CH), 0.95 (d, J=6.6 Hz, 3H, -CH3), 0.85 (d, J=6.6 Hz, 3H, -CH3); 13C NMR (100 MHz, DMSO-d6) δ 173.39 (C=O), 152.05 (Purine-C), 151.65 (Purine-C), 150.77 (Purine-C), 141.29 (Purine-C), 140.02 (Purine-C), 137.72 (Ar-C), 137.63 (Ar-C), 137.11 (Ar-C), 137.02 (Ar-C), 136.92 (Ar-C), 129.93 (Ar-C), 122.91 (Ar-C), 122.7 (Ar-C), 116.92 (Ar-C), 94.14 (Ar-C), 85.73 (Ar-C), 60.47 (-CH), 45.81 (-CH2), 31.44 (-CH), 19.90 (-CH3), 16.96 (-CH3)。
化合物10的制备方法同上, 淡黄色粉末, 收率为51.7%, mp 113~114 ℃。1H NMR (400 MHz, DMSO-d6) δ 10.94 (s, 1H, NH), 8.30 (s, 1H, N=C-H), 8.16 (d, J=8.8 Hz, 2H, Ar-H), 7.71 (d, J=8.4 Hz, 2H, Ar-H), 7.60 (d, J=8.8 Hz, 2H, Ar-H), 7.27 (m, 4H, Ar-H), 7.19 (m, 1H, Ar-H), 7.12 (d, J=8.0 Hz, 2H, Ar-H), 5.33 (s, 1H, -CH2), 3.72 (s, 1H, -CH), 3.09 (m, 1H, -CH2), 2.68 (m, 1H, -CH2); 13C NMR (100 MHz, DMSO-d6) δ 172.96 (C=O), 152.04 (Purine-C), 151.66 (Purine-C), 150.73 (Purine-C), 141.34 (Purine-C), 139.98 (Purine-C), 138.91 (Ar-C), 137.66 (Ar-C), 137.10 (Ar-C), 136.89 (Ar-C), 129.91 (Ar-C), 129.60 (Ar-C), 128.29 (Ar-C), 126.30 (Ar-C), 122.89 (Ar-C), 116.95 (Ar-C), 94.10 (Ar-C), 85.75 (Ar-C), 56.92 (-CH), 45.83 (-CH2), 40.62 (-CH2)。
化合物7的制备以化合物22为原料, 方法同上, 收率为57.4%, mp 218~220 ℃。1H NMR (400 MHz, DMSO-d6) δ 10.00 (s, 1H, NH), 8.20 (s, 1H, N=C-H), 8.16 (d, J=10 Hz, 2H, Ar-H), 7.59 (d, J=8.8 Hz, 2H, Ar-H), 3.54 (m, 1H, -CH), 1.24 (d, J=7.2 Hz, 3H, -CH3); 13C NMR (100 MHz, DMSO-d6) δ 174.12 (C=O), 151.88 (Purine-C), 151.52 (Purine-C), 151.16 (Purine-C), 142.13 (Purine-C), 140.10 (Purine-C), 137.03 (Ar-C), 122.77 (Ar-C), 116.86 (Ar-C), 85.59 (Ar-C), 51.21 (-CH), 29.70 (-CH3), 21.37 (-CH3)。
1.13 目标化合物9的合成化合物9的制备方法同化合物7, 吡啶中-15 ℃冰盐浴条件下反应30 min, 将反应液倒入冰水中, 搅拌。静置至室温, 加入EA, 用饱和NaCl洗, 取有机层旋干, 柱色谱分离得淡黄色粉末, 收率58.1%, mp119~120 ℃。1H NMR (600 MHz, DMSO-d6) δ 10.09 (s, 1H, NH), 9.82 (s, 1H, NH), 8.29 (s, 1H, N=C-H), 8.12 (d, J=6.0 Hz, 2H, Ar-H), 7.71 (d, J=5.2 Hz, 2H, Ar-H), 7.59 (d, J=6.0 Hz, 2H, Ar-H), 7.13 (d, J=5.2 Hz, 2H, Ar-H), 5.34 (s, 1H, -CH2), 3.17 (s, 2H, -CH2), 2.30 (s, 6H, -(CH3)2N); 13C NMR (100 MHz, DMSO-d6) δ 168.20 (C=O), 151.87 (Purine-C), 151.66 (Purine-C), 150.69 (Purine-C), 141.37 (Purine-C), 139.90 (Purine-C), 137.66 (Ar-C), 137.08 (Ar-C), 136.87Ar-C), 129.94 (Ar-C), 122.94 (Ar-C), 116.95 (Ar-C), 94.09 (Ar-C), 85.82 (Ar-C), 63.38 (-CH2), 45.83 (-CH2), 45.52 (-(CH3)2N)。
2 抗肿瘤活性实验初步活性实验采用MTT法对人乳腺癌细胞MCF-7、人胰腺癌细胞PANC-1、人神经癌细胞株SY5Y、人肺癌细胞A549进行体外抗肿瘤活性测试, 以紫杉醇作为阳性对照品。
实验前的无菌处理:无菌室及无菌操作台用紫外灯照射0.5~1 h进行灭菌, 无菌操作台面用70%的乙醇溶液擦拭, 无菌操作的风扇运转15 min, 保证良好的消毒效果后再进行实验操作。
细胞接种:收集对数生长期细胞, 调整细胞悬液浓度, 以每孔1000~10 000个细胞接种到96孔板, 每孔体积200 μL。
加药处理: 5% CO2、37 ℃孵育24 h后, 加入200 μL含40 μmol·L-1化合物的完全培养基, 加入等体积的对照组培养基, 每个药物设置3个复孔。
加MTT溶液:药物处理后在5% CO2、37 ℃孵育24 h后, 至细胞单层铺满孔底 (96孔平底板), 每孔加入含20 μL MTT溶液 (0.5% MTT) 的培养液200 μL, 继续培养3 h。
终止培养:小心吸去孔内液体, 每孔加二甲基亚砜150 μL, 置于摇床上振荡15 min, 充分溶解结晶物后停止。
OD值检测:使用酶标仪在570 nm波长下检测每孔OD值。药物对细胞的抑制效果用相对抑制率来衡量:抑制率 (%)=(对照组平均OD值-给药组平均OD值) /对照组平均OD值× 100%。
| [1] | Neuzillet C, Tijeras-Raballand A, de Mestier L, et al. MEK in cancer and cancer therapy[J]. Pharmacol Ther, 2014, 141: 160–171. DOI:10.1016/j.pharmthera.2013.10.001 |
| [2] | Libero S, Lippman SM, El-Naggar AK. Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy[J]. Expert Opin Ther Targets, 2012, 16: 103–119. DOI:10.1517/14728222.2011.645805 |
| [3] | Zhao YJ, Adjei AA. The clinical development of MEK inhibitors[J]. Nat Rev Clin Oncol, 2014, 11: 385–400. DOI:10.1038/nrclinonc.2014.83 |
| [4] | Hao PQ, An S, Yang Y, et al. The progess on MEK kinases and their inhibitors[J]. Chin J Cell Biol (中国细胞生物学学报), 2015, 37: 1425–1431. |
| [5] | Spicer JA. New small-molecule inhibitors of mito-gen-activated protein kinase[J]. Expert Opin Drug Discov, 2008, 3: 801–817. DOI:10.1517/17460441.3.7.801 |
| [6] | Barrett SD, Bridges AJ, Dudley DT, et al. The discovery of the benzhydroxamate MEK inhibitors CI-1040 and PD 0325901[J]. Bioorg Med Chem Lett, 2008, 18: 6501–6504. DOI:10.1016/j.bmcl.2008.10.054 |
| [7] | Robarge KD, Lee W, Eigenbrot C, et al. Structure based design of novel 6, 5 heterobicyclic mitogen-activated protein kinase (MEK) inhibitors leading to the discovery of imidazo[J]. Bioorg Med Chem Lett, 2014, 24: 4714–4723. DOI:10.1016/j.bmcl.2014.08.008 |
| [8] | Heald RA, Jackson P, Savy P, et al. Discovery of novel allosteric mitogen-activated protein kinase (MEK)1, 2 inhibitors possessing bidentate Ser212 interactions[J]. J Med Chem, 2012, 55: 4594–4604. DOI:10.1021/jm2017094 |
| [9] | Nobuya I, Naoki H, Joseph EW, et al. Enhanced inhibition of ERK signaling by a novel allosteric MEK inhibitor, CH5126766, that suppresses feedback reactivation of RAF activity[J]. Cancer Res, 2013, 73: 4050–4060. DOI:10.1158/0008-5472.CAN-12-3937 |
| [10] | Ohren JF, Chen H, Pavlovsky A, et al. Structures of human MAP kinase1(MEK1) and MEK2 describe novel noncompetitive kinase inhibition[J]. Nat Struct Mol Biol, 2004, 11: 1192–1197. DOI:10.1038/nsmb859 |
| [11] | Lito P, Saborowski A, Yue J, et al. Disruption of CRAF-mediated MEK activation is required for effective MEK inhibition in KRAS mutant tumors[J]. Cancer Cell, 2014, 25: 697–710. DOI:10.1016/j.ccr.2014.03.011 |
| [12] | Aoki T, Hyohdoh I, Furuichi N, et al. The sulfamide moiety affords higher inhibitory activity and oral bioavailability to a series of coumarin dual selective RAF/MEK inhibitors[J]. Bioorg Med Chem Lett, 2013, 23: 6223–6227. DOI:10.1016/j.bmcl.2013.10.001 |
| [13] | Flynn BL, Hamel E, Jung MK. One-pot synthesis of benzo[J]. J Med Chem, 2002, 45: 2670–2673. DOI:10.1021/jm020077t |
| [14] | Suzuki N, Somei M, Seki A, et al. Novel bromomelatonin derivatives as potentially effective drugs to treat bone dis-eases[J]. J Pineal Res, 2008, 45: 229–234. DOI:10.1111/jpi.2008.45.issue-3 |
| [15] | Ran JQ, Huang N, Xu H, et al. Anti HIV-1 agents 5:synthesis and anti-HIV-1 activity of some N-arylsulfonyl-3-acetylindoles in vitro[J]. Bioorg Med Chem Lett, 2010, 20: 3534–3536. DOI:10.1016/j.bmcl.2010.04.132 |
| [16] | Wang C, Sperry J. Total synthesis of the photoprotecting dipyrrolobenzoquinone (+)-terreusinone[J]. Org Lett, 2011, 13: 6444–6447. DOI:10.1021/ol2027398 |
| [17] | Liu KG, Robichaud AJ. A general and convenient synthesis of N-aryl piperazines[J]. Circ Res, 2005, 46: 7921–7922. |
 2017, Vol. 52
2017, Vol. 52



