2. 浙江省中医院, 浙江 杭州 310006
2. Zhejiang Province Hospital of Traditional Chinese Medicine, Hangzhou 310006, China
抗体药物偶联物 (antibody-drug conjugate, ADC) 是通过一个化学连接子将高效的细胞毒素分子偶联到单克隆抗体上, 靶向传递小分子药物到肿瘤病灶部位, 增加毒性分子治疗窗的同时降低其对健康组织的毒副作用。传统的ADC药物是依赖抗体表面天然的赖氨酸 (Lys) 残基或通过还原抗体链间二硫键产生的半胱氨酸 (Cys) 的巯基将细胞毒素分子偶联到抗体表面。目前, 已有超过50种ADC药物进入临床试验阶段, 已通过FDA认证的brentuximab vedotin[1]和trastuzumab emtansine[2]也是通过这两种方法制备的。但是这两种方法制备的ADC药物都存在严重的产物异质性[3], 主要表现在偶联位点的不确定和偶联药物数量的多样性, 而每一种类型的ADC都有独特的体内药物动力学、药效学和安全性[4, 5]。近年来, 研究人员多采用基因工程的手段对抗体进行改造, 从而实现抗体药物的定点偶联, 常用的定点偶联方法有引入改造的半胱氨酸[6]或插入非天然氨基酸[7]作为偶联位点, 其次是通过酶法进行偶联, 常用的酶有甲酰甘氨酸生成酶和谷氨酰胺转移酶[8, 9]。
微生物来源的谷氨酰胺转移酶 (microbial transglutaminase, MTG) 能催化谷氨酰胺的γ-羰基酰氨与赖氨酸及其结构类似物的伯氨形成异肽键[10]。研究表明MTG能识别抗体重链第295位谷氨酰胺作为反应底物来偶联毒素, 形成偶联比 (DAR) 为2的ADC药物[11]。但是, 单克隆抗体IgG1在297位天门冬酰胺位点有保守的糖基化位点, 糖基化所形成的空间位置阻止了MTG直接识别295位的谷氨酰胺, 因此偶联前需要进行复杂的去糖基化过程。
白细胞分化抗原CD24 (cluster of differentiation 24) 作为一种高度糖基化蛋白分子[12], 过表达于多种肿瘤细胞表面, 包括肝癌、结直肠癌、B细胞淋巴癌、乳腺癌和小细胞肺癌等, 而在正常组织细胞中低表达甚至不表达[13-15]。本实验室通过杂交瘤技术获得了拥有自主知识产权的抗人CD24单克隆抗体G7, 并证明其在体内外具有良好的靶向性[16, 17], 然而G7为鼠源抗体, 会诱发人抗鼠抗体反应。本研究将对本实验室进行人源化嵌合改造的抗CD24单克隆抗体cG7进行定点突变, 将抗体重链Fc段保守糖基化位点297位天冬酰胺 (N297) 突变成谷氨酰胺 (N297Q), 去糖基化的同时增加2个可进行定点偶联的谷氨酰胺位点, 以此为基础得到能利用谷氨酰胺转移酶定点偶联4个毒素小分子的抗体cG7Q, 用于后续靶向CD24分子的定点偶联ADC药物的研究。
材料与方法药物和试剂 本实验室通过杂交瘤技术获得抗人CD24的鼠源单克隆抗体G7, cG7为用人源的西妥昔单抗的Fc段替代G7的Fc段形成的嵌合抗体。大肠杆菌DH5α, 载体pMH3、pCApuro, 中国仓鼠卵巢细胞CHO-s为本实验室保存。限制性内切酶、DNA连接酶购自美国NEB公司; PCR产物纯化、琼脂糖凝胶回收试剂盒购自上海生工; 细胞电击杯购自Bio-Rad公司; ECL显色液购自Millipore公司; Goat-anti-human IgG-FITC antibody购自上海生工; Goat-anti-human IgG1 (H+L)-HRP antibody购自Pierce公司; 1 mL (0.7 cm × 2.5 cm) 装HiTrap Protein A HP (Sepharose high performance) 亲和层析柱购自GE Healthcare公司; DNA合成和测序及PCR引物合成由金斯瑞公司完成。其他所用试剂均为进口或国产纯。
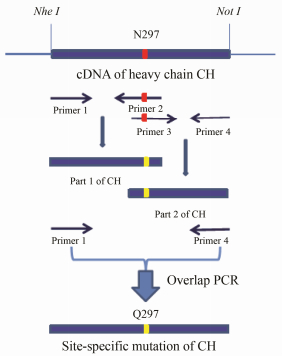
抗人CD24嵌合抗体突变体cG7Q的设计与构建 以抗人CD24嵌合抗体cG7重链的CH段为模板, 设计两对含有突变位点的引物 (表 1) primer 1、primer 2和primer 3、primer 4, 分别以两对引物进行PCR扩增, 将PCR产物分别纯化作为模板, 以primer 1、primer 4为引物进行overlap PCR得到重链CH段突变体, 过程详见图 1。将得到的突变基因与T载体连接进行测序鉴定, 选取突变成功的菌体单克隆提取质粒, 通过双酶切、酶连插入到含重链VH部分的表达载体pMH3、pCApuro, 构成重组质粒HT-pMH3、HT-pCApuro。将重组子转入大肠杆菌DH5α, 基因测序鉴定阳性克隆。
| Table 1 Primer oligonucleotide used in the overlap PCR to construct the cG7Q |
|
Figure 1 Introduction of mutation N297Q by site-directed mutagenesis using standard overlap PCR techniques (Red/yellow stripes, mutation) |
电穿孔法转染CHO-s及加压筛选稳定高产单克隆细胞株 采用抗体重链重组质粒HT-pMH3、HT-pCApuro和抗体轻链质粒L-pMH3、L-pCApuro电穿孔法共同转染CHO-s细胞。于0.4 cm的电击杯中, 160 V电击15 ms, 将电击后的细胞加到含10 mL培养基的平皿中, 37 ℃培养箱内培养。待细胞贴壁, 加入终质量浓度为900 μg·mL-1的遗传霉素 (G418) 对细胞进行加压筛选, 克隆形成, 挑单克隆于96、24孔板培养, 取培养上清4 μL点于醋酸纤维素膜上, Dot blot检测抗体的表达量, 筛选稳定高产单克隆细胞株, 共进行两轮单克隆细胞株筛选。
纯化及鉴定表达产物cG7Q 取稳定高产单克隆细胞株的静息发酵液上清于5 000 r·min-1、4 ℃离心30 min, 0.22 μm滤膜抽滤。参照GE公司Hi-Trap Protein A柱说明书, 以0.5 mL·min-1的流速上样, 再用10倍柱体积的平衡缓冲液去除非特异性吸附后用洗脱液洗脱, 收集洗脱液用1 mol·L-1 Tris溶液中和。取纯化后的蛋白进行还原和非还原SDS-PAGE凝胶电泳鉴定, 并用HRP标记的羊抗人IgG (H+L) 进行Western blot检测。
表面等离子共振法 (SPR) 检测cG7QmAb的亲和力 采用SPR, 偶联合适浓度的抗体cG7Q或cG7于CM5芯片。梯度稀释的CD24-GST抗原以恒定流速进样, 让偶联在芯片上的抗体与样品中的CD24-GST结合, 记录响应值 (RU) 的变化。理论上抗体和CD24-GST蛋白是按1:2的比例结合, 因此选择二价模型进行拟合。用Biacore X100自带软件, 分析结合常数Ka和解离常数Kd, 计算得平衡解离常数KD (Kd/Ka)。
流式细胞技术检测cG7QmAb的细胞抗原结合率 消化制备CD24阳性肝癌细胞Huh-7、BEL-7402和CD24阴性结直肠癌细胞HCT-116的细胞悬液, 设置实验组、阴性对照组。阴性对照组用脱脂牛奶封闭; 实验组用200 nmol·L-1的cG7Q或cG7在4 ℃条件下孵育1 h, 用含2%胎牛血清的PBS溶液洗涤, 于1 500 r·min-1转速下低温离心5 min, 弃上清, 重复洗涤2次, 加入按1:1 000稀释的goat-anti-human IgG-FITC antibody, 避光冰浴1 h, 洗涤同上, 最后用500 μL PBS溶液重悬细胞, 上流式细胞仪, 设置合适参数检测。
抗体依赖细胞介导的细胞毒性 (ADCC) 检测 提取人外周血单个核细胞PBMCs作为效应细胞, CD24高表达肝癌细胞BEL-7402或Huh-7作为靶细胞, 将效应细胞和靶细胞于37 ℃共孵育4 h。根据CytoTox 96非放射性细胞毒性检测试剂盒说明书, 取50 μL共孵育上清, 检测靶细胞裂解释放的乳酸脱氢酶 (LDH) 量。实验组抗体为cG7Q或cG7; 5个对照组为:效应细胞自发LDH释放、靶细胞自发LDH释放、靶细胞最大LDH释放、裂解液体积校正对照及培养基背景对照。计算每组效应细胞与靶细胞比例 (效靶比) 的细胞毒性百分比公式:细胞毒性 (%)=(实验组-效应细胞自发组-靶细胞自发组)/(靶细胞最大组-靶细胞自发组)×100。
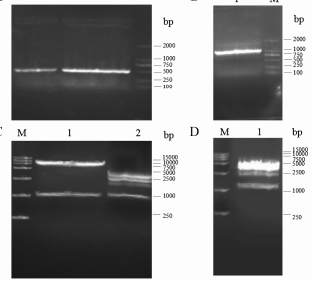
结果 1 G7Q重链恒定区基因CH定点突变及HT-pMH3、HT-pCApuro重组质粒的构建和鉴定cG7重链CH基因定点突变示意图 (图 1), 将CH基因前半段和后半段PCR产物及overlap PCR产物经1%琼脂糖凝胶电泳检测 (图 2), lane 1、lane 2为CH基因前半段和后半段产物, 分别在571 bp、481 bp出现目的条带 (A图); 二者overlap PCR突变拼接的条带大小为1 023 bp (B图)。将overlap PCR产物连接到T载体进行测序鉴定, 通过双酶切 (NotⅠ、NheⅠ) 将突变成功的重链CH基因分别替换连接至含有cG7抗体原始重链的pMH3、pCApuro载体, 双酶切琼脂糖凝胶电泳检测 (图 2), lane 1分别为pMH3、pCApuro载体双酶切 (C、D图), lane 2为携带突变重链基因的T载体双酶切 (C图)。将构建好的重组质粒载体HT-pMH3、HT-pCApuro, 转化大肠杆菌DH5α, 挑取单克隆测序验证。
|
Figure 2 Construction of the HT-pMH3, HT-pCApuro plasmid. A: Amplification of the two parts of the antibody CH-chain by PCR; Lane 1: Part 1 of the CH (571 bp); Lane 2: Part 2 of the CH (481 bp). B: Combination of the two parts by overlap PCR; Lane 1: Overlap PCR product (1 023 bp). C, D: Double digestion of the plasmids and the overlap PCR product in T plasmid; Lane 1: pCApuro and pMH3 plasmid; Lane 2: overlap PCR product in T plasmid. M: Marker |
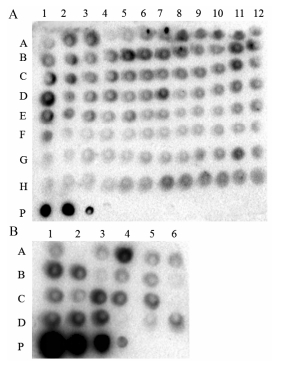
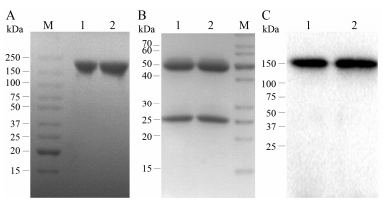
通过电穿孔法将重组质粒载体共转染CHO-s, 经G418筛选后随机挑选96个克隆于96孔板中, 吸取上清进行Dot blot检测 (图 3); 挑选24个表达量较高的克隆于24孔板中亚培养。Dot blot检测选出表达量相对较高的两个克隆, 分别于细胞培养皿中亚培养, 进行第二轮筛选。Dot blot检测第一轮筛选96孔板目的蛋白表达量 (A) 及第二轮筛选24孔板中目的蛋白表达量 (B)。将筛选出的高产单克隆细胞株静息发酵, 收集发酵上清用HiTrap Protein A柱分离纯化得到目的蛋白cG7Q (图 4), 非还原和还原条件下检测目的蛋白分子量和装配。cG7Q和cG7在非还原条件下检测到二者在150 kDa处的主带 (A), 在还原条件下检测到cG7Q、cG7在50 kDa处的重链和25 kDa处的轻链 (B); 纯化后的cG7Q在非还原条件下Western blot鉴定, 使用goat-anti-human IgG1 (H+L)-HRP antibody检测, lane 1、lane 2对应cG7Q和cG7 (C), 进一步说明cG7Q表达正确。综上所述, 定点突变后的cG7Q保持母体单抗的结构且蛋白表达装配完好, 纯化达到电泳纯。
|
Figure 3 Selection of the stably transfected clones. A, B: Semi-quantitative determination of the target protein by Dot blot. The high-yield clones in 96-well plate (A) was selected to a 24-well plate (B) and three preferable clones B1, C3, A4 in 24-well plate was selected, P1, P2, P3 represents the standard substance and the concentrations are 50, 25, 12.5 μg·mL-1 respectively |
|
Figure 4 Purification and identification of cG7Q. A: SDS-PAGE analysis of the purified cG7Q and cG7 under non-reducing conditions; Lane 1: cG7Q (150 kDa); Lane 2: cG7 (150 kDa). B: SDS-PAGE analysis of the purified cG7Q under reducing conditions; Lane 1, Lane 2: cG7Q, cG7, the heavy chain (50 kDa), the light chain (25 kDa). C: Western blot analysis of the purified cG7Q; Lane 1: cG7Q; Lane 2: cG7 |
在Biacore-X100亲和力分析平台上进行亲和力分析, 获得具体的亲和力常数 (图 5A), cG7Q亲和力常数KD (M): 8.62E-10; Kon (1/Ms): 8.38E+05; Koff (1/s): 7.23E-04;对比母体单抗cG7亲和力常数KD (M): 1.91E-10; Kon (1/Ms): 1.76E+06; Koff (1/s): 3.36E-4 (结果未显示), 可以看出对于CD24抗原, cG7Q对抗原的亲和力仅略有下降。流式细胞技术检测抗体与细胞表面CD24抗原的结合情况 (图 5B), cG7Q和cG7对CD24阴性的细胞株HCT-116均无结合; 而cG7Q和cG7对CD24阳性细胞株BEL-7402的结合率分别为86.3%、86.0%;对CD24阳性细胞株Huh-7结合率分别为93.0%、92.8%。由此可见cG7Q和cG7对CD24表达阳性细胞株均有结合且结合能力相当。综上所述, 改造后的cG7Q保持亲本抗体cG7与抗原的亲和力及特异性结合能力。

|
Figure 5 Affinity and binding capacity analysis. A: Affinity of cG7Q binding to human CD24 antigen measured by SPR, experimental results for the real-time binding of CD24 to immobilized cG7Q showed that the association rate increased with increasing concentration of the CD24 antigen. B: cG7Q and cG7 demonstrated relatively high binding signals with Huh-7, BEL-7402, but not with the CD24-negtive HCT-116 cells, and the binding rate of cG7Q and cG7 is almost the same |
ADCC实验选用PBMCs作为效应细胞, BEL-7402和Huh-7作为靶细胞, 在效靶比充足100:1时摸索合适药物浓度, 设置6个药物质量浓度 (0.01、0.1、1、10、100和1 000 μg·mL-1), 选择达到细胞裂解率平台期的药物质量浓度为最佳给药质量浓度, 即100 μg·mL-1 (665 nmol·L-1)。将效应细胞PBMCs分别与靶细胞BEL-7402或Huh-7共孵育, 检测细胞毒性 (图 6)。设置效靶比梯度5:1、30:1和100:1, 设置定点突变抗体cG7Q和母体单抗cG7实验组, 同时设置空白对照组 (只将PBMCs细胞和BEL-7402或Huh-7共孵育, 不加药)。结果可见, 随着效应细胞数量的增加, PBMCs对BEL-7402和Huh-7细胞的杀伤作用呈依赖型增长 (6A, B), 在效靶比最高100:1时, cG7Q和cG7对BEL-7402的细胞裂解率分别为40.0%、45.6%; cG7Q和cG7对Huh-7的细胞裂解率分别为43.6%、57.4%。在相同效靶比的情况下, cG7Q组的细胞裂解率均低于cG7组, 表明对cG7保守糖基化位点突变对抗体的ADCC效应有一定影响, 但cG7Q仍能在PBMCs中发挥对靶细胞的杀伤力。
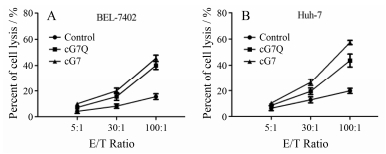
|
Figure 6 Antibody-dependent cell-mediated cytotoxicity. A, B: Cytotoxicity assay to assess the PBMCs dependent killing of BEL-7402 or Huh-7 cells in the presence of cG7Q or cG7. The control group is the co-cultured cells absence of the antibody. The increase of cell lysis was weaken slightly upon treatment with cG7Q compared to cG7 because of deglycosylated of the cG7Q heavy chain |
肝癌是一种常见的恶性肿瘤, 全球50%以上的肝癌发生在我国[18], 因此开发靶向肝癌的定点偶联ADC药物极具应用前景。ADC药物利用抗体的靶向性, 将杀伤力强大的小分子药物带入肿瘤细胞内, 显著提高药物的安全性。基于传统偶联技术制备的ADC药物为混合物[19, 20], 本文设计利用酶法进行偶联, 该方法一般需要人为改造抗体, 使抗体产生可被特定酶所识别的氨基酸序列, 再通过酶对底物的特异性, 修饰特定的氨基酸残基从而实现抗体的定点偶联。利用甲酰甘氨酸生成酶偶联, 需在抗体上引入一个五肽序列作为酶识别的底物, 外源序列的引入可能存在免疫源性, 而利用谷氨酰胺转移酶催化实现定点偶联, 只需突变抗体上的一对位点。微生物来源的谷氨酰胺转移酶 (MTG) 是一种廉价易得的酶, 它对谷氨酰胺 (Glu) 残基具有独特的选择性, 而MTG对赖氨酸的选择性不高, 它可以识别赖氨酸及其结构类似物中的伯胺[21], 因而可以设计一种带有伯胺的接头, 通过接头上的伯胺与抗体上特定的谷氨酰胺反应, 进而实现抗体与药物的定点偶联。在后续实验中, 将设计合成一种含缬氨酸-瓜氨酸的二肽接头, 一端为伯胺, 一端连接高毒性的微管蛋白抑制剂MMAE。这种二肽接头能被溶酶体中的蛋白酶降解, 使ADC药物在靶细胞内释放细胞毒小分子, 提高药物在血液循环中的稳定性, 减少脱靶效应[22]。
鉴于G7对CD24过表达的肝癌具有良好的靶向性, 本文在嵌合抗体cG7的基础上, 定点改造cG7的重链CH段, 得到cG7Q。抗体可变区不变, 表面等离子共振及流式结果证明, cG7Q保持母体单抗cG7对抗原的结合能力, 可用于进一步研究靶向CD24的抗体药物偶联物, 也可将定点改造的Fc片段与其他抗体可变区拼接, 制备靶向其他肿瘤表面标记物的定点偶联ADC药物。抗体的ADCC效应依赖抗体Fc段与效应细胞的Fcγ受体结合而发挥作用, 文中将cG7第297位保守糖基化位点突变, 使抗体Fc段减少了一个糖基化位点, 实验结果表明cG7Q的ADCC效应相较于亲本抗体的ADCC效应, 强度有所降低。Lhospice等研究[23]显示, 297位去糖基化的抗体cAC10Q的Fc段与FcγR的结合力变弱, 减少了ADC药物脱靶时对FcγR阳性正常细胞的毒性, 体内数据显示, cAC10Q在肝和肾脏中的富集明显减少, 与已上市的brentuximab vedotin相比, 显著提高了小鼠的体内耐受, 因此, 本研究预期突变体将具有优于野生型抗体的体内稳定性与毒副作用。
本文成功表达出具有4个谷氨酰胺偶联位点的cG7Q, 后续可通过谷氨酰胺转移酶将可降解的含有伯胺的毒素接头偶联到抗体天然的295位的谷氨酰胺以及突变的297位谷氨酰胺位点上, 制备偶联比均一的靶向人CD24的ADC药物, 为CD24高表达肝癌提供潜在的治疗研究方案。
| [1] | Ansell SM. Brentuximab vedotin[J]. Blood, 2014, 124: 3197–3200. DOI:10.1182/blood-2014-06-537514 |
| [2] | LoRusso PM, Weiss D, Guardino E, et al. Trastuzumab emtansine:a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer[J]. Clin Cancer Res, 2011, 17: 6437–6447. DOI:10.1158/1078-0432.CCR-11-0762 |
| [3] | Wang L, Amphlett G, Blättler WA, et al. Structural charac-terization of the maytansinoid-monoclonal antibody immunoconjugate, huN901-DM1, by mass spectrometry[J]. Protein Sci, 2005, 14: 2436–2446. DOI:10.1110/(ISSN)1469-896X |
| [4] | Boswell CA, Mundo EE, Zhang C, et al. Impact of drug conjugation on pharmacokinetics and tissue distribution of anti-STEAP1 antibody-drug conjugates in rats[J]. Biocon-jug Chem, 2011, 22: 1994–2004. DOI:10.1021/bc200212a |
| [5] | Hamblett KJ, Senter PD, Chace DF, et al. Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate[J]. Clin Cancer Res, 2004, 10: 7063–7070. DOI:10.1158/1078-0432.CCR-04-0789 |
| [6] | Bhakta S, Raab H, Junutula JR. Engineering THIOMABs for site-specific conjugation of thiol-reactive linkers[J]. Methods Mol Biol, 2013, 1045: 189–203. DOI:10.1007/978-1-62703-541-5 |
| [7] | Hallam TJ, Wold E, Wahl A, et al. Antibody conjugates with unnatural amino acids[J]. Mol Pharm, 2015, 12: 1848–1862. DOI:10.1021/acs.molpharmaceut.5b00082 |
| [8] | Behrens CR, Liu B. Methods for site-specific drug conjugation to antibodies[J]. MAbs, 2014, 6: 46–53. DOI:10.4161/mabs.26632 |
| [9] | Zhou Q, Kim J. Advances in the development of site-spe-cific antibody-drug conjugation[J]. Anticancer Agents Med Chem, 2015, 15: 828–836. DOI:10.2174/1871520615666150302125448 |
| [10] | Mindt TL, Jungi V, Wyss S, et al. Modification of different IgG1 antibodies via glutamine and lysine using bacterial and human tissue transglutaminase[J]. Bioconjug Chem, 2008, 19: 271–278. DOI:10.1021/bc700306n |
| [11] | Dennler P, Chiotellis A, Fischer E, et al. Transglutaminase-based chemo-enzymatic conjugation approach yields homogeneous antibody-drug conjugates[J]. Bioconjug Chem, 2014, 25: 569–578. DOI:10.1021/bc400574z |
| [12] | Kristiansen G, Sammar M, Altevogt P. Tumour biological aspects of CD24, a mucin-like adhesion molecule[J]. J Mol Histol, 2004, 35: 255–262. |
| [13] | Lee JH, Kim SH, Lee ES, et al. CD24 overexpression in cancer development and progression:a meta-analysis[J]. Oncol Rep, 2009, 22: 1149–1156. |
| [14] | Lim SC. CD24 and human carcinoma:tumor biological aspects[J]. Biomed Pharmacother, 2005, 59: S351–S354. DOI:10.1016/S0753-3322(05)80076-9 |
| [15] | Hong YP, Li ZD, Prasoon P, et al. Immunotherapy for hepatocellular carcinoma:from basic research to clinical use[J]. World J Hepatol, 2015, 7: 980–992. DOI:10.4254/wjh.v7.i7.980 |
| [16] | He H, Tu X, Zhang J, et al. A novel antibody targeting CD24 and hepatocellular carcinoma in vivo by near-infrared fluorescence imaging[J]. Immunobiology, 2015, 220: 1328–1336. DOI:10.1016/j.imbio.2015.07.010 |
| [17] | Wang T, Sun F, Xie W, et al. A bispecific protein rG7S-MICA recruits natural killer cells and enhances NKG2D-mediated immunosurveillance against hepatocellular carci-noma[J]. Cancer Lett, 2016, 372: 166–178. DOI:10.1016/j.canlet.2016.01.001 |
| [18] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008[J]. CA Cancer J Clin, 2008, 58: 71–96. DOI:10.3322/CA.2007.0010 |
| [19] | Panowski S, Bhakta S, Raab H, et al. Site-specific antibody drug conjugates for cancer therapy[J]. MAbs, 2014, 6: 34–45. DOI:10.4161/mabs.27022 |
| [20] | Sun Y, Huang R, Sun BW. Advances in the study of site-specific antibody-drug conjugates[J]. Acta Pharm Sin (药学学报), 2015, 50: 1225–1231. |
| [21] | Fontana A, Spolaore B, Mero A, et al. Site-specific modifi-cation and PEGylation of pharmaceutical proteins mediated by transglutaminase[J]. Adv Drug Deliv Rev, 2008, 60: 13–28. DOI:10.1016/j.addr.2007.06.015 |
| [22] | Doronina SO, Toki BE, Torgov MY, et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy[J]. Nat Biotechnol, 2003, 21: 778–784. DOI:10.1038/nbt832 |
| [23] | Lhospice F, Brégeon D, Belmant C, et al. Site-specific conjugation of monomethyl auristatin E to anti-CD30 anti-bodies improves their pharmacokinetics and therapeutic index in rodent models[J]. Mol Pharms, 2015, 12: 1863–1871. DOI:10.1021/mp500666j |
 2017, Vol. 52
2017, Vol. 52


