2. 河南大学 淮河临床学院转化医学中心, 河南 开封 475001;
3. 河南大学 体育学院, 河南 开封 475001
2. Translational Medical Center of Huaihe Clinical College, Henan University, Kaifeng 475001, China;
3. School of Physical Education, Henan University, Kaifeng 475001, China
树突状细胞 (dendritic cells, DCs) 是机体免疫系统中最重要的抗原递呈细胞 (antigen-presenting cells, APCs), 在建立先天免疫和获得性免疫反应中发挥至关重要的作用[1, 2]。根据DCs所介导的免疫反应程度分为未成熟树突状细胞 (imDCs) 和成熟DCs (mDCs)。imDCs分布于全身, 具有强大的捕获和处理抗原的能力。在捕获和加工抗原后, imDCs迁移到淋巴器官的T细胞区域, imDCs变为mDCs[3]。DCs的成熟是诱发机体产生抗原特异性T细胞免疫应答的关键, 在发挥抗肿瘤和介导免疫耐受中具有重要作用[1, 4]。而imDCs作用于T细胞可以诱导T细胞所介导的免疫耐受, 将有助于缓解自身免疫病[5]。因此, 如何阻止imDCs转变为mDCs, 已成为研究防治自身免疫病和移植免疫的研究热点。
研究发现, 中药及其主要活性成分已被应用于治疗人类的多种疾病。本课题组和其他课题组的研究发现, 中药或食物本身或其中的主要植物化合物 (活性成分) 可以调节DCs的成熟和抗原递呈能力, 影响炎症细胞因子的表达, 并进一步影响T细胞介导的免疫应答, 包括辅助性T细胞 (T helper, Th) 1和Th2细胞[6-11]。芹菜素 (apigenin, Api) 是一种天然来源的黄酮类化合物, 存在于多种水果、蔬菜、中药材中[12]。研究证实, 芹菜素具有抗氧化、抗炎、抗诱变、抑制肿瘤发生、增生和转移、抑制血管生成等作用[13]。此外, 芹菜素可以抑制脂多糖 (lipopolysaccharide, LPS) 诱导的人肺腺癌细胞系A549分泌产生的诱导型一氧化氮合酶和环氧化酶-2的mRNA表达、NO的产生和促炎症细胞因子 (IL-1β、IL-6、IL-8、TNF-α) 的mRNA表达[14]。而动物实验发现芹菜素预处理C57BL/6小鼠, 可以减少LPS引起的实验动物死亡[15]。然而, 芹菜素是否直接影响脾细胞中炎症细胞因子的分泌及DCs的成熟和抗原呈递功能, 仍未见报道。
本研究旨在研究芹菜素对脾细胞中炎症细胞因子及DCs的作用, 以期为其潜在的临床应用价值提供理论依据。
材料与方法实验动物 所用雌性6~8周龄C57BL/6小鼠由南京大学模式动物研究所提供, 合格证号为SCXK (苏) 2015-0001。小鼠均为SPF级, 并用普通饲料在12 h光/12 h无光中饲养。
药品与试剂 芹菜素购自西安开来生物工程有限公司, 纯度 > 98%;丙二醇甲酸乙酯 (phorbol-12-myristate-13-acetate, PMA)、inomycin、莫能菌素、二甲基亚砜 (dimethyl sulfoxide, DMSO) 和LPS均为Sigma公司产品; 荧光标记的单克隆抗体CD4、CD11c、CD80、CD86、MHCII、IL-4、IFN-γ、非特异性封闭抗体CD16/CD32及IL-6、IL-10和TNF-α ELISA定量试剂盒、CD11c阳性选择分选试剂盒均购自美国eBioscience公司; 胎牛血清和RPMI 1640培养基购自GIBCO公司。IL-1β ELISA试剂盒购自美国RND Systems公司。细胞活性检测试剂盒CCK-8购自日本同仁化学研究所。肽卵清白蛋白 (OVA)323-339由上海吉尔生化有限公司合成。将芹菜素溶解于DMSO, 储备液浓度为200 mmol·L-1。
脾细胞分离 C57BL/6小鼠CO2处死后, 取出脾脏。将分离后的脾脏研碎后, 通过200目的铜网过滤, 通过流式细胞仪 (中国迈瑞公司) 进行细胞计数。
脾细胞的体外培养 将分离后的脾细胞与不同浓度的芹菜素 (0、1、2.5、5、10、20 μmol·L-1) 共孵育2 h, 然后将细胞以每孔2×106个的浓度置于24孔细胞培养板, 在37 ℃、5% CO2培养箱培养20 h, 加入CCK8培养4 h, 酶标仪测定450 nm处的吸光度。细胞存活率计算公式为:细胞存活率=(实验组-对照组) / (对照组-溶剂组) × 100%。经不同浓度芹菜素孵育后的脾细胞与LPS (1 mg·L-1) 共培养24 h, 收集细胞后用流式细胞仪检测树突状细胞共刺激分子的变化, 并收集细胞上清用ELISA检测炎症细胞因子的变化情况。
CD11c+ DC的分选 C57BL/6脾细胞经20 μmol·L-1芹菜素和LPS共培养24 h后, 根据eBioscience公司CD11c阳性分选试剂盒的说明书经磁珠分选获得纯度 > 95%的CD11c+ DCs。
过继转移实验 将纯化的CD11c+ DCs与100 mg·L-1 OVA323-339肽共同孵育2 h后, 静脉注射3×105个细胞到C57BL/6小鼠体内。小鼠被分为四组: ① Api处理的DCs (Api); ②未处理DCs+OVA组 (OVA); ③ Api+LPS处理DCs+OVA (Api+LPS+OVA); ④ LPS处理DCs+OVA (LPS+OVA)。注射1周后, CO2处死小鼠, 分离脾细胞。脾细胞与不同浓度的OVA323-339 (0、1、10、100 mg·L-1) 共培养72 h, 最后4 h加入CCK-8检测T细胞增殖情况。另外, 脾细胞与100 mg·L-1 OVA323-339共培养68 h, 加入PMA、inomycin和莫能菌素再培养4 h后, 用流式细胞术检测CD4+T细胞中IL-4和IFN-γ的表达情况[16]。
ELISA检测脾细胞分泌炎症细胞因子情况 根据eBioscience IL-1β、IL-6、IL-10和TNF-α的说明书, 检测细胞上清中细胞因子的表达。将捕获抗体在包被液中过夜结合到ELISA板上, 经BSA封闭后, 加入标准品和待检验品2 h, 再加入对应的检测抗体, 经TMB显色和终止液终止后, 酶标仪 (美国BioTek公司) 测定450 nm和参考波长630 nm的OD值, 并用Gen5软件计算出各种炎症细胞因子的浓度。
统计学分析 用GraphPad Prism5.0软件对相关数据进行统计分析, 数据以x±s表示。多组间比较用one-way ANOVA dunnett检验, 两两之间的比较采用LSD法。P < 0.05差异显著。
结果 1 芹菜素对脾细胞分泌促炎症细胞因子的影响如图 1所示, 与对照组 (0 μmol·L-1) 比, 芹菜素抑制脾细胞分泌的促炎症细胞因子IL-1β (A)、IL-6 (B) 和TNF-α (C) 的产生, 20 μmol·L-1芹菜素具有最强的抑制作用。然而并没有观察到芹菜素改变脾细胞分泌的抗炎症细胞因子IL-10的表达 (图 1D)。这些结果提示, 芹菜素并非通过增加IL-10的表达而发挥其对促炎症细胞因子的抑制作用, 推测芹菜素可能是直接通过其特定的方式而发挥该抑制效应。
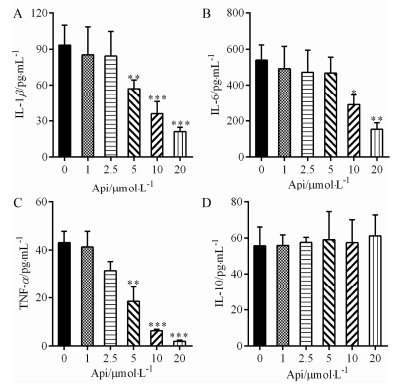
|
Figure 1 Effect of apigenin (Api) on the production of pro-and anti-inflammatory cytokines from spleen cells. After spleen cells were treated with different concentration of Api (0, 1, 2.5, 5, 10, 20 μmol·L-1) for 2 h, they were co-cultured with lipopolysaccharide (LPS) for 24 h. Then the cell-free supernatants were collected to analyze the production of IL-1β (A), IL-6 (B), TNF-α (C) and IL-10 (D) using quantity ELISA assay. n=6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs 0 μmol·L-1 |
如图 2所示, 在脾细胞中加入不同浓度的芹菜素处理24 h后, CCK-8检测脾细胞存活的数量结果显示, 即使较高浓度 (20 μmol·L-1) 的芹菜素也不影响脾细胞的存活率, 但具有最强的抑制功能。因此, 选用20 μmol·L-1的芹菜素进行后续研究。
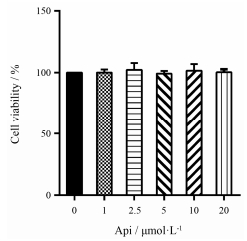
|
Figure 2 Effect of apigenin on spleen cell viability. After spleen cells were treated with different concentration of apigenin (0, 1, 2.5, 5, 10, 20 μmol·L-1) for 20 h, the CCK-8 was added to culture for another 4 h. The OD450values were acquired using Bio-Rad Plate reader. The cell viability was determined as described in the Materials and Methods. n=6, x±s |
在一定程度上, 炎症细胞因子可以通过反馈的方式调控APCs表面共刺激分子的表达。上述研究结果表明:芹菜素能显著抑制促炎症细胞因子的产生, 而TNF-α和IL-6是APCs (包括B细胞、DCs和巨噬细胞) 分泌的主要细胞因子。因此, 本研究检测了总APCs表面共刺激分子的表达。实验结果显示, 芹菜素抑制脾细胞中表面共刺激分子CD80 (A)、CD86 (B) 和MHCII (C) 的表达 (图 3), 提示芹菜素可能通过抑制APCs的成熟而减少促炎症细胞因子的表达。
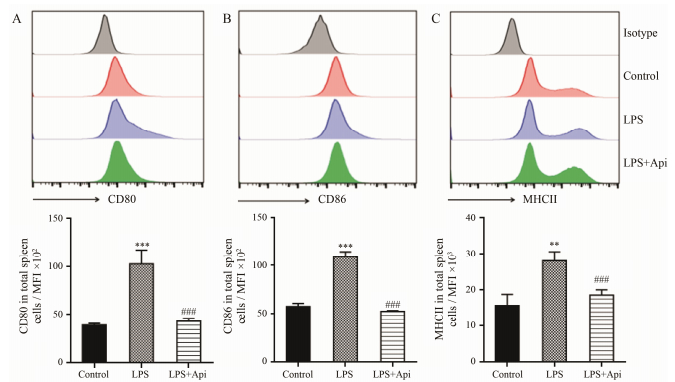
|
Figure 3 Effect of apigenin on the expression of co-stimulatory on total spleen cells. After spleen cells were treated without or with apigenin (20 μmol·L-1) for 2 h, they were co-cultured with LPS for 24 h and the cells were collected to measure the expression of co-stimulatory. The histograms show a representative experiment (above) and bar figures are x±s of three independent experiments (below). **P < 0.01, ***P < 0.001 vs control; ###P < 0.001 vs LPS. MFI: Mean fluorescence intensity. Control: 0 μmol·L-1 Api treated; LPS: 0 μmol·L-1 Api+LPS; LPS+Api: 20 μmol·L-1 Api+LPS |
DCs是机体内最主要的APCs, 是建立先天免疫和获得性免疫反应的重要细胞。由于上述结果显示, 芹菜素抑制所有抗原递呈细胞表面共刺激分子的表达, 推测其可能影响DCs的成熟。因此, 进一步流式细胞术分析DCs表面共刺激分子的表达情况。图 4结果显示, 芹菜素的确抑制CD11c+ DCs的共刺激分子CD80 (A)、CD86 (B) 和MHCII (C) 的表达。这些结果提示, 芹菜素可能抑制imDCs转化为mDCs, 进而抑制其抗原递呈能力。
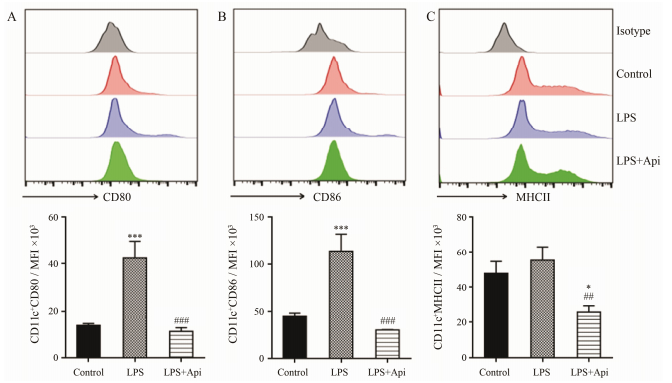
|
Figure 4 Effect of apigenin on the expression of co-stimulatory on DCs. After spleen cells were treated without or with apigenin (20 μmol·L-1) for 2 h, they were co-cultured with LPS for 24 h and the cells were collected to measure the expression of co-stimulation molecules using flow cytometry. After cells were gated into CD11c, the CD80, CD86 and MHCII expressions were analyzed using FlowJo7.6 software. The histograms show a representative experiment (above) and bar figures are x±s of three independent experi ments (below). *P < 0.05, ***P < 0.001 vs control; ##P < 0.01, ###P < 0.001 vs LPS |
DCs作为主要的APCs, 主要功能是加工抗原并递呈给T细胞, 从而使T细胞活化并发挥其效应功能 (获得性免疫应答)。在发现芹菜素可抑制CD11c+DCs的活化后, 进一步研究芹菜素对DCs的成熟抑制是否导致其抗原递呈能力的改变。过继转移实验发现, 与LPS处理的DCs相比, 经芹菜素和LPS共处理的DCs抑制抗原特异性T细胞的增殖 (图 5A)、CD4+T细胞分泌的细胞因子IFN-γ (图 5B) 和IL-4 (图 5C) 的产生, 而该作用与OVA单独处理的DCs具有相似的T细胞增殖和分泌细胞因子的能力。这些结果提示芹菜素可以抑制脾细胞中DCs的抗原递呈能力, 从而诱导弱的抗原特异性T细胞的效应性作用, 包括Th1和Th2细胞介导的免疫应答。
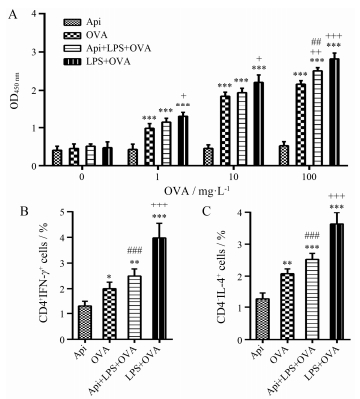
|
Figure 5 Api-treated DCs from C57BL/6 mice impaired antigen-specific T cell response in vivo. Splenocytes from the DC adoptive transfer recipient mice were re-stimulatedin vitrowith OVA323-339peptide to determine OVA323-339-specific T cell proliferation (A) and production of cytokine IFN-γ (B) and IL-4 (C) by CD4+ T cells. n=5, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs Api; +P < 0.05, ++P < 0.01, +++P < 0.001 vs OVA; ##P < 0.01, ###P < 0.001 vs LPS+OVA |
研究发现芹菜素具有免疫调节功能, 而其作用方式可能是通过调控炎症细胞对炎症细胞因子的分泌作用。脾脏作为机体最大的免疫器官, 是成熟T和B细胞对病原微生物的抗原以及自身抗原刺激产生免疫应答的场所; 同时也是大量捕捉和处理抗原的APCs存在的场所, 包括DCs和巨噬细胞等, 这类细胞的特点就是迅速捕获和处理抗原, 并将处理后的抗原呈递给T细胞。APCs或巨噬细胞在受到抗原刺激后, 会快速产生分泌促炎症细胞因子如IL-1β、IL-6、IL-12和TNF-α等, 这些炎症细胞因子将进一步促进APCs的成熟和抗原递呈能力[17]; 而抗炎症细胞因子IL-10, 有助于诱导APCs的不成熟进而诱导免疫耐受[18, 19]。除此之外, APCs不仅可以通过炎症细胞因子诱导或辅助Th0细胞分化为不同的效应性Th细胞, 如IL-1β和IL-6诱导Th17的产生, 而TNF-α扩增Th9细胞, IL-10诱导1型调节性T细胞的产生[9]; 也可通过APCs的状态及递呈抗原的能力影响T细胞的表型和不同效应性Th细胞的产生[20]。这些促炎症Th细胞除了发挥其抗病毒作用外, 也介导自身免疫病的发生发展。当前的研究发现, 芹菜素抑制LPS刺激脾细胞对促炎症细胞因子IL-1β、TNF-α和IL-6的分泌, 而不影响IL-10的产生。这些结果提示, 芹菜素可能通过抑制促炎细胞因子来发挥两方面的免疫调节作用:其一, 改变巨噬细胞的吞噬功能或DCs的成熟进而减少抗原特异性的免疫应答, 其二, 可能有助于改善效应性T细胞的平衡。
除了脾脏中存在的大量DCs外, DCs也可以从骨髓发育分化产生, 从而发挥其抗原递呈的能力。前期研究发现[21, 22], 芹菜素可以抑制骨髓来源的DCs的成熟和抗原递呈能力进而缓解小鼠关节炎的发生发展, 但并没有观察是否影响脾细胞中DCs的成熟及功能状态。在本研究中发现, 芹菜素可以抑制脾细胞中所有APCs的共刺激分子CD80、CD86和MHCII的表达, 尤其是能够抑制CD11c+ (DC的标记物) 的DCs表面共刺激分子的表达。这些结果提示, 芹菜素可能有助于诱导免疫耐受或削弱机体抗原特异性的免疫应答。
本研究发现芹菜素抑制了DCs的成熟标记物CD80、CD86和MHCII的表达, 为考察它是否改变DCs的抗原呈递能力, 进一步分选芹菜素和/或LPS处理后的CD11c+DCs, 经OVA处理后, 过继转移到正常的小鼠体内, 评价抗原特异性的免疫应答。分离过继转移的小鼠脾细胞后, 体外经特异性抗原OVA刺激, 检测OVA特异性的T细胞增殖的结果发现, 与LPS和OVA共培养的DCs相比, 添加芹菜素可以显著抑制OVA特异性T细胞的增殖。进一步研究发现, 添加芹菜素也可以抑制OVA特异性的CD4+ T细胞表达的IFN-γ和IL-4的产生。这些结果提示, 芹菜素可能通过调控脾细胞中DCs的抗原递呈功能而削弱抗原特异性的Th1 (IFN-γ) 和Th2 (IL-4) 细胞免疫应答。
总之, 本研究证实芹菜素在体外可以直接抑制脾细胞分泌的促炎症细胞因子的产生, 而该作用可能是由于改变脾细胞中APCs的成熟所介导。进一步的研究发现, 芹菜素抑制DCs的成熟和呈递抗原的能力, 并抑制抗原特异性的T细胞增殖和Th细胞相关细胞因子的产生。这些结果提示, 芹菜素可作为中药或食物来源的新型免疫调节剂, 用于防治炎症和免疫相关的疾病等。
| [1] | Koski GK, Cohen PA, Roses RE, et al. Reengineering dendritic cell-based anti-cancer vaccines[J]. Immunol Rev, 2008, 222: 256–276. DOI:10.1111/j.1600-065X.2008.00617.x |
| [2] | Guerder S, Joncker N, Mahiddine K, et al. Dendritic cells in tolerance and autoimmune diabetes[J]. Curr Opin Immunol, 2013, 25: 670–675. DOI:10.1016/j.coi.2013.10.004 |
| [3] | Chung CY, Ysebaert D, Berneman ZN, et al. Dendritic cells:cellular mediators for immunological tolerance[J]. Clin Dev Immunol, 2013, 2013: 972865. |
| [4] | Dudek AM, Martin S, Garg AD, et al. Immature, semi-mature, and fully mature dendritic cells:toward a DC-cancer cells interface that augments anticancer immunity[J]. Front Immunol, 2013, 4: 438. |
| [5] | Lutz MB, Schuler G. Immature, semi-mature and fully mature dendritic cells:which signals induce tolerance or immunity?[J]. Trends Immunol, 2002, 23: 445–449. DOI:10.1016/S1471-4906(02)02281-0 |
| [6] | Chirumbolo S. Plant phytochemicals as new potential drugs for immune disorders and cancer therapy:really a promising path?[J]. J Sci Food Agric, 2012, 92: 1573–1577. DOI:10.1002/jsfa.v92.8 |
| [7] | Wang J, Niu X, Du X, et al. Dietary supplementation with white button mushrooms augments the protective immune response to Salmonella vaccine in mice[J]. J Nutr, 2014, 144: 98–105. DOI:10.3945/jn.113.185165 |
| [8] | Wang J, Ren Z, Xu Y, et al. Epigallocatechin-3-gallate ameliorates experimental autoimmune encephalomyelitis by altering balance among CD4+ T-cell subsets[J]. Am J Pathol, 2012, 180: 221–234. DOI:10.1016/j.ajpath.2011.09.007 |
| [9] | Wu D, Wang J, Pae M, et al. Green tea EGCG, T cells, and T cell-mediated autoimmune diseases[J]. Mol Aspects Med, 2012, 33: 107–118. DOI:10.1016/j.mam.2011.10.001 |
| [10] | Niu X, Huang Z, Zhang L, et al. Auraptene has the inhibitory property on murine T lymphocyte activation[J]. Eur J Pharmacol, 2015, 750: 8–13. DOI:10.1016/j.ejphar.2015.01.017 |
| [11] | Li T, Chen H, Liu XG, et al. Immunoregulatory effect of artesunate on allergic contact dermatitis and its mechanism[J]. Acta Pharm Sin (药学学报), 2012, 47: 884–889. |
| [12] | Qu LB, Wang L, Yang R, et al. Interaction of bovine serum albumin with luteolin and apigenin[J]. Acta Pharm Sin (药学学报), 2006, 41: 352–357. |
| [13] | Birt DF, Walker B, Tibbels MG, et al. Anti-mutagenesis and anti-promotion by apigenin, robinetin and indole-3-carbinol[J]. Carcinogenesis, 1986, 7: 959–963. DOI:10.1093/carcin/7.6.959 |
| [14] | Patil RH, Babu RL, Naveen Kumar M, et al. Anti-inflammatory effect of apigenin on LPS-induced pro-inflammatory mediators and AP-1 factors in human lung epithelial cells[J]. Inflammation, 2016, 39: 138–147. DOI:10.1007/s10753-015-0232-z |
| [15] | Nicholas C, Batra S, Vargo MA, et al. Apigenin blocks lipopolysaccharide-induced lethality in vivo and proinflam-matory cytokines expression by inactivating NF-κB through the suppression of p65 phosphorylation[J]. J Immunol, 2007, 179: 7121–7127. DOI:10.4049/jimmunol.179.10.7121 |
| [16] | Wang J, Pae M, Meydani SN, et al. Green tea epigallo-catechin-3-gallate modulates differentiation of naive CD4+ T cells into specific lineage effector cells[J]. J Mol Med (Berl), 2013, 91: 485–495. DOI:10.1007/s00109-012-0964-2 |
| [17] | Caux C, Dezutter-Dambuyant C, Schmitt D, et al. GM-CSF and TNF-α cooperate in the generation of dendritic Langerhans cells[J]. Nature, 1992, 360: 258–261. DOI:10.1038/360258a0 |
| [18] | Levings MK, Gregori S, Tresoldi E, et al. Differentiation of Tr1 cells by immature dendritic cells requires IL-10 but not CD25+CD4+ Tr cells[J]. Blood, 2005, 105: 1162–1169. |
| [19] | Chen L, Zheng L, He W, et al. Cotransfection with IL-10 and TGF-β1 into immature dendritic cells enhances immune tolerance in a rat liver transplantation model[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 306: G575–G581. DOI:10.1152/ajpgi.00283.2013 |
| [20] | de Lastic AL, Rodi M, Mouzaki A. Effect of dendritic cell state and antigen-presentation conditions on resulting T-cell phenotypes and Th cytokine profiles[J]. Immunobiology, 2016, 221: 862–870. DOI:10.1016/j.imbio.2016.04.001 |
| [21] | Yoon MS, Lee JS, Choi BM, et al. Apigenin inhibits immunostimulatory function of dendritic cells:implication of immunotherapeutic adjuvant[J]. Mol Pharmacol, 2006, 70: 1033–1044. DOI:10.1124/mol.106.024547 |
| [22] | Li X, Han Y, Zhou Q, et al. Apigenin, a potent suppressor of dendritic cell maturation and migration, protects against collagen-induced arthritis[J]. J Cell Mol Med, 2016, 20: 170–180. DOI:10.1111/jcmm.12717 |
 2017, Vol. 52
2017, Vol. 52


