2. 中国医学科学院、北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
天然糖基化产物普遍存在于微生物和动植物中, 在生物体内通常由糖基转移酶催化一个糖分子与另一个糖分子或有机分子生成糖苷键, 即天然多糖或糖苷化的产物。这些天然有机分子不仅直接参与多种生理病理过程并在其生命活动中起着重要作用, 一些次级代谢合成的天然糖苷还具有很高的药用价值。目前许多天然糖苷已经作为治疗各类疾病的药物, 最常见的糖苷药物当属含有不同糖基的抗生素如氨基糖苷类抗生素, 还有一些作为潜在的药物, 具有抗炎、抑菌、抗病毒、抗氧化、抗肿瘤、抗辐射和免疫调节等诸多生物活性[1, 2]。
天然糖苷中最常见的是由葡萄糖、鼠李糖、阿拉伯糖、木糖、半乳糖等糖基修饰的天然产物。但植物和微生物中也广泛存在一类天然稀有的阿洛糖苷, 其稀有性是相对于普遍存在的单糖苷如D-葡萄糖苷。天然罕见的D-阿洛糖是D-葡萄糖的C-3差向异构体, 它主要通过微生物或酶促生物催化方法合成[3]。天然游离的D-阿洛糖在维基百科记载的非洲灌木海神花属 (Protea) 植物叶子中有分布, 也有文献[4]报道从辣木 (Moringa oleifera) 叶和树皮中鉴定到游离的D-阿洛糖。有关D-阿洛糖的生物活性和生物合成制备已经进行了深入广泛的研究[3], 它是一种低能量、不被消化的安全无毒的食糖替代品, 特别适用于肥胖者[5, 6]; D-阿洛糖还具有抑制癌细胞增殖[4, 7]、肝脑肾缺血再灌注的损伤保护[8-10]、抑制成骨细胞分化[11]、抑制活性氧[12]和免疫抑制[13]等药理活性功能。D-阿洛糖在自然界生物体内绝大部分以糖苷的形式存在, 在微生物中多以不常见的6-脱氧阿洛糖苷的形式存在如查尔霉素 (chalcomycin) 和泰乐菌素 (tylosin)[14, 15]; 在植物中阿洛糖苷和6-脱氧阿洛糖苷两种形式都广泛存在。本文对已发现鉴定的天然阿洛糖苷 (没有包括与苷元不直接形成糖苷键的含有阿洛糖基的二糖或多糖苷) 及其药理活性进行较全面的综述, 以期对此类稀有糖苷在生物医药领域的应用和深入研究提供借鉴。
天然阿洛糖苷化合物根据苷元的结构分为黄酮苷、酚苷、强心苷、葫芦烷型三萜皂苷。
1 黄酮阿洛糖苷 1.1 黄酮阿洛糖苷类化合物的概述黄酮类化合物是许多中草药中的有效成分, 具有保肝、降血压、抗菌、抗心律失常等作用; 目前已鉴定25个黄酮阿洛糖苷类化合物[16-30], 化合物名称见表 1和分子结构 (1~25) 见图 1。阿洛糖基使得黄酮苷具有抗高尿酸血症、抗骨质疏松症等不同于常见的葡萄糖苷的生物活性。
| Table 1 Flavonoid allopyranosides |
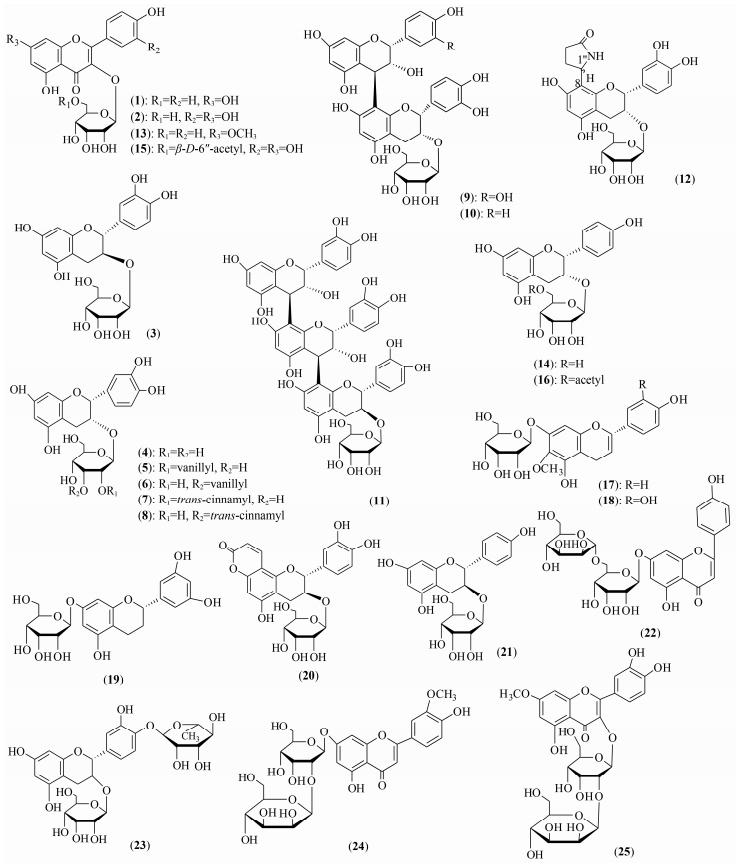
|
Figure 1 Structures of flavonoid allopyranosides |
Lu等[22]在贯叶连翘 (Hypericum perforatum) 中提取出黄酮苷, 鉴定为6"-O-乙酰基槲皮素-3-O-β-D-阿洛糖苷 (6"-O-acetyl quercetin-3-O-β-D-allopyranoside) (15), 进行抗真菌活性研究发现其抗根腐病原菌 (Helminthosporium sativum) 和禾谷镰刀菌 (Fusarium graminearum) 的最小抑菌浓度 (MICs) 分别为25和100 μg·mL-1, 然而其苷元槲皮素和槲皮素3-O-鼠李糖苷 (quercitrin 3-O-rhamnoside) 仅对根腐病原菌具有较弱抑菌作用 (MICs为50 μg·mL-1)。Rashid等[28]在山杏 (Prunus armeniaca) 的丁醇提取物中分离鉴定出两个新的黄酮苷, 其中包括4', 5, 7-三羟基黄酮7-O-[β-D-甘露糖基 (1"'→2")]-β-D-阿洛糖苷 (22)。在抗菌活性实验中, 提取物抗革兰阳性菌的MICs为31.25~250 μg·mL-1, 其中藤黄色微球菌 (Micrococcus luteus) 的抑菌活性为31.25~250 μg·mL-1, 对革兰阴性菌的MICs为125 μg·mL-1或250 μg·mL-1。
1.2.2 促细胞增殖作用Chang等[23]从骨碎补 (Drynaria fortunei) 的甲醇提取物分离鉴定了8个黄烷-3醇及黄烷醇苷类化合物, 其中化合物 (-)-表阿夫儿茶精-3-O-β-D-吡喃阿洛糖苷 (14) 和 (-)-表阿夫儿茶精-3-O-(6"-O-乙酰基)-β-D-阿洛糖苷 (16) 与阳性药17β-雌二醇对比呈剂量依赖地促进MCF-7 (1×10-15~1×10-6 mol·L-1) 和ROS 17/2.8 (1×10-15~1×10-9 mol·L-1) 细胞增殖作用。这2个黄烷醇阿洛糖苷具有类似大豆异黄酮金雀异黄素 (genistein) 的植物性雌激素作用, 可用于治疗人体雌激素分泌不足或雌激素依赖型的疾病, 在预防肿瘤、心脑血管疾病、骨质疏松等方面有重要作用。
1.2.3 抗氧化作用Sun等[25]在清香藤 (Jasminum lanceolarium) 的乙醇提取物中, 提取出两个新黄酮苷其中包括 (2S)-5, 7, 3', 5'-四羟基黄酮7-O-β-D阿洛糖苷 ((2S)-5, 7, 3', 5'-tetrahydroxy-flavanone 7-O-β-D-allopyranoside) (19), 在筛选它们体外抗氧化活性实验中, 此阿洛糖苷表现出对1, 1-二苯基-2-三硝基苯肼 (1, 1-diphenyl-2-picrylhydrazyl, DPPH) 的自由基清除能力 (EC50为29.27 μg·mL-1) 超过苷元 (5, 7, 3', 5'-tetrahydroxy-flavanone) 的自由基清除能力 (EC50为97.30 μg·mL-1)。
1.2.4 抗高尿酸血症Chen等[26]测定了大叶骨碎补乙醇提取物的抗高尿酸血症活性, 其中黄酮苷epiphyllocoumarin-3-O-β-d-allopyranoside (20) 具有体外抑制黄嘌呤氧化酶的活性 (124 μmol·L-1) 和降低氧嗪酸诱导的急性高尿酸血症模型大鼠体内的血清尿酸水平。这是第一次报道黄酮阿洛糖苷有降高尿酸血症活性, 这可能研发为降尿酸血症的潜在药物。
1.2.5 抗炎作用Dongmo等[29]从羽叶金合欢 (Acaciapennata Willd.) 的叶子提取物中分离出两个新的黄酮类化合物, 其中一个为槲皮素4'-O-α-鼠李糖3-O-β-D-阿洛糖 (quercetin 4'-O-α-L-rhamnopyranosyl-3-O-β-D-allopyranoside) (23), 测定了其药物浓度100 μg·mL-1的抗炎活性, 结果证实此阿洛糖苷具有对环氧合酶 (COX-1和COX-2) 的抑制活性, 对COX-1具有最高的抑制率80.4%, 其IC50为11.6 μg·mL-1, 而阳性对照阿司匹林的IC50为70.0 μg·mL-1, 其他4个黄酮糖苷的抑制活性较阿洛糖苷弱。
1.2.6 抗骨质疏松症Ko等[31]在体外研究中, 证实了大叶骨碎补乙醇提取物对核因子κB受体活化因子配基 (RANKL) 诱导破骨细胞分化的抑制作用, 并提取鉴定出活性成分 (-)-表儿茶素3-O-β-D-阿洛糖苷 ((-)-epicatechin 3-O-β-d-allopyranoside, ECAP) (4), 其IC50为25 μg·mL-1, 乙醇提取物具有预防切除卵巢大鼠骨质疏松的体内活性。此外, Singh等[30]利用高脂肪饮食诱导糖尿病小鼠模型和罗格列酮 (10 mg·kg-1)、非诺贝特 (250 mg·kg-1) 为阳性对照, 研究证实ECAP (10、20、40 mg·kg-1) 呈剂量依赖地提高糖尿病和高血脂小鼠的肌肉和肝脏AMP活化蛋白激酶 (AMPK) 的磷酸化水平和膜蛋白GLUT4的表达, 表明其具有抗糖尿病和降血脂活性。
2 阿洛糖酚苷 2.1 阿洛糖酚苷类化合物及其药理活性阿洛糖酚苷是苷元分子中的酚羟基与阿洛糖的端基碳原子缩合而成的苷, 其中研究最深入的酚苷是在临床上广泛应用的豆腐果苷 (helicid) (β-D-阿洛吡喃糖对甲酰苯基苷, formaldehydephenyl-O-β-D-pyranosyl alloside) (26), 可以从云南深绿山龙眼属萝卜树 (Helicia nilagirica) 种子中制备。1981年Chen等[32]首先从山龙眼属植物 (Helicia erratica Hook) 提取物分离鉴定出豆腐果苷 (26), 随后Luo等[33]从该植物中分离得到豆腐果醇 (对羟甲基苯-O-β-D-吡喃阿洛糖苷) (4-(hydroxymethyl) phenyl-O-β-D-pyranosyl alloside) (27), 二者的化学结构与天麻素 (对羟甲基苯-O-β-D-吡喃葡萄糖苷, 4-(hydroxymethyl) phenyl-O-β-D-glucopyranoside) 相似。豆腐果苷具有镇静、催眠、止痛、抗惊厥等作用, 其镇静、止痛作用较天麻素强, 对神经官能症引起的头痛、头昏、睡眠障碍的治疗作用显效快, 由其制成的产品神衰果素片已在临床上应用; 而豆腐果醇的研究少有报道。
豆腐果苷经常被用来在临床上用于治疗神经衰弱综合征、血管头痛和三叉神经痛, 其疗效高, 低副作用和毒性; 其独特性在于糖基为稀有的吡喃阿洛糖。豆腐果苷是一种安全有效的止痛、安眠和镇静药, 且具有一定的抗惊厥作用, 连续服用, 未发现中毒或其他不良反应且药效恒定; 其缺点是起效缓慢, 作用强度较弱, 且给药量较大, 生物利用度较低; 其起效慢和生物利用度低的原因可能是脂溶性较差, 不易透过血脑屏障[34, 35]。因此, 许多学者基于豆腐果苷为先导化合物进行结构修饰的新药研究, Li等[36]以豆腐果苷为原料合成一系列豆腐果苷类似物, 如2-(4-β-D-吡喃阿洛糖苷-苯基)-5-取代芳基-1, 3, 4-噁二唑, 部分化合物 (28~30, 图 2) (200 mg·kg-1) 具有比母体化合物更好的镇静催眠活性。Ye等[37]以豆腐果苷为原料合成一系列豆腐果苷类似物, 如4-(4-β-D-吡喃阿洛糖苷-苯基)-2-芳基-5-腈基-6-甲氧基吡啶, 共获得12个新化合物, 并进行了药理活性筛选, 部分化合物 (31、32, 图 2) 也具有比母体化合物更好的镇静催眠活性。Zhu等[38]以豆腐果苷为原料合成一系列豆腐果苷类似物, 如4-取代亚甲基苯基-β-D-吡喃阿洛糖苷, 共合成了14个豆腐果苷衍生物, 药理证明所合成的化合物均具有镇静活性, 其中部分化合物 (33~35, 图 2) 与原药相比, 具有更强镇静活性。
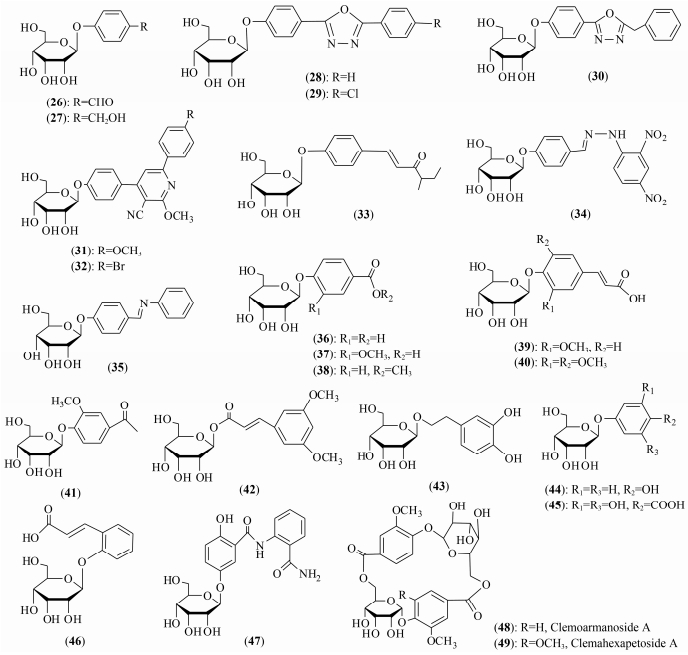
|
Figure 2 Structures of phenolic allopyranosides |
到目前为止, 还从土荆皮 (Pseudolarix kaempferi) 鉴定出3个土荆皮苷 (pseudolaroside) A、B、C (36~38)[39, 40]和从藏药甘青乌头 (Aconitum tanguticum) 中分别鉴定出香草酸、阿魏酸、芥子酸和4-羟基-3-甲氧基苯乙酮等酚羟基形成的阿洛糖酚苷 (37、39~41)[41-43]和一个反式-3, 4-二甲氧基肉桂酸所形成的非常少见的羧酸阿洛糖酚苷 (42)[44]。已鉴定的天然阿洛糖酚苷化合物[32, 33, 38-50]见表 2及其结构见图 2。其中, Clemoarmanoside A和Clemahexapetoside A (48, 49)[50], 是从中草药棉团铁线莲 (clematis hexapetala) 中分离鉴定到结构新颖的环状二聚阿洛糖糖酚苷。
| Table 2 Natural phenolic allopyranosides |
甾体皂甙是植物中一类重要的生物活性物质, 目前已鉴定的含有阿洛糖基的甾体苷主要为强心苷。
3.1 阿洛糖强心苷及其生物活性目前, 这类化合物主要来源于桑科见血封喉属植物见血封喉 (Antiaris toxicaria (Pers.) Lesch.), 强心苷元为五元内酯环型, 并以见血封喉苷元 (antiari genin) 和毒毛旋花子苷元 (strophanthidin) 为主, 其生物活性主要包括抗肿瘤的细胞毒作用和强心作用。1964年Mühlradt等[51]首先从见血封喉中分离鉴定了含有阿洛糖基的强心苷 (图 3) 见血封喉阿洛糖苷 (antialloside, 50)、见血封喉去氧阿洛糖苷 (antiogoside, 51)、毒毛旋花子阿洛糖苷 (strophalloside, 52)、杠柳阿洛糖苷 (peripalloside, 53) 等。Zhang等[52]从海南产见血封喉的乙醇提取物中也分离出这一系列强心苷, 其中毒毛旋花子阿洛糖苷处理人胃腺癌细胞SGC-7901能够明显地呈时间和剂量依赖性地抑制其增殖, 并能有效地诱导细胞凋亡, 其中1 μg·mL-1的药物浓度作用48 h对胃腺癌细胞SGC-7901生长抑制率为89%。Dong等[53]也进行了强心苷 (50~52) 对慢性髓原白血病细胞 (K562)、人胃癌细胞 (SGC-7901) 和人肝癌细胞 (SMMC-7721) 的生长抑制活性研究, 这3个强心苷类阿洛糖苷的细胞毒活性 (IC50) 为0.01到0.2 μg·mL-1; 其中毒毛旋花子阿洛糖苷对3种肿瘤细胞毒活性 (IC50) 分别为0.10、0.20、0.02 μg·mL-1, 然而其相应的毒毛旋花子苷元对3种肿瘤细胞毒活性 (IC50) 分别为5.00、3.40、1.80 μg·mL-1。可见, 阿洛糖基使得毒毛旋花子阿洛糖苷的细胞毒活性分别提高了50、17和9倍。Ankli等[54]从缨瓣属植物Crossopetalum gaumeri分离鉴定2个强心苷sarmentogenin-3β-O-[α-allosyl-(1→4)-β-6-deoxy alloside (54)、securigenin-3β-O-[α-allosyl-(1→4)-β-6-deoxy alloside (55) (图 3), 其对KB细胞具有强的细胞毒 (IC50分别为0.075 μmol·L-1和0.104 μmol·L-1)。
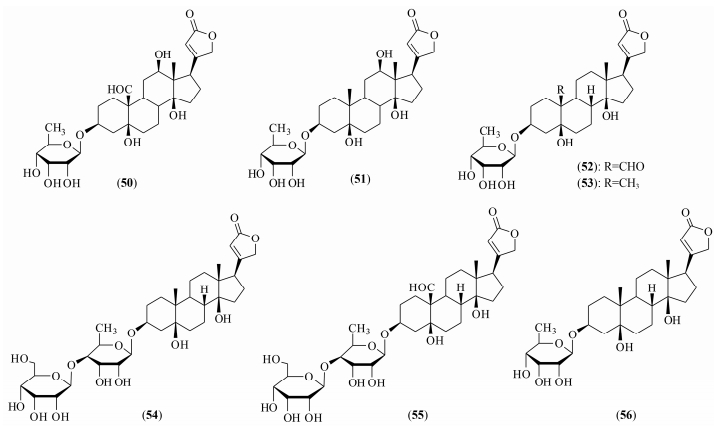
|
Figure 3 Structures of cardenolide allopyranosides |
阿洛糖强心苷的强心作用主要以强心致死剂量为活性评价指标, Mei等[55]在见血封喉化学成分与药理活性研究中总结了见血封喉中的强心苷类成分, 其中这4种强心苷强心致死剂量为0.118~0.138 mg·kg-1。此外, Clarkson等[56]从萝藦科植物Kanahia laniflora分离出强心苷coroglaucigenin 3-O-6-deoxy-beta-d-allopyranoside (56) (图 3)。
4 葫芦烷型阿洛糖苷 4.1 葫芦烷型阿洛糖苷的概述葫芦烷型阿洛糖苷最主要的糖基取代发生在C-3位, 所有糖苷C-11没有氧化取代; 该类糖苷属于葫芦科植物中葫芦素 (cucurbitacin) 的重要组成成分, 主要从苦瓜 (Momordica charantia L.) 中分离鉴定得到。
苦瓜作为民间治疗糖尿病的传统植物药方, 其提取物具有抗氧化、抗炎症、抗肿瘤、抗糖尿病、抗菌、减肥和免疫调节等药理活性。从苦瓜不同组织中提取的物质主要为葫芦烷三萜化合物, 到目前为止从苦瓜不同组织中提取的葫芦烷三萜化合物超过150个, 已确定分子构型的有120多个, 其化学结构骨架主要有Ⅰ和Ⅱ两类, Ⅰ类骨架主要特征在C-5和C-6之间形成双键; Ⅱ类骨架的主要特征是在C-5和C-19之间由环氧基连接, 且一般情况下C-6和C-7之间形成双键, 该类结构只在苦瓜属植物中发现。与其他绝大多数葫芦素化学结构相比, 苦瓜的葫芦烷三萜化合物C-11处没有发生氧化; 不管是Ⅰ类还是Ⅱ类骨架的化合物, 配基的修饰主要发生在C-3、C-7、C-19、C-22、C-23和C-25。已鉴定的葫芦烷型阿洛糖苷[57-70]的命名见表 3, 分子结构 (57~87) 见图 4。
| Table 3 Natural cucurbitane-type triterpene allopyranosides. aThe absolute configuration of C-23 hydroxyl group not established; bNo bioactivities reported |
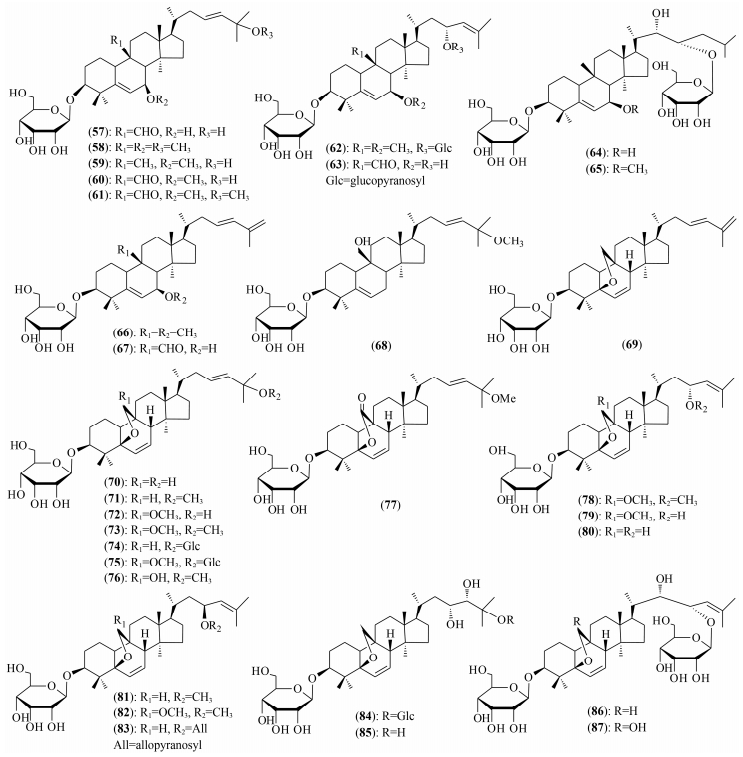
|
Figure 4 Structures of cucurbitane-type triterpene allopyranosides |
苦瓜在中药中用于治疗糖尿病和其他代谢病, Hsiao等[57]研究发现糖苷 (57) 具有较好的降血糖作用, 与momordicoside F2 (70)、goyagglycoside b (72) 和momordicoside U (78) 进行构效关系对比分析推测C-5β, 19之间的环氧环降低了降血糖作用, 而与其相同苷元的kuguaoside C相比, 阿洛糖基促进了其降血糖作用。
Nhiem等[59]的研究证实了阿洛糖苷charantosides A (60)、karaviloside Ⅱ (58)、Karaviloside Ⅲ (59)、57、Charantoside C (77)、momordicoside G (71)、momordicoside F2 (70)、goyaglycoside-b (72) 都具有中等强度的α-糖苷酶抑制活性 (12.50%~18.63%), 其中70和71的抑制活性也明显强于其苷元结构相同的葡萄糖苷momordicoside Ⅰ和momordicoside F1的抑制作用; 另外momordicoside M具有最强的α-糖苷酶抑制活性 (18.63%), 结构分析可见它与双阿洛糖苷 (64) 的区别是C-3羟基形成葡萄糖苷且其含有C-22、C-23羟基, 这些结构特点增强其抑制活性; 对比72和59的α-糖苷酶抑制活性分别为10.88%和15.85%, 说明C-5, 19之间的环氧降低α-糖苷酶的抑制活性。
Tan等[61]发现karaviloside XI (85) (0.1 μmol·L-1) 提高肌肉细胞L6和脂肪细胞3T3-L1中的AMPK磷酸化水平, 促进葡萄糖转运GLUT4转位效应优于苷元, 说明糖基促进生物活性, 但小于相对应的葡萄糖苷momordicoside Q。
4.2.2 抗肿瘤活性Hsiao等[57]研究发现苦瓜果实的乙醇提取物中的葫芦烷型三萜苷对MCF-7、WiDr、HEp-2和Doay人肿瘤细胞系有抗增殖活性, 分离鉴定了70、72、goyagglycoside d (73) 和Momordicoside U (78) 等葫芦烷型阿洛糖苷对肿瘤细胞MCF-7、Doay、HEp-2、WiDr均有抑制增殖作用 (IC50为10~20 μg·mL-1), 其中70和78抗增殖作用与其具有相同苷元结构的葡萄糖苷momordicoside Ⅰ和kuguaoside B相似, 构效关系分析表明C-5β, 19之间的环氧和C-25的甲氧基对抗增殖起主要作用。Wang等[68]还证实了charantagenin E (82) 体外抗肺癌A549、胶质母细胞瘤细胞系U87、肝癌Hep3B的生长抑制活性。
4.2.3 抗炎作用Nhiem等[67]研究证实了阿洛糖苷 (71) 和charantoside C (77) 抑制肝肿瘤细胞HepG2细胞NF-κB的激活, 其IC50值为0.4 μmol·L-1, 阳性对照柳氮磺胺吡啶 (sulfasalazine) IC50为0.9 μmol·L-1; 而与71对应的葡萄糖苷momordicoside F1 (C-3葡萄糖苷) 的IC50值为4.9 μmol·L-1, 说明阿洛糖基是重要的药效基团。此外, karaviloside Ⅱ (58) 也有很好的抑制活性 (IC50=3.9 μmol·L-1)。71和77也剂量依赖地抑制TNFα诱导的iNOS (inducible nitric oxide synthase) 和COX-2的表达; Momordicoside U (79) 能激活PPARγ的转录表达, 参与代谢和炎症反应调节。结构分析表明糖苷71、77和79都具有相同的C-17侧链 (C-23, 24双键和C-25的甲氧基), 即发挥药效的官能团。糖苷57和59也剂量依赖地抑制TNFα诱导的iNOS和COX-2基因表达。
此外, 除了以上常见的阿洛糖苷外还有苄基苷和环醚萜苷, 目前也有文献报道了其中的阿洛糖苷, 鉴于已鉴定的此类糖苷数目较少, 不作详述。如丹麦Jaroszewski和美国Seigler两个研究组都从西番莲科 (Passifloraceae) 西番莲属的鸡蛋果 (Passiflora edulia Sims) 的树叶中分离得到两个稀有的苄基-β-D-阿洛糖苷和苄基氰-β-D-阿洛糖苷[71, 72]; 环烯醚萜苷是唇形科植物中一类常见的单萜成分, 最近Venditti和Tundis分别从该科植物Melittis melissophyllum L.和Stachys lavandulifolia分离微量的阿洛糖苷allobetonicoside和5-allosyloxy-aucubin[73, 74], 其中5-allosyloxy-aucubin具有酪氨酸酶 (tyrosinase) 抑制活性。
5 结语自然界中存在着大量的天然阿洛糖苷化合物, 已有的研究表明该类化合物具有多种药理活性; 同时D-阿洛糖单糖本身具有良好的药用价值, 其抗肿瘤效应已得到体内外的研究结果证实, 将其用于膳食将是一种长期保持健康、预防并辅助治疗疾病的有效途径。通过化学或生物催化方法对药物进行阿洛糖基化的结构修饰, 能提高药物的生物活性、降低毒性和克服抗药性 (如豆腐果苷的结构改造)。因此, 将D-阿洛糖作为糖基修饰现有药物和天然产物, 将有助于研发许多新型的糖苷类临床药物。目前阿洛糖苷的化学修饰得到发展, 而生物催化研究才刚开始[75], 可以预见天然阿洛糖苷的发现、生物活性研究的深入及化学分子结构修饰技术的发展, 将会促进此类糖苷创新药物的发展。
| [1] | Grynkiewicz G, Szeja W. Synthetic glycosides and glyco-conjugates of low molecular weight natural products[J]. Curr Pharm Des, 2016, 22: 1592–1627. DOI:10.2174/1381612822666151211094345 |
| [2] | Fu G, Pang H, Wong YH. Naturally occurring phenylethanoid glycosides:potential leads for new therapeutics[J]. Curr Med Chem, 2008, 15: 2592–2613. DOI:10.2174/092986708785908996 |
| [3] | Li Z, Gao Y, Nakanishi H, et al. Biosynthesis of rare hexoses using microorganisms and related enzymes[J]. Beilstein J Org Chem, 2013, 9: 2434–2445. DOI:10.3762/bjoc.9.281 |
| [4] | Al-Asmari AK, Albalawi SM, Athar MT, et al. Moringa oleifera as an anti-cancer agent against breast and colorectal cancer cell lines[J]. PLoS One, 2015, 10: e0135814. DOI:10.1371/journal.pone.0135814 |
| [5] | Lin QQ, Liu YC, Li LF, et al. The latest progress in preparation and application of uncommon sugars[J]. Food Ferm Indust (食品与发酵工业), 2013, 39: 146–151. |
| [6] | Iga Y, Nakamichi K, Shirai Y, et al. Acute and sub-chronictoxicity of D-allose in rats[J]. Biosci Biotechnol Biochem, 2010, 74: 1476–1478. DOI:10.1271/bbb.100121 |
| [7] | Noguchi C, Kamitori K, Hossain A, et al. D-Allose inhibits cancer cell growth by reducing GLUT1 expression[J]. To-hoku J Exp Med, 2016, 238: 131–141. DOI:10.1620/tjem.238.131 |
| [8] | Yokohira M, Hosokawa K, Yamakawa K, et al. Potential inhibitory effects of D-allose, a rare sugar, on liver preneoplastic lesion development in F344 rat medium-term bioassay[J]. J Biosci Bioeng, 2008, 105: 545–553. DOI:10.1263/jbb.105.545 |
| [9] | Huang T, Gao D, Hei Y, et al. D-Allose protects the blood brain barrier through PPARγ-mediated anti-inflammatory pathway in the mice model of ischemia reperfusion injury[J]. Brain Res, 2016, 1642: 478–486. DOI:10.1016/j.brainres.2016.04.038 |
| [10] | Ueki M, Asaga T, Chujo K, et al. D-Allose protects against endotoxemic acute renal injury[J]. J Biosci Bioeng, 2008, 105: 481–485. DOI:10.1263/jbb.105.481 |
| [11] | Yamada K, Noguchi C, Kamitori K, et al. Rare sugar D-allose strongly induces thioredoxin-interacting protein and inhibits osteoclast differentiation in Raw264 cells[J]. Nutr Res, 2012, 32: 116–123. DOI:10.1016/j.nutres.2011.12.010 |
| [12] | Sun Y, Hayakawa S, Chuamanochan M, et al. Antioxidant effects of Maillard reaction products obtained from ovalbumin and different D-aldohexoses[J]. Biosci Biotechnol Biochem, 2006, 70: 598–605. DOI:10.1271/bbb.70.598 |
| [13] | Tanaka S, Sakamoto H. Effects of D-allose on the endocytic activity of dendritic cells and the subsequent stimulation of T cells[J]. Cell Immunol, 2011, 271: 141–146. DOI:10.1016/j.cellimm.2011.06.015 |
| [14] | Morisaki N, Hashimoto Y, Furihata K, et al. Glycosylative inactivation of chalcomycin and tylosin by a clinically isolated Nocardia asteroides strain[J]. J Antibiot (Tokyo), 2001, 54: 157–165. DOI:10.7164/antibiotics.54.157 |
| [15] | Kubiak RL, Phillips RK, Zmudka MW, et al. Structural and functional studies on a 3'-epimerase involved in the biosynthesis of dTDP-6-deoxy-D-allose[J]. Biochemistry, 2012, 51: 9375–9383. DOI:10.1021/bi3012737 |
| [16] | Okuyama T, Hosoyama K, Hiraga Y, et al. The con-stituents of Osmunda spp. Ⅱ.:a new flavonol glycoside of Osmunda asiatica[J]. Chem Pharm Bull, 1978, 26: 3071–3074. DOI:10.1248/cpb.26.3071 |
| [17] | Murakami T, Satake T, Hirasawa C, et al. Chemical and chemotaxonomical studies on filices. 46. a few new flavonoid glycosides[J]. Yakugaku Zasshi, 1984, 104: 142–146. |
| [18] | Hwang TH, Kashiwada Y, Nonaka GI, et al. Flavan-3-ol and proanthocyanidin allosides from Davallia divaricata[J]. Phytochemistry, 1989, 28: 891–896. DOI:10.1016/0031-9422(89)80138-4 |
| [19] | Cui CB, Tezuka Y, Kikuchi T, et al. Davallioside A and B, novel flavin-3-ol derivatives with a γ-lactam, from the rhi-zomes of Davallia Mariesii Moore[J]. Chem Pharm Bull, 1990, 38: 2620–2622. DOI:10.1248/cpb.38.2620 |
| [20] | Iwashina T, Ootani S. Three flavonol allosides from Glaucidium palmatum[J]. Phytochemistry, 1990, 29: 3639–3641. DOI:10.1016/0031-9422(90)85291-M |
| [21] | Liu S, Xiao Z, Feng R. Studies on the chemial constituents of Drynaria propinqua (Wall) J. Sm.[J]. China J Chin Mater Med (中国中药杂志), 1992, 17: 737–737. |
| [22] | Lu Y, Zhang Z, Shi G, et al. A new antifungal flavonol glycoside from Hypericum perforatum[J]. Acta Bot Sin (植物学报), 2002, 44: 743–745. |
| [23] | Chang EJ, Lee WJ, Cho SH, et al. Proliferative effects of flavan-3-ols and propelargonidins from rhizomes of Drynaria fortunei on MCF-7 and osteoblastic cells[J]. Arch Pharm Res, 2003, 26: 620–630. DOI:10.1007/BF02976711 |
| [24] | Santos LC, Rodrigues CM, Silva MA, et al. Chemical profile of Eriocaulon ligulatum (Vell.) L.B. Smith (Eriocaulaceae)[J]. Biochem Syst Ecol, 2005, 33: 1159–1166. DOI:10.1016/j.bse.2004.12.029 |
| [25] | Sun JM, Yang JS, Zhang H. Two new flavanone glycosides of Jasminum lanceolarium and their anti-oxidant activities[J]. Chem Pharm Bull (Tokyo), 2007, 55: 474–476. DOI:10.1248/cpb.55.474 |
| [26] | Chen CY, Huang CC, Tsai KC, et al. Evaluation of the antihyperuricemic activity of phytochemicals from Davallia formosana by enzyme assay and hyperuricemic mice model[J]. Evid Based Complement Alternat Med, 2014, 2014: 873607. |
| [27] | Liang YH, Ye M, Yang WZ, et al. Flavan-3-ols from the rhizomes of Drynaria fortunei[J]. Phytochemistry, 2011, 72: 1876–1882. DOI:10.1016/j.phytochem.2011.05.011 |
| [28] | Rashid F, Ahmed R, Mahmood A, et al. Flavonoid gly-cosides from Prunus armeniaca and the antibacterial activity of a crude extract[J]. Arch Pharm Res, 2007, 30: 932–937. DOI:10.1007/BF02993959 |
| [29] | Dongmo AB, Miyamoto T, Yoshikawa K, et al. Flavonoids from Acacia pennata and their cyclooxygenase (COX-1 and COX-2) inhibitory activities[J]. Planta Med, 2007, 73: 1202. DOI:10.1055/s-2007-981596 |
| [30] | Gupta D, Singh J. Flavonoid glycosides from Cassia alata[J]. Phytochemistry, 1991, 30: 2761–2763. DOI:10.1016/0031-9422(91)85140-U |
| [31] | Ko YJ, Wu JB, Ho HY, et al. Antiosteoporotic activity of Davallia formosana[J]. J Ethnopharmacol, 2012, 139: 558–565. DOI:10.1016/j.jep.2011.11.050 |
| [32] | Chen WX, Lu SD, Breitmaier E. Helicide, in β-allopyranoside from Helicia erratica Hook[J]. Liebigs Ann Chem, 1981, 10: 1893–1895. |
| [33] | Luo SD, Ruecker G. Structure of helicidol, an additionl β-allopyranoside from Helicia erratica[J]. Planta Med, 1986, 5: 412. |
| [34] | Liu GY, Ma SC, Zhang YM, et al. Study on chemical con-stituents in seeds of Helicia nilagirica[J]. China J Chin Mater Med (中国中药杂志), 2005, 30: 830–832. |
| [35] | Liu Q, Shi Y, Guo T, et al. Metabolite discovery of helicidum in rat urine with XCMS based on the data of ultra performance liquid chromatography coupled to time-of-flight mass spectrometry[J]. J Chromatogr B, 2012, 907: 146–153. DOI:10.1016/j.jchromb.2012.09.029 |
| [36] | Li JL, Fan B, Luo HL, et al. Synthesis and calm activity of 2-(4-β-D-allopyranosyloxyphenyl)-5-substitutedaryl-1, 3, 4-oxadiazoles[J]. Chin J Org Chem (有机化学), 2011, 31: 110–114. |
| [37] | Ye D, Fu L, Liang B, et al. Synthesis and calm activity of 4-(4-β-D-allopyranosyl oxyphenyl)-2-aryl-5-cyano-6-methoxypyridine derivatives[J]. Chin J Org Chem (有机化学), 2009, 29: 1768–1773. |
| [38] | Zhu QL, Li Y, Li J, et al. Synthesis and sedation activity of 4-substituted methylene phenyl-β-D-allopyranoside[J]. West China J Pharm Sci (华西药学杂志), 2008, 23: 12–16. |
| [39] | Liu P, Guo H, Tian Y, et al. Benzoic acid allopyranosides from the bark of Pseudolarix kaempferi[J]. Phytochemistry, 2006, 67: 1395–1398. DOI:10.1016/j.phytochem.2006.05.017 |
| [40] | Feng SX, Guo HZ, Liu P, et al. Chemical contituents in bark of Pseudolarix kaempferi[J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 10–12. |
| [41] | Xu L, Li YR, Li C, et al. Chemical constituents from whole plants of Aconitum tanguticum[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 2818–2825. |
| [42] | Xu L, Luo M, Lin LM, et al. Three new phenolic glycosides from the Tibetan medicinal plant Aconitum tanguticum[J]. J Asian Nat Prod Res, 2013, 15: 743–749. DOI:10.1080/10286020.2013.799145 |
| [43] | Yang L, Feng W, Li C, et al. Three new phenolic glycosides from the whole plant of Aconitum tanguticum (Maxim.) Stapf[J]. Phytochem Lett, 2015, 11: 311–315. DOI:10.1016/j.phytol.2015.01.020 |
| [44] | Li YR, Xu L, Li C, et al. Two new compounds from Aconitum tanguticum[J]. J Asian Nat Prod Res, 2014, 16: 730–734. DOI:10.1080/10286020.2014.904292 |
| [45] | Sui HF, Yin SQ, Zou AY. Studies on chemical contituents of Drynaria roosii[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 2992–2995. |
| [46] | Iwagawa T, Takahashi H, Munesada K, et al. A phenol alloside from Viburnum wrightii[J]. Phytochemistry, 1984, 23: 468–469. DOI:10.1016/S0031-9422(00)80358-1 |
| [47] | Chen YG, Yang JH, Zhang Y, et al. A new alloside from Neocheiropteris palmatopedata[J]. Chem Nat Comp, 2010, 46: 173–175. DOI:10.1007/s10600-010-9560-2 |
| [48] | Cottiglia F, Bonsignore L, Casu L, et al. Phenolic constitu-ents from Ephedra nebrodensis[J]. Nat Prod Res, 2005, 19: 117–123. DOI:10.1080/14786410410001704714 |
| [49] | Liu J, Xie T, Wei XL, et al. Chemical studies on Rabdosia rubenscens[J]. Chin J Nat Med (中国天然药物), 2004, 2: 276–279. |
| [50] | Shi S, Dong C, Jiang D, et al. Macrocyclic glycosides from Clematis hexapetala[J]. Helv Chim Acta, 2006, 89: 3002–3006. DOI:10.1002/(ISSN)1522-2675 |
| [51] | Mühlradt P, Weiss E, Reichstein T. Die cardenolide der samen von Antiaris toxicaria Lesch. Mitteilung:isolierungen und identifizierungen[J]. Helv Chim Acta, 1964, 47: 2164–2186. DOI:10.1002/hlca.19640470810 |
| [52] | Zhang XJ, Mei WL, Cai CH, et al. Apoptosis of gastric adenocarcinoma cells type SGC-7901 induced by strophal-loside and its mechanism[J]. Chin General Practice (中国全科医学), 2015, 18: 1743–1747. |
| [53] | Dong WH, Mei WL, Zeng YB, et al. Cardenolides from the seeds of Antiaris toxicaria and their cytotoxicity[J]. J Trop Subtrop Bot (热带亚热带植物学报), 2011, 19: 171–176. |
| [54] | Ankli A, Heilmann J, Heinrich M, et al. Cytotoxic cardenolides and antibacterial terpenoids from Crossopetalum gaumeri[J]. Phytochemistry, 2000, 54: 531–537. DOI:10.1016/S0031-9422(00)00144-8 |
| [55] | Mei WL, Gan YJ, Dai HF. Advonces in studies on chemical constituents of Antiaris toxicaria[J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 151–154. |
| [56] | Clarkson C, Staerk D, Hansen SH, et al. Hyphenation of solid-phase extraction with liquid chromatography and nuclear magnetic resonance:application of HPLC-DAD-SPE-NMR to identification of constituents of Kanahia laniflora[J]. Anal Chem, 2005, 77: 3547–3553. DOI:10.1021/ac050212k |
| [57] | Hsiao PC, Liaw CC, Hwang SY, et al. Antiproliferative and hypoglycemic cucurbitane-type glycosides from the fruits of Momordica charantia[J]. J Agric Food Chem, 2013, 61: 2979–2986. DOI:10.1021/jf3041116 |
| [58] | Nakamura S, Murakami T, Nakamura J, et al. Structures of new cucurbitane-type triterpenes and glycosides, karavilagenins and karavilosides, from the dried fruit of Momordica charantia L. in Sri Lanka[J]. Chem Pharm Bull (Tokyo), 2006, 54: 1545–1550. DOI:10.1248/cpb.54.1545 |
| [59] | Nhiem NX, Kiem PV, Minh CV, et al. alpha-Glucosidase inhibition properties of cucurbitane-type triterpene glycosides from the fruits of Momordica charantia[J]. Chem Pharm Bull (Tokyo), 2010, 58: 720–724. DOI:10.1248/cpb.58.720 |
| [60] | Liu Y, Ali Z, Khan IA. Cucurbitane-type triterpene gly-cosides from the fruits of Momordica charantia[J]. Planta Med, 2008, 74: 1291–1294. DOI:10.1055/s-2008-1081297 |
| [61] | Tan MJ, Ye JM, Turner N, et al. Antidiabetic activities of triterpenoids isolated from bitter melon associated with activation of the AMPK pathway[J]. Chem Biol, 2008, 15: 263–273. DOI:10.1016/j.chembiol.2008.01.013 |
| [62] | Liu JQ, Chen JC, Wang CF, ET AL. New cucurbitane triter-penoids and steroidal glycoside from Momordica charantia[J]. Molecules, 2009, 14: 4804–4813. DOI:10.3390/molecules14124804 |
| [63] | Yen PH, Dung DT, Nhiem NX, et al. Cucurbitane-type triterpene glycosides from the fruits of Momordica charantia[J]. Nat Prod Commun, 2014, 9: 383–386. |
| [64] | Akihisa T, Higo N, Tokuda H, et al. Cucurbitane-type triterpenoids from the fruits of Momordica charantia and their cancer chemopreventive effects[J]. J Nat Prod, 2007, 70: 1233–1239. DOI:10.1021/np068075p |
| [65] | Okabe H, Miyahara Y, Yamauchi T. Structures of momordicosides F1, F2, G, I, K, and L, novel cucurbitacins in the fruits of Momordica charantia L.[J]. Tetrahedron Lett, 1982, 23: 77–80. DOI:10.1016/S0040-4039(00)97537-3 |
| [66] | Murakami T, Emoto A, Matsuda H, et al. Medicinal foodstuffs. XXI. Structures of new cucurbitane-type triterpene glycosides, goyaglycosides-a, -b, -c, -d, -e, -f, -g, and-h, and new oleanane-type triterpene saponins, goyasaponins Ⅰ, Ⅱ, and Ⅲ, from the fresh fruit of Japanese charantia L.[J]. Chem Pharm Bull (Tokyo), 2001, 49: 54–63. DOI:10.1248/cpb.49.54 |
| [67] | Nhiem NX, Yen PH, Ngan NT, et al. Inhibition of nuclear transcription factor-κB and activation of peroxisome proliferator-activated receptors in HepG2 cells by cucurbitane-type triterpene glycosides from Momordica charantia[J]. J Med Food, 2012, 15: 369–377. DOI:10.1089/jmf.2011.1766 |
| [68] | Wang X, Sun W, Cao J, et al. Structures of new triterpenoids and cytotoxicity activities of the isolated major compounds from the fruit of Momordica charantia L.[J]. J Agric Food Chem, 2012, 60: 3927–3933. DOI:10.1021/jf204208y |
| [69] | Zhao GT, Liu JQ, Deng YY, et al. Cucurbitane-type triterpenoids from the stems and leaves of Momordica charantia[J]. Fitoterapia, 2014, 95: 75–82. DOI:10.1016/j.fitote.2014.03.005 |
| [70] | Li QY, Chen HB, Liu ZM, et al. Cucurbitane triterpenoids from Momordica charantia[J]. Magn Reson Chem, 2007, 45: 451–456. DOI:10.1002/(ISSN)1097-458X |
| [71] | Christensen J, Jaroszewski JW. Natural glycosides containing allopyranose from the passion fruit plant and circular dichroism of benzaldehyde cyanohydrin glycosides[J]. Org Lett, 2001, 3: 2193–2195. DOI:10.1021/ol016044+ |
| [72] | Seigler DS, Pauli GF, Nahrstedt A, et al. Cyanogenic allosides and glucosides from Passiflora edulis and Carica papaya[J]. Phytochemistry, 2002, 60: 873–882. DOI:10.1016/S0031-9422(02)00170-X |
| [73] | Venditti A, Frezza C, Guarcini L, et al. Reassessment of Melittis melissophyllum L. subsp. melissophyllum iridoidic fraction[J]. Nat Prod Res, 2016, 30: 218–222. DOI:10.1080/14786419.2015.1040792 |
| [74] | Tundis R, Bonesi M, Pugliese A, et al. Tyrosinase, acetyl-and butyryl-cholinesterase inhibitory activity of Stachys lavandulifolia Vahl (Lamiaceae) and its major constituents[J]. Rec Nat Prod, 2015, 9: 81–93. |
| [75] | Simkhada D, Lee HC, Sohng JK. Genetic engineering approach for the production of rhamnosyl and allosyl flavonoids from Escherichia coli[J]. Biotechnol Bioeng, 2010, 107: 154–162. DOI:10.1002/bit.v107:1 |
 2017, Vol. 52
2017, Vol. 52


